La sarcopenia es un síndrome geriátrico frecuente e importante para la práctica clínica diaria de los profesionales que trabajan con personas mayores. El número de personas mayores afectadas y su relación con la incapacidad, la fragilidad, muchas enfermedades, hábitos de vida y resultados adversos son de gran relevancia para la práctica geriátrica. Además, los cambios biológicos que conducen a la pérdida de fuerza y masa muscular se relacionan intrínsecamente con los mecanismos del envejecimiento. No es, por tanto, sorprendente que la investigación en este campo esté creciendo exponencialmente en los últimos años y que la sarcopenia se haya colocado en los últimos años en el primer plano del interés geriátrico y gerontológico.
La Sociedad Española de Geriatría y Gerontología ha creado recientemente un Observatorio de la Sarcopenia, que pretende promover actividades formativas y de investigación en este campo. La primera actividad del Observatorio ha sido poner a disposición de nuestra comunidad científica una revisión de la situación actual de la sarcopenia, que permita unificar conceptos y aumentar el interés en este prometedor campo de la geriatría.
Sarcopenia is a common and prominent geriatric syndrome, of major interest for daily clinical practice of professionals working with older people. The number of affected individuals and its relation with disability, frailty, many chronic diseases, lifestyle and adverse outcomes are extremely relevant for geriatric care. Moreover, biological changes that lead to the loss of muscle mass and strength are intrinsically related to the mechanisms of aging. It is not therefore surprising that research in this field is growing exponentially in recent years, and sarcopenia has been placed in recent years in the forefront of research in geriatric medicine and gerontology.
The Spanish Society of Geriatrics and Gerontology has recently created an Observatory of Sarcopenia, which aims to promote educational and research activities in this field. The first activity of the Observatory has been to offer the Spanish speaking scientific community a review of the current status of sarcopenia, that may allow unifying concepts and fostering interest in this promising field of geriatrics.
Uno de los principales problemas relacionados con el envejecimiento es la elevada incidencia de discapacidad física y mental. Muchas enfermedades agudas y crónicas pueden producir dicha discapacidad, pero los cambios en la fuerza y función muscular relacionados con el envejecimiento se están revelando como una causa frecuente y relevante. Estos cambios han recibido muy recientemente el nombre de sarcopenia, una palabra que todos los geriatras han incorporado a su vocabulario y uno de los conceptos que están generando una mayor aportación de nuevo conocimiento en nuestra especialidad1-3.
La Sociedad Española de Geriatría y Gerontología, consciente de la importancia de la sarcopenia en la práctica actual y futura de la especialidad, ha creado recientemente un Observatorio de la Sarcopenia, que pretende promover las actividades formativas y de investigación en este campo. La primera actividad del Observatorio ha sido poner a disposición de nuestra comunidad científica una breve revisión de la situación actual de la sarcopenia, que permita unificar el lenguaje y aumentar el interés en este prometedor campo de investigación.
Fisiopatología del envejecimiento muscularEl envejecimiento humano está asociado a una pérdida de masa muscular que se inicia en la cuarta década de la vida con una pérdida de fuerza de alrededor del 1% al año y que se acelera con el transcurso de los años4. Sus causas son complejas: se considera que no es una única, sino que están implicados en dicha pérdida una amplia variedad de procesos. Entre los factores implicados en la pérdida de masa y funcionalidad del músculo esquelético podemos destacar las alteraciones en la síntesis y degradación de proteínas, la inflamación, las alteraciones hormonales y la disfunción mitocondrial5-9. La mayor parte de estas alteraciones se relacionan con el estrés oxidativo, un término que fue definido en 1985 como el desequilibrio entre el balance prooxidante y antioxidante a favor del primero10. A mitad de siglo xx, Rebeca Gershmann propuso que el envejecimiento se asociaba a alteraciones moleculares debidas a los radicales libres; posteriormente, Denham Harman postuló la teoría de los radicales libres en el envejecimiento en 195611. Esta teoría fue refinada por Jaime Miquel, que propuso que las mitocondrias eran, a su vez, causa de la producción de radicales y diana de las acciones deletéreas de los mismos12,13. Diversos autores han relacionado la disfunción mitocondrial, con el acúmulo de alteraciones en el ADN mitocondrial y con la sarcopenia, tanto en seres humanos como en animales14-17. El envejecimiento, por tanto, se ha asociado a nivel mitocondrial y en el músculo esquelético con: a) mutaciones en el ADN mitocondrial; b) reducciones en el contenido del ADN mitocondrial; c) alteraciones en la señalización en el proceso de apoptosis18; d) disminución de la actividad de la cadena de transporte electrónico19 y, por último, e) aumento de la producción mitocondrial de radicales libres20,21.
Recientemente, se ha sugerido que el envejecimiento puede estar asociado con una disminución de la biogénesis mitocondrial22. El motivo por el que se produce una disminución de la biogénesis mitocondrial durante el envejecimiento todavía se desconoce; sin embargo, se especula con las alteraciones en la cascada de señalización que conducen al proceso de mitocondriogénesis como un mecanismo relevante para explicar dicha disminución23. Se considera que el coactivador-1α del receptor-γ activado por proliferación de los peroxisomas podría ser un factor importante en la disminución observada en el proceso de mitocondriogénesis durante el envejecimiento24-26.
Pese a que la importancia de la mitocondria en la pérdida de masa muscular asociada a la edad es incuestionable, otros factores, como la inflamación, parecen estar muy implicados en la sarcopenia. Las citocinas están relacionadas con la disfunción muscular y el catabolismo27-29. Se ha demostrado que con la edad se produce un incremento de distintas interleucinas (IL-1, IL-6), así como del factor de necrosis tumoral (TNF-α) en sangre en humanos30. La unión de TNF-α a sus receptores en el sarcolema estimula la producción de radicales libres por la mitocondria muscular27, lo que refuerza la importancia del estrés oxidativo en el desarrollo de la sarcopenia. Del mismo modo, el factor nuclear κB (NF-κB) está incrementado de forma constitutiva en el músculo esquelético, tanto de animales como de seres humanos mayores31. NF-κB es un factor transcripcional conocido por su papel en la activación de mecanismos inflamatorios32, ya que se relaciona con aumentos en la expresión basal de citocinas proinflamatorias, moléculas de adhesión (moléculas de adherencia intercelular-1, moléculas de adherencia vascular), así como enzimas generadoras de especies reactivas del oxígeno, tales como la ciclooxigenasa-2. De hecho, la activación crónica de NF-κB se ha identificado como uno de los factores más relevantes en la pérdida de masa muscular asociada a la edad32.
Los estudios recientes que han permitido la inserción o la deleción de genes en la fibra muscular han facilitado la evaluación de la importancia de diversas vías de señalización en la remodelación muscular. El uso de animales transgénicos o deficientes (KO) que posibilitan la activación o inhibición de vías de señalización celular específicas promueven la interconversión entre distintos tipos de fibras musculares33, aumentan la masa muscular y la resistencia a la fatiga y disminuyen el daño muscular34,35. Además se están desarrollando nuevas tecnologías para regular la expresión génica en el músculo esquelético. En este sentido los micro-ARN están emergiendo como potentes reguladores de la expresión génica en múltiples tejidos, entre los que se encuentra el músculo esquelético36.
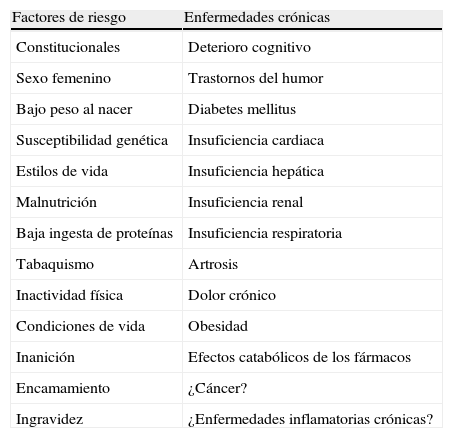
Un aspecto importante a tener en cuenta es que con la edad disminuyen una serie de hormonas y esta disminución está directamente relacionada con las alteraciones que se observan en diversos procesos fisiológicos. La disminución en los niveles séricos de testosterona se relaciona con una pérdida de la masa y de la fuerza muscular, y la disminución de los niveles de estrógenos en la mujer, asociada a la menopausia, puede tener efectos similares, dados los efectos anabólicos sobre la masa muscular que tienen los estrógenos4. Por otra parte, los estrógenos y la testosterona pueden inhibir la producción de IL-1 e IL-6, por lo que su disminución con la edad supondría de forma indirecta un aumento del catabolismo4. Durante la menopausia se ha observado una disminución en la fuerza muscular que se correlaciona con una rápida disminución en la producción de hormonas por los ovarios5. Estas observaciones sugieren que las hormonas sexuales femeninas pueden desempeñar un papel en la regulación del tamaño de la musculatura esquelética en mujeres de mediana y avanzada edad. En la tabla 1 se muestran, además del propio proceso de envejecimiento, algunos factores de riesgo relevantes de la sarcopenia.
Factores de riesgo de sarcopenia*
| Factores de riesgo | Enfermedades crónicas |
| Constitucionales | Deterioro cognitivo |
| Sexo femenino | Trastornos del humor |
| Bajo peso al nacer | Diabetes mellitus |
| Susceptibilidad genética | Insuficiencia cardiaca |
| Estilos de vida | Insuficiencia hepática |
| Malnutrición | Insuficiencia renal |
| Baja ingesta de proteínas | Insuficiencia respiratoria |
| Tabaquismo | Artrosis |
| Inactividad física | Dolor crónico |
| Condiciones de vida | Obesidad |
| Inanición | Efectos catabólicos de los fármacos |
| Encamamiento | ¿Cáncer? |
| Ingravidez | ¿Enfermedades inflamatorias crónicas? |
La masa magra, formada fundamentalmente por los músculos esqueléticos, representa aproximadamente el 45-55% de la masa corporal total y se reduce con el paso de los años. Dicha pérdida es uno de los elementos que intervienen en la pérdida funcional que frecuentemente aparece con la edad.
La sarcopenia fue definida por primera vez por Irwing Rosenberg en 1989 para describir la pérdida de masa muscular asociada al envejecimiento37, matizando posteriormente que dicha pérdida debe producirse de forma involuntaria38. Más tarde, William Evans confirmó dicha definición39. Esta pérdida puede no estar acompañada de una pérdida significativa de peso, puesto que a la pérdida de masa muscular puede asociarse un aumento de la masa grasa. Desde entonces se han sucedido diferentes definiciones de acuerdo al progreso en el conocimiento sobre los cambios de la composición corporal asociada al envejecimiento, en las técnicas de medida y en el acceso a la información de los estudios epidemiológicos más importantes. Sin embargo, pronto se reconoció que la pérdida de masa muscular no guardaba una relación lineal directa con la pérdida de fuerza muscular y se fue incorporando a la definición de sarcopenia la pérdida de fuerza y función muscular. Otro aspecto relevante es la confirmación de que con el envejecimiento también se producen cambios en las características micro y macroscópicas del músculo.
A partir de los 50 años el lento declive de la masa y la fuerza muscular, que se produce desde el pico alcanzado entre los 20 y 30 años, se acelera de forma muy llamativa, especialmente en las personas sedentarias y en los varones más que en las mujeres40. A pesar de ello, los varones tienen mayor masa muscular que las mujeres y una esperanza de vida más corta, por lo que la sarcopenia es, potencialmente, un problema de salud pública mayor en las mujeres que en los varones y podría explicar las diferencias entre géneros en la esperanza de vida activa. La pérdida muscular sigue un patrón diferente en los varones y en las mujeres. Mientras que en los primeros se produce de manera gradual, en las segundas, se produce de manera más abrupta al llegar la menopausia.
DefiniciónLa definición actual de sarcopenia, por tanto, no incluye solamente la pérdida de masa muscular, sino que considera también la pérdida de fuerza muscular y los cambios cualitativos del tejido muscular41. A pesar del reconocimiento de su importancia, no hay un consenso único para la definición operativa de la sarcopenia que facilite su utilización en la práctica clínica, aunque recientemente se están alcanzando consensos.
Un primer problema consiste en definir la forma de medir la masa muscular con las distintas técnicas disponibles y los puntos de corte. Así, la definición más clásica se basa en una fórmula que utiliza la suma de la masa muscular de las cuatro extremidades (masa muscular esquelética apendicular [ASM]), medida con DXA, y que define el índice de masa muscular esquelética (SMI) como ASM/altura2 (kg/m2)42. Esta definición se ve limitada por la dificultad que tiene la DXA de identificar la retención de líquidos o la infiltración grasa entre el músculo y los tejidos blandos. Algunos adultos obesos tienen una masa muscular baja si se considera en relación con su masa corporal total, aunque tengan una masa muscular en valores absolutos normal o incluso alta. Este concepto, que se conoce hoy como «obesidad sarcopénica», está causando grandes dificultades en la definición de la masa muscular normal. En los adultos delgados ocurre lo contrario. Así pues, el SMI probablemente clasifica inadecuadamente a las personas mayores obesas con limitaciones funcionales y de movilidad con un SMI alto, y también a las personas delgadas con SMI bajo y sin limitaciones funcionales. Para solucionar este problema, se han realizado diferentes propuestas. Así, Baumgartner et al43, en el estudio de Nuevo México, han ajustado el SMI según la masa grasa y encontraron que las personas con sarcopenia y obesidad tenían un mayor riesgo de discapacidad. Por otro lado, Janssen et al44 han utilizado la masa muscular en relación con el peso corporal según la fórmula: SMI = (ASM/masa corporal) x 100. Se considera un SMI normal si está por encima de 1 desviación estándar por debajo de la media de un joven adulto (entre 18 y 39 años) del mismo sexo. Se considera sarcopenia clase I si está entre 1 y 2 desviaciones estándar y clase II por debajo de dos desviaciones estándar. Las personas con sarcopenia clase II tienen 3 veces más probabilidades (las mujeres) y 2 veces más (los varones) de tener limitaciones funcionales y discapacidad que las personas mayores con un SMI normal44. De manera interesante, Newman et al45 utilizaron el ajuste de la masa magra por la masa grasa y el peso con dos fórmulas diferentes: masa magra apendicular dividida por altura al cuadrado (aLM/ht2) y masa magra apendicular ajustada por altura y masa grasa. Como punto de corte utilizaron el percentil 20 de la población estudiada. En los varones la sarcopenia se asoció a peor estado de salud, tabaquismo, baja actividad y limitaciones funcionales en extremidades inferiores. En las mujeres se encontró especialmente una asociación con las limitaciones funcionales en extremidades inferiores45. Recientemente, Cruz-Jentoft et al1 han propuesto una estrategia diagnóstica para su uso clínico, a la vez que defienden el manejo de la sarcopenia como un síndrome geriátrico1. En la estrategia se incluye, en una fase previa de cribado, la valoración de la velocidad de la marcha y la pérdida de fuerza muscular además de síntomas clínicos como la fatiga o debilidad muscular. Los seleccionados en esta fase deberán completar el estudio con la determinación de la masa muscular.
Esta falta de una definición de consenso de la sarcopenia está limitando gravemente la investigación clínica de este problema, por lo que recientemente varias sociedades científicas (European Union Geriatric Medicine Society (EUGMS), European Society for Clinical Nutrition and metabolism (ESPEN), International Academy on Nutrition and Aging e International Association of Gerontology and Geriatrics-European Region (IAGG-ER)) han presentado una definición de consenso de la sarcopenia en personas mayores y un procedimiento diagnostico2. Para este grupo, la sarcopenia es «un síndrome caracterizado por una progresiva y generalizada pérdida de masa y fuerza muscular esquelética con riesgo de resultados negativos como discapacidad física, peor calidad de vida y muerte». Es importante pues insistir en que la definición se basa en la pérdida de masa, de fuerza y de función muscular.
Puntos de cortePara poder interpretar adecuadamente los datos antropométricos, es necesario disponer de informaciones sobre los umbrales específicos para cada población y específicamente en personas mayores. Los mejores datos de referencia deberían contener información representativa de las diferentes etnias, razas y edades de un determinado territorio. En el estudio de Baugmgartner en la población de Nuevo México43, los puntos de corte para la sarcopenia son: SMI menor a 7,26kg/m2 en los varones y 5,45kg/m2 en las mujeres. Janssen et al,. utilizando datos del National Health and Nutritional Survey III (NHANES III) y habiendo evaluado la masa muscular con impedancia bioeléctrica (BIA) en una población de Estados Unidos, han señalado los puntos de corte por debajo de los cuales el riesgo de discapacidad aumenta de manera significativa46. Las mujeres con un SMI por debajo de 5,75kg/m2 tienen un incremento del riesgo de discapacidad física (OR=3,31, IC del 95%,1,91-5,73) y los varones por debajo de 8,50kg/m2 tienen un incremento del riesgo de discapacidad física de (OR=4,71, IC del 95%, 2,28-9,74). Finalmente, hay que destacar la importancia de disponer de datos de nuestro entorno para realizar un diagnóstico más ajustado. En este sentido, el estudio de Masanes et al47 propone puntos de corte en un estudio realizado en nuestro país de 8,31kg/m2 en los varones y 6,68kg/m2 en las mujeres.
EpidemiologíaLa prevalencia de la sarcopenia dependerá de la definición y de las técnicas utilizadas en los estudios de referencia. Así, según la definición de Baumgartner et al43 a partir de los datos del New Mexico Elder Health Survey, que utilizó la BIA para la valoración de la masa muscular, la sarcopenia afecta al 20% de los varones entre 70 y 75 años, al 50% de los de más de 80 años y entre el 25 y el 40% en las mujeres en las mismas franjas de edad. El mismo autor publicó datos de la misma población pero estudiada con DXA, obteniendo datos del 8,8% en mujeres y el 13,5% en varones de 60 a 69 años, y del 16% en mujeres y el 29% en varones mayores de 80 años48. En personas sanas que viven en la comunidad procedentes del estudio francés EPIDOS, el 10% de las mujeres tenían sarcopenia. El estudio NHANES III reporta que el 35% de las personas mayores tenían sarcopenia moderada y el 10% severa46. Estos estudios se basan sólo en la medida de la masa muscular y no en definiciones que incluyan masa y función, por lo que aún son muy preliminares.
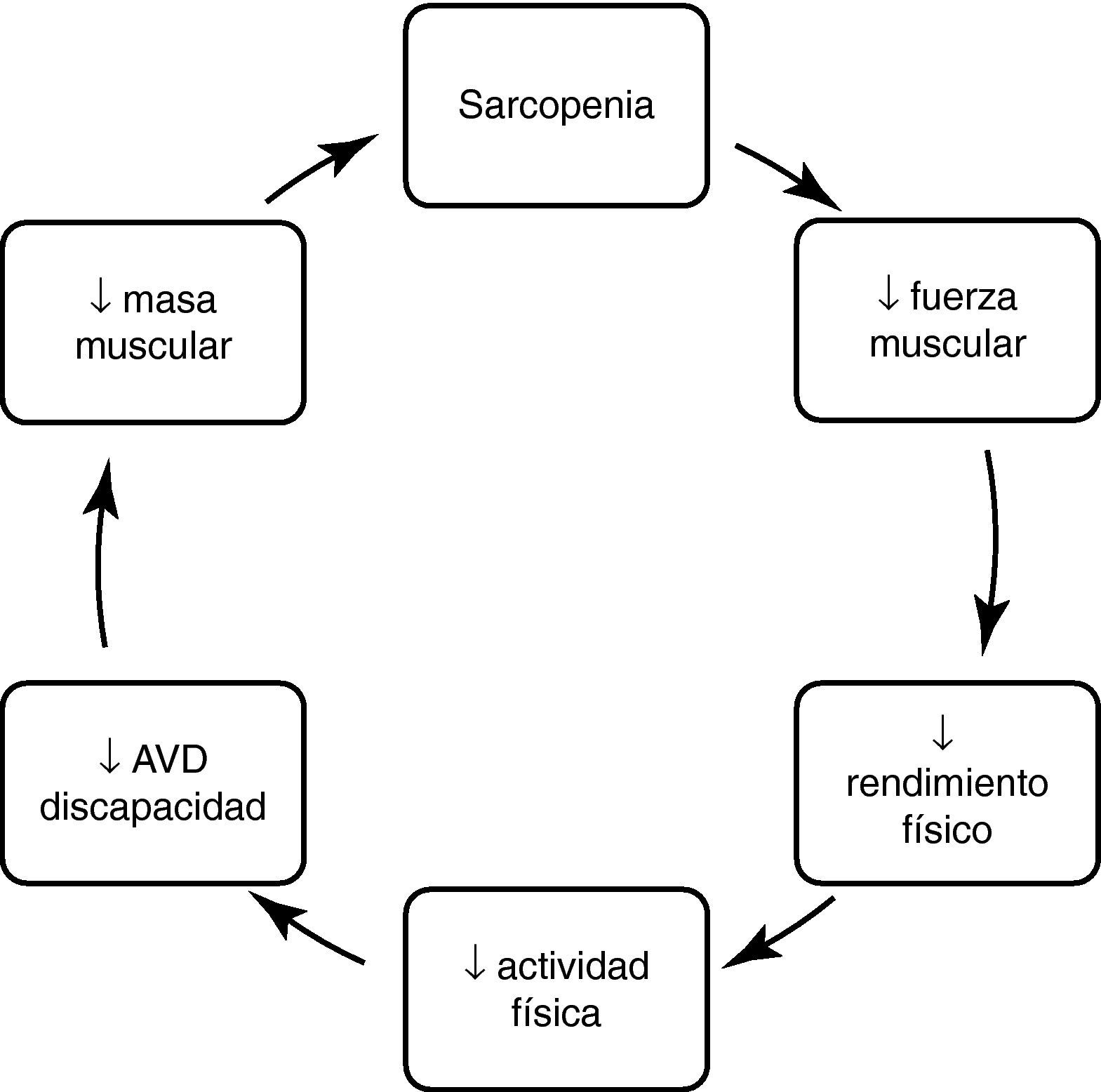
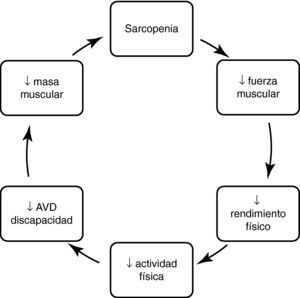
ConsecuenciasLa sarcopenia se asocia con una pérdida funcional y discapacidad y, como consecuencia, a una mala calidad de vida y finalmente a una mayor mortalidad. El mecanismo por el que aparecen estas consecuencias sigue un orden lógico en el que la disminución de la masa muscular se asocia a una disminución de fuerza muscular que, a su vez, disminuye el rendimiento físico, dificultando la realización de actividades habituales de la vida diaria, discapacidad y dependencia (Fig. 1).
Así, la sarcopenia se ha correlacionado, en estudios transversales, a un peor rendimiento físico y a discapacidad física. Las personas con sarcopenia parecen tener entre 2 y 5 veces más probabilidades de tener discapacidad que aquellas sin sarcopenia49. También se ha asociado a una menor fuerza muscular y resistencia50. Sin embargo, todavía hay muy pocos estudios longitudinales que hayan corroborado esta asociación de sarcopenia y discapacidad, y en algunos de ellos, como en el Cardiovascular Health Study, esta asociación es pequeña y solamente asociada a la sarcopenia importante51. En el estudio de Nuevo México, la asociación entre discapacidad y sarcopenia se ha encontrado solamente en los obesos sarcopénicos con un riesgo relativo de 2,652. La relación entre masa y fuerza muscular es, aproximadamente, lineal. Sin embargo, la relación entre masa muscular y rendimiento físico medido con un test como la velocidad de la marcha es curvilínea, por ello el punto de corte depende del tipo de actividad que valoremos. Ello es importante para comprender que el incremento de masa muscular puede no tener un impacto en la mejora del rendimiento en personas sanas y, sin embargo, un pequeño incremento puede tener un gran impacto en personas frágiles41.
La sarcopenia desempeña un papel determinante en la fisiopatología de la fragilidad y a través de ella la sarcopenia predispone a las caídas, al deterioro funcional, la discapacidad, un mayor uso de recursos hospitalarios y sociales, una peor calidad de vida y, finalmente, la muerte1,53. Atendiendo a todas las relaciones comentadas entre la sarcopenia y la salud, fundamentalmente por su relación con el rendimiento físico y la discapacidad, el impacto de la sarcopenia en la salud pública puede ser muy importante54.
DiagnósticoDiagnóstico de la pérdida de masa muscularGeneralmente, se utilizan dos indicadores para estandarizar la masa muscular: el índice de masa muscular (IMM) y el índice de masa esquelética (IME). El IMM, de forma similar al índice de masa corporal, se define como la cantidad de masa muscular en relación con la estatura (peso total de la masa muscular/altura2: kg/m2), mientras que el IME es el porcentaje de masa muscular en relación con el peso corporal (peso total de la masa muscular/peso corporal x 100: %).
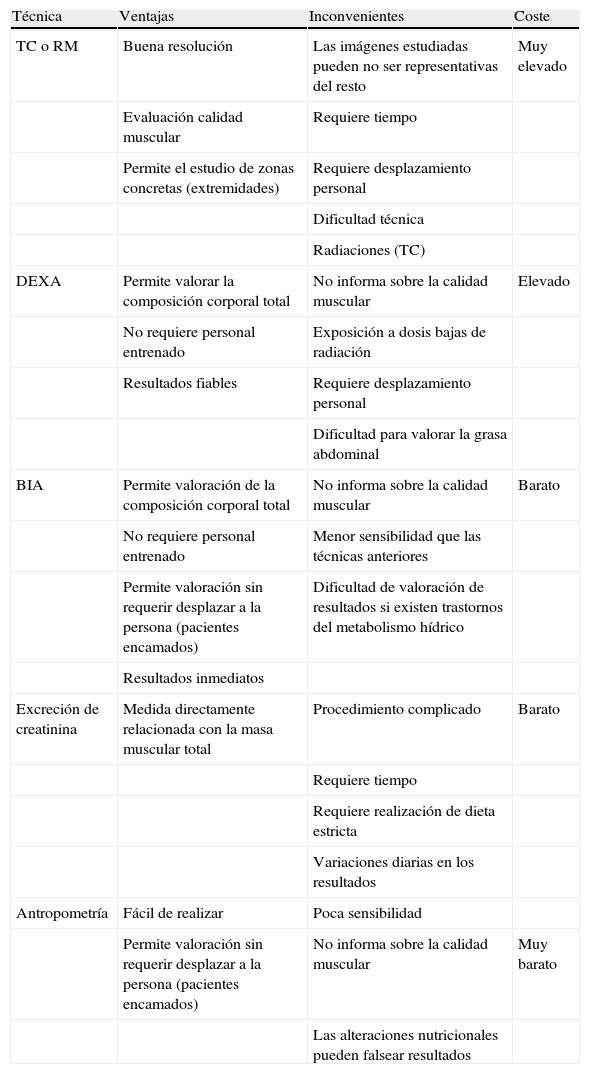
La cuantificación de la masa muscular total de una persona no es sencilla, ya que todos los métodos existentes tienen ventajas e inconvenientes. Disponemos para ello de la resonancia magnética (RM), la tomografía computarizada (TC), la DXA, la BIA, la determinación de la excreción urinaria de creatinina y la antropometría8,55 (tabla 2). Las técnicas radiológicas de diagnóstico por la imagen (RM y TC) permiten una valoración precisa de la masa muscular total mediante la realización de diversos cortes del cuerpo que permiten conocer el volumen total de cada componente. Basándose en la diferencia de densidad del tejido muscular (1,04kg/l), permiten calcular la masa total con gran exactitud, por lo que son el método de referencia o patrón de oro, pero su escasa accesibilidad y su elevado coste hacen poco viable su uso de forma generalizada, fuera de entornos de investigación.
Métodos utilizados para el diagnóstico de sarcopenia
| Técnica | Ventajas | Inconvenientes | Coste |
| TC o RM | Buena resolución | Las imágenes estudiadas pueden no ser representativas del resto | Muy elevado |
| Evaluación calidad muscular | Requiere tiempo | ||
| Permite el estudio de zonas concretas (extremidades) | Requiere desplazamiento personal | ||
| Dificultad técnica | |||
| Radiaciones (TC) | |||
| DEXA | Permite valorar la composición corporal total | No informa sobre la calidad muscular | Elevado |
| No requiere personal entrenado | Exposición a dosis bajas de radiación | ||
| Resultados fiables | Requiere desplazamiento personal | ||
| Dificultad para valorar la grasa abdominal | |||
| BIA | Permite valoración de la composición corporal total | No informa sobre la calidad muscular | Barato |
| No requiere personal entrenado | Menor sensibilidad que las técnicas anteriores | ||
| Permite valoración sin requerir desplazar a la persona (pacientes encamados) | Dificultad de valoración de resultados si existen trastornos del metabolismo hídrico | ||
| Resultados inmediatos | |||
| Excreción de creatinina | Medida directamente relacionada con la masa muscular total | Procedimiento complicado | Barato |
| Requiere tiempo | |||
| Requiere realización de dieta estricta | |||
| Variaciones diarias en los resultados | |||
| Antropometría | Fácil de realizar | Poca sensibilidad | |
| Permite valoración sin requerir desplazar a la persona (pacientes encamados) | No informa sobre la calidad muscular | Muy barato | |
| Las alteraciones nutricionales pueden falsear resultados |
BIA: análisis de impedancia bioeléctrica; DEXA: absorciometría dual de energía de rayos X RM: resonancia magnética nuclear; TC: tomografía computarizada.
La DXA permite estimar la composición corporal mediante el uso de absorciometría dual de energía de rayos X, ayudado por un programa específico que calcula la masa del tejido graso, óseo y magro. El cálculo se realiza sobre medidas realizadas en las extremidades y con estos datos se realiza la estimación de la masa muscular total. La correlación con la RM es buena y tiene un menor coste, pero para ciertos pacientes resulta poco accesible y la valoración puede distorsionarse según la cantidad de tejido graso que infiltra el músculo56,57.
En los últimos 20 años se ha extendido el uso de la BIA. Se basa en la medida de la conductividad eléctrica de los tejidos, lo que permite la cuantificación de la masa muscular a partir de fórmulas predictivas. Las alteraciones extremas del metabolismo hídrico (deshidratación o edema generalizado) pueden alterar los resultados obtenidos. Sin embargo, tiene la ventaja de que es fácil de realizar en cualquier lugar a un coste asequible, lo que la convierte en una herramienta útil en trabajos de campo. Su correlación con la RM también es buena, pero muestra mayor variabilidad en los resultados respecto a las técnicas anteriormente citadas58-60.
La determinación de la excreción urinaria de creatinina es una medida directamente relacionada con la masa muscular total, pero requiere un control estricto de la dieta realizada y los resultados obtenidos presentan una gran variabilidad en un mismo individuo. Por último, las técnicas basadas en la antropometría sólo dan una aproximación muy indirecta y son dependientes del observador, por lo que hoy día no son recomendables en este campo.
Diagnóstico de la pérdida de fuerza muscularExisten diferentes técnicas que permiten medir la fuerza muscular en diferentes grupos musculares, tanto a nivel de extremidades superiores como inferiores. Aunque es la función muscular a nivel de extremidades inferiores la que mejor se correlaciona con la función física, la medición de fuerza de manos también es un buen marcador. Los estudios en que se ha valorado la fuerza muscular mediante dinamómetro a nivel de mano (handgrip o prensión) o de extremidades (flexoextensión) han confirmado una progresiva pérdida de fuerza con el propio envejecimiento y su uso es apropiado para valorar la función muscular8. Se discute aún el valor de medir la potencia muscular (fuerza en función del tiempo), que parece guardar mejor correlación con ciertas actividades que la fuerza por sí misma.
Diagnóstico de la pérdida de función muscularUn escalón más es la medida de la función o rendimiento muscular, un escalón intermedio entre la fuerza muscular y la discapacidad. Existen varios instrumentos válidos, como la Short Physical Performance Battery, el test de los 6 minutos o la medición de la velocidad de la marcha61.
Aunque sería demasiado prolijo, es importante recordar la importancia de realizar un correcto diagnóstico diferencial de la sarcopenia con la desnutrición proteico-calórica y la caquexia, ya que son procesos que pueden compartir alguna característica, pero que responden a mecanismos fisiopatológicos diferentes62-64.
Nutrición y músculoLa ingesta de proteínas constituye el elemento fundamental para lograr una adecuada masa muscular en la juventud que se mantenga hasta edades avanzadas. Por este motivo, es necesario optimizar la ingesta proteica en los mayores, ya que se estima que un 32-41% de las mujeres y un 22-38% de los varones con edad igual o superior a los 50 años consumen proteínas por debajo de las recomendaciones existentes (DRI [Dietary Reference Intakes])65.
En las personas mayores coinciden algunos hechos fundamentales66. Por una parte, la ingesta proteica es inadecuada, y de hecho se postula que las DRI para proteínas (0,8g/kg/día) no son suficientes. Así, se propone alcanzar 1,0-1,2g/kg/día hasta obtener resultados concluyentes en los estudios en proceso. De momento, no se aconseja exceder 1,6g/kg/día, en un intento por evitar los efectos adversos relacionados con el deterioro de la función renal. El empleo de las DRI está basado en cálculos de balance nitrogenado que no expresan los requerimientos proteicos necesarios para prevenir la aparición de sarcopenia. Además, no considera las modificaciones que acompañan al envejecimiento (reducción de masa muscular, incremento de compartimento graso, cambios en ingesta alimentaria, niveles de actividad física y existencia de comorbilidad)67. Por otra parte, existe una resistencia a la síntesis proteica y una incapacidad para reducir el catabolismo proteico. En edades medias, se mantiene un equilibrio entre síntesis y catabolismo de proteínas; sin embargo, este último predomina en edades avanzadas. A continuación, se detallan las razones que sostienen este planteamiento:
- –
Las diferencias en la absorción intestinal de aminoácidos entre grupos de edad son inexistentes, excepto cuando se reduce el aporte de aminoácidos esenciales, lo que abre un papel fundamental en la intervención nutricional y en el desarrollo de la suplementación oral. Es de especial interés el caso de la leucina, ya que se ha descrito una menor sensibilidad a sus efectos en el anciano, lo que conlleva una resistencia anabólica que puede revertirse mediante un mayor aporte en la dieta. El aporte de su metabolito, denominado ß-hidroxi-ß-metilbutirato, se ha asociado con un aumento en la circunferencia braquial, fuerza prensora y masa muscular. Su empleo combinado con arginina y lisina en periodos de hasta 12 semanas conlleva una mejoría de parámetros de funcionalidad, fuerza, masa magra y síntesis proteica en mujeres ancianas68.
- –
En el anciano se ha descrito una mayor resistencia a la insulina, que mejora al realizar ejercicio físico de tipo aeróbico69. Su efecto sobre la síntesis proteica depende del aumento de vascularización muscular mediada por el óxido nítrico. En las personas mayores aumentan las concentraciones de endotelina-1 en respuesta a la secreción insulínica posprandial, actuando como antagonista del óxido nítrico70. El aporte proteico eleva los niveles del factor de crecimiento de tipo insulina (IGF-1), que tiene efectos anabólicos sobre el músculo. Este sería otro punto importante al plantear la intervención terapéutica; de hecho, en todos los estudios se enfatiza la necesidad de realizar ejercicio para contrarrestar el desarrollo de sarcopenia.
- –
Papel del estrés oxidativo. Como se explicó antes con más detalle, el envejecimiento provoca un daño oxidativo en el ADN, proteínas y lípidos. El daño celular se explica por factores intrínsecos y extrínsecos. Dentro de los factores extrínsecos destaca una ingesta alimentaria pobre en elementos antioxidantes71, sobre todo carotenoides, que son el mejor marcador biológico del consumo de frutas y verduras. Desde el punto de vista nutricional, la ingesta de carotenoides puede contrarrestar este fenómeno y mejorar la calidad del músculo. Estos elementos forman parte de la membrana celular e inhiben la peroxidación lipídica. Su déficit se relaciona con un incremento en los niveles de IL-672. Esto puede tener una trascendencia clínica, de hecho la disminución en los niveles séricos de carotenoides se relaciona en estudios multivariantes73 con una mayor dificultad para la deambulación, una menor fuerza prensora y una menor capacidad flexoextensora en rodilla y cadera a los 6 años de seguimiento. La oxidación proteica secundaria al estrés oxidativo se relaciona de forma independiente con una menor fuerza de prensión en mujeres ancianas no institucionalizadas74. Otros elementos antioxidantes procedentes de la dieta, pero menos estudiados, son selenio, vitamina E, alfa tocoferol, ascorbato y polifenoles.
El tratamiento de la sarcopenia tiene tres grandes pilares: la intervención nutricional, el ejercicio físico y, posiblemente, la intervención farmacológica. Revisaremos brevemente cada uno de ellos.
Recomendaciones sobre ingesta proteicaPara lograr una síntesis proteica muscular adecuada es fundamental el aporte de aminoácidos derivados de la dieta. Algunos autores defienden75 abandonar la concepción de requerimientos proteicos diarios a favor de profundizar en la cantidad de proteínas de alto valor biológico aportadas en cada comida y en el patrón de ingesta a lo largo del día. De esta forma, sería inútil considerar unos aportes proteicos globales diarios si en alguna de las comidas no se llega a una ingesta mínima, lo que favorecería en ese momento el catabolismo proteico. Este enfoque se complica si se considera que la ingesta energética procede de varios principios inmediatos, y que el aporte de hidratos de carbono reduce la respuesta anabólica en relación con los sujetos de menor edad, ya que posiblemente la síntesis proteica en el anciano es resistente a la acción insulínica, independientemente de la tolerancia a la glucosa. En este sentido, la introducción del factor ejercicio mejora la sensibilización del músculo ante el estímulo nutricional. Incluso se pueden obtener beneficios añadidos optimizando el momento de aporte proteico. Así, se ha observado que la ingesta de aminoácidos esenciales como la leucina mejora la síntesis proteica cuando se ofrece al finalizar la actividad física. Se ha demostrado un incremento del 25% en el área transversal del músculo cuádriceps y de un 15% en la fuerza extensora cuando un suplemento oral se tomaba inmediatamente tras el ejercicio, pero no 2h después76,77. Esto se ha podido comprobar igualmente en sujetos encamados, en los que el empleo combinado de ejercicio de resistencia y suplementación oral atenúa las pérdidas de masa y fuerza musculares78. Si el individuo consume ya una cantidad de proteínas adecuada, no se aprecian tan claramente estos efectos79.
El efecto estimulante de los aminoácidos esenciales se debe a la acción directa de la leucina en el inicio de la síntesis proteica80. El músculo del anciano es más sensible al efecto negativo de la inactividad y requiere un mayor aporte proteico que el recomendado. Aumentar la proporción de leucina en una mezcla de aminoácidos esenciales puede mejorar la respuesta anabólica muscular en el sujeto mayor por diferentes mecanismos81 (vías intracelulares de síntesis proteica muscular y mecanismos independientes de la insulina) y ser similar al observado en sujetos jóvenes. Este efecto anabólico se mantiene a largo plazo, aunque el proceso de síntesis proteica muscular es saturable, por lo que el aporte de aminoácidos esenciales debe respetar ciertos niveles82. Por otra parte, el volumen y el aporte energético de los suplementos utilizados debe ser razonable para no enlentecer el vaciamiento gástrico y aumentar la saciedad. Para alcanzar la máxima eficacia en la formulación se deben aportar los nutrientes que sean absolutamente necesarios para la síntesis proteica, minimizando las fuentes de energía procedentes de aminoácidos no esenciales e hidratos de carbono. En la tabla 3 se señalan algunos puntos fundamentales acerca de los requerimientos de proteínas.
Algunos conceptos interesantes sobre recomendaciones dietéticas
| La mayoría de los adultos se benefician de ingestas proteicas superiores a las establecidas por las Dietary Reference Intakes |
| Este aporte aumentado es beneficioso, no solo para mantener la masa muscular, sino para el manejo de otras entidades como la obesidad, la osteoporosis, la diabetes mellitus y el síndrome metabólico |
| Los requerimientos de proteínas son proporcionales al peso corporal, no a la ingesta de energía, ya que ésta se reduce con el envejecimiento |
| Las necesidades de proteínas aumentan en 1% por cada descenso de 100 Kcal en la ingesta energética por debajo de las 2000 Kcal diarias |
| Un estilo de vida sedentario reduce la eficiencia de los aminoácidos. La calidad de la dieta y la actividad física son los factores limitantes parta mantener un adecuado recambio proteico que permita la regeneración muscular |
| La síntesis proteica muscular requiere al menos 30 g de proteínas totales o 15 g de aminoácidos esenciales. La leucina sería un aminoácido básico |
| La edad altera la digestión y biodisponibilidad de algunas proteínas. Respecto a las proteínas de la leche, se absorben mejor las proteínas procedentes del suero que las caseínas |
Tomada de Whigham et al84.
El único elemento nutricional que ha demostrado mejorar la fuerza y disminuir el riesgo de caídas y fracturas en personas mayores en estudios controlados y aleatorizados es la vitamina D, como se comentará en el apartado de tratamiento farmacológico83. La suplementación con ácido linolénico disminuye las concentraciones de IL-6 en ancianos varones, pero no en mujeres. Su efecto sobre la masa y la fuerza muscular es mínimo, aunque su uso se acompaña de un discreto aumento de la grasa corporal84. Un metaanálisis85 valoró el efecto de los suplementos dietéticos sobre el aumento de masa y fuerza muscular; de los 250 compuestos estudiados, tan solo la creatina y el ß-hidroxi-ß-metilbutirato incrementaban fuerza y masa musculares en combinación con el ejercicio de resistencia. El efecto de la creatina está relacionado con la expresión de cadenas pesadas de miosina y con una acción anticatabólica sobre ciertas proteínas, mientras que el ß-hidroxi-ß-metilbutirato reduce el catabolismo proteico.
Por tanto, en el enfoque terapéutico de la sarcopenia son fundamentales la realización de ejercicio y la ingesta proteica, que en muchos casos debe alcanzarse mediante suplementos orales, especialmente en el sujeto desnutrido. Se considera esencial el efecto sinérgico existente entre suplementación y ejercicio físico, especialmente en aquellas personas que no alcanzan unos requerimientos proteicos mínimos86,87.
Ejercicio físicoComo se ha comentado, la potencia muscular alcanza un pico máximo entre la segunda y la tercera décadas de la vida, manteniéndose hasta los 45-50 años, comenzando entonces a disminuir88,89. La velocidad de esta reducción depende de multitud de factores, pero uno de los fundamentales es, sin duda, la actividad física. Está demostrado que la sarcopenia empeora con el desuso del músculo y que la inactividad produce una mayor y más rápida pérdida de masa muscular. Sin embargo, incluso los atletas veteranos desarrollan sarcopenia, lo que sugiere que esta entidad no puede ser completamente prevenida sólo con la actividad física. Pero es evidente que el estilo de vida sedentario típico en los países occidentales, que afecta a todas las edades pero especialmente a los ancianos, hace que la inactividad acelere la pérdida de masa muscular.
Es preciso distinguir entre actividad física (cualquier movimiento del cuerpo producido por una contracción de la musculatura esquelética que aumenta el gasto energético), ejercicio físico (es una subcategoría de la actividad física en la cual se realizan de una manera voluntaria, estructurada y repetitiva cierto tipo de movimientos corporales, con o sin la intención explícita de mejorar alguna característica del bienestar físico) y del bienestar físico o fitness, que se refiere a una serie de características que contribuyen a la capacidad de poder realizar trabajo físico: capacidad cardiorrespiratoria, potencia muscular, equilibrio, flexibilidad, composición corporal, etc.
Existen cuatro modalidades de ejercicio físico que pueden ser beneficiosos para los ancianos90,91: ejercicios de resistencia o potenciación muscular, aeróbicos, de equilibrio y de flexibilidad o elasticidad. En relación con la sarcopenia, no existe un tipo de ejercicio específico, todos parecen tener alguna utilidad, aunque los más beneficiosos son los de resistencia o potenciación muscular.
Ejercicios de resistenciaConsisten en la realización de contracciones dinámicas o estáticas contra una resistencia92. Pueden realizarse levantando pesas, con máquinas de resistencia o utilizando bandas elásticas. Estos ejercicios no solo aumentan la masa y potencia muscular, sino que mejoran otros aspectos como el equilibrio, la capacidad aeróbica, la flexibilidad, y otras limitaciones funcionales, como la velocidad de marcha, la capacidad de levantarse de una silla o la capacidad de subir escaleras, por lo que contribuyen a mantener la independencia funcional93,94. Las recomendaciones específicas son realizar estos ejercicios con pesas, 2-3 días por semana, en 1-3 series de 8-12 repeticiones cada una, que incluyan los 8-10 grupos musculares mayores, con una intensidad del 70-80% de la potencia máxima que puede realzarse con ese grupo muscular y con un descanso de un minuto entre las series95,96. Los movimientos deben ser realizados lentamente y el aumento de intensidad debe ser progresivo para evitar lesiones. Para pacientes muy debilitados u hospitalizados pueden emplearse lastres de tobillo para fortalecer los cuádriceps y los flexores de la cadera para recuperar o mantener o mejorar la capacidad de caminar. Suelen ser bien tolerados incluso por los muy mayores, institucionalizados y muy frágiles. Está ampliamente demostrado que los ejercicios de resistencia producen un incremento de la masa y potencia muscular algo más pequeño en términos absolutos en mayores que en jóvenes, pero similar en términos relativos. Latham et al97,98 han revisado recientemente la literatura sobre los programas de fortalecimiento muscular en ancianos. Su análisis ha demostrado un incremento en la potencia muscular entre moderado y grande, tanto en ancianos que viven en la comunidad como en institucionalizados.
Ejercicio aeróbicoLos ejercicios aeróbicos de intensidad media o moderada, como caminar o bicicleta estática a un 60% de la frecuencia cardiaca máxima, han demostrado su utilidad en la mejora de las prestaciones cardiovasculares y en actividades tales como caminar o levantarse de una silla. Se recomienda la realización de alguna de estas actividades (por ejemplo caminar) entre 3 y 7 días a la semana, 20-60min por sesión, a una intensidad alrededor del 40-60% de la reserva cardiaca máxima. Por supuesto, el aumento del tiempo y la intensidad debe ser progresivo.
Ejercicio de equilibrioLos ejercicios de equilibrio han demostrado eficacia en ancianos sanos y en aquellos con alteraciones de la movilidad. Respecto al tipo de ejercicio, el taichi y una intervención multifactorial que combina ejercicios de resistencia y equilibrio han demostrado eficacia en reducir las caídas. Ejemplos de ejercicios de equilibrio incluyen además del taichi, la marcha en tándem, mantenerse en pie sobre un solo pie, subir y bajar escaleras lentamente, caminar sobre las puntas y los talones, etc. Se recomiendan estos ejercicios entre 1 y 7 días por semana, en 1-2 series de 4-10 ejercicios diferentes, aumentando la dificultad progresivamente.
Ejercicios de flexibilidadLa elasticidad o flexibilidad disminuye con la edad y se acentúa por las deformidades óseas, la debilidad muscular, el acortamiento de los tendones y la menor elasticidad tisular frecuentes en los ancianos. Esta disminución de la elasticidad se asocia a un aumento de la incapacidad física. Se recomiendan ejercicios encaminados a aumentar la amplitud de los movimientos de los grupos musculares mayores 1-7 días en semana. La distensión del músculo debe mantenerse unos 20s. La intensidad debe aumentarse progresivamente.
Intervenciones farmacológicasEl reconocimiento de la importancia de la sarcopenia en la aparición de la discapacidad está promoviendo la investigación sobre las posibilidades de que una intervención farmacológica pueda intervenir en su curso. Sin embargo, la falta de criterios diagnósticos y de acuerdos sobre las medidas de resultados relevantes en los ensayos clínicos, que tampoco han sido aún definidas por las agencias reguladoras, está frenando la investigación y dificultando la interpretación de los resultados de los pocos estudios clínicos publicados. El número de moléculas en fase preclínica es, sin embargo, enorme y abre perspectivas de futuro prometedoras99.
La mayoría de los ensayos clínicos sobre la utilidad de fármacos en la sarcopenia se han basado en el uso de hormonas anabolizantes. En estos ensayos clínicos debe diferenciarse si el tratamiento hormonal empleado ha tenido en cuenta la determinación previa de los niveles de la hormona en cuestión porque, como se verá más adelante, es de suma importancia en la interpretación de los resultados obtenidos. A continuación, se revisan muy brevemente algunos de los medicamentos de los que existen datos más sólidos en seres humanos.
Vitamina DLa administración de vitamina D disminuye el riesgo de caídas, tanto en ancianos de la comunidad como institucionalizados100; sin embargo, sus efectos sobre la masa muscular, la fuerza muscular101 y el rendimiento arrojan resultados controvertidos102. Probablemente, el tratamiento con vitamina D en la sarcopenia adquiere mayor efectividad cuando se administra a personas con déficit de esta vitamina y forma parte de un tratamiento multifactorial. La forma farmacológica más empleada es el colecalciferol. La dosis no debe ser inferior a 800 U/día y en la evaluación de la respuesta terapéutica deben tenerse en cuenta las variables clínicas y los niveles plasmáticos de 25-OH-D3 (1.000 U/día aumentan en 10 ng/ml los niveles a los 3-4 meses de tratamiento)103.
Hormonas esteroides sexualesLa premisa que sostiene la utilización de hormonas esteroides en la sarcopenia se basa en que esta terapia hormonal sustitutiva altera la expresión de los genes a nivel muscular, aumenta la masa muscular y este aumento de la masa muscular aumenta la fuerza104.
La testosterona disminuye con la edad, tanto en varones como en mujeres, aunque son los niveles de testosterona libre los que guardan una mejor correlación con la masa que con la fuerza muscular105. La testosterona exógena administrada a personas con hipogonadismo aumenta la fuerza de prensión106, la fuerza muscular global76 y el rendimiento físico107. En varones sanos también se ha observado un aumento moderado de la fuerza muscular global y de la masa muscular con la administración de testosterona o dihidrotestosterona108, pero no de la fatigabilidad109. Cuando todos los sujetos reciben vitamina D y calcio, parece que el efecto de la testosterona sobre la fuerza muscular desaparece, manteniéndose sólo un aumento de la masa muscular y una disminución de la masa grasa corporal total110. Las dosis de testosterona utilizadas en estos estudios son de unos 5mg/día y la administración bien puede ser oral o transdérmica110, existiendo un buen perfil de seguridad a estas dosis en sujetos con niveles disminuidos de andrógenos. No obstante, es importante recordar los potenciales efectos secundarios de la administración de andrógenos, como son el aumento de la masa eritrocitaria, el aumento del riesgo cardiovascular, la retención hidrosalina, la ginecomastia, la inducción y exacerbación de las apneas del sueño y el riesgo de neoplasia de próstata.
La dehidroepiandosterona disminuye con la edad y se correlaciona de forma independiente con el área muscular de la pantorrilla y con la fuerza muscular111. Los estudios muestran resultados contradictorios. Así, la administración de 50mg/día durante 12 semanas en mujeres posmenopáusicas, cuando se combina con ejercicios de resistencia, no muestra beneficios adicionales a corto plazo112 ni tampoco a largo plazo en varones y mujeres con niveles bajos previos113 o con niveles normales114, mientras que dosis más elevadas de 100mg/día durante 6 meses aumentan la masa muscular en varones, pero no en mujeres115.
La mayoría de los estudios realizados en mujeres posmenopáusicas apuntan a que la sustitución estrogénica no aumenta la fuerza muscular a corto plazo116,117 ni a largo plazo118. La tibolona, un compuesto de perfil hormonal estrogénico, progestágeno y androgénico, ha mostrado a medio plazo, a dosis de 2,5mg/día, un aumento en la fuerza de prensión119.
Hormona del crecimientoLos niveles de hormona del crecimiento (GH) disminuyen con la edad. El primer gran ensayo realizado en personas mayores sanas a los que se administró dosis 0,3mg/kg 3 veces por semana de GH durante 6 meses mostró un aumento de la masa muscular, pero no de la fuerza muscular y todo ello a costa de elevados efectos adversos120. Posteriormente, se ha visto que la administración de GH, además de aumentar la masa muscular, podría aumentar la fuerza muscular, el número de fibras tipo II121 y la velocidad de la marcha, pero estos efectos desparecerían a las 8 semanas una vez suspendido el tratamiento122. Recientemente, se han analizado los efectos de la GH sobre la masa muscular en ancianos con déficit de GH después de 10 años en tratamiento sustitutivo y se ha observado que la masa muscular aumenta, como lo hace de forma transitoria la fuerza flexora de la rodilla123. También se han realizado ensayos que han combinado la GH con la testosterona en varones o con estradiol y progesterona en mujeres, viéndose un aumento de la masa muscular a las 26 semanas, pero sin prácticamente efecto sobre la fuerza muscular, a expensas de graves efectos adversos como edema, síndrome del túnel carpiano, artralgias e intolerancia a la glucosa y diabetes mellitus124. Otros, en cambio, realizados reciente y exclusivamente en varones han mostrado un aumento en la masa muscular y mejora de la capacidad aeróbica125, aumento de la fuerza muscular, aunque a expensas de una ligera elevación de la presión arterial sistólica126. En resumen, por el momento los riesgos de la GH siguen pareciendo mayores que los beneficios como para recomendar su uso clínico, que está lejos de ser autorizado.
Actualmente, también se están realizando ensayos con agentes miméticos de la grelina (la grelina estimula la secreción de GH) u otros secretagogos de la GH. Todavía es pronto para sacar conclusiones, pero los primeros resultados son contradictorios. Así, la administración de un agente mimético de la grelina (MK-667) durante 12 meses no ha mostrado ni un aumento de la masa muscular ni de la fuerza en ancianos sanos127. Por el contrario, la administración de capromorelina en ancianos con limitación funcional leve aumentó no solo la masa muscular, sino también la marcha en tándem y disminuyó la fatiga durante los 6 meses de tratamiento128. No obstante, ninguno de estos tratamientos es claramente superior a la actividad física.
Otros tratamientos farmacológicosSe ha comprobado que los inhibidores de la enzima convertidora de la angiotensina (IECA) previenen el declive mitocondrial, mejoran la función endotelial y el metabolismo muscular129, así como que los pacientes hipertensos que reciben tratamiento con IECA tienen una mayor área muscular y un declive de la velocidad de la marcha menor que aquellos hipertensos que toman otros antihipertensivos130. El perindropil a dosis de 4mg/día en ancianos con problemas de movilidad aumenta la distancia recorrida en la prueba de los 6min131. Sin embargo, recientemente después de 6 meses de tratamiento con fosinopril en ancianos con perfil de riesgo cardiovascular no se ha objetivado un aumento de la fuerza muscular ni del «rendimiento»132 ni cuando se han comparado IECA y antagonistas del calcio133.
Existen más posibilidades de terapia farmacológica para la sarcopenia que están en desarrollo en diferentes dianas terapéuticas como los bloqueadores de la miostatina134, los factores de crecimiento IGF-1 y MGF (factor de crecimiento mecánico), los moduladores androgénicos sintéticos135, el factor neutrofílico ciliar136 o los betaagonistas99 entre otros.
ConclusionesLa sarcopenia es un síndrome geriátrico frecuente y relevante para la práctica clínica diaria. Los cambios biológicos que conducen a la pérdida de fuerza y masa muscular se relacionan además, intrínsecamente, con los mecanismos del envejecimiento. No es, por tanto, sorprendente que la investigación en este campo esté creciendo exponencialmente y que la sarcopenia se haya colocado en los últimos años en el primer plano del interés geriátrico y gerontológico. Las personas que trabajan en estas disciplinas deben mantenerse al día en los conocimientos y participar, si es posible, en la investigación sobre la misma. El Observatorio de la Sarcopenia de la SEGG pretende ser un instrumento útil en la consecución de estos objetivos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.