INTRODUCCION
En todos los seres vivos las funciones corporales no son estáticas, sino que varían con el tiempo de una manera cíclica, bien sea mediante patrones de 24 h (ritmos circadianos), mensuales, estacionales o anuales. Quizá los mejores ejemplos de biorritmos los muestran las plantas con su dependencia de las estaciones anuales y de otros factores como la intensidad de luz, la presión atmosférica, la humedad, etc. Este mismo carácter rítmico se presenta en el reino animal y, por supuesto, en el hombre. Variaciones como el patrón día/noche (vigilia-sueño), ritmo mensual (menstruación) son bien conocidas. Estos cambios dependen en gran medida del eje inmunitario-neuroendocrino1,2. Uno de los relojes que controlan los cambios rítmicos está situado en el núcleo supraquiasmático, al menos en la rata3. Esta dependencia de los ritmos tiene suma importancia tanto en fisiología como en patología e incluso en terapéutica: p. ej., tanto las muertes por infarto de miocardio4, el tamaño del infarto5 o la incidencia de taquicardia/fibrilación ventricular6 siguen un ritmo estacional, con un pico máximo en invierno; en terapéutica, muchos tratamientos, como, por ejemplo, los quimioterapéuticos, se ajustan según un ritmo circadiano7.
Desde los pioneros trabajos de Gerschman et al8, las teorías sobre el envejecimiento se basan en la acción tóxica del oxígeno, particularmente la de los radicales libres de oxígeno (RLO) en las mitocondrias9-13, aunque también hay evidencia en modelos de envejecimiento de daño de ADN14,15.
Los RLO atacan todos los principios elementales produciendo diferentes metabolitos (p.ej., malondialdehído [MDA] en el caso de la peroxidación lipídica, ácidos grasos, 8-hidroxi-deoxiguanosina de las bases (nucleicas, etc.), la determinación de los cuales sirve como expresión de estrés oxidativo (EO). La determinación urinaria de sustancias reactivas al ácido tiobarbitúrico (TBARS), por espectrofotometría, es uno de los métodos frecuentemente utilizados para valorar los valores de MDA y de esta forma establecer el estado oxidativo16. La tasa de MDA depende de la producción de RLO y de su dismutación (neutralización) por moléculas antioxidantes, cuya fuente en condiciones habituales está en los alimentos de origen vegetal (vitaminas C y E, carotenos, polifenoles, etc.).
Con el objeto de obtener muestras de MDA en amplias poblaciones, hemos puesto a punto una técnica de determinación de TBARS en orina, que al ser incruenta, facilita la posibilidad de aumentar las cohortes17. Los estudios se han realizado en balnearios incluidos en el Programa de Termalismo Social del Instituto para las Migraciones y Servicios Sociales (IMSERSO) del Ministerio de Trabajo y Asuntos Sociales de España que, por sus características, permite tener controlados a los voluntarios en hábitos de vida y tratamiento. Hernández-Torres et al17,18 han mostrado que la estancia en el balneario disminuye significativamente la eliminación urinaria de TBARS, particularmente a partir del noveno día de tratamiento. La magnitud de la disminución depende directamente de la cantidad de TBARS urinarios a la llegada al balneario19.
Las causas de la producción de RLO en el organismo son varias, e influyen de un modo notable el ejercicio físico20-22, la obesidad23-25 y la edad26, entre otros factores. El objetivo del presente trabajo es analizar si la eliminación urinaria de TBARS depende del mes del año en que se hace la determinación.
MATERIAL Y MÉTODOS
Se han obtenido muestras de orina de 230 voluntarios del Programa de Termalismo Social del IMSERSO, 115 varones y 115 mujeres, rango de edad de 52-81 años, que asistieron a 2 balnearios españoles, uno de aguas sulfuradas (110 voluntarios; 55 varones y 55 mujeres) y otro de aguas bicarbonatadas-sulfatadas (120 voluntarios; 60 varones y 60 mujeres), en 3 estaciones distintas del año: otoño (septiembre, octubre y noviembre), primavera (marzo y mayo) y verano (julio), aunque en años diferentes. Se determinó la concentración de TBARS mediante espectrofotometría a la llegada al balneario y a los 14 días de tratamiento con aguas mineromedicinales; paralelamente se les realizó historia clínica que incluía tratamiento médico-crenoterápico a recibir y registro de la presión arterial, entre otras variables. Todos los voluntarios se sometieron a la misma dieta y al mismo régimen de vida y continuaron tomando su medicación. En ningún caso hubo modificaciones del tratamiento farmacológico que realizaban los pacientes hipertensos.
Los voluntarios realizaron un régimen de comidas diarias a base de desayuno, comida y cena, con dietas globales diarias entre 2.000 y 2.500 calorías, rica en verduras y vegetales, hiposódica en origen y con vino tinto (250 ml) durante las comidas, con ejercicio físico moderado superior a 60 min de paseo diario.
Técnica de detección en orina humana de productos de peroxidación lipídica
La metodología ha sido descrita previamente por Hernández Torres et al17,18: las muestras de orina se recogen en tubos de plástico estériles, que se recubren con papel de estaño, para preservarlos de la luz solar y rápidamente se congelan para evitar oxidaciones, manteniéndolas en el frigorífico congelador a 20 ºC durante el traslado al laboratorio, que se realiza en nevera con nieve carbónica, para posteriormente conservarlas en el laboratorio a 78 ºC. La determinación se realiza en espectrofotómetro a 535 nm mediante una modificación de la técnica de Uchiyama y Mihara27. Los valores obtenidos se expresan en relación con la tasa de creatinina en orina como nmol/mg de creatinina.
Análisis estadístico
Los datos obtenidos se expresan como media ± error estándar de la media. Las medias se compararon mediante el test de la t de Student, previa prueba de Snedecor y correspondiente corrección de Welch, cuando las varianzas no eran homogéneas. Se utilizó el método de Bonferroni para comparar más de 2 medias. Se consideró significativo p < 0,05.
RESULTADOS
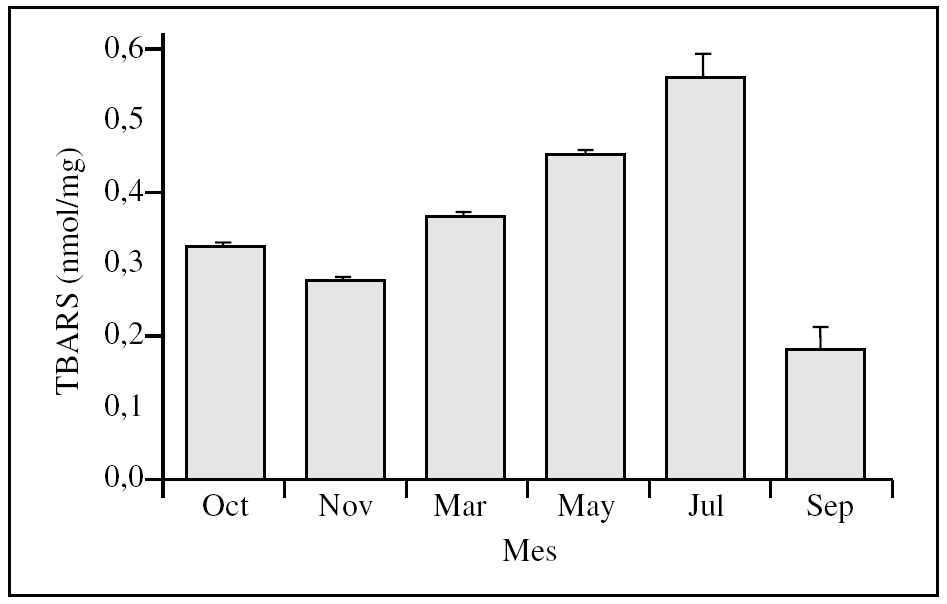
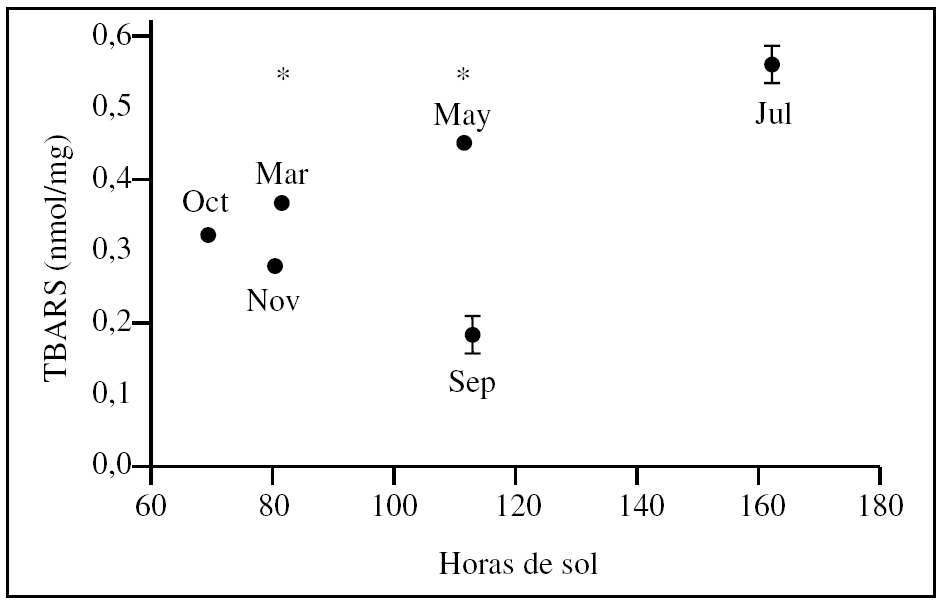
La excreción urinaria de TBARS a la llegada al balneario varió dependiendo del mes del año (fig. 1). Se observa un incremento paulatino de la concentración de TBARS desde noviembre (mínimo) a julio (máximo), seguida de un descenso en septiembre. Los resultados no indican que haya una relación directa entre la excreción urinaria de TBARS y las radiaciones solares (expresadas como horas de sol) recibidas, pues a 80 h corresponden 2 niveles distintos (p = 0,00); lo mismo sucede con 110 h (fig. 2).
Hay diferencia estadísticamente significativa entre casi todos los valores, salvo entre los medidos en las muestras de octubre y noviembre, pese a que hay 10 h de sol de diferencia; por otro lado, noviembre y marzo, con tan sólo una diferencia de 2 h de sol, presentan valores estadísticamente distintos (p < 0,05). (Se desconoce qué pasa en agosto por no haber obtenido muestras en ese mes.) No existió diferencia entre ambos sexos.
DISCUSION
Los valores de TBARS excretados son la expresión del EO global del organismo, así como de los producidos localmente en el riñón, variable según el estado fisiopatológico renal28.
Entre otros factores, la producción de RLO está influida por la edad, y hay un aumento progresivo de MDA en sangre desde el nacimiento hasta los 90 años26. Sin embargo, el análisis por quintiles muestra que entre los 55 y los 75 años no hay cambios apreciables en la eliminación urinaria de TBARS17,18, por lo que hay que concluir que, o bien el incremento con la edad de la producción de MDA es muy paulatino, o bien que el pequeño déficit de función renal debido al envejecimiento enmascara en la orina el aumento de TBARS en sangre. Por otra parte, también podría deberse a la diferente metodología utilizada, MDA en sangre26 y TBARS en orina17,18.
El presente estudio muestra cambios en la cantidad de TBARS urinarios dependiendo de la época del año en que se haga el estudio. Las variaciones estacionales pueden deberse a las radiaciones solares recibidas; sin embargo, en la figura 2 se muestran las radiaciones similares que producen distintos valores urinarios de TBARS, dependiendo de la época del año, lo que hace pensar que hay otros factores condicionantes. Uno de los factores sería la síntesis de la vitamina D que varía con la época del año29; esta vitamina es un antioxidante de membrana, ya que la vitamina D3 (colecalciferol), su metabolito 1,25-dehidroxicolecalciferol y la vitamina D2 (ergocalciferol) inhiben la lipoperoxidación dependiente de hierro29. Éste no es evidentemente el único factor, ya que la síntesis de la vitamina D3 sí depende de la radiación solar.
Arnaud et al30, en un estudio llevado a cabo en la isla de Cuba entre varones sanos, encuentran también variaciones estacionales en los componentes plasmáticos del balance oxidativo, TBARS y antioxidantes; sin embargo, en su estudio encuentran la mayor concentración plasmática de TBARS en el mes de octubre y la menor en los meses de junio-julio. Seguramente los diferentes valores atmosféricos debidos a la diferente situación geográfica de la isla en comparación con España explican la diferencia.
¿Cuáles pueden ser las causas de este carácter rítmico? Como factor único hay que excluir las horas de radiación solar, pues no hay una relación estricta (fig. 2), ya que dependiendo del mes la eliminación urinaria es distinta. Como factores contribuyentes no hay que descartar las diferentes tasas de síntesis de factores antioxidantes (ácido úrico, vitamina D, glutatión, etc.) debidas a cambios estacionales; además hay que tener en consideración la variación anual del contenido de moléculas antioxidantes que se ingieren con la alimentación, fundamentalmente de frutas y verduras (vitaminas C y E, carotenos, licopenos, quercetoides, isoflavonas, resveratroles, etc.).
Lenton et al31 han mostrado una correlación entre el contenido de glutatión y vitamina C en linfocitos humanos: éstos son 2 antioxidantes que se complementan en su efecto barredor de RLO, de tal modo que la administración de ascorbato incrementa los valores de glutatión. El análisis estacional de los valores de vitamina C en linfocitos muestra que hay un máximo desde finales de primavera y el verano y un mínimo en otoño-invierno. Como glutatión y ascorbato van paralelos, se puede deducir que ambos antioxidantes tienen su máximo en primavera-verano. Se han descrito resultados similares en las mediciones de vitamina D32. Sin embargo, estos resultados no explican el incremento de productos de lipoperoxidación basales, precisamente en los meses en que hay una tasa mayor de glutatión, ascorbato y vitamina D, aunque se puede especular que la producción de RLO exógenos (radiaciones ultravioladas y otros agentes) está regulada por los mismos factores que los disminuyen mediante un incremento de antioxidantes.
En resumen, hay variaciones estacionales en la eliminación urinaria de los productos de peroxidación lipídica. Los factores causales son una conjunción de diferentes agentes oxidantes (horas de radiación solar, etc.) y antioxidantes (dieta, valores plasmáticos de antioxidantes, efecto balneario, etc.). Quizá sería conveniente tener presente esta estacionalidad a la hora de tratar procesos crónicos ligados a cambios en el equilibrio oxidativo.
Correspondencia: Dr. J.R. Ramón.
Instituto de Salud Carlos III.
Sinesio Delgado, 6. 28029 Madrid. España.
Correo electrónico: jramon@isciii.es
Recibido el 3-3-2006; aceptado el 23-5-2006.