La población de mayor edad infectada por COVID-19 presenta una peor evolución clínica, siendo más susceptible a desarrollar manifestaciones graves. Las diferencias entre la población anciana y muy anciana, la mortalidad y los factores pronósticos asociados a la infección por SARS-CoV-2 no han sido suficientemente estudiados.
MétodosRegistro observacional de 416 pacientes ancianos ingresados de forma consecutiva por infección respiratoria COVID-19 entre el 1 de marzo y el 30 abril de 2020 en el Hospital General Universitario de Ciudad Real. Se registraron variables clínicas y analíticas, intervenciones terapéuticas y desarrollo de eventos durante el ingreso y tras el alta hasta el 15 de junio de 2020, con el objetivo de analizar la mortalidad y factores pronósticos asociados.
ResultadosLa edad media fue de 84,43±5,74 años. Los pacientes ancianos (entre 75 y 84 años) constituyeron un 50,2% de la muestra y los muy ancianos (≥85 años) el 49,8% restante. En el modelo de regresión de Cox multivariante, el riesgo de mortalidad fue mayor en pacientes muy ancianos (HR=2,58; IC95%: 1,23-5,38; p=0,01), hipertensos (HR=3,45; IC95%: 1,13-10,5; p=0,03) y con enfermedad renal crónica (HR=3,86; IC95%: 1,3-11,43; p=0,02). En cambio, la prescripción de calcioantagonistas (HR=0,27; IC95%: 0,12-0,62; p=0,002) y la terapia anticoagulante durante la hospitalización (HR=0,26; IC95%: 0,08-0,83; p=0,02) se asociaron con mayor tiempo libre de mortalidad.
ConclusionesLos pacientes muy ancianos, hipertensos y con enfermedad renal crónica presentaron mayor riesgo de mortalidad por infección respiratoria COVID-19. En cambio, el empleo de anticoagulación terapéutica y calcioantagonistas durante el ingreso se asociaron con mayor probabilidad de supervivencia en el seguimiento a corto plazo.
Elderly patients with COVID-19 has a worse clinical evolution, being more susceptible to develop serious manifestations. The differences between the elderly and very elderly population, mortality and associated prognostic factors of SARS-CoV-2 infection have not been enough studied yet.
MethodsAn observational study of 416 elderly patients admitted consecutively to Hospital General Universitario de Ciudad Real for COVID-19 respiratory infection from March 1st to April 30th, 2020. Data were collected including patient demographic information, medical history, clinical characteristics, laboratory data, therapeutic interventions and clinical outcomes during the hospitalization and after discharge, until June 15, 2020 with the aim of analyzing mortality, and associated prognostic factors.
ResultsThe mean age was 84.43±5.74 years old; elderly patients (75-84 years) were 50.2% of the sample and very elderly (≥85 years) the remaining 49.8%. In Cox regression model, mortality rate was higher in very elderly group (HR = 2.58; 95% CI: 1.23-5.38; P = .01), hypertensive (HR = 3, 45; 95% CI: 1.13-10.5; P = .03) and chronic kidney disease patients (HR = 3.86; 95% CI: 1.3-11.43; P = .02). In contrast, calcium antagonists (HR = 0.27; 95% CI: 0.12-0.62; P = .002) and anticoagulant therapy during hospitalization (HR = 0.26; 95% CI: 0.08 0, 83; P = .02) were associated with a longer time free of mortality.
ConclusionsMortality rate was higher in very eldery patients compared with eldery; and in hypertensive and chronic kidney disease patients. Anticoagulation therapy and calcium chanel bloquers treatment during hospitalization were associated with a higher survival in the short-term follow-up in patients hospitalized with COVID-19.
La infección por el coronavirus tipo 2 del síndrome respiratorio agudo grave (SARS-CoV-2) denominada COVID-19 (coronavirus infectious disease) constituye una emergencia sanitaria a nivel mundial. Los primeros casos reportados fueron notificados en China el 31 de diciembre de 2019; desde entonces, los contagios y muertes se han multiplicado, alcanzando la actual categoría de pandemia, decretada por la Organización Mundial de la Salud el 11 de marzo de 20201–3.
Las manifestaciones clínicas de la COVID-19 son variadas y principalmente implican al aparato respiratorio; los síntomas más frecuentes son fiebre, tos, disnea, dolor de garganta y rinorrea. Sin embargo, la afectación más grave es el síndrome de distrés respiratorio agudo (SDRA)2–4. Además de las manifestaciones respiratorias, la infección grave por COVID-19 puede tener importantes implicaciones cardiovasculares. De hecho, se ha señalado que los pacientes con enfermedad cardiovascular o hipertensión arterial presentan peor pronóstico3–5. Asimismo, se ha asociado a complicaciones tales como daño miocárdico agudo, arritmias y enfermedad tromboembólica2,6.
Aunque la relación existente entre la infección por coronavirus y la enfermedad cardiovascular es controvertida, podría ser atribuible a la relación que hay entre el SARS-CoV-2 y la enzima conversora de angiotensina 2 (ECA2)7. Se postula que el SARS-CoV-2 utiliza a la proteína ECA2, presente en la superficie de las células pulmonares, como puerta de entrada en la infección. Así, los inhibidores de la enzima conversora de angiotensina (IECA)/antagonistas del receptor de angiotensina 2 (ARA2) producen un aumento de la expresión de la ECA2, lo que a nivel de las células pulmonares favorecería la entrada del virus, propiciando y agravando la infección5,8,9. Sin embargo, otras publicaciones apuntan a un probable papel beneficioso o, al menos, no perjudicial de estos fármacos10–12, existiendo actualmente la recomendación de no suspenderlos10–14.
España ha sido un país fuertemente castigado por la COVID-19; a 24 de junio de 2020 Castilla-La Mancha, con 17.965 casos y 3022 muertes, constituye la comunidad autónoma española con mayor tasa de mortalidad (145,6 muertos/100.000 habitantes), destacando la situación de Ciudad Real, que con 200,9 decesos por cada 100.00 habitantes representa la provincia con mayor tasa de mortalidad ajustada por población, datos notablemente superiores a la tasa nacional (60,8/100.000)15.
Esta enfermedad ha afectado en enorme medida a la población anciana, constituyendo una verdadera emergencia geriátrica15, algo que no es baladí, sobre todo si tenemos en cuenta que nuestro país es uno con una población más envejecida (aproximadamente 3.328.334 personas son mayores de 75 años)16. No en vano, la Organización de las Naciones Unidas sitúa a España como el país más envejecido del mundo para 205017, cuando se espera que la población octogenaria llegue a los 4 millones de habitantes, y hasta un 30% de la población sea mayor de 65 años17,18.
La evidencia acerca del impacto por COVID-19 en la población muy anciana es reducida. Se ha identificado la edad como predictor independiente de mortalidad, incrementado de manera importante el riesgo de muerte en los pacientes septuagenarios y casi triplicándolo en los pacientes octogenarios3,19. Estos resultados pueden atribuirse a la elevada comorbilidad, la alta prevalencia de demencia y síndromes geriátricos, la mayor fragilidad y la menor reserva fisiológica y funcional18. La población anciana es un colectivo muy vulnerable y heterogéneo, sin embargo, no está justificado emplear la edad como único criterio en la toma de decisiones. A este respecto, tanto el informe del Ministerio de Sanidad sobre los aspectos éticos en situaciones de pandemia SARS-CoV-2 del 2 de abril 2020 como la European Geriatric Medicine Society recuerdan que la edad avanzada no debe ser un criterio para excluir a pacientes de unidades hospitalarias especializadas y, en ningún caso, debe considerarse como criterio único para denegar o limitar la asistencia sanitaria20,21.
El presente trabajo pretende evaluar la evolución clínica del COVID-19 en población anciana (75-84 años) y muy anciana (≥85 años) en términos de mortalidad y factores pronósticos asociados (comorbilidad, parámetros clínicos y analíticos y tratamiento recibido).
MétodosDiseño del estudio y poblaciónSe trata de un estudio unicéntrico de carácter observacional de cohorte retrospectivo de pacientes ingresados por COVID-19 en el Hospital General Universitario de Ciudad Real entre el 1 de marzo y el 30 de abril de 2020.
Se incluyeron a los pacientes, con edad≥75 años, ingresados en planta de hospitalización del Hospital General Universitario de Ciudad Real entre el 1 de marzo y el 30 de abril de 2020 con resultado positivo de la prueba de «reacción en cadena de la polimerasa» para el SARS-COV-2 y semiología clínica y/o radiológica de afectación respiratoria. Se excluyeron a los pacientes ingresados en dicho centro que, con resultado positivo, ingresasen sin afectación clínica ni radiológica a nivel respiratorio.
El protocolo del estudio fue aprobado por el comité ético de investigación clínica del hospital. Se obtuvo el consentimiento informado para el uso de los datos, y la confidencialidad de estos se garantizó según la Ley de Protección de Datos Personales y garantía de los derechos digitales, realizando una base de datos anonimizada y disociada. En aquellos pacientes en los que por determinadas circunstancias no se pudo recabar el consentimiento informado para el uso de datos de forma directa, se obtuvo de forma indirecta a partir de familiares de primer grado.
Recogida de datosA partir de la historia clínica digitalizada se recogieron las variables demográficas (sexo y edad), clínicas (motivo de consulta e ingreso, constantes vitales, exploración física) y las principales comorbilidades previas al ingreso, tales como factores de riesgo cardiovascular (hipertensión arterial, diabetes mellitus, hábito tabáquico activo); enfermedad pulmonar obstructiva crónica, asma; enfermedad renal crónica, a partir del estadio G3a (filtrado glomerular<60ml/min/1,73m2); cardiopatía isquémica, insuficiencia cardiaca y fibrilación auricular. Del mismo modo, se registró la mortalidad durante el ingreso, la mortalidad total y la tasa de reingreso hospitalario hasta el final del seguimiento. Los resultados de las variables analíticas (hemograma, coagulación y bioquímica) se obtuvieron del sistema informatizado de pruebas complementarias. El tratamiento domiciliario previo al ingreso se consultó en el registro electrónico de prescripción del Sistema de Salud de Castilla La Mancha; de igual modo, la medicación administrada durante el ingreso se obtuvo del registro electrónico de farmacia hospitalaria. Se registraron las terapias administradas frente COVID-19, así como el tratamiento antihipertensivo (IECA, ARA2, calcioantagonistas, diuréticos, betabloqueantes y fármacos alfabloqueantes con indicación cardiovascular) durante el ingreso y previo al mismo.
DefinicionesLa variable resultado principal fue la mortalidad por cualquier causa asociada a la infección por SARS-CoV-2 en la población anciana durante el ingreso hospitalario y en el seguimiento hasta el 15 de junio de 2020. Por otro lado, se analizaron las diferencias en la evolución entre pacientes ancianos (75-84 años) y muy ancianos (≥85 años) y las diferencias con respecto a la prescripción previa al ingreso de antihipertensivos, así como los tratamientos empleados durante la hospitalización.
Se consideró como fecha de inicio de seguimiento la fecha de ingreso hospitalario y como fecha fin de seguimiento, el fallecimiento, o en caso de no producirse, el 15 de junio de 2020.
Análisis estadísticoTodos los análisis estadísticos se realizaron con el software Statistics (Versión 26.0, IBM, Armonk, Nueva York, Estados Unidos). Las variables cualitativas se presentan como frecuencias y porcentajes. Las variables cuantitativas como estadísticos de tendencia central (media aritmética o mediana) y estadístico de dispersión (desviación típica o rango intercuartílico)
Inicialmente, se llevó a cabo un estudio descriptivo, valorando la distribución de frecuencias absolutas y porcentajes de todas las variables estudiadas. Posteriormente, se llevó a cabo el estudio analítico en el que se compararon los grupos de ancianos frente a muy ancianos (tabla 1) y los pacientes que fallecieron frente aquellos que sobrevivieron (tabla 2). Para la comparación de variables dicotómicas o politómicas se empleó la prueba de chi-cuadrado y, si los valores esperados de al menos el 80% de las celdas en una tabla de contingencia eran menores de 5, se empleó la prueba exacta de Fisher. En el caso de las variables cuantitativas, en primer lugar, se contrastó la normalidad de las distribuciones mediante el test de Kolmogorov-Smirnov; en el caso de tratarse de una distribución normal se empleó la prueba de T de Student para muestras independientes, y como test no paramétrico en aquellas variables de distribución no normal, se utilizó el test de U de Mann-Whitney.
Características clínicas basales, manejo intrahospitalario e incidencia de eventos en función de la edad
| Población del estudio (n=416) | 75-84 años (n=209) [50,2%] | ≥85 años (n=207) [47,8%] | Valor de p | |
|---|---|---|---|---|
| Edad (años) | 84,43±5,74 | 79,7±2,8 | 89,2±3,5 | |
| Sexo, n (%) | ||||
| Varón | 199 (47,85) | 107 (51,2) | 92 (44,4) | 0,17 |
| Antecedentes personales, n (%) | ||||
| Hipertensión arterial | 342 (82,2) | 171 (81,8) | 171 (82,6) | 0,83 |
| Diabetes mellitus | 110 (26,4) | 67 (32,1) | 44 (21,3) | 0,01 |
| Tabaquismo | 53 (12,7) | 30 (14,4) | 23 (11,1) | 0,45 |
| Obesidad | 58 (13,9) | 36 (17,2) | 22 (10,6) | 0,52 |
| EPOC | 43 (10,3) | 23 (11) | 19 (9,2) | 0,54 |
| Asma | 9 (2,2) | 3 (1,4) | 6 (2,9) | 0,34 |
| SAHS | 29 (7) | 19 (9,1) | 10 (4,8) | 0,09 |
| ERC | 83 (20) | 35 (16,7) | 48 (23,2) | 0,1 |
| Cardiopatía isquémica | 49 (11,8) | 23 (11) | 26 (12,6) | 0,62 |
| Insuficiencia cardiaca | 61 (14,7) | 27 (12,9) | 34 (16,4) | 0,31 |
| Fibrilación auricular | 78 (18,8) | 32 (15,3) | 46 (22,2) | 0,71 |
| Tratamiento antihipertensivo previo, n (%) | ||||
| IECA/ARA2 | 240 (57,7) | 112 (58,4) | 118 (57) | 0,78 |
| ACA | 84 (20,2) | 41 (19,6) | 43 (20,8) | 0,77 |
| Diurético de asa | 117 (28,1) | 45 (21,5) | 72 (34,8) | 0,003 |
| Betabloqueantes | 117 (28,1) | 61 (30,6) | 53 (25,6) | 0,25 |
| Alfabloqueantes | 32 (7,7) | 17 (8,1) | 15 (7,2) | 0,73 |
| PaO2/FiO2al ingreso, Me (RIQ) [n] | 349 (285-386) [411] | 353,5 (291-390) [208] | 340 (283-376) [203] | 0,04 |
| Patrón radiológico al ingreso, n (%) | ||||
| Sin infiltrados | 3 (0,7) | 2 (1) | 1 (0,5) | 0,86 |
| Infiltrado unilateral | 84 (20,1) | 43 (20,6) | 41 (19,8) | |
| Infiltrados bilaterales | 308 (73,7) | 156 (74,6) | 152 (73,4) | |
| Escala CURB-65, n (%) | ||||
| 0-1 | 125 (32,6) | 71 (34) | 54 (26,1) | 0,2 |
| 2-3 | 223 (58) | 99 (47,3) | 124 (59,9) | |
| 4-5 | 36 (9,4) | 17 (8,1) | 19 (9,1) | |
| Parámetros analíticos en el ingreso, Me (RIQ) [n] | ||||
| Leucocitos máximos (103/μL) | 8,6 (7-11) [405] | 8,3 (6,8-11,3) [203] | 8,6 (6,7-11,2) [202] | 0,91 |
| Linfocitos mínimos (103/μL) | 0,7 (0,4-1) [403] | 0,7 (0,5-1,1) [202] | 0,6 (0,4-1) [201] | 0,07 |
| IL-6 (pg/mL) | 82,1 (9-524) [6] | 83,7 (22,8-1362) [4] | 53,78 (5,8-53,8) [2] | 0,36 |
| Ferritina (ng/mL) | 468 (299-1033) [232] | 471 (366-1136,8) [115] | 466,8 (255-913) [117] | 0,25 |
| Dímero D (μg/mL) | 1,3 (0,8-2,2) [324] | 1,2 (0,7-2,4) [163] | 1,43 (0,87-2,2) [161] | 0,3 |
| Fibrinógeno (mg/dL) | 651 (544-758) [379] | 674 (581-778,5) [189] | 626 (530-725,7) [190] | 0,01 |
| PCR (mg/dL) | 12,67 (5,5-19,7) [396] | 13 (5,5-20,7) [197] | 12,4 (5,5-19,3) [199] | 0,44 |
| Pico de troponina I ultrasensible (ng/L) | 33,55 (16,2-94,9) [34] | 29,7 (18,4-62,4) [15] | 40,7 (16-124,4) [19] | 0,44 |
| LDH (UI/L) | 455,5 (324-632) [388] | 466 (327,5-653) [192] | 452,5 (322,5-619,5) [196] | 0,68 |
| Creatinina (mg/dL) | 1,2 (0,8-1,7) [407] | 1,14 (0,8-1,6) [204] | 1,27 (0,9-1,74) [203] | 0,57 |
| SDRA, n (%) | ||||
| Leve (PaO2/FIO2201-300) | 83 (20) | 38 (18,2) | 45 (21,7) | 0,27 |
| Moderado (PaO2/FIO2101-200) | 116 (39,3) | 84 (40,2) | 79 (38,2) | |
| Grave (PaO2/FIO2 <100) | 82 (19,8) | 36 (17,2) | 46 (22,2) | |
| Tratamiento antihipertensivo en el ingreso, n (%) | ||||
| IECA/ARA2 | 107 (19,5) | 49 (23,4) | 58 (28) | 0,28 |
| ACA | 178 (42,9) | 93 (44,5) | 85 (41,1) | 0,5 |
| Betabloqueantes | 110 (26,4) | 56 (26,8) | 54 (26,1) | 0,87 |
| Diuréticos de asa | 138 (33,2) | 56 (26,8) | 82 (39,6) | 0,01 |
| Alfabloqueantes | 21 (5) | 15 (7,2) | 6 (2,9) | 0,04 |
| Tratamientos frente al COVID-19 durante el ingreso, n (%) | ||||
| Hidroxicloroquina | 346 (83,4) | 183 (87,6) | 163 (78,7) | 0,02 |
| Lopinavir/Ritonavir | 101 (24,3) | 68 (32,5) | 33 (15,9) | <0,0001 |
| Azitromicina | 256 (61,5) | 126 (60,3) | 130 (62,8) | 0,6 |
| Anticoagulación profiláctica | 273 (65,3) | 141 (67,5) | 132 (63,8) | 0,37 |
| Anticoagulación terapéutica | 95 (22,8) | 44 (21) | 51 (24,6) | 0,38 |
| Por FA | 41 (9,8) | 16 (7,6) | 25 (12,1) | 0,7 |
| Por otro motivo | 54 (13) | 28 (13,4) | 26 (12,5) | 0,9 |
| Corticoides | 219 (52,6) | 106 (50,7) | 113 (54,6) | 0,43 |
| Tratamiento biológico | 9 (2,2) | 7 (3,3) | 2 (1) | 0,95 |
| Eventos intrahospitalarios, n (%) | ||||
| Mortalidad durante el ingreso | 176 (42,3) | 79 (37,8) | 97 (46,9) | 0,06 |
| Eventos al alta, n (%) | ||||
| Reingresos | 34 (14,2) | 19 (14,6) | 15 (13,6) | 0,85 |
| Mortalidad tras el alta hospitalaria | 22 (9,2) | 8 (6,2) | 20 (18,2) | 0,07 |
| Eventos totales, n (%) | ||||
| Mortalidad total | 198 (47,6) | 87 (41,6) | 111 (53,6) | 0,01 |
| Estancia hospitalaria (días) | 8,16±5,5 | 8,3±5,5 | 8,1±5,4 | 0,71 |
| Tiempo medio de seguimiento (días) | 41,8±3,5 | 46, 6±31,2 | 36,8±31 8 | 0,002 |
ACA: calcioantagonista; ARA2: antagonista del receptor de angiotensina 2; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; FA: fibrilación auricular; FiO2: fracción inspirada de oxígeno; IECA: inhibidor de la enzima conversora de angiotensina; IL-6: interleucina 6; LDH: lactato deshidrogenasa; PaO2: presión arterial de oxígeno; Me: mediana; PCR: proteína C reactiva; RIQ: rango intercuartílico; SAHS: síndrome apnea-hipopnea del sueño; SDRA: síndrome de distrés respiratorio agudo.
Datos expresados como número absoluto (porcentaje) en las variables cualitativas, como mediana (rango intercuartílico) [número absoluto] para las variables cuantitativas que no se ajustan a la normalidad y como media±desviación típica que se ajustan a la normalidad.
Valor de p: comparación de ambos grupos de edad. Comparación de variables cuantitativas de distribución no normal: test U de Mann-Whitney.
En negrita, los resultados estadísticamente significativos.
Comparación de las características clínicas basales, analíticas y terapéuticas en función de la mortalidad
| Muerte por cualquier causa (n=198) | No muerte (n=218) | Valor de p | |
|---|---|---|---|
| Edad | 85,3±5,7 | 83,6±5,6 | 0,003 |
| Sexo, n (%) | |||
| Varón | 96 (48,5) | 103 (47,2) | 0,8 |
| Antecedentes personales, n (%) | |||
| Hipertensión arterial | 160 (80,8) | 182 (83,5) | 0,48 |
| Diabetes mellitus | 45 (22,7) | 66 (30,3) | 0,08 |
| Tabaquismo | 30 (15,2) | 23 (10,6) | 0,37 |
| Obesidad | 29 (14,6) | 29 (13,3) | 0,69 |
| EPOC | 21 (10,6) | 21 (9,6) | 0,74 |
| Asma | 4 (2,5) | 5 (1,8) | 0,63 |
| SAHS | 18 (9,1) | 11 (5) | 0,1 |
| ERC | 55 (27,8) | 28 (12,8) | <0,0001 |
| Cardiopatía isquémica | 19 (9,6) | 30 (13,8) | 0,19 |
| Insuficiencia cardiaca | 27 (13,6) | 34 (15,6) | 0,57 |
| Fibrilación auricular | 41 (20,7) | 37 (17) | 0,33 |
| Tratamiento antihipertensivo previo, n (%) | |||
| IECA/ARA2 | 101 (51) | 139 (63,8) | 0,009 |
| ACA | 37 (18,7) | 47 (21,6) | 0,47 |
| Diurético de asa | 64 (32,3) | 53 (24,3) | 0,07 |
| Betabloqueantes | 56 (28,3) | 61 (28) | 0,95 |
| Alfabloqueantes | 17 (8,6) | 15 (6,9) | 0,52 |
| PaO2/FiO2al ingreso, Me (RIQ) [n] | 321 (197-375) [196] | 369 (316-390) [215] | <0,0001 |
| Patrón radiológico al ingreso, n (%) | |||
| No infiltrados | 0 (0) | 3 (1,4) | |
| Infiltrado unilateral | 36 (18,2) | 48 (22) | 0,145 |
| Infiltrado bilateral | 152 (80,8) | 156 (71,6) | |
| Escala CURB-65, n (%) | |||
| 1 | 29 (14,6) | 96 (44) | |
| 2-3 | 124 (62,7) | 99 (45,4) | <0,0001 |
| 4-5 | 30 (15,1) | 6 (2,8) | |
| Parámetros analíticos en el ingreso, Me (RIQ) [n] | |||
| Leucocitos máximos (103/μL) | 9,2 (7,4-12,3) [190] | 8 (6,5-10,8) [215] | 0,006 |
| Linfocitos mínimos (103/μL) | 0,6 (0,4-1) [191] | 0,7 (0,5-1,1) [212] | 0,02 |
| IL-6 (pg/mL) | 105 (101,7-1781) [3] | 9,5 (5,8-56) [3] | 0,05 |
| Ferritina (ng/mL) | 727 (405-1282) [72] | 434,3 (256-795,4) [160] | 0,001 |
| Dímero D (μg/mL) | 5,7±11,4 | 1,1 (0,7-2) [179] | 0,001 |
| Fibrinógeno (mg/dL) | 662 (557-761) [173] | 646 (534-757) [206] | 0,46 |
| PCR (mg/dL) | 16,9 (9,4-23,9) [186] | 9,5 (4-15) [210] | <0,0001 |
| Pico de troponina I ultrasensible (ng/L) | 54 (26-149) [22] | 23 (7,6-32) [12] | 0,02 |
| LDH (UI/L) | 465 (329-704) [179] | 448 (313-595) [209] | 0,047 |
| Creatinina (mg/dL) | 1,4 (0,9-2,2) [191] | 1 (0,8-1,4) [216] | <0,0001 |
| SDRA, n (%) | |||
| Leve (PaO2/FIO2201-300) | 17 (8,6) | 66 (30,3) | |
| Moderado (PaO2/FIO2101-200) | 102 (51,8) | 61 (28) | <0,0001 |
| Grave (PaO2/FIO2<100) | 70 (35,4) | 12 (5,5) | |
| Tratamiento antihipertensivo en el ingreso, n (%) | |||
| IECA/ARA2 | 48 (24,2) | 59 (27,1) | 0,51 |
| ACA | 62 (31,3) | 116 (53,2) | <0,0001 |
| Betabloqueantes | 54 (27,3) | 56 (25,7) | 0,71 |
| Diuréticos de asa | 75 (37,9) | 63 (28,9) | 0,05 |
| Alfabloqueantes | 12 (6,1) | 9 (4,1) | 0,37 |
| Tratamientos frente al COVID-19 durante el ingreso, n (%) | |||
| Hidroxicloroquina | 151 (76,3) | 195 (89,4) | <0,001 |
| Lopinavir/Ritonavir | 42 (21,2) | 59 (27,1) | 0,16 |
| Azitromicina | 107 (54) | 149 (68,3) | 0,003 |
| Anticoagulación profiláctica | 131 (66,2) | 139 (63,8) | 0,68 |
| Anticoagulación terapéutica | 33 (16,7) | 62 (28,4) | 0,001 |
| Por FA | 17 (8,6) | 24 (11) | 0,039 |
| Por otro motivo | 16 (8,1) | 38 (17,4) | 0,007 |
| Corticoides | 105 (53) | 114 (52,3) | 0,88 |
| Tratamientos biológicos | 6 (3) | 3 (1,4) | 0,25 |
ACA: calcioantagonista; ARA2: antagonista del receptor de angiotensina 2; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; FA: fibrilación auricular; FiO2: fracción inspirada de oxígeno; IECA: inhibidor de la enzima conversora de angiotensina; IL-6: interleucina 6; LDH: lactato deshidrogenasa; PaO2: presión arterial de oxígeno; Me: mediana; PCR: proteína C reactiva; RIQ: rango intercuartílico; SAHS: síndrome apnea-hipopnea del sueño; SDRA: síndrome de distrés respiratorio agudo.
Datos expresados como número absoluto (porcentaje) en las variables cualitativas, como mediana (rango intercuartílico) [número absoluto] para las variables cuantitativas que no se ajustan a la normalidad y como media±desviación típica que se ajustan a la normalidad.
Comparación de variables cuantitativas de distribución no normal: test U de Mann-Whitney.
En negrita, los resultados estadísticamente significativos.
El tiempo hasta los eventos se analizó siguiendo curvas de Kaplan-Meier, empleando como estadístico la prueba de log-rank (ver tabla A2 del material adicional). Finalmente, también se calculó un modelo de regresión de Cox univariado (crudo) y multivariado (ajustado) a través del método incluir (tabla 3). Las variables incluidas en el modelo de la regresión de Cox multivariante fueron aquellas que mostraron significativamente un riesgo elevado de mortalidad en el análisis univariado así como las variables de tratamiento y aquellas que en la literatura aparecen relacionadas con mortalidad. Para todos los contrastes se seleccionó un riesgo alfa del 5% (asumiendo significación estadística si p<0,05). Todos los intervalos se muestran con un grado de confianza del 95%.
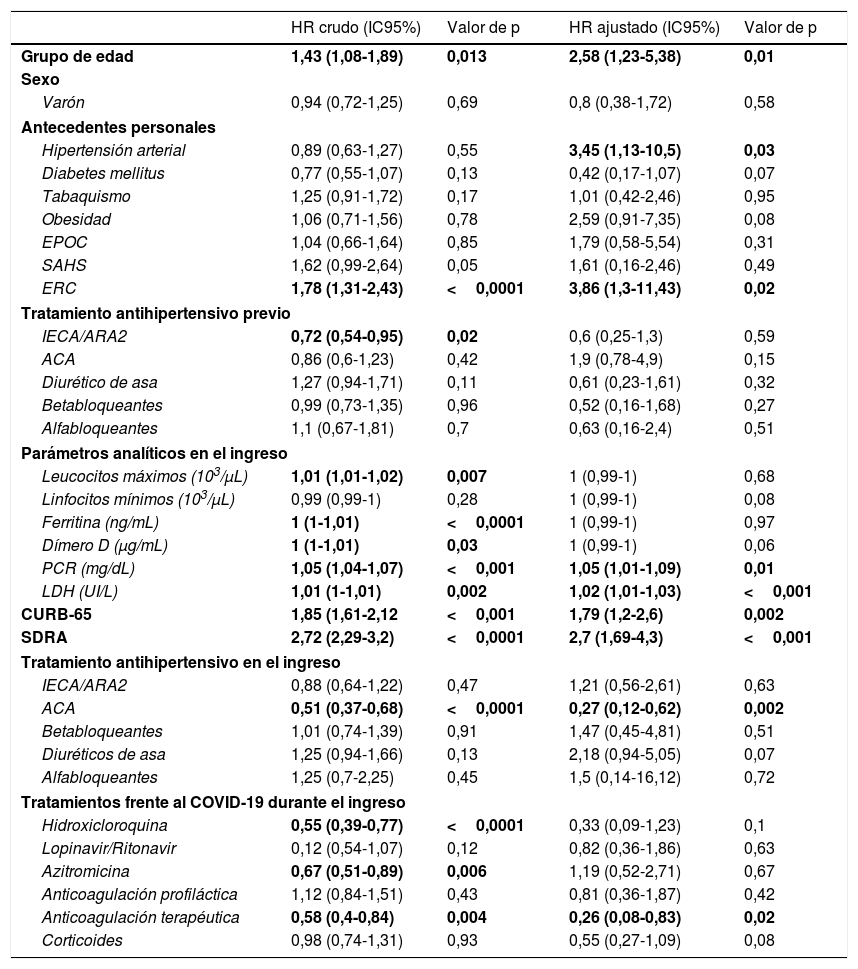
Regresión multivariante de Cox. Factores predictores de mortalidad
| HR crudo (IC95%) | Valor de p | HR ajustado (IC95%) | Valor de p | |
|---|---|---|---|---|
| Grupo de edad | 1,43 (1,08-1,89) | 0,013 | 2,58 (1,23-5,38) | 0,01 |
| Sexo | ||||
| Varón | 0,94 (0,72-1,25) | 0,69 | 0,8 (0,38-1,72) | 0,58 |
| Antecedentes personales | ||||
| Hipertensión arterial | 0,89 (0,63-1,27) | 0,55 | 3,45 (1,13-10,5) | 0,03 |
| Diabetes mellitus | 0,77 (0,55-1,07) | 0,13 | 0,42 (0,17-1,07) | 0,07 |
| Tabaquismo | 1,25 (0,91-1,72) | 0,17 | 1,01 (0,42-2,46) | 0,95 |
| Obesidad | 1,06 (0,71-1,56) | 0,78 | 2,59 (0,91-7,35) | 0,08 |
| EPOC | 1,04 (0,66-1,64) | 0,85 | 1,79 (0,58-5,54) | 0,31 |
| SAHS | 1,62 (0,99-2,64) | 0,05 | 1,61 (0,16-2,46) | 0,49 |
| ERC | 1,78 (1,31-2,43) | <0,0001 | 3,86 (1,3-11,43) | 0,02 |
| Tratamiento antihipertensivo previo | ||||
| IECA/ARA2 | 0,72 (0,54-0,95) | 0,02 | 0,6 (0,25-1,3) | 0,59 |
| ACA | 0,86 (0,6-1,23) | 0,42 | 1,9 (0,78-4,9) | 0,15 |
| Diurético de asa | 1,27 (0,94-1,71) | 0,11 | 0,61 (0,23-1,61) | 0,32 |
| Betabloqueantes | 0,99 (0,73-1,35) | 0,96 | 0,52 (0,16-1,68) | 0,27 |
| Alfabloqueantes | 1,1 (0,67-1,81) | 0,7 | 0,63 (0,16-2,4) | 0,51 |
| Parámetros analíticos en el ingreso | ||||
| Leucocitos máximos (103/μL) | 1,01 (1,01-1,02) | 0,007 | 1 (0,99-1) | 0,68 |
| Linfocitos mínimos (103/μL) | 0,99 (0,99-1) | 0,28 | 1 (0,99-1) | 0,08 |
| Ferritina (ng/mL) | 1 (1-1,01) | <0,0001 | 1 (0,99-1) | 0,97 |
| Dímero D (μg/mL) | 1 (1-1,01) | 0,03 | 1 (0,99-1) | 0,06 |
| PCR (mg/dL) | 1,05 (1,04-1,07) | <0,001 | 1,05 (1,01-1,09) | 0,01 |
| LDH (UI/L) | 1,01 (1-1,01) | 0,002 | 1,02 (1,01-1,03) | <0,001 |
| CURB-65 | 1,85 (1,61-2,12 | <0,001 | 1,79 (1,2-2,6) | 0,002 |
| SDRA | 2,72 (2,29-3,2) | <0,0001 | 2,7 (1,69-4,3) | <0,001 |
| Tratamiento antihipertensivo en el ingreso | ||||
| IECA/ARA2 | 0,88 (0,64-1,22) | 0,47 | 1,21 (0,56-2,61) | 0,63 |
| ACA | 0,51 (0,37-0,68) | <0,0001 | 0,27 (0,12-0,62) | 0,002 |
| Betabloqueantes | 1,01 (0,74-1,39) | 0,91 | 1,47 (0,45-4,81) | 0,51 |
| Diuréticos de asa | 1,25 (0,94-1,66) | 0,13 | 2,18 (0,94-5,05) | 0,07 |
| Alfabloqueantes | 1,25 (0,7-2,25) | 0,45 | 1,5 (0,14-16,12) | 0,72 |
| Tratamientos frente al COVID-19 durante el ingreso | ||||
| Hidroxicloroquina | 0,55 (0,39-0,77) | <0,0001 | 0,33 (0,09-1,23) | 0,1 |
| Lopinavir/Ritonavir | 0,12 (0,54-1,07) | 0,12 | 0,82 (0,36-1,86) | 0,63 |
| Azitromicina | 0,67 (0,51-0,89) | 0,006 | 1,19 (0,52-2,71) | 0,67 |
| Anticoagulación profiláctica | 1,12 (0,84-1,51) | 0,43 | 0,81 (0,36-1,87) | 0,42 |
| Anticoagulación terapéutica | 0,58 (0,4-0,84) | 0,004 | 0,26 (0,08-0,83) | 0,02 |
| Corticoides | 0,98 (0,74-1,31) | 0,93 | 0,55 (0,27-1,09) | 0,08 |
ACA: calcioantagonista; ARA2: antagonista del receptor de angiotensina 2; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; HR: Hazard Ratio; IECA: inhibidor de la enzima conversora de angiotensina; IC95%: intervalo de confianza al 95%;; LDH: lactato deshidrogenasa; PCR: proteína C reactiva; SAHS: síndrome apnea-hipopnea del sueño; SDRA: síndrome de distrés respiratorio agudo.
En negrita, los resultados estadísticamente significativos.
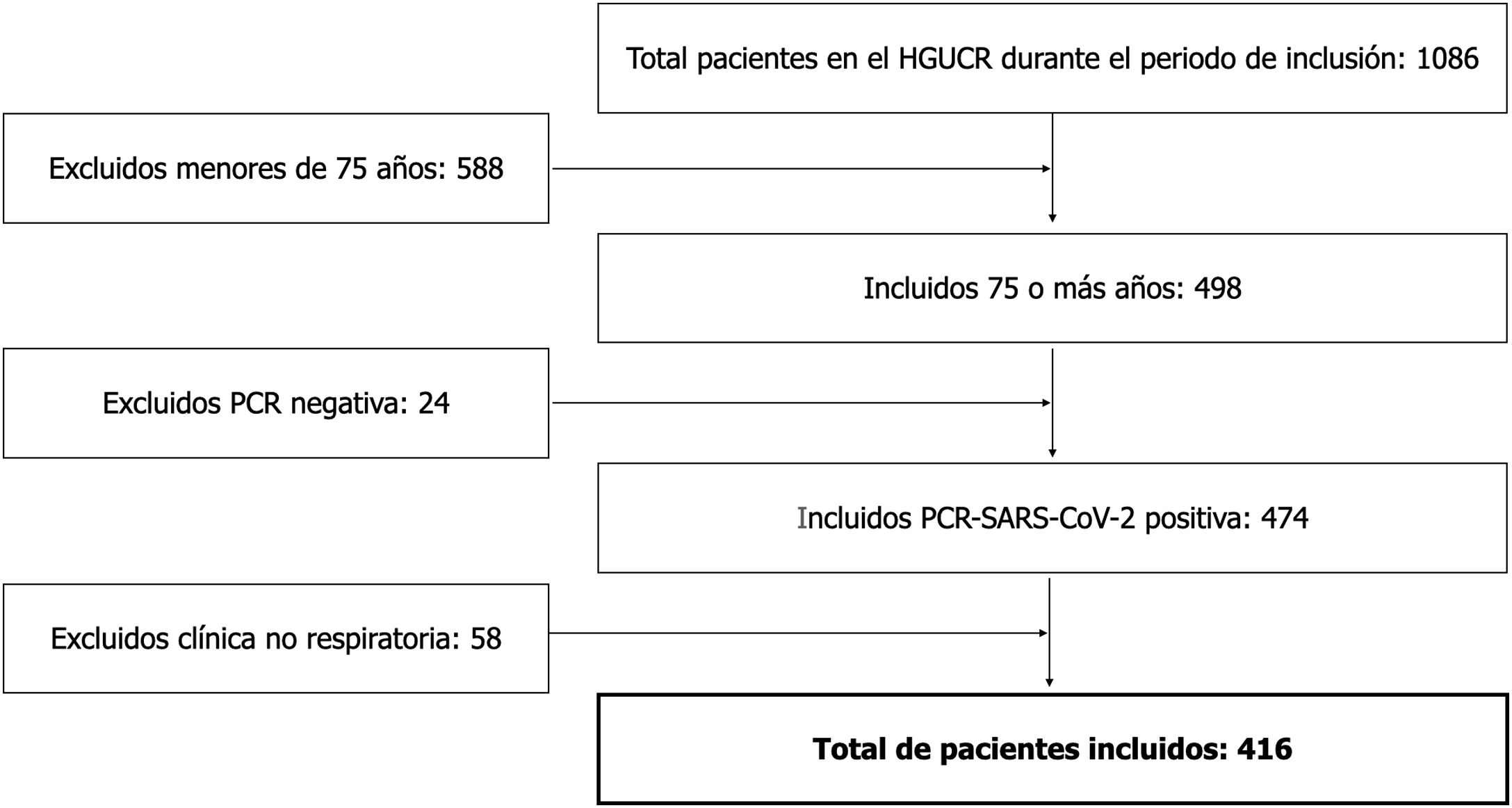
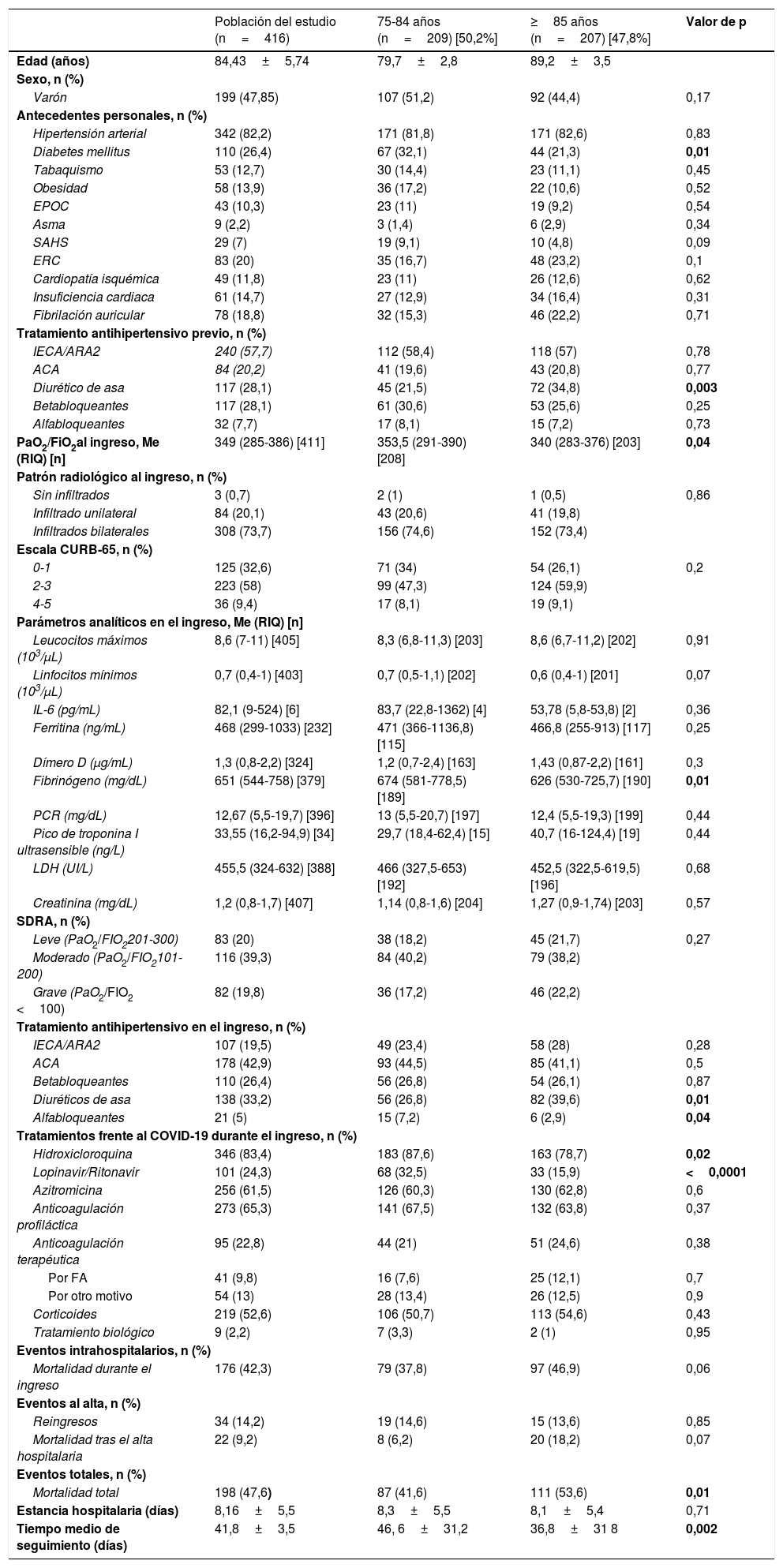
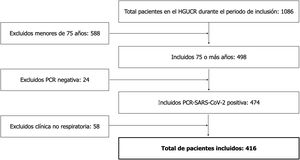
Durante el periodo del estudio ingresaron 1086 pacientes en nuestro centro con sospecha de infección por SARS-CoV-2, de los cuales 498 fueron pacientes de 75 o más años. Se excluyeron 58 pacientes con infección por SARS-COV-2, pero sin afectación clínica ni radiológica a nivel respiratorio (fig. 1). Finalmente, obtuvimos una muestra de 416 pacientes, de los cuales 209 tenía una edad comprendida entre los 75-84 años y 207 de 85 o más años, siendo la edad media de 84,4±5,7 años y el rango de edad 75-103 años. El 52,2% fueron mujeres. Respecto a las características basales de la población cabe destacar la alta prevalencia de hipertensión arterial, presente en el 82,2% de la muestra, así como el uso ampliamente extendido de IECA/ARA2 como fármaco antihipertensivo, prescrito en el 57,7%. La duración media de la permanencia hospitalaria fue de 8,1±5,5 días. La mediana de seguimiento fue de 54 días (rango intercuartílico 6,2-71). El resto de las características basales aparecen en la tabla 1.
La distribución de hombres y mujeres fue homogénea en ambos grupos de edad. La distribución de factores de riesgo cardiovascular fue similar, salvo una mayor prevalencia de diabetes mellitus en el grupo más joven. Respecto al resto de variables clínicas, el grupo más anciano presentó un peor índice PaO2/FiO2 al ingreso, si bien esto no se tradujo en una peor puntuación en la escala CURB-65 ni en una mayor incidencia de SDRA moderado-grave durante su estancia hospitalaria. La mayoría de los pacientes ingresados presentaron una neumonía bilateral, sin diferencias entre grupos de edad. Analíticamente, cabe destacar la mayor concentración de fibrinógeno en el grupo más joven. Respecto al tratamiento antihipertensivo empleado, no se observaron diferencias en la prescripción de IECA/ARA2 ni ACA antes ni durante su estancia hospitalaria. No obstante, en el tratamiento frente al COVID-19, el grupo de 75-84 años recibió tratamiento con hidroxicloroquina y lopinavir/ritonavir más frecuentemente que los pacientes más ancianos (tabla 1).
Eventos durante el seguimientoDurante el seguimiento, 198 pacientes (47,6%) fallecieron; la mayoría, 176 (42,3%) durante el ingreso. En total, tras el alta se produjo un total de 34 reingresos (14,2%) y 22 defunciones (9,2%). El análisis bivariado mostró una mayor mortalidad en los pacientes muy ancianos (tabla 1).
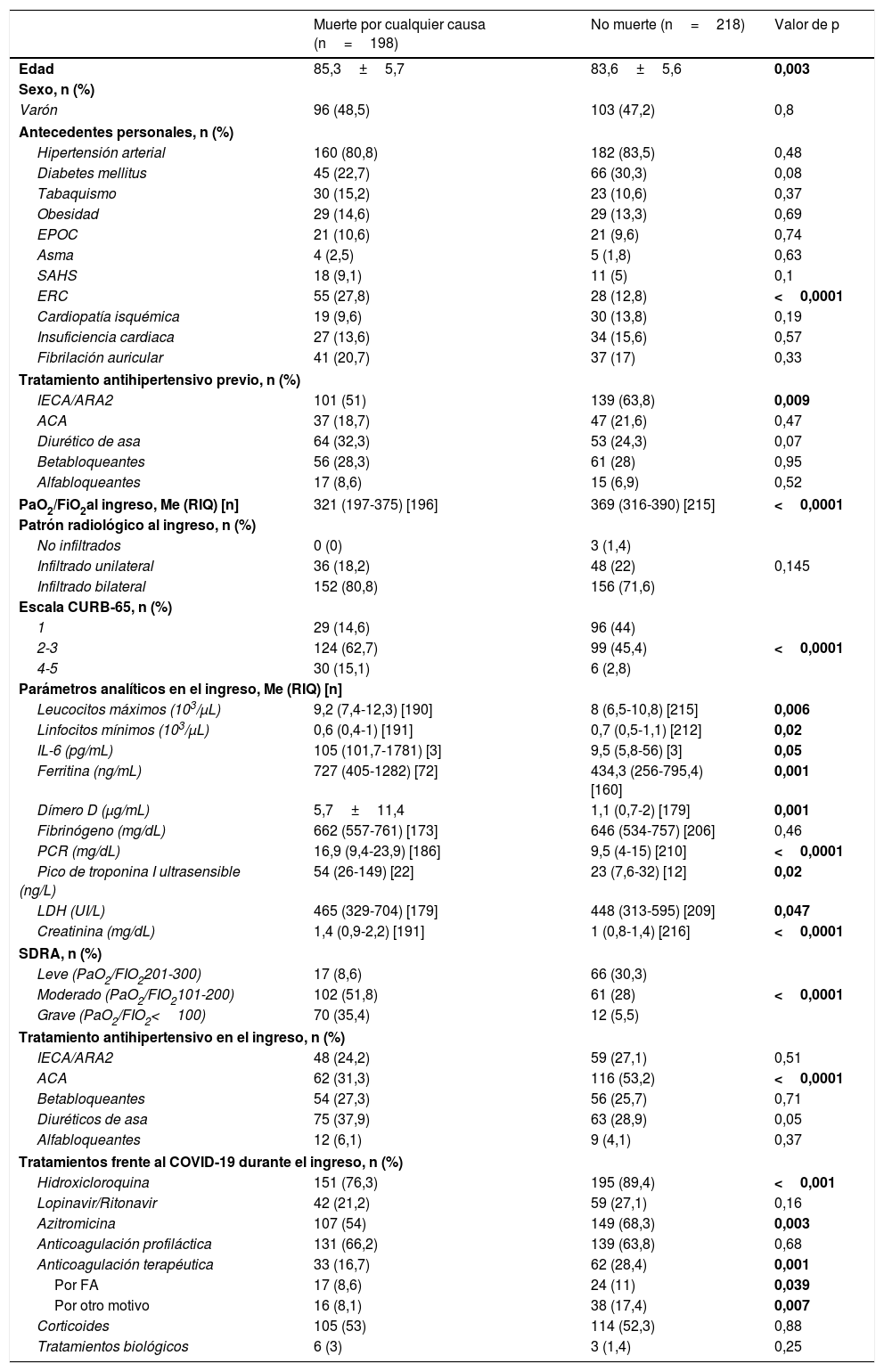
Los pacientes que fallecieron eran más ancianos, presentaban mayor elevación de parámetros inflamatorios, más leucocitosis y linfopenia más acusada, una peor puntuación en la escala CURB-65 y el desarrollo de un SDRA más severo. Sin embargo, no observaron diferencias en el patrón radiológico. Aquellos pacientes que fueron anticoagulados durante su hospitalización bien con heparina de bajo peso molecular en dosis terapéuticas, antagonistas de la vitamina K o anticoagulantes de acción directa, presentaron menor mortalidad, independientemente de la gravedad del cuadro clínico y el motivo de su anticoagulación (fibrilación auricular vs. otros motivos). En cambio, estas diferencias no se observaron en aquellos anticoagulados de forma profiláctica con heparina de bajo peso molecular (tabla 2).
Respecto al tratamiento antihipertensivo, el tratamiento con ACA durante el ingreso se asoció a una menor mortalidad (tabla 2).
Inhibición del sistema renina-angiotensina y eventos en la evoluciónNo se registraron diferencias de edad entre el grupo con tratamiento previo con IECA/ARA2 y el resto; sin embargo, fue más frecuente entre los pacientes que tenían prescritos IECA/ARA2 la presencia de hipertensión y diabetes mellitus. No hubo diferencias en el resto de comorbilidades registradas ni tampoco en los parámetros analíticos o gravedad del cuadro clínico. La terapia frente al COVID-19 fue similar en ambos grupos. Tanto el tratamiento ambulatorio previo al ingreso con IECA/ARA2 como durante la hospitalización tuvieron un efecto neutro sobre la mortalidad durante el seguimiento a corto plazo. Las diferencias entre IECA y ARA2 previos y durante el ingreso con respecto a la mortalidad aparecen reflejadas en la tabla A1 del material adicional).
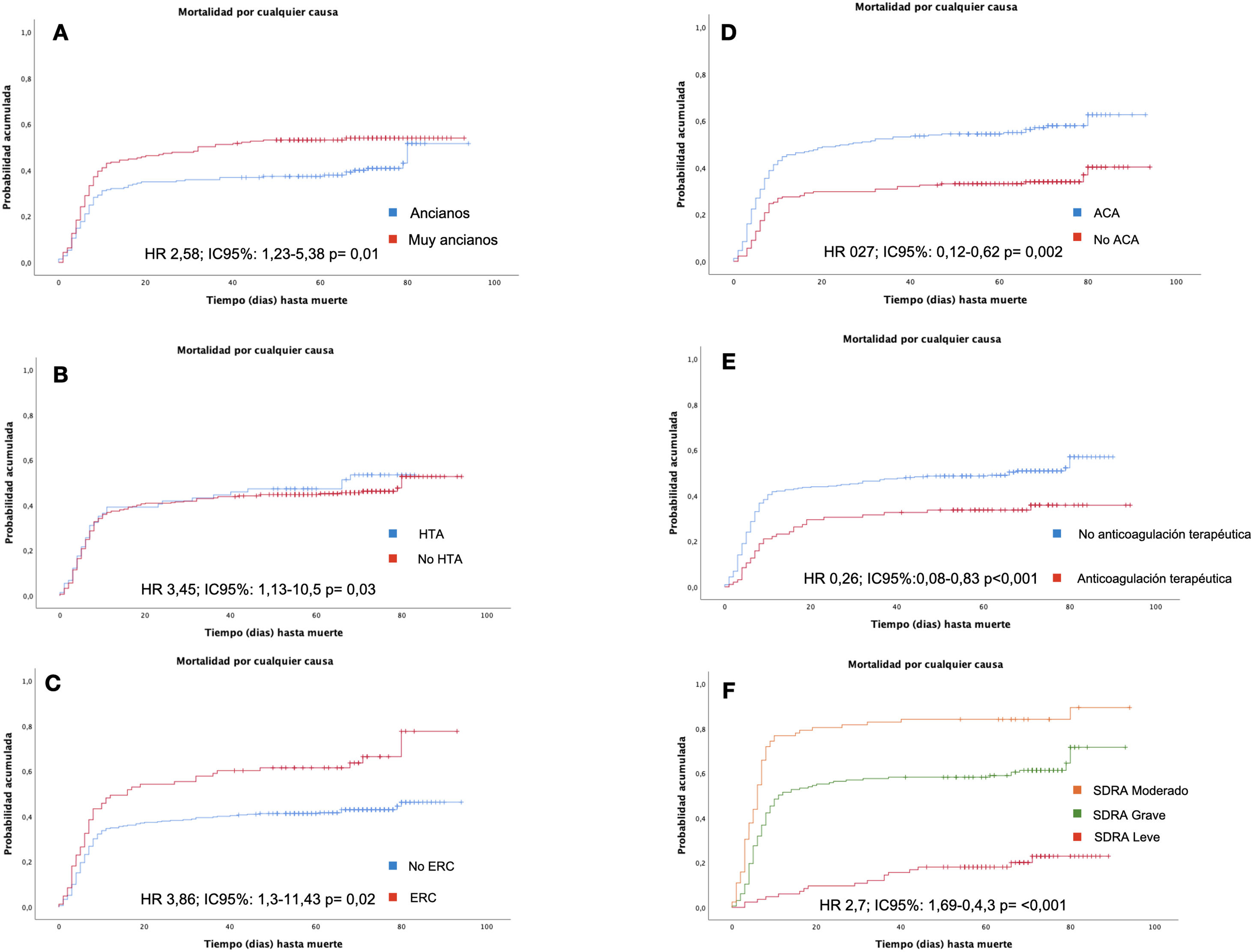
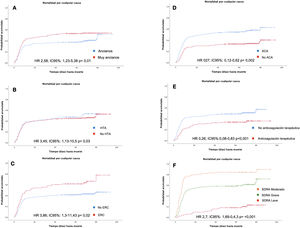
Análisis de supervivenciaSe construyó un modelo de regresión de Cox univariado (crudo) y multivariado (ajustado) (tabla 3). En este último, se observó mayor riesgo de mortalidad más temprana en pacientes muy ancianos, hipertensos y enfermos renales crónicos. Igualmente, la presencia de SDRA, la puntuación en la escala de CURB-65 y la elevación de reactantes de fase aguda como la proteína C reactiva (PCR) o lactato deshidrogenasa también se asociaron a una mortalidad más precoz. En cambio, la terapia anticoagulante y el tratamiento hospitalario con ACA se mostraron como factores asociados con mayor supervivencia en el seguimiento (fig. 2).
Curvas de supervivencia. A: pacientes ancianos vs. pacientes muy ancianos; B: pacientes hipertensos vs. pacientes no hipertensos; C: pacientes con enfermedad renal crónica vs. pacientes sin enfermedad renal crónica; D: pacientes con tratamiento con ACA durante el ingreso hospitalario vs. pacientes sin tratamiento con ACA durante el ingreso; E: pacientes con SDRA leve, moderado y grave; F: pacientes con anticoagulación terapéutica durante la hospitalización vs. resto de pacientes. ACA: antagonistas del calcio; ERC: enfermedad renal crónica; HR: Hazard Ratio; HTA: hipertensión arterial; IC95%: intervalo de confianza al 95%; SDRA: Síndrome de distrés respiratorio agudo.
El presente estudio evalúa las diferencias clínicas y pronosticas del COVID-19 entre la población anciana y muy anciana. Pertenecer al grupo pacientes muy ancianos, la hipertensión arterial y la enfermedad renal crónica se asociaron a mayor riesgo de muerte. Por otro lado, los pacientes que recibieron tratamiento con anticoagulación terapéutica y ACA durante el ingreso mostraron menor riesgo de mortalidad.
A pesar de que actualmente no resulta fácil tener datos fiables acerca de cuál es la tasa de mortalidad global por COVID-19, distintas investigaciones la sitúan entre el 2 y el 5%3,22. En cualquier caso, se puede afirmar que la edad se asocia a un mayor riesgo de muerte. Así, diversos estudios realizados en cohortes chinas sitúan la tasa de letalidad en un 8% en pacientes de 70 a 79 años, y entre un 14,8-18,8% en mayores de 80 años3,23. En nuestro país, en el análisis de los casos de COVID-19 notificados a la Red Nacional de Vigilancia Epidemiológica (RENAVE) hasta el 10 de mayo, se comunicó una tasa de mortalidad del 14% en pacientes entre 70-79 años y del 21,8% en pacientes>80 años24. En el presente estudio, se registró una tasa de mortalidad del 47,6%, cifra muy superior pero que, a diferencia de las previas, se ha calculado únicamente sobre pacientes ingresados y, por ello, con presumible peor situación basal y pronóstico.
Si bien el sexo masculino se ha asociado con mayor riesgo de muerte en algunos registros25, otros registros en población geriátrica no han observado estas diferencias26,27. Por otro lado, la hipertensión arterial, la diabetes y la enfermedad renal crónica se han asociado en algunos trabajos con mayor mortalidad3,28; el presente estudio identificó la hipertensión y la enfermedad renal crónica como factores de riesgo independientes de mortalidad. Por el contrario, no se observaron diferencias entre los pacientes no diabéticos y diabéticos, aunque se advirtió una tendencia de mayor riesgo en estos últimos.
En el presente registro, casi el 20% de la muestra sufrió SDRA grave sin existir diferencias entre grupos etarios, de forma similar a otras investigaciones que sitúan el desarrollo de formas graves de enfermedad en ancianos entre el 22,2 y 23,6%27,29. Asimismo, el presente estudio, al igual que otros en población anciana, relaciona las formas graves de enfermedad y la elevación de reactantes de fase aguda tales como la PCR y lactato deshidrogenasa con una mortalidad más precoz durante el seguimiento27–30.
Por otro lado, cabe destacar el alto porcentaje de pacientes hipertensos en la muestra (82,2%), muy superior al recogido en otras series de pacientes ancianos, donde oscilaba entre el 40-48% 23,31. La mayoría de los pacientes recibían como tratamiento ambulatorio IECA/ARA2. Al comparar a estos pacientes con el resto, no se observó peor puntuación en la escala CURB-65 ni mayor desarrollo de SDRA moderado-grave, tampoco se registró mayor elevación de marcadores inflamatorios ni depleción linfocitaria más acusada en la analítica, ni se observaron diferencias en el tratamiento recibido frente a la infección por SAR-CoV-2. El efecto del tratamiento con IECA/ARA2 previo y durante el ingreso presentó un efecto neutro sobre la mortalidad durante el seguimiento.
Desde que se descubrió que el SARS-Cov-2 emplea la ECA2 como puerta de entrada a nuestro organismo, el papel de la hipertensión y, sobre todo, el de su tratamiento con IECA/ARA2, ha estado en constante revisión7–12. Inicialmente se relacionó el empleo de estos fármacos con un peor pronóstico, dado que al alterar la expresión y disponibilidad de ECA2 se podría favorecer la entrada del virus5,9,10. Las últimas publicaciones, sin embargo, no relacionan el antecedente de toma de IECA/ARA2 con un aumento de mortalidad por la infección.
El papel que desempeñan otros antihipertensivos, como los calcioantagonistas, no ha sido tan bien estudiado. Los datos experimentales que relacionan el Ca2+ y SARS-CoV-2 son insuficientes. Sin embargo, algunos estudios recientes sobre otros coronavirus (con genoma análogo) como el SARS-CoV o el MERS-CoV, han destacado que en ambos casos el Ca2+ desempeña un papel fundamental en su capacidad infectiva. Los virus suelen secuestrar los canales y bombas de calcio de la célula huésped para liberar más Ca2+ intracelular participando activamente en el inicio y propagación de la infección32. En este sentido, el presente estudio apunta en la misma dirección que otros en población general y población anciana que relacionan el empleo de calcioantagonistas con un mejor pronóstico en la infección por COVID-1933,34. Sin embargo, es probable que, en nuestra muestra, parte del beneficio clínico observado no se deba al efecto bloqueante de los calcioantagonistas, sino a que no fueron administrados en pacientes con hipotensión, la cual se asocia a estados más graves de enfermedad y complicaciones como la insuficiencia cardiaca avanzada o la sepsis.
El tratamiento de nuestra cohorte frente al SARS-CoV-2 fue similar al realizado por los pacientes del mayor registro nacional de hospitalizados por COVID-19 hasta la fecha. El porcentaje de pacientes tratados con hidroxicloroquina, azitromizina, o anticoagulación tanto en dosis profilácticas como terapéuticas fue parecido, sin embargo, en nuestra muestra el tratamiento con lopinavir/ritonavir y corticoterapia sistémica fue menor35.
La alteración en los parámetros de la coagulación, sobre todo la elevación de dímero D, se han asociado a peor pronóstico, relacionándose con mayor riesgo trombótico y de mortalidad, por lo que el tratamiento anticoagulante se plantea como una opción terapéutica válida en pacientes hospitalizados por COVID36,37. Si bien la decisión de iniciar una terapia anticoagulante en el paciente anciano debe ser sopesada ante el riesgo de sangrado que puede suponer, el efecto protector de la anticoagulación detectado en el presente trabajo indica que este tratamiento es una alternativa eficaz frente a la coagulopatía derivada de la infección tal y como se ha reportado en otros estudios en población general38.
A pesar de constituir el colectivo más afectado y vulnerable, los estudios realizados en pacientes ancianos y muy ancianos son escasos, siendo este uno de los que reúne mayor número de pacientes hospitalizados, y el primero que explora el impacto del tratamiento con inhibidores del eje renina-angiotensina en la población geriátrica española hospitalizada por COVID-19. Los principales resultados obtenidos son concordantes con la mayoría de las publicaciones realizadas hasta la fecha. Sin embargo, el presente estudio no está exento de limitaciones siendo la principal de ellas su carácter observacional. Por otro lado, la incapacidad para garantizar una correcta adherencia terapéutica al tratamiento ambulatorio con IECA/ARA2, el carácter unicéntrico del estudio y la imposibilidad de reportar la valoración funcional de los pacientes son sesgos que amenazan la validez de nuestros resultados. Posiblemente motivado por la sobresaturación del sistema sanitario y la necesidad de atención médica por especialidades no geriátricas no ha sido posible realizar una adecuada recogida de variables como la carga de comorbilidad, la demencia moderada-severa o el grado de fragilidad, las cuales han demostrado desempeñar un papel importante en el impacto pronóstico del paciente geriátrico afectado por COVID-1939.
ConclusionesLos pacientes muy ancianos presentaron mayor riesgo de mortalidad. La hipertensión, la enfermedad renal crónica, la presencia de SDRA, la puntuación en la escala de CURB-65 y la elevación de PCR y lactato deshidrogenasa fueron identificadas como factores predictores independientes de mortalidad. En cambio, el empleo de anticoagulación terapéutica y tratamiento con ACA durante el ingreso se asociaron con mayor supervivencia en el seguimiento a corto plazo.
FinanciaciónNo se ha percibido ningún tipo de financiación para la elaboración del presente trabajo.
Conflicto de interesesLos autores del presente documento declaran la ausencia de cualquier conflicto de interés relacionado con la publicación de este manuscrito.
En primer lugar, queremos dar las gracias por el esfuerzo realizado y por su ayuda para la realización del presente estudio a Cristina Mateos Gómez, a Daniel Salas Bravo y a Marta Rodríguez Martínez. Por otro lado, por su labor y trabajo durante la pandemia de COVID-19, a Lourdes Porras Leal y a Francisco Javier González Gasca, responsables de la unidad de Enfermedades Infecciosas del servicio de Medicina Interna del Hospital General Universitario de Ciudad Real. Además, queremos agradecer la gestión, esfuerzo y trabajo por parte de la Dirección Médica, de Enfermería y la Dirección de la Gerencia de Atención Integral de Ciudad Real. Finalmente, damos las gracias a los compañeros de Geriatría, Medicina Interna y, en general, a todos los que participaron en la asistencia de pacientes con infección COVID-19.