La nefropatía membranosa (NM) es la principal causa de síndrome nefrótico (SN) en adultos no diabéticos1,2. Se caracteriza por un engrosamiento de las membranas basales con poca o nula proliferación o infiltración y depósitos inmunes subepiteliales1,3. La mayoría de NM en el adulto son idiopáticas, y menos frecuentes secundarias a otras enfermedades (autoinmunes, infecciosas, neoplasias) o fármacos1.
Caso clínicoVarón de 75 años, con antecedentes de hipertensión arterial, diabetes mellitus, obesidad, dislipemia, fibrilación auricular, isquemia cerebrovascular, inicio de demencia progresiva desde noviembre de 2011, hemorragia digestiva por antiinflamatorios no esteroideos, adenocarcinoma prostático (año 2010) tratado con cirugía y radioterapia, infección respiratoria e insuficiencia cardíaca (año 2011). En seguimiento por nefrología por proteinuria (<0,5g/día). Recibía tratamiento con: acenocumarol, valsartan-hidroclorotiazida, gabapentina, atenolol, furosemida, atorvastatina, pantoprazol e insulina.
Unos meses antes, el paciente había estado en el hospital de día geriátrico (HDG) para tratarse unas ampollas en los miembros inferiores transformadas en úlceras dolorosas, que limitaban su movilidad y producían dependencia (índice de Barthel [IB]: 10/100).
Veinte días después de revisarse en geriatría (IB: 65/100), el paciente fue diagnosticado de colecistitis gangrenosa e intervenido quirúrgicamente. La analítica previa a la cirugía fue: glucosa 200mg/dl, creatinina 0,8mg/dl, leucocitos 17.530, actividad de protrombina 17%. En orina elemental: proteínas+++, 20-25 hematíes/campo y cilindros hialino-granulosos.
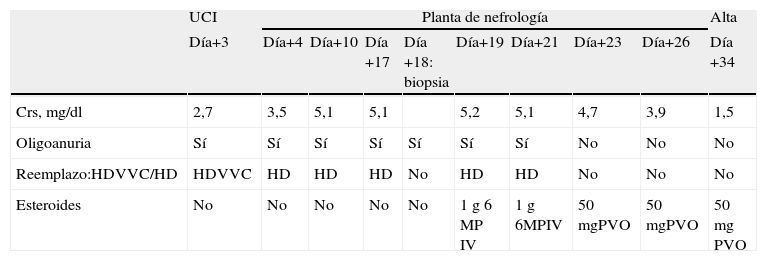
Tras la cirugía, precisó noradrenalina, perfusión de furosemida y se inició hemodiafiltración. La evolución clínica y de función renal durante el ingreso se recoge en la tabla 1.
Evolución clínica y de la función renal durante el ingreso
| UCI | Planta de nefrología | Alta | ||||||||
| Día+3 | Día+4 | Día+10 | Día +17 | Día+18: biopsia | Día+19 | Día+21 | Día+23 | Día+26 | Día +34 | |
| Crs, mg/dl | 2,7 | 3,5 | 5,1 | 5,1 | 5,2 | 5,1 | 4,7 | 3,9 | 1,5 | |
| Oligoanuria | Sí | Sí | Sí | Sí | Sí | Sí | Sí | No | No | No |
| Reemplazo:HDVVC/HD | HDVVC | HD | HD | HD | No | HD | HD | No | No | No |
| Esteroides | No | No | No | No | No | 1g 6MP IV | 1g 6MPIV | 50mgPVO | 50mgPVO | 50mg PVO |
Crs: creatinina sérica; HD: hemodiálisis convencional; HDVVC: hemodiafiltración veno-venosa continua; IV: intravenoso; MP: metilprednisolona; P: prednisona; VO: vía oral.
Al estudiar el fracaso renal agudo (FRA), la bioquímica diferida en sangre reveló como hallazgos patológicos: creatinina 3,5mg/dl, albúmina 1,8g/dl, calcio 7,5mg/dl y fósforo 5,4mg/dl. El estudio inmunológico (ANA, anti-DNA y ANCA) fue negativo. La IgG fue 524mg/dl (normal: 751-1.560). El complemento C3 fue 65mg/dl (normal: 79-152). La serología de virus B, C y VIH fue negativa. La T3 libre fue 2,22pmol/l (normal: 3,50-6,50). Los marcadores tumorales (PSA, CEA, CA 19-9 y AFP) fueron negativos.
El eco-Doppler renal mostró riñones normales en tamaño, con discreta hiperecogenicidad, sin dilatación y permeables vascularmente. El TAC abdominal detectó como hallazgos: Derrame pleural bilateral y dilatación aórtica infrarrenal con un diámetro máximo de 3,6cm.
Para esclarecer la causa del FRA se realizó biopsia renal, y fue diagnosticado de una NM.
Fue tratado con pulsos endovenosos de 1g de 6-metilprednisolona durante 3 días, seguido de 50mg de prednisona oral. Cinco días después, y reintroduciendo furosemida, el volumen urinario fue incrementándose paulatinamente (se constató proteinuria de 18g/día), permitiendo la retirada de hemodiálisis y una mejoría renal (creatinina 1,5mg/dl al alta).
Quince días después, en consulta, presentaba ligeros edemas en miembros superiores y analíticamente: creatinina 1mg/dl, albúmina 2,4g/dl, proteínas totales 4,3g/dl y proteinuria 7g/día.
DiscusiónEl SN es la presentación más habitual de la NM1. El FRA es menos común4. En nuestro caso, encontramos un diagnóstico inesperado de NM, estudiando un FRA severo tras colecistectomía.
En la NM, la acumulación gradual de depósitos subepiteliales, y el subsiguiente daño podocitario, hacen que los rasgos típicos del SN, puedan pasar desapercibidos por los médicos, al expresarse clínicamente a ritmo más lento que en otras entidades que cursan también con SN como la nefropatía mínimos cambios (NMC) o la glomeruloesclerosis primaria5,6. En el caso que exponemos, las ampollas y úlceras por las que estaba siendo tratado en HDG, pudieran ser expresión del SN inadvertido clínicamente.
El FRA se ha descrito poco en pacientes con NM4. Niang et al., describen el caso de una mujer joven estudiada por FRA, que precisó de hemodiálisis, encontrando una NM en la biopsia renal efectuada a las 3 semanas de evolución7. Entre los factores que pueden provocar FRA, en pacientes con NM, podemos señalar, la sobreimposición de una glomerulonefritis extracapilar o una trombosis venosa aguda renal8,9. Además, en estos pacientes, también tienen otros factores descritos en la NMC como causas de FRA, como son: marcada proteinuria e hipoalbuminemia, hipertensión arterial y edad avanzada6. En nuestro caso apuntamos como factores precipitantes del FRA: hipoalbuminemia, proteinuria (18g/24h), proceso actual (colecistitis), y ser un anciano diabético e hipertenso.
Respecto al tratamiento de NM, en pacientes de alto riesgo de progresión de enfermedad renal (proteinuria >8g/24h, insuficiencia renal), además de las medidas generales del SN, se consideran los inmunosupresores con diversos regímenes10.
Concluyendo, el FRA como complicación de una colecistitis permitió diagnosticar una NM, que habría pasado inadvertida unos meses antes, con su presentación más habitual en forma de SN. El tratamiento corticoideo permitió recuperar completamente la función renal, pero parcial de proteinuria.