Rev Esp Geriatr Gerontol 1998; 33 (NM2): 33-40
REVISION
Precáncer oral en el paciente anciano
A. Blanco Carrión*, E. Velasco Ortega**, J. López López*** y J. M. Gándara Rey****.
* Profesor Asociado de Medicina Oral. Universidad de Santiago de Compostela. ** Profesor Titular de Odontología Integrada de Adultos. Universidad de Sevilla. *** Profesor Asociado de Medicina Oral. Universidad de Barcelona. **** Profesor Titular de Medicina Oral. Universidad de Santiago de Compostela.
Correspondencia: Andrés Blanco Carrión. República de El Salvador, 4, 1º C. 15702 Santiago de Compostela. La Coruña.
RESUMEN
El cáncer oral tiene una incidencia alta entre la población de edad avanzada, lo que determina que los ancianos sean considerados como pacientes de riesgo. Por otra parte, es una enfermedad que representa un importante problema de salud, debido a que su mortalidad y morbilidad son muy elevadas. Sirva como ejemplo que su supervivencia es alrededor del 50% a los cinco años. La mayor esperanza de mejorar estas expectativas es el diagnóstico y tratamiento precoz, y más aun, reconocer aquellas situaciones en las que existe una frecuencia alta de evolución hacia la malignidad. Nos referimos a la existencia de unos factores desencadenantes o factores etiológicos de riesgo y a la de unos factores predisponentes, lesiones y estados precancerosos, que conforman lo que se denomina precáncer oral. En este trabajo recogemos aquellos procesos patológicos incluidos en el concepto de precáncer y que corresponden al origen de la mayoría de los procesos malignos de la cavidad bucal. Analizamos sus características clínicas, diagnóstico, pronóstico y tratamiento.
Palabras clave
Mucosa oral. Leucoplasia. Liquen plano. Eritroplasia. Síndrome de Plummer-Vinson. Lupus eritematoso discoide. Fibrosis oral submucosa. Queilitis actínica.
Oral precancer in the elderly patient
SUMMARY
Oral cancer has a high incidence in aged people, what determines that olds are considerated as risk patients. On the other hand, it is a disease that represents an important health problem due to its high mortality and morbility. For example, its survival is above 50% after 5 years. The best expectancy to obtain good results is the early diagnosis and treatment, and even, to recognize those situations with a high frecuency of malignity. We are talking about unchaining factors or ethiologic risk factors and other predisponent factors, precancerous lesions and precancerous conditions; they all are the oral precancer. In this report we collected those pathologic process included in the precancer concept and belonging to the origin of the most oral malignity process. We study its clinics characteristics, diagnosis, prognostic and treatment.
Key words
Oral mucos. Leucoplakia. Lichen planus. Erythroplakia. Plummer-Vinson syndrome. Discoid lupus erythematosus. Oral submucous fibrosis. Actinic cheilitis.
Rev Esp Geriatr Gerontol 1998;33(NM2):33-40
El cáncer oral, al igual que ocurre con la mayoría de neoplasias, tiene una mayor incidencia entre la población adulta de edad avanzada. Esto es particularmente patente en los países desarrollados, en donde más del 95% de las lesiones malignas orales se presentan en personas mayores de 40 años, siendo el promedio de edad en el momento de establecer el diagnóstico de 60 años (1). El que su incidencia aumente con la edad determina que los ancianos sean considerados como una población de riesgo.
Más del 90% de los tumores malignos de la boca son carcinomas epidermoides o de células escamosas. El resto incluye otros tipos histológicos de cáncer: sarcomas, melanomas, tumores malignos de glándulas salivales, de los maxilares, de células sanguíneas y tumores metastásicos (2). Como consecuencia, cuando hablamos de cáncer oral nos referimos de forma fundamental al carcinoma epidermoide.
La etiología del cáncer oral es desconocida y se considera una enfermedad multifactorial. Existen unos factores desencadenantes o factores de riesgo (tabaco, alcohol, sepsis oral, irritación por dientes o prótesis, radiación solar, dieta, virus, hongos, oncogenes) y unos factores predisponentes entre los que se incluyen las lesiones y los estados precancerosos (3).
La OMS (4) define la lesión precancerosa como un tejido de morfología alterada, más propenso a cancerizarse que el tejido equivalente de apariencia normal. Son lesiones precancerosas la leucoplasia y la eritroplasia.
Por estado precanceroso entiende un estado generalizado que se asocia a un riesgo significativamente mayor de presentar cáncer. Incluye el liquen plano, la disfagia sideropénica, la sífilis, la fibrosis oral submucosa y el lupus eritematoso (4).
Scully modifica en parte esta relación de entidades. Lesiones precancerosas serían la leucoplasia, la eritroplasia, la queilitis actínica, el lupus eritematoso y el liquen plano. Estados precancerosos serían la fibrosis oral submucosa, el síndrome de Plummer-Vinson, la sífilis, la deficiencia de vitamina A, la cirrosis hepática, las inmunodeficiencias, el xeroderma pigmentoso y la disqueratosis congénita (5).
LEUCOPLASIA ORAL
La OMS (4) define la leucoplasia como una placa blanca que no puede desprenderse por raspado y que no puede ser caracterizada clínica o histológicamente como ninguna otra lesión. Es por tanto un concepto eminentemente clínico. Van der Waal y cols. (6) añaden años más tarde que no se asocia con agente físico o químico alguno, a excepción del tabaco. Otros autores consideran que no deben excluirse las lesiones blancas producidas por agentes mecánicos como dientes o prótesis (5, 7).
La prevalencia en la población general oscila entre el 1 y el 4%, es más frecuente en hombres y entre el 70 y el 80% están comprendidos entre 40 y 70 años (5). La gran discrepancia entre diferentes estudios es por la diferente selección de muestra estudiada (leucoplasias por tabaco e idiopáticas exclusivamente, otros incluyen las producidas por agentes irritativos físicos). Por otra parte la leucoplasia aumenta cuando nos referimos a grupos especiales de población. Así Velasco (8), en un estudio realizado en 565 pacientes psiquiátricos institucionalizados encontró una tasa de prevalencia del 7,6%, sólo comparable a la encontrada por Berry y Landwerlen (9) del 10,9% en una población similar.
Desde el punto de vista etiológico, el tabaco es el factor fundamental relacionado con la presencia de leucoplasias (3, 5, 10, 11). Actúa a través de tres mecanismos diferentes: físico (el calor que se desprende), químico (productos derivados de la combustión del tabaco) y mecánico (colocación del pitillo, cigarro o pipa en la misma posición del labio). En cuanto al tipo de tabaco utilizado se ha comprobado que los cigarrillos producen menos lesiones que cualquier otra forma. Cuando se combinan los cigarrillos y la pipa se producen el mayor número de leucoplasias (12). Otros hábitos tienen una alta incidencia como mascar tabaco, fumar bidi o «snuff» (13, 14). La cantidad de tabaco consumido está directamente relacionada con la presencia de leucoplasias. Así, a medida que es mayor la cantidad, sea del tipo que sea, se incrementan las lesiones leucoplásicas. Por otra parte su disminución o supresión también influyen. Suprimiendo el tabaco durante un año, en el 60% de los casos desaparecerían de forma completa (13).
El segundo factor etiológico en importancia es el alcohol. Los pacientes con leucoplasia consumen casi el doble de alcohol que la población general (15).
Otros factores son los irritativos o friccionales. Diferentes autores consideran que juegan un papel tan importante como pueda ser el tabaco (7). Otros sin embargo, no los incluyen como mecanismos etiopatogénicos y consideran que estas lesiones blancas son hiperqueratosis friccionales y no verdaderas leucoplasias (3).
Se ha podido comprobar la existencia de Cándida en el epitelio de lesiones leucoplásicas aunque parece más razonable que respondan a una infección secundaria sobreañadida o bien una forma de candidiasis hiperplásica crónica o leucoplasia candidiásica. Lo que es evidente es que en las leucoplasias moteadas o nodulares hallaremos frecuentemente Cándida y que, cuando existen histopatológicamente suele haber mayor displasia epitelial y por tanto, presentar mayor tendencia a la malignización (16, 17).
En gran cantidad de ocasiones no somos capaces de hallar ningún factor etiológico; son las leucoplasias idiopáticas. Aquí cabría mencionar el posible papel de algunos virus (papilomavirus) o de algunas sustancias endógenas (18).
Por último, se han asociado leucoplasias con algunas enfermedades sistémicas como sífilis y ciertas anemias sideropénicas (síndrome de Plummer-Vinson) (19).
Para la descripción clínica estudiaremos la localización, la sintomatología y los tipos clínicos.
La leucoplasia puede localizarse en cualquier zona de la boca. Aunque existen diferencias ostensibles entre los estudios realizados, la mayoría de autores coinciden en afirmar que las localizaciones prioritarias son por orden de frecuencia: la mucosa yugal (sobre todo zona retrocomisural), encía, lengua, labios, suelo de boca y paladar (20, 21).
La sintomatología suele ser muy anodina y escasa; a lo sumo existe escozor, sensación de tirantez o rugosidad en la zona. Por ello el paciente acude a la consulta cuando la lesión tiene cierto tiempo de evolución. Sólo en el 25% de los casos se consulta al médico/odontólogo durante el primer año de evolución (22).
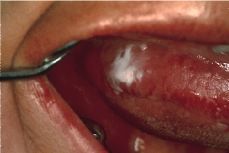
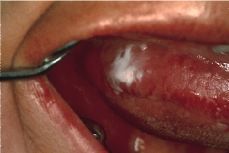
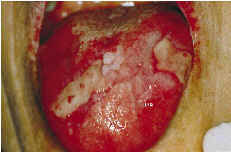
Se han establecido múltiples clasificaciones de los diferentes tipos de leucoplasias orales. La más utilizada actualmente es la de Van der Waal y cols. en 1986 (6) que las clasifican en homogéneas y no homogéneas; estas últimas las dividen en moteadas y verrugosas. Las homogéneas corresponden a manchas o placas blancas bien definidas, que pueden tener un aspecto arrugado (Fig. 1). Las moteadas presentan en su superficie áreas blancas interpuestas con otras atróficas erosivas o eritroplásicas, lo que les confiere el aspecto moteado o nodular que las define. Las verrugosas son lesiones blancas con aspecto de coliflor, con proyecciones dactiliformes y con un carácter más exofítico que el resto de leucoplasias. En estas últimas es difícil la diferenciación clínica e histológica con otras entidades como la hiperplasia verrugosa, la papilomatosis oral florida y el carcinoma verrugoso de Ackerman.
Figura 1.Leucoplasia homogénea en borde lateral derecho de lengua.
Las homogéneas son mucho más frecuentes que las no homogéneas. Aproximadamente se sigue una proporción, sobre 100 leucoplasias, de 95 homogéneas, cuatro moteadas y una verrugosa (7).
El diagnóstico es eminentemente clínico y se confirma histológicamente.
Desde el punto de vista de la histología, las leucoplasias orales se pueden diferenciar en dos tipos o formas: las leucoplasias orales benignas o sin displasia y las formas con displasia (tabla I). En las primeras existe una asociación variable de hiperqueratosis (orto o paraqueratosis) acantosis, papilomatosis y escaso o nulo infiltrado inflamatorio (23, 24).
| Tabla I. Tipos histológicos de leucoplasias orales |
| Sin displasia epitelial (75-90%) |
| Hiperqueratosis. |
| Para y/u ortoqueratosis. |
| Acantosis. |
| Papilomatosis. |
| Escaso o nulo infiltrado inflamatorio en corion. |
| Con displasia epitelial (10-25%) |
| Pérdida de polaridad de células basales. |
| Más de una capa de células basales. |
| Mayor relación núcleo citoplasma. |
| Papilas en forma de gotas. |
| Estratificación irregular del epitelio. |
| Muchas figuras mitóticas. |
| Mitosis en la mitad superior del epitelio. |
| Pleomorfismo celular. |
| Hipercromatismo nuclear. |
| Nucleolos agrandados. |
| Menor cohesión celular. |
| Disqueratosis. |
Las leucoplasias displásicas pueden calificarse como ligeras, moderadas o graves, dependiendo de la presencia de un mayor o menor número de anomalías atípicas y de la situación de éstas en estratos superficiales, intermedios o profundos del epitelio. De cualquier modo es una apreciación subjetiva del observador (23, 24).
La existencia o no de displasia es un factor determinante a la hora de la elección del tratamiento. En las leucoplasias displásicas, aunque sean ligeras o moderadas, la actitud debe ser agresiva con exéresis quirúrgicas por extensas que sean; en las formas sin displasia podemos adoptar medidas más conservadoras. El porcentaje de leucoplasias con displasia es del 10 al 25% según los estudios, y dentro de ellas las más frecuentes son las ligeras (50-60%), moderadas (30-35%) y severas (10-15%) (7, 24, 25).
La citología exfoliativa y las tinciones con azul de toluidina nunca deben sustituir a la biopsia y son de escaso valor (26). La biopsia será única o múltiple, tomando muestras de las diferentes áreas sospechosas, sobre todo de las formas atrófico-erosivas de las formas moteadas.
La leucoplasia oral es considerada una lesión precancerosa por diversos motivos. Gran cantidad de carcinomas epidermoides tienen asociadas lesiones leucoplásicas (probablemente estas neoplasias hayan aparecido sobre áreas inicialmente leucoplásicas). Por otra parte, se ha objetivado que lesiones leucoplásicas se han transformado con el paso de los años en epiteliomas (15).
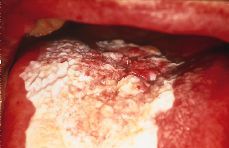
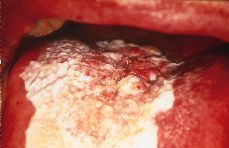
Existen diversos factores que favorecen la transformación maligna de las leucoplasias: tiempo de evolución elevado, pacientes mayores de 70 años, el sexo femenino, persistencia de factores etiopatogénicos (tabaco y alcohol), las formas idiopáticas (más frecuentes en las mujeres), las que se localizan en la cara ventral de la lengua o suelo de la boca (áreas más raramente exploradas), los tipos clínicos nodulares o moteados (Fig. 2) (se malignizan en el 26% de los casos frente al 2% de las homogéneas) y la presencia de signos displásicos en el epitelio (3, 5).
Figura 2.Leucoplasia no homogénea en dorso de lengua que se ha transformado en un carcinoma espinocelular.
Para plantearnos el tratamiento que vamos a emplear, primeramente debemos catalogar al paciente desde tres puntos de vista: etiopatogénico (presencia o no de factores como tabaco o alcohol, o elementos irritativos o friccionales, o si es idiopática), clínico (se trata de una leucoplasia homogénea o no homogénea) e histológico (si existe o no displasia).
El tratamiento consistirá en los pasos siguientes:
1. Eliminación de todos los factores etiológicos implicados: tabaco, alcohol, elementos irritativos de tipo dentario o protésico.
2. Simultáneamente se realizará una biopsia (o varias). Si se trata de una lesión pequeña la extirparemos en el mismo acto de la biopsia. Según el resultado de la histopatología actuaremos de diferente forma:
2a. Si se trata de una leucoplasia sin displasia y se trata de una lesión extensa insistiremos en la eliminación de los factores etiopatogénicos. Si en un plazo de seis meses no ha existido mejoría plantearemos su extirpación con láser CO2 o por criocirugía.
2b. Si se trata de una leucoplasia con displasia y aunque sea leve, se debe realizar la extirpación quirúrgica con medios convencionales valorando los márgenes. A veces se necesitan injertos para cubrir el área extirpada.
Si la biopsia nos indica la presencia de Cándida utilizaremos antifúngicos durante 2-3 semanas previamente a la cirugía para descartar lesiones muy similares de candidiasis hipertrófica crónica.
Algunos autores recomiendan la utilización de vitamina A o ácido retinoico (menos tóxico) ya sea de forma sistémica o tópicamente en forma de pomada, asociado a adhesivos a mucosa (27).
ERITROPLASIA
Pindborg (15) define la eritroplasia como una placa aterciopelada de color rojo intenso, que no se puede caracterizar clínica ni patológicamente como atribuible a ningún otro estado. Su prevalencia es desconocida, siendo mucho más infrecuente que la leucoplasia. Generalmente aparece entre los 50 y los 70 años, y aunque la causa es desconocida se asume que los factores etiológicos son los mismos que para el carcinoma epidermoide. En ocasiones se pueden ver placas blancas en el interior de la lesión o zonas adyacentes. Se localiza sobre todo en el suelo de la boca, cara ventral de la lengua y paladar blando (28).
Presenta una gran tendencia a desarrollar carcinomas, mucho más que la leucoplasia y en el 90% de los casos se aprecian imágenes displásicas. Por todo ello hoy se considera como un carcinoma in situ y como tal debe tratarse (5).
LIQUEN PLANO
El liquen plano es una enfermedad inflamatoria crónica, de etiología desconocida, cutáneo-mucosa, con una afectación oral muy importante, una histología característica y aunque benigna, en algunas ocasiones puede malignizarse.
Se trata de un proceso frecuente que afecta entre el 0,2 y el 2% de la población, mayor incidencia en el sexo femenino (7:3) y se presenta entre los 35 y los 70 años de edad (29).
Aunque es una enfermedad de etiología desconocida hoy se acepta que existe una base autoinmune con una predisposición genética y una serie de factores predisponentes o desencadenantes como alteraciones psicosomáticas, traumatismos y algunas enfermedades sistémicas (hepatopatías, diabetes, enfermedades intestinales crónicas, etc.) (30).
Cuando existe una relación directa con fármacos u otras sustancias químicas recibe el nombre de reacción liquenoide.
Se han postulado gran variedad de clasificaciones de formas clínicas de liquen plano oral. La más usada es la que las divide en reticulares, atróficas y erosivas (31). Pero si lo valoramos desde un punto de vista de su comportamiento clínico, evolución, pronóstico y tratamiento, es más correcto dividirlo en dos grupos o formas: liquen plano oral blanco y liquen plano oral rojo.
En el liquen blanco aparecen exclusivamente formas blancas hiperqueratósicas que no se desprenden con el raspado, fundamentalmente en disposición estriada o reticular (estrías de Wickham). Estas estrías son el signo clínico fundamental y característico para el diagnóstico. En otras ocasiones, las menos, se trata de placas blancas situándose sobre todo en el dorso de la lengua y la encía.
En el liquen rojo aparecen formas atróficas que afectan a zonas más o menos extensas de la cavidad oral y/o erosivas consistentes en úlceras crónicas, únicas o múltiples. Es frecuente que en la periferia de las lesiones rojas aparezcan estrías blanquecinas.
Presenta una localización característica. Para cualquiera de las formas se sitúa en el 80-90% de los casos en la mucosa yugal, porciones posteriores y de forma bilateral y simétrica. A continuación dorso de la lengua y encía. Menos frecuentemente, mucosa labial, suelo de boca y paladar. Las formas atróficas y en placas se localizan casi exclusivamente en el dorso de la lengua y en la encía (32).
La sintomatología varía según el tipo clínico. Nula o prácticamente asintomática en el liquen blanco. A lo sumo el paciente se queja de una sensación de rugosidad o tirantez de la zona afecta. Otra cosa diferente es el liquen rojo, donde el paciente refiere una sensación urente o dolor a veces intenso y con una gran incapacidad funcional, dependiendo del número y localización de las lesiones. No es raro encontrar un edema en la zona geniana cuando existen ulceraciones a este nivel de la mucosa. Aunque no se trata de una enfermedad infecciosa, la persistencia de las úlceras favorece una sobreinfección bacteriana por los microorganismos saprofitos de la cavidad oral, pudiendo acompañarse de adenopatías submaxilares (33).
Es muy frecuente la afectación generalizada de la encía con formas atróficas. Esta localización recibe el nombre de gingivitis descamativa crónica. Aparece una mucosa gingival roja, atrófica, dolorida y con una gingivorragia marcada tanto a la exploración como de forma espontánea. Suele acompañarse de sensibilidad dentinaria y presencia de placa bacteriana en los dientes. Los signos y síntomas son más manifiestos en la porción vestibular pero también pueden afectar a la zona lingual y palatina (34, 35).
No es raro observar una afectación cutánea y de otras mucosas. Así, en la piel aparecen unas pápulas de color rojo vinoso con las estrías blancas en su interior que tienden a unirse unas a otras formando placas muy pruriginosas. El lugar de elección es la cara anterior de la zona de la muñecas. En las uñas se produce un adelgazamiento progresivo (uña en «papel de fumar») hasta que se terminan perdiendo y el cuero cabelludo puede cursar con una alopecia de tipo cicatricial. La lesión en otras mucosas es similar a la cavidad oral. La que más frecuentemente se afecta es la genital (36).
El diagnóstico se confirma con la biopsia. El informe histopatológico debe reflejar las siguientes características: hiperqueratosis y acantosis epitelial, degeneración hidrópica de la porción basal del epitelio con la formación de los cuerpos coloides o de Civate y un infiltrado inflamatorio dérmico yustaepitelial de linfocitos, sobre todo de linfocitos T (37). En ocasiones para confirmar el diagnóstico hay que recurrir a técnicas inmunohistoquímicas como la inmufluorescencia directa (38).
El pronóstico también es totalmente diferente según se trate de formas blancas o rojas. Así el liquen plano blanco nunca se maligniza y puede llegar a desaparecer espontáneamente sin necesidad de tratamiento en el 40% de los casos. Las formas rojas siempre necesitan tratamiento y pueden llegar a malignizarse (39).
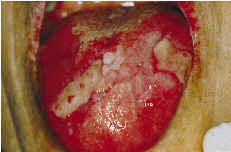
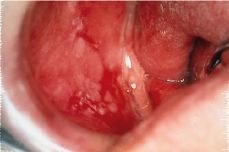
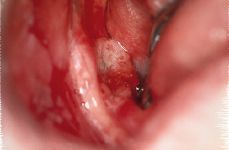
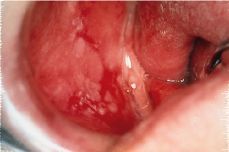
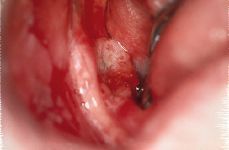
La posibilidad de malignización es del 0,1 al 10% de los casos y lo hacen las formas rojas (erosivo-atróficas), sobre todo de localización lingual (40) (Fig. 3). Se discute sobre la transformación maligna de estas lesiones, si verdaderamente es el liquen plano el que se maligniza o si es la mucosa donde se asienta la enfermedad, susceptible de una acción más directa de factores carcinogénicos sobre esa zona atrófica o ulcerada, la que termina evolucionando a carcinoma. De cualquier manera, múltiples estudios verifican este riesgo de malignización (31, 40-43) (Fig. 4a y 4b).
Figura 3.Liquen plano rojo lingual con formación de úlceras. Estas lesiones son las que se malignizan con mayor frecuencia.
Figura 4a.Liquen rojo ulcerado en mucosa yugal derecha.
Figura 4b.Misma paciente que 4a con presencia de un carcinoma a nivel del borde lingual. No hay antecedentes de factores carcinogenéticos (tabaco, alcohol, etc).
El tratamiento de elección son los corticoides, a poder ser tópicos, en pomadas asociados a adhesivos a mucosa, soluciones acuosas o en inyecciones intralesionales (32). El que utilizamos más frecuentemente es el acetónido de triamcinolona a dosis de 0,1 a 0,5%. Si existe una afectación generalizada habrá que recurrir a los corticoides sistémicos.
El uso continuado de corticoides hará necesario prescribir antimicóticos de forma preventiva, para evitar infecciones candidiásicas sobreañadidas (44).
Se utilizan otras formas terapéuticas y medicamentos como los retinoides tanto de forma tópica como sistémica (45). Una buena higiene, la eliminación de factores irritativos y el control psicológico del paciente son medidas indicadas en todos los casos de liquen plano.
DISFAGIA SIDEROPÉNICA
La asociación de anemia ferropénica y disfagia constituye el denominado síndrome de Plummer-Vinson o síndrome de Paterson-Kelly o disfagia sideropénica. Afecta típicamente a mujeres de mediana edad del Norte de Europa, en las que las deficiencias de hierro se acompañan con déficit dietéticos de vitaminas y proteínas animales. Suele acompañarse de queilitis comisural (3).
Además de la intensa disfagia, otros componentes del síndrome son la presencia de una mucosa atrófica, labios delgados, queilitis angular frecuente y una lengua dolorosa, roja y depapilada.
Se ha demostrado una mayor predisposición al cáncer de vías respiratorias y digestivas altas (46). La atrofia del epitelio, fundamentalmente del dorso lingual, favorece la acción de factores etiológicos carcinogenéticos como el tabaco y el alcohol (10).
SIFILIS
Numerosos autores han referido la asociación entre el cáncer oral y las lesiones de sífilis, más específicamente con formas de sífilis terciaria como es la esclerosis sifilítica (47). Actualmente esta relación es muy infrecuente por la utilización de medidas preventivas y el uso de penicilina cuando ésta se diagnostica en sus estadios iniciales.
La esclerosis sifilítica es casi exclusiva del varón y afecta a la lengua, de ahí que se denomine también glositis intersticial. Es una endoarteritis obliterante a nivel de los vasos linguales que produce una atrofia y fibrosis de la lengua, que aunque en un principio aparezca edematosa, termina retrayéndose (microglosia) (3).
En el dorso lingual aparecen induraciones irregulares más o menos dolorosas, no ulceradas con un patrón de surcos asimétricos; hay zonas de leucoplasia alternando con zonas depapiladas lisas y brillantes.
Se considera un estado precanceroso, ya que la tercera parte de los pacientes desarrollan carcinoma de células escamosas. La mucosa, previamente alterada, es más susceptible de la acción carcinogenética de factores externos, sobre todo el tabaco, alcohol y traumatismos (10).
FIBROSIS ORAL SUBMUCOSA
Es una entidad que aparece casi exclusivamente en hindúes, la India, Pakistán y Birmania. Pindborg (48) la describe como una enfermedad crónica, de curso insidioso, que afecta a la mucosa oral y a veces a la faríngea, caracterizada por una alteración fibroelástica de la lámina propia y atrofia epitelial, que conduce a una rigidez de la mucosa, determinando trismus y dificultando la deglución. El hábito de masticar nuez de areca es el principal factor etiológico (49).
Se considera un estado precanceroso por diversos motivos: a) Una proporción considerable de estas lesiones presentan displasia epitelial. b) La incidencia de leucoplasia es en estos pacientes 6 a 8 veces superior que en el resto de la población. c) En el Sur de la India, casi la mitad de los pacientes con cáncer oral padecen fibrosis oral submucosa. d) Estudios de seguimiento han constatado la aparición de cáncer oral en pacientes con fibrosis oral submucosa (48). Murti y cols. encontraron una tasa de transformación maligna de un 7,6% en un período de seguimiento de 17 años (50).
LUPUS ERITEMATOSO DISCOIDE
Es una enfermedad cutáneo-mucosa que afecta a la boca entre un 15-25% de los casos. Las manifestaciones orales pueden preceder a las lesiones cutáneas e incluso ser la única manifestación. Aunque se localizan en diversas zonas de la mucosa bucal, un lugar preferente es la semimucosa del labio (3).
Las lesiones labiales por lupus eritematoso discoide (labio lúpico) se presentan como formas típicas, con zonas de hiperqueratosis y áreas atróficas, o bien, como lesiones discoides atípicas en forma de estrías blancas de formas caprichosas en el borde rojo. Existen dos características clínicas diferenciales en el labio lúpico: el signo de la «invasión cutánea» (51), la lesión del bermellón desdibuja el límite con la piel, invadiéndola; y el signo de «engrosamiento asimétrico» (52), debido probablemente a la infiltración en parches profundos e irregulares de la lámina propia de la mucosa. Estos dos signos lo diferencian de otras patologías similares como la queilitis descamativa y el liquen plano (53).
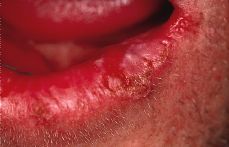
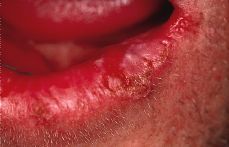
Diversos autores han descrito el desarrollo de un carcinoma de células escamosas en las lesiones labiales de lupus discoide (54, 55) (Fig. 5). Se estima un riesgo de malignización entre el 0,4 y el 4,2%, aunque es probable que las cifras sean inferiores, pues existen pocos casos descritos. Hasta el año 1988 se habían publicado en la literatura 43 casos de carcinomas sobre lesiones discoides crónicas de labio. No ha sido descrita ninguna lesión intraoral transformada en cáncer (53).
Figura 5.Paciente con historia de lupus discoide lingual. La biopsia de esta lesión confirmó un carcinoma espinocelular.
QUEILITIS ACTINICA
Consiste en una degeneración de los tejidos del bermellón labial, especialmente del labio inferior, secundaria a una exposición repetitiva a la radiación solar. Existe una relación directa con la cantidad de radiación acumulada y el grado de pigmentación mucocutánea del individuo (56). Así se ha constatado su mayor frecuencia en personas de raza blanca y tez pálida, que habitan en áreas con gran cantidad de horas de sol y que desarrollan su actividad al aire libre.
El bermellón labial presenta un aspecto atrófico, blanco-grisáceo, con fisuras y arrugas radiales. En casos avanzados hay un borramiento del límite cutáneo, apareciendo áreas queratósicas y erosivas, e incluso, ulceraciones y costras. Histológicamente existen áreas atróficas alternando con áreas hiperplásicas, con para u ortoqueratosis. Así mismo puede verse una gran variedad de cambios displásicos, desde una ligera atipia a un carcinoma in situ. La submucosa presenta una característica degeneración basófila del colágeno (57).
El riesgo de malignización de la queilitis actínica es elevado, pudiéndose producir un carcinoma invasivo tras años de evolución, por lo que requiere un estrecho seguimiento y la realización de una biopsia si existe una ulceración persistente o aparece una zona indurada (3).
BIBLIOGRAFIA
1. Silverman Jr S, Gorsky M. Epidemiology and demographic update in oral cancer: California and national data - 1973 to 1985. J Am Dent Assoc 1990;120:495-9.
2. Milián Masanet A, González Moles MA. Tumores malignos de la mucosa oral. En: Bagán Sebastián JV, Ceballos Salobreña A, Bermejo Fenoll A, Aguirre Urizar JM, Peñarrocha Diago M, eds. Medicina Oral. Barcelona: Masson 1995:186-201.
3. Martínez-Sahuquillo Márquez A, Bullón Fernández P. El cáncer oral en el paciente geriátrico (I): Epidemiología y etiología. Precáncer oral En: Bullón Fernández P, Velasco Ortega E, eds. Odontoestomatología geriátrica. Madrid: Coordinación Editorial IM&C 1996:291-306.
4. WHO Collaborating centre for Oral Precancerous lesions. Defenitions of leucoplakia and related lesions: An aid to studies on oral precancer. Oral Surg Oral Med Oral Pathol 1978;46:518-39.
5. Bagán Sebastián JV. Lesiones y estados precancerosos de la mucosa oral. En: Bagán Sebastián JV, Ceballos Salobreña A, Bermejo Fenoll A, Aguirre Urizar JM, Peñarrocha Diago M, eds. Medicina Oral. Barcelona: Masson 1995:166-76.
6. Van der Waal I, Bánòczy J, Axell T, et al. Diagnostic and therapeutic problems of oral precancerous lesions. Int J Oral Maxillofac Surg 1986;15:790-8.
7. Bagán JV, Vera F, Milián MA, Peñarrocha M, Silvestre FJ, Sanchís JM. Leucoplasia oral: estudio clínico-patológico de 110 casos. Arch Odontoestomatol 1993;9:127-38.
8. Velasco Ortega E, Vigo Martínez M, Valencia Alejandre S, Martínez-Sahuquillo Márquez A, Bullón Fernández P. La leucoplasia oral en pacientes psiquiátricos. Valoración clínica de un grupo de riesgo. Arch Odontoestomatol 1997;13:647-51.
9. Berry H, Landwerlen J. Cigarette smoker´s lesion in psychiatric patients. J Am Dent Assoc 1973;86:657-62.
10. Bagán Sebastián JV, Vera Sempere F. Patología de la Mucosa oral. Barcelona: Syntex Latino 1989;69-75.
11. Bascones A, Cerero R, Esparza G, Llanes F. Lesiones precancerosas de la cavidad oral. Arch Odontoestomatol 1992;8:491-8.
12. Baric JM, Alman JE, Feldman RS, Chauncey HH. Influence of cigarette, pipe, and cigar smoking, removable partial dentures, and age on oral leucoplakia. Oral Surg Oral Med Oral Pathol 1982;54:424-9.
13. Roed Petersen B, Pindborg JJ. A study of danish snuffed-induced oral leucoplakias. J Oral Pathol 1973;2:301-13.
14. Creath CJ, Cutter G, Bradley DH, Wright JT. Oral leucoplakia and adolescent smokeless tobaco use. Oral Surg Oral Med Oral Pathol 1991; 72:35-41.
15. Pinborg JJ. Cáncer y precáncer bucal, 1ª edición. Buenos Aires: Panamericana; 1981.
16. Jepsen H, Winther JE. Mycotic infection in oral leukoplakia. Acta Odontol Scand 1965;23:239-56.
17. Cawson RA. Chronic oral candidiasis and leukoplakia. Oral Surg 1966;22:582-91.
18. González Moles MA, Ruiz Avila I, Giner Martínez M, Ceballos Salobreña A. Consideraciones sobre las implicaciones pronósticas de los papilomas virus humanos en leucoplasias orales. Avanc Odontoestomatol 1993;9:473-6.
19. Silverman S, Rozen RD. Observations on the clinical characteristics and natural history of oral leukoplakia. J Am Dent Assoc 1968;76:772-7.
20. Axell T. Ocurrence of leukoplakia and some other oral white lesions among 20.333 adult Swedish people. Community Dent Oral Epidemiol 1987;15:46-51.
21. Hogewind WFC, Van der Waal I. Prevalence study of oral leukoplakia in a selected population of 1.000 patients from the Netherlands. Community Dent Oral Epidemiol 1988;16:302-5.
22. Bagán JV, Peydró A, Vera-Sampere F. Leucoplasia bucal. Estudio clínico de 33 pacientes. Rev Esp Estomatol 1985;33:195-204.
23. Waldrom CA, Shafer WG. Leukoplasis revisited. A clinicopathologic study of 3.256 oral leukoplasias. Cancer 1975;36:1386-92.
24. Bagán JV, Vera-Sampere F, Peydró A. Leucoplasia bucal. Estudio histopatológico de 31 casos. Rev Esp Estomatol 1985;33:93-8.
25. Bánòczy J, Csiba A. Ocurrence of epithelial dysplasia in oral leukoplakia. Oral Surg Oral Med Oral Pathol 1976;42:766-74.
26. Miller RL, Simms BW, Gould AR. Toluidine blue staining for detection of oral premalignant lesions and carcinomas. J Oral Pathol 1988;17:73-8.
27. Koch HF. Biochemical treatment of precancerous oral lesions: the efectiveness of various analogues of retinoic acid. J Maxillofac Surg 1978; 6:59-63.
28. Shear M. Erytroplakia of the mouth. In Dent J 1972;22:460-70.
29. Axell T, Rundquist L. Oral lichen planus, a demographic study. Community Dent Oral Epidemiol 1987;15:52-6.
30. López J, Ferré J, Rosello X. Liquen plano oral: revisión. Avanc Odontoestomatol 1993;9:461-72.
31. Silverman S, Lozada-Nur F. A prospective follow-up study of 570 patients with oral lichen planus: Persistence, remission, and malignant association. Oral Surg Oral Med Oral Pathol 1985;60:30-4.
32. Bagán Sabastián JV, Cerero Lapiedra R. Liquen plano oral. En: Bagán Sebastián JV, Ceballos Salobreña A, Bermejo Fenoll A, Aguirre Urizar JM, Peñarrocha Diago M. Medicina Oral. Barcelona: Masson 1995: 202-19.
33. Bagán Sebastián JV, Milián Masanet MA, Peñarrocha Diago M, Jimenez Y. A clinical study of 205 patients with oral lichen planus. J Oral Maxillofac Surg 1992;50:116-8.
34. Bascones A, Caballero R. Gingivitis descamativa crónica. Avanc Odontoestomatol 1989;5:9-15.
35. Bagán Sebastián JV, Milián Masanet MA, Martínez Canut P, Peñarrocha Diago M. Gingivitis descamativas crónicas por liquen plano atrófico y/o erosivo: Presentación de 48 casos. Avanc Period 1993;3:45-59.
36. Irvine C, Irvine F, Champion RH. Long term follow-up of lichen planus. Acta Derm Venereol (Stochk) 1991;71:242-4.
37. Andreasen JO. Oral lichen planus. A histologic evaluation of ninety-seven cases. Oral Surg 1968;25:158-66.
38. Bagán JV, Alapont L, Milian MA, et al. Inmufluorescencia directa del liquen plano oral. Estudio de 20 casos. Arch Odontoestomatol 1988; 4:353-6.
39. Sanchís JM, Bagán JV, Jorda E, Jimenez Y, Peñarrocha M. Liquen plano oral: estudio clínico-evolutivo de 156 pacientes seguidos durante un año. Arch Odontoestomatol 1994;10:231-6.
40. Barnard NA, Scully C, Everson JW, Cunniham S, Porter SR. Oral cancer development in patients with oral lichen planus. J Oral Pathol Med 1993;22:421-4.
41. Krutchoff DJ, Cutler I, Laskowski S. Oral lichen planus: the evidence regarding potential malignant transformation. J Oral Pathol 1978;7:1-7.
42. Murti PR, Daftary DK, Bhonsle RB, Gupta PC, Mehta FS, Pindborg JJ. Malignant potential of oral lichen planus: observations in 722 patients from India. J Oral Pathol 1986;15:71-7.
43. Holmstruup P, Thorn JJ, Rindum J, Pindborg JJ. Malignant development of lichen planus-affected oral mucosa. J Oral Pathol 1988;17:219-25.
44. Vincent SD. Diagnosing and managing oral lichen planus. J Am Dent Assoc 1991;122:93-4.
45. Baudet Pommel M, Janin Mercier A, Souteyrand P, Peri G. Ongoing clinical study of oral lichen planus treated with retinoin and etretinate. Oral Surg Oral Med Oral Pathol 1991;71:197-202.
46. Wynder EL, Hultberg S, Jaconsson F. Enviromental factors in cancer of the upper alimentary tract: a Swedish study with special reference to Plummer-Vinson (Paterson-Kelly) syndrome. Cancer 1957;10:470-87.
47. Bánòczy J. Follow-up studies in oral leukoplakia. J Maxillofac Surg 1977;5:69-75.
48. Pindborg JJ. Atlas de enfermedades de la mucosa oral. 5ª ed. Barcelona: Masson Salvat 1994:222-4.
49. Murti PR, Gupta PC, Bhonsle RB, Daftary DK, Mehta FS, Pindborg JJ. Effect on the incidence of oral submucous fibrosis with special reference to the ethiologic role of areca nut. J Oral Pathol Med 1990;19:99-100.
50. Murti PR, Bhonsle RB, Pindborg JJ, Daftary DK, Gupta PC, Mehta FS. Malignant transformation rate in oral submucous fibrosi over a 17-year period. Monnunity Dent Oral Epidemiol 1985;13:340-1.
51. Grispan D. Enfermedades de la boca, vol III. Buenos Aires: Mundi 1976:2309-42.
52. Bermejo A, Román P, Bagán JV, González L. Lupus érythémateux discoide oral. Considérations diagnostiques à propos dún cas. Rev Stomatol Chir Maxillofac 1985;3:156-64.
53. Bermejo Fenoll A. Enfermedades inflamatorias del tejido conectivo. En: Bagán Sebastián JV, Ceballos Salobreña A, Bermejo Fenoll A, Aguirre Urízar JM, Peñarrocha Diago M. Medicina Oral. Barcelona: Masson 1995:241-53.
54. Bermejo Fenoll A. Lupus eritematoso II. Pronóstico, tratamiento, evolución y manejo estomatológico. Avanc Odontoestomatol 1991;7:541-7.
55. Handlers JP, Abrams AM, Aberle AM, Auyong T, Melrose RJ. Squamous cell carcinoma of the lip developing in discoid lupus erythematosus. Oral Surg Oral Med Oral Pathol 1985;4:382-6.
56. Chimenos E, Rosello X, Camps M. Queilitis actínica. Arch Odontoestomatol 1993;9(1):3-10.
57. Gándara Rey JM, Blanco Carrión A, Blanco Fondevila J. Patología Labial: queilitis y macroqueilitis. Arch Odontoestomatol 1992;8:500-9.