En la última década se viene observando en todo el mundo un incremento en la incidencia de colonización e infección por enterobacterias productoras de carbapenemasas (EPC) en centros sanitarios1, paralelo al consumo de antibióticos carbapenémicos que favorece la aparición de mecanismos de resistencia en las familias Enteobacteriacea y en otros bacilos gramnegativos como Pseudomonas aeruginosa y Acinetobacter baumannii, fundamentalmente por la producción de carbapenemasas, pertenecientes en su mayoría a 3 clases distintas: clase A, principalmente del tipo KPC; clase B, principalmente VIM y NDM; y clase D, principalmente OXA-48.
El aumento de la prevalencia de EPC en España constituye un problema de salud pública por el gran impacto económico y personal que supone, dada su alta facilidad de transmisión, prolongada duración de la colonización, dificultad en el tratamiento de las infecciones y elevada mortalidad en bacteriemias2. En los últimos años se han implementado estrategias para prevenir su introducción y transmisión en centros sanitarios, basadas esencialmente en: 1) Vigilancia activa, 2) Cumplimiento estricto de precauciones estándar y de las particulares basadas en transmisión, limpieza y desinfección ambiental, formación sanitaria y agrupación en cohorte de los casos, y 3) Control de diseminación entre diferentes niveles asistenciales mediante identificación de casos a través de un flujo de información normalizado3.
La Fuenfría, un hospital de media/larga estancia (HMLE) de la Comunidad de Madrid con 192 camas, dispone de 12 camas individuales ubicadas en un extremo del hospital para pacientes colonizados y/o infectados por EPC, y realiza vigilancia activa con toma de muestras de exudado rectal a todos los ingresos en las primeras 24h y, para descartar transmisión cruzada, al compañero de habitación de los casos EPC y mensualmente a los pacientes ubicados en la planta de la cohorte. Estas muestras se remiten al Laboratorio de Microbiología del Hospital de El Escorial donde se siembran en medio selectivo cromogénico (Brilliance CRE Agar. ThermoFisherScientific). Las colonias se someten a test de sensibilidad disco/placa según método de Kirby-Bauer. Los halos de inhibición<25mm en ertapenem, meropenem o ambos conducen a la realización de técnicas rápidas inmunocromatográficas que permiten la identificación de las carbapenemasas más habituales (Resist-4 O.K.N.V. Coris BioConcept). Si todas son negativas, la cepa se remite al Laboratorio de Antibióticos del Centro Nacional de Microbiología para genotipado.
El propósito de este estudio es describir nuestra experiencia tras la implementación del plan de vigilancia activa y control de EPC durante el año 2018, enfatizando su importancia.
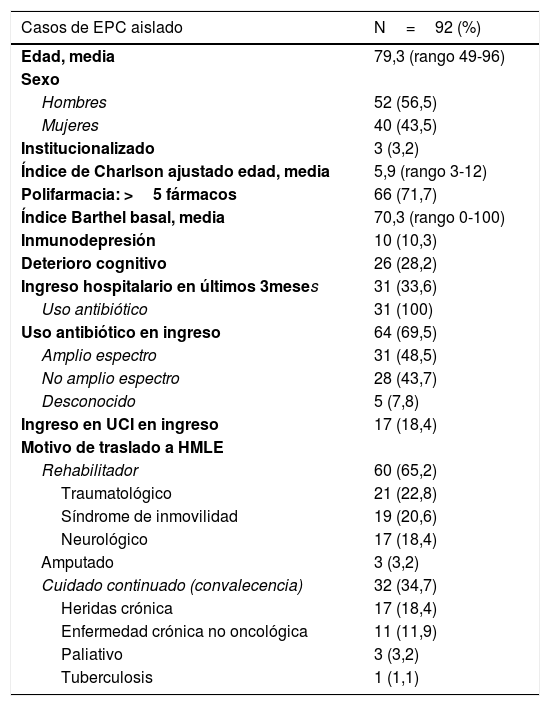
ResultadosDe 984 pacientes ingresados en 2018, procedentes de 19 hospitales, se hallaron EPC en 92 (9,3%), de los cuales 81 (8,2%) fueron detectados por vigilancia activa al ingreso. El principal mecanismo de resistencia fue la producción de carbapenemasa OXA-48 (60,8%), y el microorganismo dominante la Klebsiella pneumoniae (54,3%). Durante su estancia en nuestro centro, 3 casos desarrollaron infección por EPC (una infección urinaria, una infección de partes blandas y una bacteriemia). No se objetivó transmisión cruzada de EPC y el 10% de los pacientes se mostró descolonizado al alta (tabla 1). La edad media fue de 79,3 años, el 56,5% varones. La estancia media fue de 59,2 días y la mortalidad del 21,7%. El 65% recibió tratamiento rehabilitador. La comorbilidad medida por índice Charlson medio ajustado a la edad fue de 5,9, la funcionalidad medida por Índice Barthel medio fue de 70. El 71,7% tenía prescritos más de 5 fármacos y el 28,2% presentaba algún grado de deterioro cognitivo. Un 10,8% estaba inmunodeprimido (corticoterapia prolongada y/o tratamiento oncológico), un 33,6% estuvo expuesto a antibióticos en los 3 meses previos al último ingreso, un 75% había recibido antibióticos durante este ingreso (siendo el 48% antibióticos de amplio espectro) y un 18,4% había ingresado en la Unidad de Cuidados Intensivos (UCI) (tabla 2).
Características microbiológicas y clínicas de los pacientes con colonización y/ o infección por EPC en el HMLE
| Casos EPC aislados | N=92 (%) |
|---|---|
| Microorganismo | |
| Klebsiella pneumoniae | 50 (54,3) |
| Pseudomonas aeruginosa | 11 (10,8) |
| Klebsiella oxytoca | 8 (8,6) |
| Escherichia coli | 8 (8,6) |
| Acinetobacter baumannii | 7 (7,6) |
| Enterobacter cloacae | 6 (6,6) |
| Otros | 2 (2,2) |
| Carbapenemasa | |
| OXA-48 | 56 (60,8) |
| KPC | 17 (18,4) |
| VIM | 11 (11,9) |
| OXA-23,24 | 7 (7,6) |
| NMD | 1 (1,1) |
| Infección | |
| Sí | 3 (3,3) |
| No | 89 (96,7) |
| Tipo infección y adquisición | |
| Infección nosocomial al ingreso (<72h) | 0 (0) |
| Infección nosocomial (>72h) | 3 (3,3) |
| Tipo de colonización y adquisición | |
| Colonización al ingreso (<72h) | 92 (100) |
| Colonización nosocomial (>72h) | 0 (0) |
| Tipo de colonización | |
| Muestra exudado rectal (vigilancia activa) | 81(88) |
| Muestra orina | 11 (11) |
| Tipo de infección | |
| ITU | 1 (1,1) |
| Bacteriemia | 1 (1,1) |
| Úlcera/herida | 1 (1,1) |
| Persistencia de colonización al alta | 82 (89,1) |
Características clínicas de los pacientes procedentes de los diferentes hospitales de la Comunidad de Madrid trasladados al HMLE
| Casos de EPC aislado | N=92 (%) |
|---|---|
| Edad, media | 79,3 (rango 49-96) |
| Sexo | |
| Hombres | 52 (56,5) |
| Mujeres | 40 (43,5) |
| Institucionalizado | 3 (3,2) |
| Índice de Charlson ajustado edad, media | 5,9 (rango 3-12) |
| Polifarmacia: >5 fármacos | 66 (71,7) |
| Índice Barthel basal, media | 70,3 (rango 0-100) |
| Inmunodepresión | 10 (10,3) |
| Deterioro cognitivo | 26 (28,2) |
| Ingreso hospitalario en últimos 3meses | 31 (33,6) |
| Uso antibiótico | 31 (100) |
| Uso antibiótico en ingreso | 64 (69,5) |
| Amplio espectro | 31 (48,5) |
| No amplio espectro | 28 (43,7) |
| Desconocido | 5 (7,8) |
| Ingreso en UCI en ingreso | 17 (18,4) |
| Motivo de traslado a HMLE | |
| Rehabilitador | 60 (65,2) |
| Traumatológico | 21 (22,8) |
| Síndrome de inmovilidad | 19 (20,6) |
| Neurológico | 17 (18,4) |
| Amputado | 3 (3,2) |
| Cuidado continuado (convalecencia) | 32 (34,7) |
| Heridas crónica | 17 (18,4) |
| Enfermedad crónica no oncológica | 11 (11,9) |
| Paliativo | 3 (3,2) |
| Tuberculosis | 1 (1,1) |
Existen pocos estudios sobre vigilancia activa de EPC en España, siendo más habitual la presentación los de casos o brotes así como estudios de prevalencia4. Los resultados obtenidos en nuestro HMLE son similares a los descritos en los informes mensuales epidemiológicos de vigilancia de EPC de la Comunidad de Madrid, incluido el tener a la Klebsiella pneumoniae OXA-48 como microorganismo predominante, informes que señalan la presencia de EPC en hospitales de alta complejidad pero también en HMLE. Esto podría deberse a que todos los pacientes procedían de estos primeros hospitales y presentaban algún factor de riesgo para colonización o infección: edad avanzada, comorbilidad, ingresos hospitalarios previos, exposición a antibióticos, estancia en UCI, inmunodepresión y deterioro funcional5.
Las estrategias para la detección precoz de EPC son decisivas para evitar su propagación y la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC)6 recomienda la utilización de medios selectivos para un primer cribado. De producirse algún crecimiento, debe confirmarse la especie y la sensibilidad a carbapenémicos. Las cepas que cumplen los criterios EUCAST7 para resistencia a carbapenémicos se someten a pruebas de confirmación fenotípicas o genotípicas. Entre las primeras existen diversos test basados en la inhibición de las distintas carbapenemasas por diversos agentes (ácido fenilborónico, EDTA, ácido dipicolínico etc.) pero ninguno de ellos es 100% sensible y específico. Alternativamente, se han desarrollado métodos inmunocromatográficos, como los que usaron en nuestro laboratorio, que utilizan anticuerpos monoclonales frente a las carbapenemasas más frecuentes, siendo de fácil realización, rápidos (resultados en 15min) y con buenos valores de sensibilidad y especificidad.
Siguiendo las recomendaciones de la Comunidad de Madrid8–10 se mantuvieron precauciones de contacto con los pacientes hasta que sus cultivos fueron negativos durante 3 semanas consecutivas, precauciones que deben ajustarse al riesgo de transmisión que depende de las características del paciente (dependencia para actividades básicas, presencia de deterioro cognitivo, trastornos de conducta, incontinencia fecal/urinaria y heridas de drenaje de difícil control) a fin de asegurar su bienestar y minimizar daños, especialmente psicológicos. En nuestros casos, con un 65,2% de pacientes con deterioro funcional, un 28,2% con deterioro cognitivo y un 18,4% con heridas crónicas, la valoración se realizó de manera individualizada. La persistencia de colonización al alta en un 90% está en consonancia con los 3-6 meses de colonización descritos en la literatura11. Las medidas de control parecieron ser efectivas ya que no se detectó ningún caso de transmisión cruzada durante el periodo estudiado. Respecto al desarrollo de infecciones en pacientes colonizados, se hallaron 3 casos más allá de las 72h de ingreso y todos sobrevivieron. En hospitales de alta complejidad se encuentra infección en un 10-30% de los pacientes colonizados, asociada a mayor comorbilidad y presencia de factores de riesgo12.
En conclusión, la vigilancia activa es un componente importante en la prevención y control de EPC en los HMLE, lo que supone un reto para todos los profesionales sanitarios, incluidos gestores, pues implementarla supone realizar modificaciones relevantes en la práctica diaria, formar y sensibilizar al personal, así como acometer cambios estructurales, incluida la integración del médico preventivista y microbiólogo en el equipo multidisciplinar.