Información de la revista
Vol. 18. Núm. 5.
Páginas 325-330 (agosto 1999)
Vol. 18. Núm. 5.
Páginas 325-330 (agosto 1999)
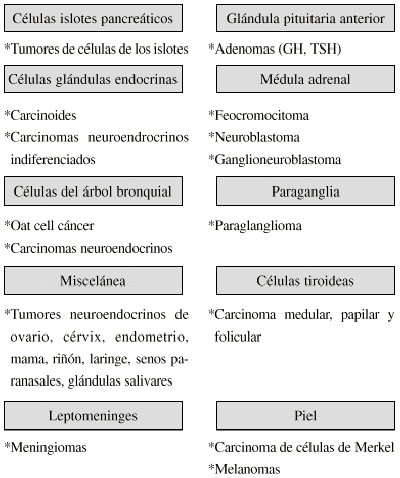
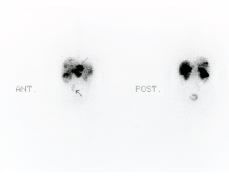
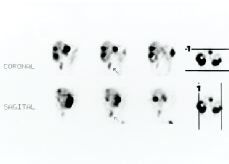
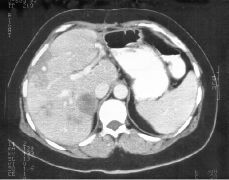
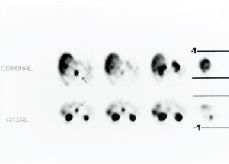
111In-pentetreótida en el estudio de tumores que expresan receptores para la somatostatina
111IN-PENTETREOTIDE IN THE STUDY OF TUMORS EXPRESSING SOMATOSTATIN RECEPTORS
Visitas
2303
J J. Mateos Fernández, F. Pons Pons, D. Fuster Pelfort, S. Vidal-Sicart, F. Lomeña Caballero, R. Herranz García-Romero
Este artículo ha recibido
Información del artículo
Opciones para acceder a los textos completos de la publicación Revista Española de Medicina Nuclear e Imagen Molecular
Socio
Si es usted socio de la Sociedad Española de Medicina Nuclear e Imagen Molecular (SEMNIM) puede acceder al texto completo de los contenidos de la Revista Española de Medicina Nuclear e Imagen Molecular desde los enlaces a la revista publicados en la web de la SEMNIN (enlace a https://semnim.es/iniciar-sesion/), previo inicio de sesión como socio. Si tiene problemas de acceso puede contactar con la Secretaría Técnica de la SEMNIM en el correo electrónico secretaria.tecnica@semnim.es o en el teléfono: + 34 619 594 780
Suscriptor
Suscribirse
Contactar
Teléfono para suscripciones e incidencias
De lunes a viernes de 9h a 18h (GMT+1) excepto los meses de julio y agosto que será de 9 a 15h
Llamadas desde España
932 415 960
Llamadas desde fuera de España
+34 932 415 960
E-mail