Introducción
La ciclooxigenasa 2 (COX-2) es una isoforma de la enzima ciclooxigenasa, que interviene en la conversión del ácido araquidónico en prostaglandina H, permitiendo la síntesis de mediadores bioquímicos que favorecen la inflamación crónica y la transformación tumoral1. La isoforma 1 (COX-1) está ampliamente distribuída a nivel tisular y sus concentraciones y actividad permanecen constantes, mientras que la COX-2 cursa con valores tisulares nulos o muy bajos en la mayoría de los tejidos, y es inducible tras ciertos estímulos. Sólo los riñones, los testículos y el sistema nervioso central tienen siempre altas concentraciones de la enzima. Los principales inductores de la COX-2 son los polisacáridos bacterianos, las interleucinas 1β y 2, y el factor de necrosis tumoral alfa (TNFα). También la estimulan el factor de crecimiento epidérmico (EGF), el derivado de las plaquetas (PDGF) y ciertos promotores tumorales. Por el contrario, la inhiben las interleucinas 13, 10 y 4, así como los corticosteroides2.
La sobreexpresión de COX-2 se asocia a la de prostaglandina E2, y ambas están involucradas en la génesis de los carcinomas no microcíticos de pulmón (CPNM), merced a una resistencia a la apoptosis, la inhibición del sistema inmune y un incremento de la angiogénesis, todo lo cual contribuye a potenciar la invasión y la metastatización tumoral3-5. Recientemente, se ha visto que ciertos polimorfismos de la COX-2 se relacionan con el hábito tabáquico6 y que la enzima es también la mediadora de los efectos oncogénicos del factor de crecimiento de los hepatocitos (HGF) en los tumores pulmonares7.
En los CPNM el papel fisiopatológico de la COX-2 es superior en los adenocarcinomas, se asocia con la mayor expresión de ciertas metaloproteasas de matriz, como la MMP28 y el oncogén erbB29, sus valores son independientes de la expresión del receptor del EGF (EGFR)10 y, para algunos grupos, se comporta como factor pronóstico, preferentemente en varones y en el subtipo adenocarcinoma10-13. Sin embargo, otros autores no lo han podido constatar12,14.
La COX-2 se ha utilizado como diana terapéutica3,15, y se ha comprobado que su inhibición se acompaña de mayor apoptosis y un descenso del porcentaje de células en las fases S y G2-M16. Asimismo, determina una reducción muy notable del factor de crecimiento del endotelio vascular A (VEGFA)17. Se ha visto que el efecto inhibidor de la COX-2 se realiza induciendo la expresión de p2118 y que los inhibidores aumentan la respuesta del tumor a la radioterapia y quimioterapia19,20, y además, posee un efecto protector sobre de la aparición de un cáncer de pulmón21.
En relación con la biología de los CPNM, merece destacarse, además, que la inhibición de las señales celulares mediadas por el EGFR incrementa notablemente la 15-OH-prostaglandina dehidrogenasa, enzima que metaboliza la PGE2 en esos tumores22, lo cual puede explicar su diferente comportamiento clínico13. Asimismo, la inhibición de la bombesina, hormona involucrada en la génesis de estos carcinomas pulmonares, está ligada, entre otros factores, a la supresión de la COX-223. La proteína p16, inhibidor del ciclo celular, es de gran valor en estos tumores, pues se comporta con gen tumor-supresor y sus alteraciones (preferentemente hipermetilación de su promotor, deleciones, mutaciones, etc.) se asocian con un mayor riesgo de desarrollarlos. Asimismo, su pérdida de expresión se puede apreciar también en las lesiones bronquiales preneoplásicas24 y en pacientes fumadores25.
La tomografía por emisión de positrones (PET) con 18F-fluordeoxiglucosa (FDG) constituye una técnica habitual en el estudio del paciente afectado de CPNM, y es especialmente útil en la estadificación/ reestadificación, el control evolutivo, la planificación de la radioterapia y la respuesta al tratamiento26-28.
Debido a la escasa bibliografía que hay, a su importante interés fisiopatológico y a su vinculación con la angiogénesis, se ha querido analizar, en pacientes con CPNM, la expresión de COX-2 y su posible relación con el valor de captación estándar (SUV, standardized uptake value) máximo en la FDG-PET, el EGFR, la p16 y la proliferación celular (MIB1), con la finalidad de obtener conclusiones que pudiesen ser de utilidad clínica.
Material y método
El grupo de estudio incluyó a 45 pacientes (41 varones y 4 mujeres), de edades comprendidas entre 41 y 82 años (63,4 ± 11,5; mediana: 66) y afectados de CPNM (12 adenocarcinomas y 33 carcinomas escamosos). En función del estadio clínico, los pacientes se clasificaron del siguiente modo: estadio IA, 1; IB, 8; IIA, 1; IIB, 8; IIIA, 9; IIIB, 9; IV, 9. Se ha utilizado el Tissue Arrayer Device (Beecher Instruments. Sun Prairie. WI) para construir los tissue microarraysbloques, siguiendo protocolos convencionales29. Todos los casos se revisaron histológicamente y las áreas más representativas fueron marcadas en los bloques de parafina. Se escogieron 2 cilindros seleccionados de 1 mm de diámetro de 2 áreas diferentes de cada tumor. Se incluyeron controles internos y externos en cada tissue microarrays. Cada bloque se cortó en secciones de 4 μm. El estudio inmunohistoquímico se realizó sobre secciones de parafina de 4 μ de espesor, utilizando el kit de un anticuerpo secundario universal que incluye un polímero de dextrano ligado a peroxidada (DAKO EnVision Peroxidase/DAB; DAKO. Glostrup. Denmark) para evitar la interpretación errónea de la biotina endógena como positiva. La COX-2 se analizó mediante un anticuerpo monoclonal (COX-2; M, SP21, MD335QD de Master Diagnóstica; Granada, España) prediluido. Se consideró positiva la tinción citoplasmática. Se clasificaron como positivos +) los tumores con un porcentaje de células teñidas comprendido entre el 10 y el 30%; positivos ++ los que presentaban un porcentaje comprendido entre el 30 y el 60%, y positivos +++ aquellos con un porcentaje > 60% (fig. 1). Hemos analizado, además, la expresión inmunohistoquímica de p16, EGFR y el antígeno de proliferación celular MIB1, utilizando anticuerpos monoclonales (tabla 1).
Figura 1. Expresión inmunohistoquímica de ciclooxinesa 2 (COX-2) en un carcinoma escamoso de pulmón (x20).
Tras una anamnesis, la determinación de la glucemia (máximo valor aceptado, 160-180 mg/dl) y la administración de un miorrelajante en una sala con una temperatura de 22-24 oC, se inyectó en la extremidad superior contralateral a la lesión, 350-518 MBq de 18FFDG; los pacientes estaban en ayuno de 6 h, como mínimo. La imagen se obtuvo 60 min después en un PET Advanced System (General Electric Medical Systems) con una adquisición en 2D.
Se realizó estudio semicuantitativo mediante la determinación de los índices SUV máximo de cada lesión observada, considerando el SUV como la captación de la región de interés con relación a la dosis inyectada y el peso corporal en gramos. No se han realizado estudios secuenciales y sólo se valoró el SUV máximo obtenido en la exploración PET. La presentación del estudio se realizó empleando imágenes tomográficas axiales, coronales sagitales y mediante la proyección volumétrica. El análisis estadístico se realizó con el programa SPSS for Windows. Las variables continuas se expresan con la media ± error estándar. Para verificar la existencia de diferencias estadísticamente significativas se ha utilizado la prueba de χ2 (con la corrección de Yates) en el caso de variables cualitativas y la t de Student para las continuas, así como el análisis de la varianza cuando se ajustaron por el estadio clínico. La valoración entre variables se efectuó mediante el coeficiente de correlación de Spearman. Para la comparación de la supervivencia entre los grupos se han utilizado las curvas de Kaplan-Meier y la prueba de rangos logarítmicos. Se considero que una diferencia era significativa cuando p < 0,05.
Resultados
La expresión inmunohistoquímica de COX-2 se apreció en 35 de los 45 casos (77,8%), y fue importante (> ++) en 12 de ellos (26,6 %). Dado el número de casos estudiados y el valor clínico de la enzima, se han comparado los casos COX-2 > ++ con el resto de tumores.
Los valores de SUV fueron menores en los 12 casos COX-2 > ++ que en los 33 restantes (13,4 ± 1,2; mediana: 12,9 frente a 17,1 ± 1,5; mediana: 15,5; p = 0,059). La expresión de COX-2 > ++ no se correlacionó con el estadio tumoral (I-II: 4/18 frente a III-IV: 8/27), ni tampoco lo hizo el SUV (I-II: 17,2 ± 2,4 frente a III-IV: 15,3 ± 1,2). Independientemente del estadio clínico, los valores de SUV tuvieron tendencia a ser menores en los casos COX-2 > ++ que en el resto de casos (estadios I-II: COX-/+: 18,3 ± 3,0; COX > ++: 13,2 ± 1,5; estadios III-IV: COX-/+: 16,2 ± 1,5; COX > ++; 13,4 ± 1,7; p = 0,097).
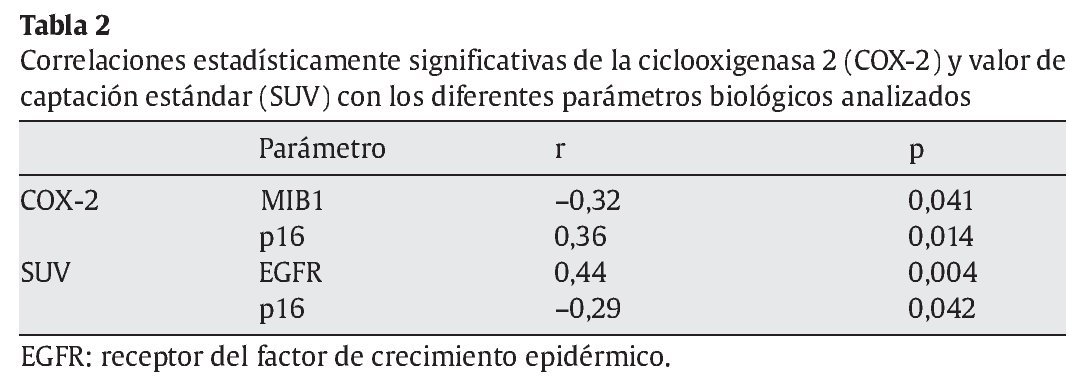
La expresión de COX-2 se correlacionó estadísticamente y de forma positiva con la de p16 y negativamente con la de MIB1. Por el contrario, los valores de SUV se correlacionaron estadística y positivamente con la del EGFR y negativamente con la de la p16 (tabla 2).
El tiempo de seguimiento de los pacientes osciló entre 1 y 78 meses, con una mediana de 21. Tras el análisis multivariado, sólo el estadio clínico fue factor pronóstico
Discusión
Dentro de la fisiopatología de los CPNM, la COX-2 posee un gran interés, pues no sólo está involucrada en la génesis, sino que también es diana de nuevas terapéuticas con finalidad preventiva y curativa. Así, se sabe que estimula la proliferación celular, la resistencia a la apoptosis, la inhibición de la respuesta inmune y la angiogénesis a través de diferentes mecanismos que incluyen la producción del VEGF. La íntima relación entre angiogénesis y la COX-2 se ha demostrado ampliamente en muchos tumores30. Asimismo, su expresión se asocia con la de otros factores que, de un modo directo o indirecto, contribuyen a explicar el comportamiento ulterior13.
La PET con 18F-FDG se ha convertido en una exploración rutinaria en los pacientes afectados de esos tumores, y es de gran valor en la estadificación y, sobre todo, en la evaluación de la actividad terapéutica. Uno de los parámetros utilizados para evaluar la exploración PET en la clínica diaria es el SUV que intenta reflejar la concentración tisular del radiofármaco, teniendo presente sus características y las del paciente, así como errores en la inyección del radiofármaco31. Independientemente de su repercusión clínica, se ha intentado analizar qué factores biológicos pueden influir en los valores SUV. Así, se sabe que pueden relacionarse con la p53, la proliferación celular y ciertos transportadores de la glucosa. Incluso su captación en la médula ósea se relaciona con las concentraciones séricas de TGF-β, pero no de VEGF o G-CSF32. No obstante, quedan muchos aspectos desconocidos. Asimismo, su papel como factor pronóstico en este tipo de tumores está sujeto a cierta controversia33. Esto hizo que se quisiera comparar la expresión de COX-2 con los valores de SUV y otros factores biológicos de interés en la génesis y evolución de estos tumores, como el EGFR, la proliferación celular mediada con el anticuerpo MIB1 y la p16, componente del ciclo celular y considerado, junto a la p53, uno de los genes supresores de tumor más importantes en oncología.
Usando técnicas inmunohistoquímicas, se pudo ver que la expresión de COX-2 se constataba en el 78% de los pacientes, y era muy intensa (> ++) en el 27% de ellos. El subtipo adenocarcinoma cursó con mayor positividad para la isoenzima (15/15 frente a 20/30; p = 0,016) y ello coincide con lo descrito en la bibliografía12. Para los estudios estadísticos y de correlación con los otros parámetros clinicobiológicos, se consideraron como positivos los tumores COX-2 > ++, y el resto de casos se agruparon como negativos. La isoenzima no se correlacionó con el estadio clínico y ni se comportó como factor pronóstico, lo cual no está en contradicción con su papel fisiopatológico.
El valor máximo de SUV fue menor en los casos COX-2 > ++ que en los negativos, y ello fue independiente del estadio clínico. Es decir, hay una correlación inversa entre la expresión intensa (> ++) de COX -2 y el consumo celular de glucosa reflejado por el SUV. Lo más interesante de nuestro trabajo fue constatar que la expresión de COX-2 se correlacionó significativa y positivamente con la de p16 y negativamente con la de MIB1, indicador de proliferación. Por el contrario, los valores de SUV se correlacionaron positivamente con el EGFR y negativamente con la p16. En relación con la MIB-1, muchos autores han descrito su relación con los valores de SUV en ciertos tumores34,35, lo que sugiere que la captación del radiofármaco está ligada a la proliferación celular. Apoyaría este hecho, además, que la expresión de EGFR se correlaciona estadística y significativamente con la proliferación33-37. Asimismo, recientemente Van Dyke et al13 han observado, en pacientes con adenocarcinomas, que la expresión de EGFR tuvo un comportamiento opuesto al de la COX-2 en relación con la evolución del tumor.
El hecho de que los valores de SUV se correlacionen inversamente con la p16, cuyo gen está inactivado en muchos tumores, incluidos los pulmonares38-40, contribuye a explicar que la proliferación celular juegue un papel importante en la captación del radiofármaco y que puedan asociarse con un peor pronóstico, pues la negatividad de la p16 sí es factor pronóstico independiente25,41,42. Por el contrario, la p16 se correlaciona directamente con la expresión de COX-2, como se ha visto en otros tumores, y ello podría contribuir a explicar que esta última y la SUV tengan un comportamiento opuesto.
Nuestros resultados, preliminares por el reducido número de pacientes incluídos, sugieren: a) la expresión intensa (> ++) de COX-2 se constató en el 26,6% de los CPNM y fue independiente del estadio clínico; b) los valores de SUV tampoco se relacionaron con el estadio y fueron menores en los tumores COX-2 > ++ que en el resto de casos, y c) este comportamiento diferente de ambos parámetros podría explicarse por sus distintas relaciones con la proliferación celular (MIB1) y la expresión de p16.
*Autor para correspondencia.
Correo electrónico:alvaro.ruibal.morell@sergas.es (A. Rubial).
Historia del artículo:
Recibido el 12 de marzo de 2008
Aceptado el 10 de septiembre de 2008