El alendronato (ALD) es el fármaco antirreabsortivo más utilizado para el tratamiento de la osteoporosis posmenopáusica. Desde su comercialización se han tratado más de 17 millones de pacientes y se han incluido en diferentes ensayos clínicos unos 17.000, con períodos de seguimiento que oscilan entre 1 y 7 años. Recientemente, se han aprobado por la FDA las dosis de 5 mg diarios para prevención de la osteoporosis y de 70 mg semanales para su tratamiento, tanto en presencia de criterios densitométricos como de fracturas vertebrales atraumáticas.
Existe amplia experiencia clínica en el uso del fármaco, sobre todo entre los reumatólogos. Por esta razón, en la presente revisión únicamente se abordarán los aspectos más novedosos del tratamiento con alendronato en la osteoporosis posmenopáusica y que abarcan desde el mecanismo de acción hasta la presentación semanal, pasando por los datos de consistencia del efecto antifractura, estudios de extensión a largo plazo y la seguridad gastroesofágica. El lector deberá acudir a las excelentes revisiones1 y artículos publicados recientemente para repasar los datos de ensayos clínicos publicados en el pasado y la utilización de alendronato en otros procesos como la osteoporosis por glucocorticoides2, la osteoporosis del varón3 o la de niños con enfermedades inflamatorias autoinmunes4.
Mecanismo de acción
Estructura
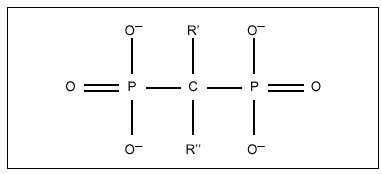
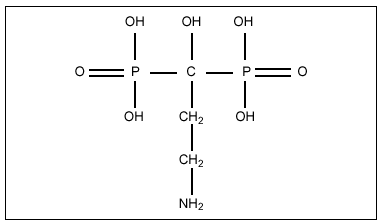
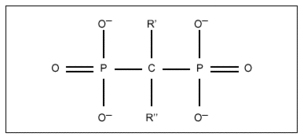
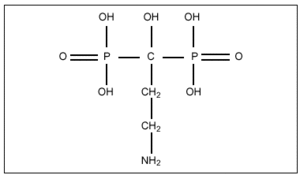
Todos los difosfonatos (DF) que se utilizan en clínica son análogos de los pirofosfatos, en los que el oxígeno unido a dos grupos fosfato ha sido sustituido por un carbono (fig. 1), lo que les confiere resistencia a la hidrólisis enzimática que sufren los pirofosfatos si se administran por vía oral5. La relación estructura-actividad de estos compuestos no se conoce con exactitud debido a que los lugares diana de la acción no han sido identificados completamente. No obstante, la potencia relativa de los diferentes compuestos cambia en función de una serie de modificaciones en la molécula, lo que sugiere que se fijan a un sitio activo con unas determinadas características estructurales6. Por ejemplo, cuando el radical R' es un grupo hidroxilo, y R'' es una cadena alifática con un grupo aminoterminal, el compuesto de cuatro carbonos (alendronato) (fig. 2) es más potente que el de tres carbonos (pamidronato) o que el de seis carbonos (neridronato). De manera similar, la acción antirreabsortiva de olpadronato es abolida por sustitución del grupo amino en R''. Evidencias adicionales de la influencia fundamental del radical R'' en la potencia antirreabsortiva han sido obtenidas por experimentos realizados en la ameba Dictyostelium discoideum7.
Figura 1. Estructura química de los difosfonatos.
Figura 2. Alendronato.
En los últimos años, se han producido notables avances en el conocimiento de las acciones celulares de estos fármacos que han contribuido a aclarar algunos aspectos oscuros de la relación estructura-actividad, que describimos brevemente a continuación.
Mecanismo de acción en el ámbito tisular
Existen numerosos estudios clínicos y experimentales que han confirmado que los DF aminados inhiben la reabsorción sin suprimir directamente la formación ósea. El alendronato tiene una elevada afinidad por la hidroxiapatita y a las 4 h de su administración ya se observan depósitos en las superficies quiescentes que permanecerían durante largo períodos de tiempo8. Cuando se activa una unidad básica de remodelado, las células que van en la primera línea de batalla, los osteoclastos, al realizar su función de reabsorción, internalizan el alendronato situado en la superficie del tejido óseo, observándose depósitos en el interior de estas células a las 12 h de la administración del fármaco y, a continuación, una disminución del remodelado, que ha sido confirmada en estudios histomorfométricos9-11.
La administración de alendronato provoca una reducción en torno al 50% de una serie de parámetros del remodelado, tanto en modelos animales como en humanos. Sin embargo, no se observa reducción en la tasa de aposición mineral, incrementándose incluso el grosor de las láminas neoformadas10, lo que indica que la formación ósea no se reduce de manera proporcional a la que experimenta la reabsorción. De esta forma, las cavidades osteoclásticas disminuyen en número y tamaño, prolongándose, por otro lado la acción formadora osteoblástica, lo que provoca finalmente un balance óseo positivo que se manifiesta por un aumento progresivo de la densidad mineral ósea (DMO).
En tratamientos prolongados12, las acciones positivas sobre DMO son continuas hasta 7 años (máximo período de seguimiento publicado). Este hecho no ha sido aclarado de manera definitiva. Se han postulado varias posibles causas, que podrían intervenir incluso de forma complementaria. Por un lado, el alendronato provoca un aumento de la secreción de parathormona (PTH), cuya acción anabólica sobre el hueso está plenamente establecida. Además se han observado acciones directas del alendronato sobre los osteoblastos y un incremento en la longitud del período de mineralización. Estos efectos podrían actuar sinérgicamente, lo que explicaría, por un lado, el mantenimiento de las acciones positivas sobre la DMO, a largo plazo y, por otro, el incremento en la resistencia ósea a las fracturas, que ha demostrado ser superior al efecto esperable en función de la ganancia de DMO producida.
Ámbito celular
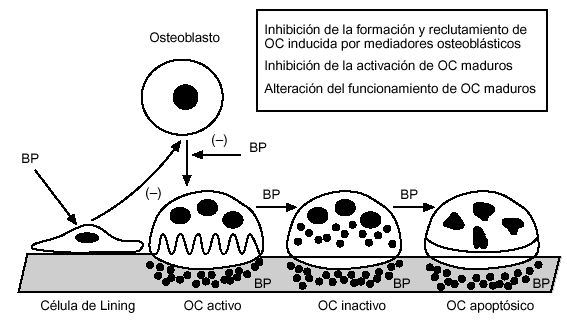
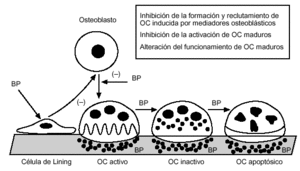
En el momento actual, existen evidencias suficientes para considerar al osteoclasto y sus progenitores de la línea hematopoyética como la diana fundamental de la acción de los difosfonatos. La administración de alendronato provoca una disminución de la formación y reclutamiento de osteoclastos en modelos in vitro13. Su papel in vivo es sugerido por el análisis de la cinética de inhibición de la reabsorción y la reducción en el número de osteoclastos tras el tratamiento a largo plazo. También se ha observado una reducción de la activación osteoclástica por mecanismos mal conocidos, aunque se ha postulado que podría resultar de un mecanismo indirecto mediado a través de osteoblastos (fig. 3).
Figura 3. Mecanismo de acción de los difosfonatos (nivel celular).
Los osteoclastos maduros expuestos al alendronato presente en las superficies quiescentes sufren una serie de modificaciones (pérdida del ribete en cepillo, alteración del citosqueleto y tráfico de vesículas, fundamentalmente) que provocan una pérdida de la capacidad de reabsorción y una reducción de la vida media de estas células que, finalmente, van a experimentar apoptosis. Estos efectos se han demostrado inicialmente in vitro pero se han confirmado in vivo, tanto en modelos animales como en humanos y han llegado a constituir la explicación más aceptada del mecanismo de acción de los difosfonatos en la osteoporosis posmenopáusica.
Ámbito molecular
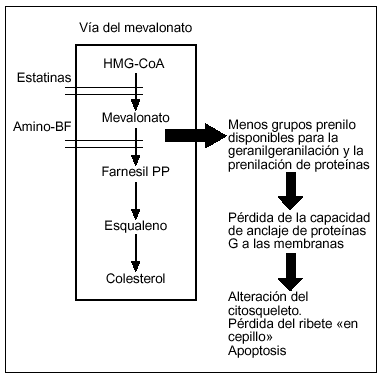
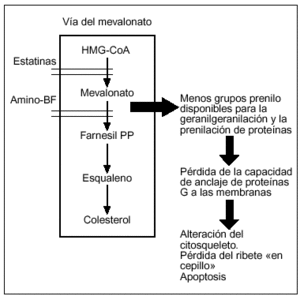
Los difosfonatos aminados inhiben la formación de metabolitos de la principal vía de síntesis de colesterol, la llamada vía del mevalonato14. Utilizando esta cascada metabólica, la HMG coenzima A es transformada en colesterol, a través de una serie de enzimas y productos intermedios que contienen grupos prenilo que son utilizados para la modificación postranslacional de pequeñas transpeptidasas (fig. 4). Mediante esta vía, se producen una serie de compuestos lipídicos que contribuyen a la prenilación de estas proteínas (unión de un grupo prenilo al extremo carboxiterminal).
Figura 4. Mecanismo de acción de los difosfonatos (nivel molecular).
En 1999, se demostró que los difosfonatos aminados inhiben una enzima de esta vía, la farnesil pirofosfato sintasa15, hallazgo que fue confirmado posteriormente utilizando modelos in vitro16,17 y, recientemente, in vivo14. La inhibición de esta enzima conlleva una reducción en la síntesis de compuestos lipídicos prenilados, alterándose el anclaje a las membranas de las proteínas G. De esta forma, el osteoclasto no puede mantener su citosqueleto y finalmente sufre apoptosis18.
Los difosfonatos con estructura más próxima al pirofosfato (clodronato y etidronato) actúan por mecanismos diferentes19,20. Al ser internalizados por el osteoclasto se incorporan al metabolismo celular en forma de análogos citotóxicos del adenosín trifosfato (ATP), que tendrían capacidad para activar determinadas caspasas (probablemente también a través de la cinasa Mst 1) con capacidad inductora de apoptosis. Estas diferencias en el mecanismo de acción, a escala molecular, sumadas a las diferencias en la estructura bioquímica han permitido clasificar a los difosfonatos en dos subtipos o generaciones (tabla 1).
Eficacia
Un buen fármaco para la osteoporosis, en ausencia de una terapia curativa, debe cumplir los siguientes requisitos: a) aumentar la DMO en esqueleto axial, cadera y huesos periféricos; b) presentar efectos consistentes sobre reducción de fracturas vertebrales, tanto morfométricas como clínicas, únicas o múltiples, sobre fracturas no vertebrales y específicamente de cadera; c) los resultados deben coincidir en los diferentes ensayos clínicos realizados y mantenerse tras el análisis de subgrupos y en diferentes poblaciones, y d) eficacia y seguridad ósea y extraósea a largo plazo establecidas en los ensayos clínicos y en el análisis de los datos de farmacovigilancia.
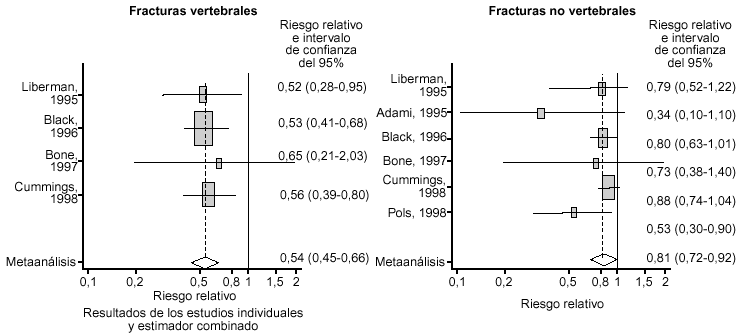
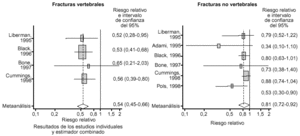
En el momento actual, disponemos de datos suficientes para concluir que el alendronato es eficaz en la prevención de fracturas vertebrales y no vertebrales en la osteoporosis posmenopáusica, diagnosticada por criterios densitométricos o en presencia de fracturas por fragilidad. Para conocer el tamaño y la consistencia del efecto, realizamos un metaanálisis21 de estudios publicados, en el que se incluyeron 7 ensayos clínicos, cuyos resultados globales se expresan en la figura 5. La consistencia de los efectos es patente en el análisis de los estudios individuales. Además, la reducción en la incidencia de fracturas es un fenómeno que comienza a ser estadísticamente significativo a los 3 meses del inicio del tratamiento (fracturas vertebrales) y alcanza valores del 63% de reducción a los 18 meses (fracturas de cadera). Un hallazgo a destacar es la drástica reducción en la incidencia de fracturas vertebrales múltiples, una temible forma evolutiva de la osteoporosis no tratada que provoca un gran impacto funcional. Los porcentajes de reducción son similares en los diferentes ensayos publicados22-29 y los hallazgos han sido confirmados en otros metaanálisis30,31.
Figura 5. Consistencia del efecto de alendronato en la incidencia de fracturas vertebrales y no vertebrales (tomada de Arboleya LR et al. Med Clin [Barc]2000).
Recientemente se han publicado los primeros datos de los estudios de extensión a 7 años32. La reducción de los marcadores óseos se mantiene constante a lo largo del tratamiento y los incrementos en la DMO son progresivos, sin que se observe efecto meseta en ninguna fase del período de estudio. No disponemos de datos, por el momento, sobre incidencia de fracturas a largo plazo.
Seguridad
En los ensayos clínicos realizados en unas condiciones relativamente diferentes a las que se producen en la práctica clínica no se observaron diferencias respecto a placebo en la incidencia de efectos adversos. Sin embargo, tras la comercialización del producto se comunicaron varios casos de toxicidad esofágica, que fueron atribuidos a una toma inadecuada del alendronato. Tras asumir las recomendaciones estrictamente, la incidencia de efectos esofágicos disminuyó drásticamente. En 1996 (con una exposición al alendronato próxima a los 500.000 pacientes) la incidencia de efectos adversos esofágicos comunicados, según un artículo publicado en New England Journal of Medicine33, no superaba el 0,05% (0,011% de efectos adversos graves). En el momento actual, estas cifras no han variado, con lo que podemos decir que el alendronato es un fármaco seguro desde el punto de vista de su toxicidad esofágica, aunque deberán seguirse estrictamente las recomendaciones de administración34 y evitar su utilización en pacientes con patología esofágica previa relevante (acalasia, estenosis, esófago de Barret, reflujo gastroesofágico severo, disfunción esofágica en la esclerodermia, etc.).
En los últimos años se ha analizado la posible toxicidad gástrica de alendronato. La evidencia disponible es escasa y procede de casos aislados o de series endoscópicas, y no se ha observado un incremento en la incidencia de complicaciones clínicamente relevantes derivadas de la utilización de alendronato35-37. En modelos animales, se ha observado que los difosfonatos aminados reducen la concentración de fosfatidilcolina con lo que disminuye la capacidad hidrofóbica de la barrera mucosa gástrica38. Estos hallazgos sugieren que los difosfonaos tienen cierta capacidad para retrasar la curación de lesiones previas, por un mecanismo independiente de prostaglandinas (aún no disponemos de datos suficientes para descartar una posible sinergia en la acción gástrica cuando se utilizan simultáneamente AINE y difosfonatos) y de la potencia antirreabsortiva. En cualquier caso, la posible toxicidad gástrica de alendronato (único difosfonato aminado del que disponemos de datos tras varios años de seguimiento poscomercialización) parece poco relevante, si tenemos en cuenta que la incidencia de complicaciones (úlcera sintomática, perforación, hemorragia) comunicada, hasta el momento, es anecdótica.
Alendronato en una sola dosis semanal
Una serie de estudios realizados en modelos animales han demostrado que es posible administrar dosis superiores de alendronato, con una periodicidad superior a una vez al día39,40. Las características farmacocinéticas y su afinidad por la hidroxiapatita provocan que, el alendronato, permanezca, durante varias semanas después de la administración, en las superficies de resorción ósea41. La absorción se mantiene constante en un rango de dosis situado entre 5 y 80 mg, por lo que, a priori, es lícito pensar que un comprimido de 70 mg a la semana proporcione la misma cantidad de alendronato farmacológicamente activo que una dosis diaria de 10 mg. Por otro lado, la adherencia al tratamiento sería indudablemente mejor, lo que permitiría la prescripción prolongada con una mayor comodidad.
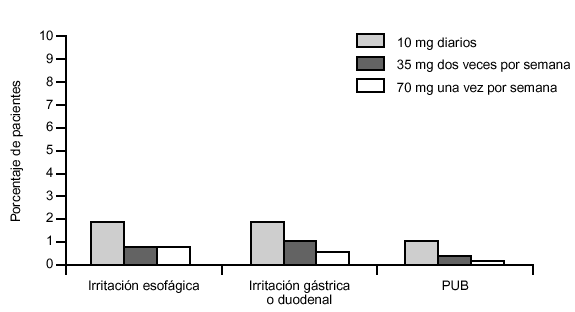
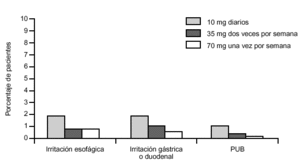
Con la intención de valorar la eficacia y seguridad de la presentación semanal se realizó un ensayo clínico multicéntrico42, de un año de duración, en el que se compararon los efectos sobre la DMO y marcadores de 70 mg de alendronato en una sola dosis semanal, 35 mg en dos dosis semanales y 10 mg diarios. Se incluyó a 1.258 mujeres de 14 países con osteoporosis posmenopáusica densitométrica o con antecedente documentado de fractura atraumática vertebral o de cadera, finalizando el estudio el 86% de la muestra inicial. Se obtuvieron cambios en la DMO similares en los tres grupos de tratamiento (en torno al 5% de ganancia). Asimismo, la reducción en los marcadores de reabsorción fue similar. Sin embargo, se observaron menos efectos adversos digestivos serios (úlcera gástrica, gastritis, estenosis esofágica, náuseas o dolor torácico) en el grupo de dosificación semanal (fig. 6).
Figura 6. Efectos adversos de alendronato en una sola dosis semanal de 70 mg (tomada de Schnitzer T et al. Aging 2000; 12: 1-12).
Aunque el trabajo no fue diseñado para detectar diferencias significativas en la incidencia de fractura, sí se recogieron como efectos adversos, sin objetivarse diferencias entre los tres grupos terapéuticos. Este estudio ha servido de aval para que la FDA autorizase la dosis única de 70 mg semanales, un claro avance médico que permitirá reducir el impacto de la osteoporosis, mejorando la comodidad y el cumplimiento del tratamiento, dos aspectos de indiscutible valor al abordar un plan terapéutico a largo plazo.