La osteoporosis es causa de frecuentes y graves complicaciones en los enfermos de artritis reumatoide (AR) y supone una causa importante de morbilidad y dolor que agravan el sufrimiento producido por la propia enfermedad.
La pérdida de masa ósea en la AR es un problema clínico real y no una cuestión estadística. Estos enfermos tienen un riesgo elevado de fracturas pelvianas y de la región proximal del fémur, con un riesgo relativo (RR) de 1,5 en los pacientes que no han recibido glucocorticoides, y entre 2,5 y 4 en los pacientes tratados con esteroides1. Al menos un tercio de los pacientes que toman más de 5 mg/día de prednisona sufrirán una fractura osteoporótica en 5 años. Con dosis acumuladas de prednisona mayores de 30 g la frecuencia de fracturas se eleva al 53%. La prevalencia de fracturas vertebrales en enfermos con AR se sitúa en torno al 10%2. En nuestros enfermos, el 10% de las mujeres posmenopáusicas y el 9% de los varones presentan una fractura vertebral3.
En un reciente estudio en población escandinava, aproximadamente el 17% de las mujeres con AR tenían osteoporosis en la región L2-L4 (< 2,5 T-score) y el 15% en el cuello de fémur. El 46% tenían osteopenia (< 1,0 T-score) en columna lumbar y el 55% en cuello de fémur4. Al analizar la aplicación de los criterios de clasificación de la OMS en nuestros pacientes con AR observamos que en un grupo de 177 mujeres, el 41% tenía valores densitométricos de osteoporosis en columna lumbar y/o cuello de fémur, el 42% valores de osteopenia, y sólo el 17% tenía una DMO normal. En 116 varones, el 30% tenía osteoporosis, el 54% osteopenia y sólo el 16% tenía unas cifras dentro de la normalidad, al aplicar los mismos criterios de clasificación que para las mujeres.
Se han identificado diversos factores de riesgo de fractura en pacientes con AR: la edad, el sexo femenino, la edad temprana de inicio de la enfermedad, la duración de la AR, la incapacidad funcional, el tratamiento esteroide y el bajo peso5-7. Algunas deformidades ortopédicas, como el valgo de rodilla y el pie planovalgo pueden, además, predisponer a la aparición de fracturas de estrés. Se han desarrollado algoritmos clínicos a partir de los factores de riesgo bien definidos que pretenden identificar en la práctica los enfermos con más alto riesgo de osteoporosis4.
Es sabido que la larga evolución de la enfermedad y las formas más incapacitantes se asocian claramente al desarrollo de la osteoporosis generalizada, mientras que los pacientes con una aparición reciente de la enfermedad tienen fundamentalmente osteoporosis peri o yuxtaarticular. Sin embargo, no debemos olvidar que la mayor parte de la pérdida ósea tiene lugar en los primeros años de la enfermedad.
Los estudios histológicos de hueso periarticular evidencian un aumento del recambio óseo, con un incremento neto de la resorción ósea. Se han descrito diversos mecanismos que explican las alteraciones del balance de resorción y reparación ósea: la inmovilidad de la articulación inflamada, los factores locales liberados por la sinovial, como la PGE-2, la interleucina-1 (IL-1), la IL-6 o el factor de necrosis tumoral alfa (TNF-*), así como el aumento de la vascularización en torno a la articulación. Cada vez es más evidente que el buen control de la actividad de la enfermedad, a través de la regulación de estos mediadores de la inflamación, es fundamental para evitar tanto la pérdida ósea local como la generalizada8,9.
La patogenia de la osteoporosis generalizada en la AR es multifactorial: algunos de ellos son factores propios del individuo, otros relacionados con la propia enfermedad o bien con sus tratamientos. El efecto de la edad en la densidad mineral ósea (DMO) es más o menos el mismo en pacientes con AR que en la población general. La osteoporosis y las fracturas son más frecuentes en las mujeres posmenopáusicas que en las premenopáusicas. Diversos grupos de trabajo han observado la presencia de bajas concentraciones de andrógenos en mujeres con AR10-12, circunstancia que también hemos apreciado en varones, con una correlación directa entre las concentraciones de los diversos andrógenos gonadales y/o adrenales y la DMO3. También se ha observado la existencia de concentraciones elevadas de prolactina en los varones con AR, que evidencian una correlación negativa con la DMO femoral13. Los factores predictivos más importantes de la DMO en los varones con AR son el peso, la edad, las concentraciones plasmáticas de testosterona y la dosis acumulada de glucocorticoides.
El polimorfismo del gen del receptor de la vitamina D se ha señalado en los últimos años como un factor determinante del turnover óseo y de la masa ósea. Gough et al14 demostraron que las mujeres con AR con el genotipo tt perdían hueso más rápidamente que las pacientes con el genotipo favorable. También se está estudiando el gen que codifica el colágeno tipo I (COLI A1), que se ha relacionado no sólo con la reducción de la DMO, sino también con un mayor riesgo de fracturas vertebrales.
La incapacidad funcional y física son factores determinantes importantes en el desarrollo de osteoporosis en los enfermos con AR. Los pacientes en estadios funcionales III/IV tienen una DMO significativamente inferior a los pacientes en los grupos I/II. Otras formas de valorar la capacidad funcional que también se han correlacionado con la masa ósea son el índice de actividad de Framingham, la fuerza de presión manual o grip, el tiempo de deambulación, la actividad muscular y el HAQ.
La duración de la enfermedad, la actividad de la AR y el grado de capacidad funcional contribuyen de forma independiente en la pérdida ósea5. Pacientes con enfermedad de inicio reciente, entre 6 meses y 2 años, pierden entre el 2,5 y el 5% de su masa ósea. Si, además, en esos primeros 6 meses se administran dosis bajas de esteroides, la pérdida puede alcanzar al 8,2%15.
Diversos estudios longitudinales han demostrado que los pacientes con una enfermedad más activa pierden más masa ósea que aquellos con una enfermedad inactiva5,16. La pérdida de masa ósea se ha correlacionado con la actividad de la enfermedad cuantificada por la velocidad de sedimentación globular (VSG), la proteína C reactiva (PCR), el título del factor reumatoide (FR) y el índice de Ritchie.
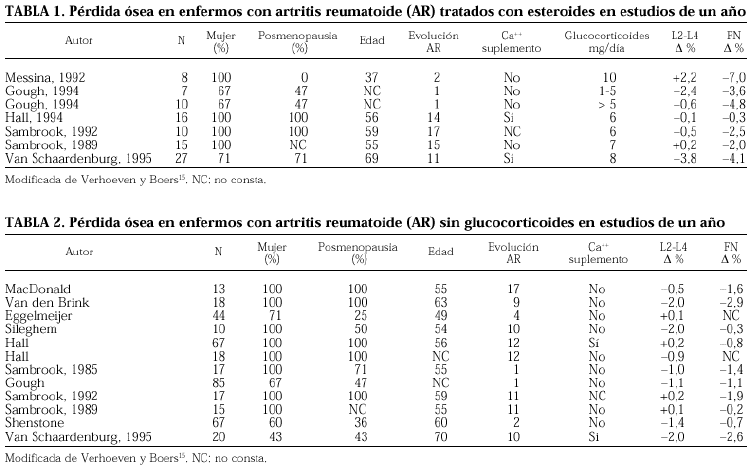
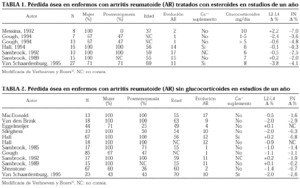
Se han llevado a cabo muchísimas investigaciones y publicaciones para definir el papel de los glucocorticoides en la osteoporosis de la AR. La mayor parte de ellos son transversales17,18 y retrospectivos, pocos son longitudinales7,19,20. Los estudios clínicos aleatorizados han demostrado que los tratamientos con dosis bajas de glucocorticoides y a corto plazo en pacientes con AR conducen a una pérdida ósea que es limitada en el fémur y poco relevante en la columna lumbar (tablas 1 y 2). Pero más de la mitad de los pacientes con dosis acumuladas superiores a los 30 g de prednisona tendrán una fractura, y tres cuartas partes tendrán osteoporosis. Esta dosis sería alcanzada por los enfermos que reciben 5 mg/día durante 16 años, situación que no es infrecuente en nuestros pacientes. El efecto nocivo tiene mayor relevancia clínica en las mujeres posmenopáusicas. Los varones tratados con glucocorticoides tienen también una DMO inferior a los enfermos tratados sin esteroides3,21 y se ha observado que la dosis acumulada de glucocorticoides está inversamente relacionada con la DMO lumbar y femoral3.
El efecto del metotrexato (MTX) sobre el hueso es también un punto controvertido. Los estudios in vitro han demostrado una disminución de la actividad osteoblástica con bajas concentraciones de MTX, siendo esta reducción dependiente de la dosis22. Se ha sugerido que el tratamiento a largo plazo con MTX puede agravar el desarrollo de osteopenia y de fracturas de estrés23. Parece que la asociación de terapia prolongada con MTX y glucocorticoides es particularmente nociva para la masa ósea24. En contra de esto, algunos estudios densitométricos han demostrado que el tratamiento con MTX no se asocia a una pérdida ósea acelerada en las mujeres posmenopáusicas con AR25, y algunos autores han observado una reducción significativa en los valores de deoxipiridinolina, lo que sugiere que el MTX podría ejercer un papel de prevención de pérdida ósea mediante el control de la actividad de la enfermedad26,27.
Los numerosos estudios densitométricos realizados demuestran que la DMO lumbar en pacientes con AR es inferior a la de la población control, y la diferencia es aún mayor en la DMO femoral. Los estudios longitudinales demuestran que la principal pérdida ósea ocurre en el primer año de enfermedad20. La densitometría ósea de la mano es una técnica nueva prometedora, que evalúa el hueso apendicular y permite constatar la pérdida ósea en fases muy incipientes y se correlaciona con la actividad de la enfermedad28,29.
Los marcadores óseos de formación como la osteocalcina y los precursores del procolágeno se hallan generalmente reducidos y de forma más acentuada en los pacientes tratados con glucocorticoides30-32. Los marcadores de resorción se hallan generalmente elevados, como la piridinolina, la deoxipiridinolina y el telopéptido carboxiterminal del colágeno tipo I, y son mayores en los pacientes con AR que en la población control. Incluso en pacientes con AR inactiva se aprecia un aumento moderado de los marcadores de resorción, lo que podría indicar que el proceso inflamatorio no está completamente ausente33.
No es posible realizar una densitometría en todos los pacientes con AR, pues los densitómetros se encuentran saturados, al menos en la red pública, y no sólo en nuestro país. De una forma arbitraria, Lems y Dijkmans34 sugirieron realizar la DMO cuando se dan dos o más de los siguientes criterios: a) enfermedad activa (PCR > 20 o VSG > 20 mantenidas); b) edad avanzada (mujeres > 50 años, varones > 60 años), y c) inmovilidad: Steinbroker > 3, HAQ > 1,25.
No se hizo entonces ninguna consideración respecto al empleo de glucocorticoides, pues se asumían las recomendaciones generales de la ACR para los pacientes tratados con glucocorticoides35. Más recientemente Solomon y Kuntz36 han publicado un análisis de coste-eficacia del cribado de osteoporosis en mujeres posmenopáusicas con AR que inician terapia esteroide mediante un modelo de decisión de Markov. En él se daban tres situaciones: a) una actitud expectante; b) tratar a todas las enfermas, o c) hacer cribado y tratar si la DMO es inferior a 1,0 T-score. La actitud expectante y de tratar con etidronato sólo en caso de fractura es la opción que comporta menor coste, mientras que el tratar a todas las pacientes con alendronato sería la más cara. La mejor relación coste-eficacia se produciría al tratar con alendronato sólo si la DMO es inferior a 4,0 T-score, lo que engloba sólo al 16% de las pacientes. Si se trata sólo a las mujeres con DMO inferior a 2,5 T-score (54% de la población de estudio), la relación coste eficacia es buena. La incidencia de fracturas se reduciría en un 50% tras 10 años de tratamiento con alendronato, con mejor relación coste-eficacia que el hecho de tratar según criterios densitométricos, que resulta más caro en todos los casos. Según estos autores, la recomendación de la ACR para enfermos en tratamiento con glucocorticoides de tratar si la DMO es inferior a 1,0 T-score con terapia hormonal sustitutiva (THS) o difosfonatos es demasiado cara en términos de coste-eficacia, si lo comparamos con otras medidas válidas menos intervencionistas. La actuación terapéutica tiene mejor relación coste-eficacia siendo más restrictiva su indicación (DMO < 2,5 T-score).
Desde un punto de vista práctico, podemos plantearnos en qué situaciones se debe realizar una densitometría en un paciente con AR. Se pueden apoyar y rebatir posturas totalmente opuestas, y de hecho es un tema actual de reflexión y debate en foros reumatológicos4,34,36. Podemos considerar tres posturas respecto al cribado y la profilaxis de la osteoporosis en la AR:
1. Realizar DMO a todos los pacientes con AR. La alta incidencia de fracturas en estos enfermos puede justificar un abordaje masivo. Además, al disponer de la cuantificación de la DMO se puede ajustar mejor la profilaxis o tratamiento farmacológico. Los detractores señalarán el alto coste económico y la saturación de las unidades de densitometría ósea, y el sobretratamiento de muchos pacientes que nunca hubieran tenido fracturas.
2. No realizar DMO en los pacientes con AR. Dada la alta incidencia de osteoporosis y fracturas en los enfermos con AR, se puede defender que es mejor y más barato realizar tratamiento o medidas de profilaxis en todos los pacientes sin DMO previa. Pero con esta postura muchos enfermos pueden resultar perjudicados por no detectarse a tiempo una pérdida ósea marcada y facilitar otros tratamientos además de la profilaxis.
3. Realizar DMO en unas indicaciones concretas. En la opinión más generalizada, la identificación de factores que aumentan el riesgo de fractura tiene la utilidad práctica básica de perfilar a qué pacientes se les debe realizar una DMO4. Lo cierto es que la larga evolución de la AR es un claro factor de riesgo de fracturas pero, en cambio, tendrá poco sentido indicar la DMO por norma en edades avanzadas. Parece más lógico realizarla en edades más tempranas y menor evolución de la enfermedad, con una finalidad realmente preventiva. Por debajo de los 50 años el porcentaje de mujeres con AR que tienen osteoporosis es del 3% en columna lumbar, del 3,1% en el cuello de fémur y del 1,6% en el total de cadera37.
Partiendo de los factores de riesgo mejor establecidos, creemos que la densitometría puede estar indicada en estas situaciones: a) pacientes tratados con glucocorticoides; b) AR con gran actividad; c) AR de inicio temprano, y d) mujer posmenopáusica con AR. Estos criterios son poco restrictivos, pues seguramente se incluyen en ellos la mayoría de los enfermos con AR que atendemos. En cambio en algunas situaciones concretas se puede desestimar u obviar la práctica de la densitometría: a) AR de comienzo reciente; b) AR con fracturas múltiples, y c) AR con capacidad funcional grado IV.
La prevención de la osteoporosis en la AR incluye el control adecuado de la actividad de la enfermedad (antiinflamatorios no esteroides [AINE] y fármacos de acción lenta), así como el empleo de tratamientos específicos para el metabolismo óseo, como el calcio, la vitamina D, la THS y los difosfonatos. Son también aplicables las medidas profilácticas generales: abstención del alcohol, tabaco, evitar el sedentarismo y potenciar los suplementos lácteos. La estrategia preventiva ideal debería ser eficaz, barata, sencilla y segura. De todos los tratamientos evaluados en la AR, sólo unos pocos han demostrado un aumento significativo de la DMO lumbar, pero no de la femoral. El etidronato38 y el alendronato39 reducen la aparición de nuevas fracturas vertebrales en mujeres posmenopáusicas en tratamiento con esteroides. La THS aumenta la DMO lumbar entre el 1 y el 2,5% anual40. La administración de calcio y de vitamina D3 previene la pérdida ósea en pacientes con AR en tratamiento con dosis bajas de glucocorticoides, pero este efecto protector no se ha confirmado con las dosis altas41. Un paso más en el tratamiento de la osteoporosis en enfermos con AR consiste en administrar agentes antirresortivos, como la calcitonina, los estrógenos o los difosfonatos. El tratamiento estrogénico debe recomendarse en toda mujer posmenopáusica con AR y tratada con glucocorticoides. Diversos estudios en los últimos años señalan la eficacia del THS en la osteoporosis de la AR, con mejoría significativa de la DMO trabecular, aunque no así de la femoral. De forma similar en los varones se ha utilizado el tratamiento con testosterona, que además de mejorar la DMO, según algunos autores también sería eficaz en el control de la actividad de la enfermedad. Algunas investigaciones apoyan la administración de dehidroepiandrosterona en pacientes sometidas a tratamiento crónico con glucocorticoides, como un factor de prevención de osteoporosis en esta situación42.
Entre los difosfonatos, el más utilizado hasta ahora, por extensión de la práctica clínica general, ha sido el etidronato, en forma de ciclos. Pero son los difosfonatos nitrogenados, como pamidronato, alendronato o risedronato, los que han mostrado mayor potencia antirresortiva en estos enfermos, si bien son escasos los estudios prospectivos en la AR. Recientemente el pamidronato por vía oral demostró ser eficaz en un período de 3 años, con mejoría en la DMO lumbar y en el antebrazo, pero no en cuello femoral43. Aunque aún falta experiencia en más grupos, las biopsias no demuestran toxicidad ni riesgo de osteomalacia. En un estudio prospectivo con alendronato en enfermos con AR de inicio se apreció, además de la reducción de los marcadores de resorción, una mejoría en los parámetros de actividad de la enfermedad y disminución de los mediadores de la inflamación, como la IL-1*, IL-6, TNF-* y ß2-microglobulina, lo que apoya un cierto efecto antiartrítico de los difosfonatos9.
El risedronato a dosis de 2,5 mg/día en enfermas posmenopáusicas con AR tratadas con glucocorticoides ha demostrado un incremento en la DMO lumbar (+1,4% a las 97 semanas) y una pérdida no significativa en cuello de fémur (1,0%). La diferencia respecto al grupo con placebo fue muy significativa en la columna lumbar, pero no en cuello femoral44. También se ha ensayado en formas de tratamientos cíclicos (15 mg de risedronato, 15 días cada 12 semanas), pero los resultados no son tan buenos como en la pauta continuada. En otros estudios se ha observado una reducción de la incidencia de fracturas vertebrales con risedronato en pacientes tratados con glucocorticoides a un año, cosa que no se ha podido observar en el estudio exclusivo en pacientes con AR.
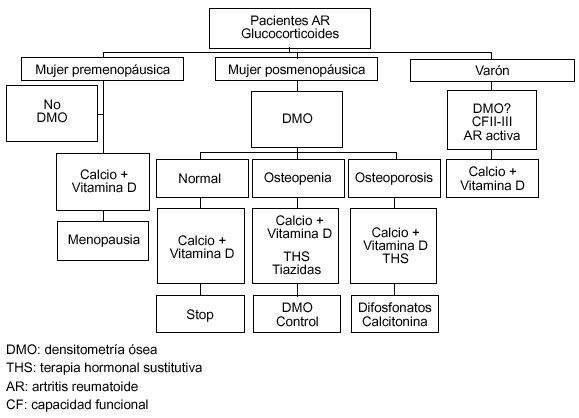
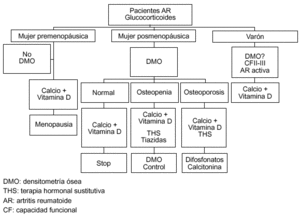
En cualquier caso, debe quedar claro que ningún tratamiento ha demostrado por el momento la reducción de fracturas en la AR, y en el mejor de los casos sólo se consigue mejorar la DMO trabecular, pero no la femoral. En la figura 1 se recogen las ideas que hemos señalado y, aunque es absolutamente discutible, creemos que en un futuro cercano aparecerán algoritmos e indicaciones similares a lo sucedido con la prevención y tratamiento de la osteoporosis por glucocorticoides aportados por la ACR.
Figura 1. Abordaje de la prevención y tratamiento de la osteoporosis en la artritis reumatoide (AR). DMO: densitometría ósea; THS: tratamiento hormonal sustitutivo.