Introducción
La osteoporosis es una de las enfermedades musculoesqueléticas más prevalentes, y las fracturas osteoporóticas suponen una carga sociosanitaria de gran dimensión, tanto en las sociedades desarrolladas como en los países en vías de desarrollo. La paulatina concienciación acerca de estas enfermedades ha derivado en un esfuerzo gigantesco por aumentar los conocimientos de biología ósea, mejorar los métodos diagnósticos y encontrar fármacos eficaces para su prevención y tratamiento. Como consecuencia, los clínicos disponemos en la actualidad de marcadores bioquímicos para evaluar el remodelado óseo, de medios fiables para medir la masa ósea y de fármacos con evidencia probada en la reducción del riesgo de fractura.
El tratamiento de la osteoporosis se basa, hoy en día, en los fármacos llamados antirresortivos. Los estrógenos, la calcitonina, los moduladores selectivos de los receptores de estrógenos (SERM) y los bisfosfonatos disminuyen la frecuencia de activación de las unidades de remodelado óseo, así como la intensidad y la duración de la acción de los osteoclastos. De este modo consiguen aumentar ligeramente la masa ósea, mejorar la microarquitectura y reducir significativamente el riesgo de fractura. Todos aumentan la masa ósea, pero difieren notablemente en su eficacia antifractura1, lo que ha relanzado el estudio de la calidad ósea frente al estudio excesivamente simplista de la cantidad ósea2.
El intento de producir más hueso nuevo, terapia anabolizante, partiendo de una situación de alto o bajo remodelado, ha tenido menos éxito, por no decir que ha cosechado importantes fracasos. Así, el fluoruro estimula directamente la acción osteoblástica, con lo que aumenta notablemente la masa ósea espinal, pero produce una disminución del hueso cortical, con el aumento consiguiente de las fracturas no vertebrales3. Esto se intentó reducir disminuyendo la dosis y cambiando la formulación de fluoruro sódico a monofluorofosfato, pero no se ha podido resolver la elevada incidencia de efectos indeseables, como el «síndrome de piernas dolorosas». A pesar de todo, el estudio de sustancias con capacidad anabolizante ósea (hormona paratiroidea o paratirina [PTH], hormona del crecimiento [GH], receptor del factor del crecimiento [IGF-I], citocina TGFß, estroncio, etc.) suscita un permanente interés y ha recobrado todo su auge4.
Paratirina
La PTH es el principal eje de la homeostasis cálcica en los mamíferos, que pasaron hace millones de años del medio acuático rico en calcio al medio terrestre más pobre, y dependen desde entonces de la dieta. En el ser humano está formada por 84 aminoácidos. Su síntesis, por las células principales de la glándula paratiroides, está muy bien regulada por las concentraciones séricas de calcio circulantes. Cuando éstas decaen, aumenta la liberación de PTH, que estimula la síntesis renal de 1,25 OH vitamina D, favorece la absorción intestinal del calcio, aumenta su reabsorción en el túbulo distal renal y moviliza el calcio esquelético.
Acción sobre el tejido óseo
La PTH actúa en el complejo sistema celular de las unidades de remodelado óseo y facilita la recogida de preosteoblastos del estroma medular e induce la maduración de osteoblastos en reposo. Por medio de receptores específicos, activa la producción de enzimas y proteínas óseas por los osteoblastos, así como de citocinas reguladoras de la recogida, activación y apoptosis de los osteoclastos5.
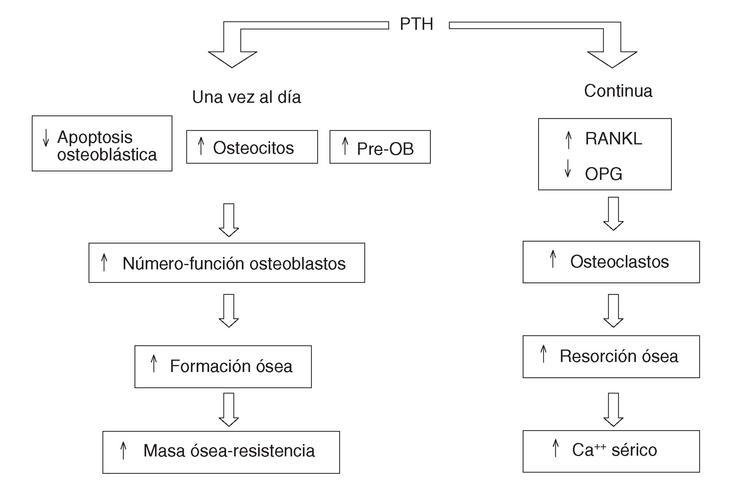
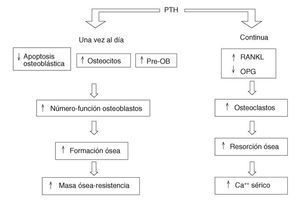
Lo más fascinante de esta interacción es que si la administración de PTH es continua el resultado final será un predominio de la resorción ósea, mientras que si es intermitente predominará la formación y se prolongará la vida de los osteoblastos6,7 (fig. 1). Una segunda particularidad es que estos efectos se producen aunque no se administre la molécula de la hormona completa (84 aminoácidos). De hecho, la porción N-terminal con los primeros 34 aminoácidos es la que actualmente ha presentado mejores resultados anabolizantes. La casa Eli Lilly & Co, mediante tecnología de ADN recombinante, ha producido una idéntica a la humana, la hrPTH (1-34) o teriparatida, que ha sido autorizada por el National Institutes of Health (NIH) para su uso en la osteoporosis. Como sucedió en el caso de los bisfosfonatos, se pueden diseñar otros fragmentos y derivados, buscando la mayor eficacia y seguridad posibles.
Figura 1. Acción de la PTH continua frente a la intermitente en el remodelado óseo. PTH: paratirina; RANKL: ligado del receptor para la activación del sector nuclear kappa B; OPG: osteoprotegerina; Pre-OB: precursores de osteoblastos.
En el ámbito histológico, los estudios con la teriparatida, tanto en animales8-10 como en humanos11, muestran un rápido aumento del volumen, la masa y la densidad mineral del hueso trabecular, y lo que es más prometedor, un aumento de su conectividad, sin un aumento de la porosidad cortical12, que se traduce en una mayor resistencia ósea (tabla 1).
Este efecto positivo sobre la formación ósea continúa durante varios meses tras haber cesado la administración del fármaco13.
En el plano bioquímico, el tratamiento con la PTH de manera discontinua produce cambios muy diferentes de los que estamos habituados a observar con los fármacos antirresortivos. Al contrario que con éstos, los marcadores de remodelado óseo no disminuyen sino aumentan, primero los de formación y posteriormente, en menor medida, los de resorción.
Ensayos clínicos en osteoporosis
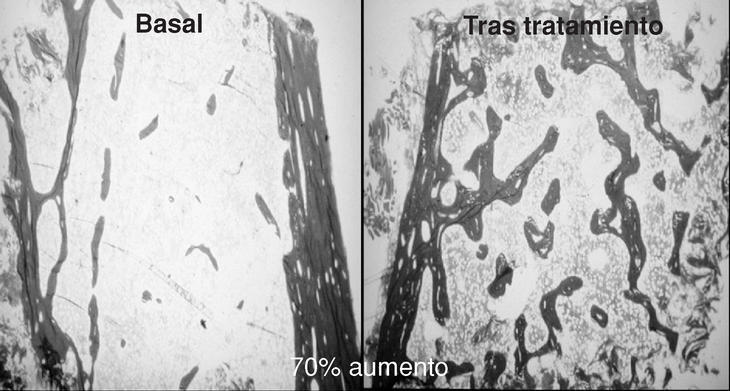
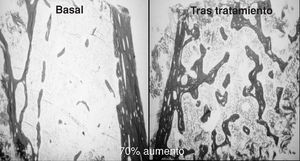
Los primeros trabajos sobre la eficacia de la PTH en la osteoporosis posmenopáusica los desarrolló el grupo de Reeve14 que, durante los últimos 25 años, ha continuado publicando datos positivos del tratamiento con la hrPTH (1-34). Así, en un ensayo de 21 mujeres con osteoporosis la administración de 100 µg/día/s.c., durante 6-24 meses produjo, aumentos de hasta un 70% del volumen trabecular óseo (ilíaco)15 (fig. 2).
Figura 2. Respuesta del hueso trabecular al tratamiento con 100 µg/día de teriparatida.
Slovic et al16 demostraban un aumento del doble de la densidad mineral lumbar basal, medida por hueso trabecular (QTC), en 8 varones osteoporóticos tratados durante un año. Numerosos ensayos observacionales, no controlados, fueron coincidiendo en este relevante aumento de la densidad mineral ósea (DMO) trabecular, mucho mayor que el observado con los tratamientos antirresortivos: un incremento anual del 7-10%, medido por absorciometría radiológica de doble energía (DXA) (hueso trabecular y cortical) y alrededor de un 40% evaluado por QTC. Esas diferencias en los resultados, según la técnica de medición, evidenciaban un aumento preferente del hueso trabecular, mientras que la densidad ósea cortical, en la cadera y el antebrazo, aumentaba o descendía levemente.
Ensayos controlados
Por tanto, era imprescindible disponer de una mayor evidencia de eficacia clínica, basada en ensayos clínicos más exigentes, donde se evaluara no sólo la masa ósea, sino también la eficacia antifractura en el hueso axial y periférico.
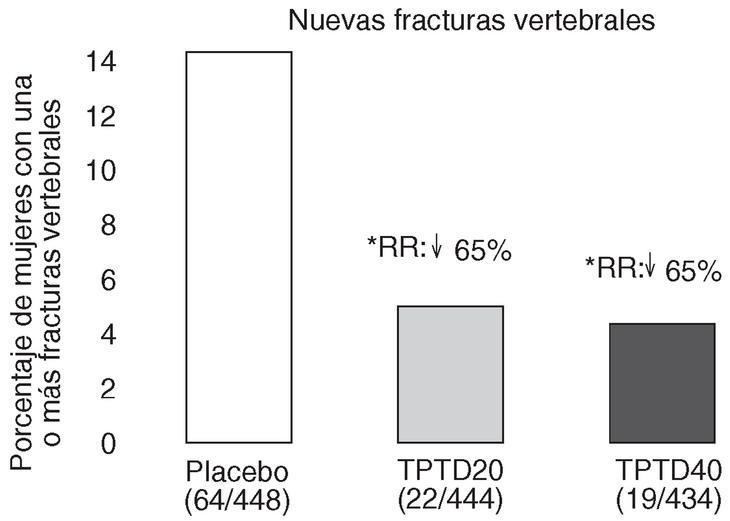
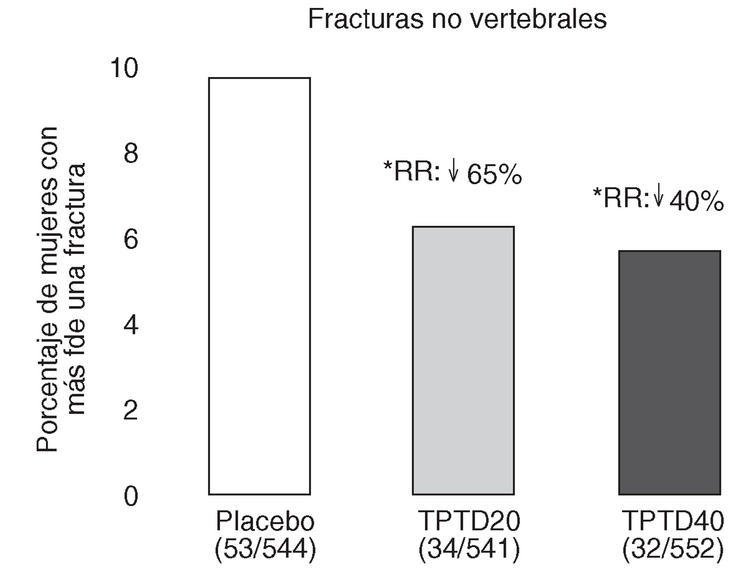
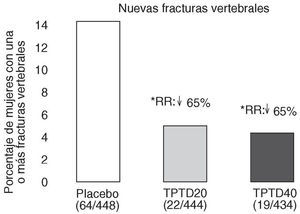
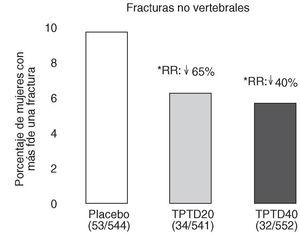
Neer et al publicaron en el año 2000 los resultados del Fracture Prevention Trial17. Es un ensayo clínico aleatorizado, a doble ciego, controlado con placebo, de carácter multicéntrico, en el que se trató a 1.637 mujeres posmenopáusicas con fracturas vertebrales previas, con teriparatida diaria subcutánea administrada en una dosis de 20 o 40 o con placebo durante una mediana de 19 meses. Todas las mujeres recibieron suplementos de calcio y vitamina D. Aunque planificado para una duración de 3 años, el ensayo se interrumpió a los 25 meses, ante los datos aparecidos sobre posible carcinogénesis en ratas. En los grupos con fármaco activo se produjo una reducción del riesgo de presentar una nueva fractura vertebral del 65 y del 69% (fig. 3), y una reducción del riesgo de presentar fracturas no vertebrales del 53 y del 54%, respectivamente (fig. 4). La dosis de 20 µg produjo un aumento de la DMO lumbar del 9,7 y del 2,8% en el cuello femoral. En el radio se observó un leve descenso, significativo en la diáfisis con la dosis de 40 µg (3,2%). El 11% de las mujeres tratadas con 20 µg y el 28% de las tratadas con 40 µg presentaron hipercalcemia leve y transitoria. Los acontecimientos adversos más frecuentes fueron náuseas, cefaleas y calambres en las piernas, algo más frecuentes con la dosis más alta, aunque en general no tuvieron consecuencias clínicas serias, por lo que sólo obligaron al abandono de un 6% de pacientes en el grupo tratado con 20 µg (similar al placebo) y a un 11% en el grupo de 40 µg.
Figura 3. Reducción del riesgo de fracturas vertebrales. Fracture Prevention Trial 17. RR: riesgo relativo frente a placebo. *p < 0,001 frente a placebo.
Figura 4. Reducción del riesgo de fracturas no vertebrales. Fracture Prevention Trial 17. RR: riesgo relativo frente a placebo. *p < 0,05 frente a placebo.
Con el fin de aclarar las dudas sobre el comportamiento del hueso cortical, Zanchetta et al18 estudiaron a 101 mujeres durante el ensayo anterior mediante QTC periférica en radio, realizada basalmente y a los 18 meses del tratamiento. Las conclusiones fueron que, aunque no hubo diferencias significativas en la DMO cortical, se apreció un aumento de la circunferencia ósea en las tratadas con la PTH, con una mejora de los indicadores de la arquitectura y geometría cortical.
Otros ensayos
Osteoporosis del varón
Disponemos de pocos estudios controlados sobre el tratamiento con PTH de la osteoporosis del varón. En un ensayo19 a doble ciego y aleatorizado, se estudió a 23 varones, de 30 a 68 años de edad, con osteoporosis idiopática (T-score lumbar o en cadera < 2,5 DE) y con remodelado óseo, el 78% de ellos con fracturas. Se inyectó, por vía subcutánea, 400 U/día de hrPTH (1-34) a 10 pacientes, y placebo a otros 13. Todos recibieron calcio y vitamina D. A los 18 meses, se observó en los tratados un aumento significativo de la masa ósea (DXA) del 13,5% en la zona lumbar, y del 2,9% en el cuello femoral, sin cambios en la diáfisis radial.
Otro estudio más ambicioso, multicéntrico20, incluyó a 437 varones con osteoporosis idiopática, de 30 a 85 años de edad, con DMO < 2,0 DE (lumbar o cadera), durante una mediana de observación de 11 meses. Se les administró aleatoriamente 20 µg/día (n = 151) o 40 µg/día (n = 139) de hrPTH (1-34), o placebo (n = 147). Los aumentos de la DMO fueron significativos en la columna lumbar (5,87, 9,03 y 0,52%, respectivamente en cada grupo) y en el cuello femoral, aunque más discretamente (1,53, 2,92 y 0,31%, respectivamente). No hubo cambios significativos en el radio, medio o distal, ni en el «cuerpo total».
En ambos estudios, los cambios en los marcadores bioquímicos del remodelado óseo son similares a los observados en las mujeres osteoporóticas tratadas con teriparatida, un aumento importante y temprano de la formación ósea y en menor medida de la resorción. Por todo ello, los autores suponen, aunque no lo han probado, que deberían reducirse las fracturas osteoporóticas en los varones con osteoporosis tratados con la teriparatida intermitente.
Osteoporosis corticoidea
La osteoporosis corticoidea es un cuadro clínico de compleja fisiopatogenia y difícil tratamiento. Algunos bisfosfonatos han mostrado cierta eficacia en preservar la masa ósea y evitar nuevas fracturas, controlando el incremento de la actividad osteoclástica. Sin embargo, ninguno modifica la importante depresión de la formación ósea producida por los corticoides. Por ello, sería de esperar un efecto positivo adicional con el uso de un anabolizante óseo, como la PTH, ya sea solo o en combinación con otros fármacos.
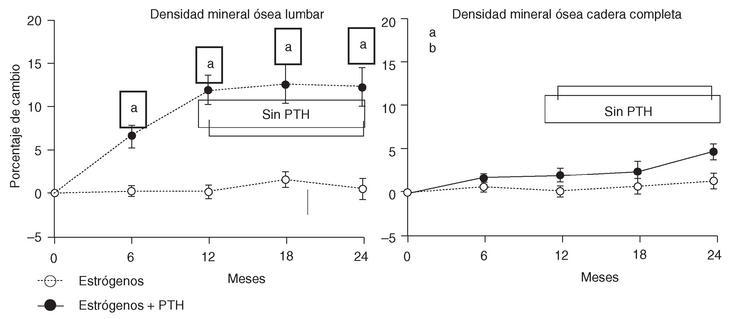
Lane et al21,22 han llevado a cabo un ensayo controlado en 51 mujeres posmenopáusicas con osteoporosis corticoidea (DMO < 2,5 DE, lumbar o femoral), que ya estaban en tratamiento con estrógenos. Fueron asignadas aleatoriamente a recibir durante 12 meses, 40 µg de hrPTH (1-34) (n = 28) o placebo (n = 23). Todas continuaron con los estrógenos. Al primer año, la DXA en columna lumbar mostró un aumento del 11% en las tratadas con la PTH y estrógenos, pero sólo del 1,7% en las que habían continuado únicamente con la THS. En la QTC espinal los incrementos fueron del 35 y del 1%, respectivamente. No hubo aumentos significativos en la DXA de la cadera y radio. Durante el segundo año del protocolo, ya sin la PTH, se produjo un nuevo incremento de la masa ósea en las que la habían recibido, con diferencias significativas en todas las áreas de medida. De modo que a los 24 meses, un año después de suspender la PTH, el aumento, respecto a la densidad mineral lumbar basal, fue del 45,9 y del 12,6% (QTC y DXA) en las que habían sido tratadas con PTH; es decir, un 43,1 y 11,9% mayor que las que recibieron sólo los estrógenos (fig. 5). Los marcadores de remodelado óseo aumentaron un 150% en los 3 primeros meses y permanecieron elevados incluso 6 meses después de haber finalizado el tratamiento con la PTH.
Figura 5. Teriparatida y estrógenos en mujeres con osteoporosis corticoidea22. PTH: paratirina. ap < 0,001 PTH + E > E; bp < 0,01 PTH + E > E.
Tratamientos combinados
El posible efecto sinérgico sobre la masa ósea entre la PTH y los antirresortivos ha sido objeto de diversos estudios. La posible mayor eficacia del tratamiento secuencial de PTH y calcitonina frente a la calcitonina sola no se evidenció de manera convincente tras 2 años de estudio23.
Lindsay et al24 demostraron, en un ensayo controlado de 3 años de duración, que las mujeres tratadas con teriparatida y estrógenos tenían aumentos de masa ósea muy superiores a las tratadas sólo con estrógenos, así como menos fracturas vertebrales. Otro grupo confirmó estos resultados, y mostró también la persistencia del efecto positivo de la PTH tras su suspensión25.
En un ensayo abierto se administró PTH o placebo durante un año a 60 mujeres con osteoporosis, y alendronato adicional durante el segundo año. La secuencia PTH-alendronato produjo un aumento de masa ósea casi del doble frente a la secuencia placebo-alendronato26. Esto hacía presumir que la respuesta ante estos 2 fármacos podía ser aditiva. Sin embargo, los datos publicados recientemente tanto en mujeres27 como en varones28 indican lo contrario: la terapia combinada es probablemente mejor que la terapia sólo con alendronato, pero la terapia sólo con PTH es mejor que la terapia combinada. Es decir, la administración previa de alendronato reduce el efecto anabólico de la PTH, al encontrar ésta menos osteoblastos activos.
Seguridad
Hasta ahora no se han descrito efectos secundarios graves durante el tratamiento con dosis bajas intermitentes de PTH. Se puede observar hipercalcemia, generalmente leve, en algunos casos, que desaparece al reducir la dosis y/o reajustar la ingesta de calcio. Es poco probable que aparezca si no se ha producido en los primeros 6 meses del tratamiento17. Si el calcio urinario aumenta, se suele corregir con un simple ajuste dietético. En algunos pacientes produce hipotensión transitoria, cefaleas, náuseas y calambres musculares, que raramente obligan a la interrupción del tratamiento. Se desconocen los posibles efectos adversos en humanos con tratamientos superiores a 3 años de duración
Estudios de carcinogénesis en ratas Fischer, sometidas a tratamiento con teriparatida durante 2 años29, han demostrado el desarrollo de osteosarcomas. Este efecto dependiente de la dosis, que no se ha observado en los estudios previos de menor duración, aparecía a los 17-20 meses, lo que equivale a un 70-80% de la vida de estas ratas. Aunque no se ha producido carcinogénesis en otros animales (monos o perros), ni existe una mayor incidencia de osteosarcoma entre los pacientes con hiperparatiroidismo primario o secundario, se ha establecido de manera cautelar un límite de 2 años para el tratamiento con teriparatida, lo que parece desproporcionado de acuerdo con los datos disponibles30.
Conclusiones
La PTH intermitente, ya sea la molécula completa o el fragmento 1-34, produce un incremento notable de la masa ósea trabecular, sin efectos secundarios relevantes, que puede ser eficaz en el tratamiento de la osteoporosis posmenopáusica, en el tratamiento de la osteoporosis del varón y en el tratamiento de la osteoporosis corticoidea. Dado su elevado coste, parece reservada por el momento a los casos graves. El tratamiento previo o concomitante con alendronato podría hacerla menos efectiva, por lo que éste debería ser administrado posteriormente. Se desconoce el efecto de tratamientos de más de 3 años de duración.
Se deberían explorar nuevas indicaciones como, por ejemplo, la aceleración de la curación de las fracturas traumáticas, el tratamiento de la osteoporosis secundaria a la inmovilización prolongada o a los vuelos espaciales.
Son necesarios ensayos más amplios sobre la reducción de fracturas de cadera; el estudio TOP (Treatment of Osteoporosis with Parathyroid Hormone), un estudio multicéntrico que seleccionará a 2.600 mujeres con osteoporosis posmenopáusica, investigará la eficacia antifracturaria de la PTH (1-84). Se están desarrollando estudios sobre nuevos metabolitos y vías de administración, oral y pulmonar, que podrían mejorar la adherencia al tratamiento31. Es necesario repetir y ampliar los pocos estudios existentes que la comparan con fármacos de eficacia probada32,33. Por último, a la luz de las últimas evidencias publicadas, se debe reconsiderar cuál es la estrategia más oportuna para los tratamientos combinados o secuenciales con otros fármacos.
En cualquier caso, la terapia anabolizante ósea ha recobrado un gran interés con los datos ya consolidados sobre la eficacia del tratamiento con la PTH intermitente, y la investigación se impulsará de nuevo más allá de lo conocido.