Introducción
La Organización Mundial de la Salud (OMS) define la osteoporosis como una reducción de la densidad mineral ósea (DMO) por debajo de 2,5 desviaciones estándar de la media del máximo promedio de la DMO, y se estima que afecta, aproximadamente, a un 30% de las mujeres en período de posmenopausia1. En España se estima que un 40% de las mujeres mayores de 50 años presentan osteoporosis, y que es la causa directa de 25.000 fracturas anuales, las cuales provocan una elevada mortalidad en el primer año y un gasto anual que supera los 150,25 millones de euros2, y estos datos posiblemente estén infravalorados por el estado previo a la fractura de la paciente (pacientes ingresadas en residencias) y por el soporte familiar que libera a la Administración de gastos medicosociales. Las fracturas vertebrales tienen una elevada incidencia en la mujer con osteoporosis y constituyen un punto importante de investigación en los distintos tratamientos que se proponen para la osteoporosis3-6.
Para evaluar el riesgo de fracturas, actualmente se usan 2 indicadores: la DMO y los cambios en los marcadores de remodelación ósea (MRO). La disminución de la DMO es un factor de riesgo de aparición de fractura. Marshall et al7 estiman que por cada desviación estándar (DE) de la DMO por debajo de la media aumenta el riesgo relativo (RR) de aparición de fractura entre 1,5 y 2,6. Por otro lado, la variación de los marcadores bioquímicos se reconoce como un factor predictivo de respuesta al tratamiento farmacológico para tratar o prevenir la osteoporosis8. Actualmente, también se estudia el papel de los bisfosfonatos en la preservación de la arquitectura trabecular, un factor que presumiblemente influye en el riesgo de aparición de fracturas en mujeres posmenopáusicas o en fase inicial de posmenopausia, y su consiguiente beneficio en la prevención de fracturas9,10. Este factor no se ha incluido en la revisión debido a la escasez de artículos que reporten datos sobre dichos cambios.
Los bisfosfonatos como, por ejemplo, el risedronato, el etidronato y el alendronato, son fármacos indicados en el tratamiento de la osteoporosis, y se utilizan para prevenir las fracturas asociadas a la enfermedad11-13. Otros como el raloxifeno13-15 son igualmente eficaces en la prevención de las fracturas vertebrales asociadas a la osteoporosis.
Se han publicado 2 revisiones sistemáticas con me-taanálisis. Una de la Cochrane Library16 que estudió el efecto de los bisfosfonatos en la osteoporosis inducida por esteroides y otra recientemente publicada11-13, sobre la eficacia (DMO y fracturas) de diferentes bisfosfonatos y raloxifeno en el tratamiento o la prevención de la osteoporosis posmenopáusica. Este estudio analiza la eficacia de estos fármacos en la reducción de las fracturas no vertebrales, evaluando independientemente la fractura de fémur y de muñeca, aspecto que no se cubre en otros metaanálisis.
El objetivo del presente estudio fue realizar un metaanálisis para evaluar la eficacia de risedronato y raloxifeno en el tratamiento y la prevención del riesgo de fracturas de cadera, vertebrales y de muñeca en mujeres posmenopáusicas con osteoporosis, así como sus efectos en los cambios de la DMO y los MRO.
Material y método
Estrategia de búsqueda
La búsqueda se realizó en bases de datos con soporte CD-ROM y en línea. Se realizó una revisión de la bibliografía publicada desde 1966 hasta septiembre del 2002 en las bases de datos MEDLINE (a través del buscador PubMed), la Cochrane Library, Embase y Pascal Biomed. Por otra parte, también se revisaron las publicaciones de la Sociedad Española de Reumatología, de la Sociedad Española de la Investigación Ósea y del Metabolismo Mineral y, finalmente, de la Fundación Hispana de Osteoporosis y Enfermedades Metabólicas Óseas. En estos casos, la búsqueda incluyó el vocabulario correspondiente en español. Por último, se procedió a una búsqueda ascendente a partir de los artículos seleccionados.
La estrategia de búsqueda para cada una de las bases de datos hizo uso de operadores boleanos, descriptores específicos, términos de conformidad y con las estructuras de sintaxis propias de cada sistema. La estrategia de sintaxis utilizada para MEDLINE tuvo en cuenta la modificación desarrollada por Haynes17 y el Cochrane Musculoskeletal group18. Para todas las estrategias se consideraron los siguientes descriptores específicos: risedronate, raloxifene, vertebral fractu-
re, bisphosphonate, bone disease, bone demineralization, bone mineral density, bone remodeling marker, osteoporosis, posmenopause/al. Y como términos en conformidad con los criterios de inclusión se utilizaron los siguientes: clinical trial, randomized controlled trial, randomization, double blind, double mask.
Criterios de inclusión/exclusión de estudios
La población estudiada en esta revisión incluyó mujeres posmenopáusicas en las que estuviera indicado el tratamiento, preventivo o no, de la osteoporosis, diagnosticada mediante densitometría y/o por la presencia de fracturas, y que no se hubieran tratado previamente a la inclusión en el ensayo clínico con raloxifeno o risedronato, o que hubieran sido incluidas en el estudio después de un período de lavado.
Ante la falta de un consenso clínico sobre el dintel diagnóstico de la osteoporosis en mujeres de edad avanzada, en esta revisión se ha incluido los estudios con pacientes posmenopáusicas con diagnóstico de osteoporosis, aunque la definición de osteoporosis utilizada por los autores de cada estudio fuera distinta de la propuesta por la OMS. En todos los casos, sin embargo, se coincidió en la presencia de una «baja masa ósea» y un «riesgo de fractura aumentado».
En la revisión se seleccionaron los artículos originales que reunían los siguientes criterios: a) diseño de ensayo clínico controlado aleatorizado a doble ciego; b) comparación de los fármacos citados con placebo; c) evaluación de los efectos vertebrales, en cadera o muñeca; d) utilización de las dosis autorizadas de los fármacos; e) obtención de una puntuación mínima de 3 puntos en la escala de Jadad18 para asegurar la calidad metodológica de los estudios, y f) que incluyeran resultados de estudios con más de 6 meses de seguimiento después del inicio del tratamiento. Las publicaciones de un mismo estudio que estuvieran duplicadas fueron excluidas exceptuando las que aportasen nuevos datos de acuerdo con los objetivos de la revisión. Tras la selección, los estudios incluidos se agruparon según el tratamiento y, posteriormente, subagrupados por duración y dosis, para realizar los distintos metaanálisis teniendo en consideración las propuestas de agrupación efectuadas en las revisiones sistemáticas previas11-19 y los resultados de la evaluación estadística de la homogeneidad.
Revisión de artículos, extracción de la información
Se siguieron los criterios usados por la Colaboración Cochrane20. Dos revisores examinaron de manera independiente los resúmenes o, en su defecto, el texto completo de todos los estudios que potencialmente respondían a los criterios de inclusión. Cuando los revisores no alcanzaron un consenso sobre inclusión (8%), se volvió a revisar el artículo conjuntamente hasta llegar a un acuerdo definitivo. En los casos en que aún no se llegó a un consenso de los 2 revisores, se contó con un tercer revisor (un solo caso).
Tras la selección e inclusión de los ensayos, 3 revisores realizaron de forma independiente la extracción de toda la información de acuerdo con un formulario de recogida de datos diseñado con ese fin. Los datos extraídos de cada artículo fueron: el número de participantes en los ensayos distribuidos en grupos de tratamiento; la edad media; la media de años con menopausia; la media de la DMO de los sujetos que recibieron tratamiento y los que recibieron placebo; la dosis empleada para cada grupo de tratamiento; las variables del estudio (incidencia de fractura y cambios en DMO y MRO), y, por último, las pérdidas de seguimiento de los pacientes.
Aunque todos los estudios hicieron uso de la absorciometría radiográfica de doble energía para la determinación de la DMO, existen diferencias en las puntuaciones obtenidas por los distintos densitómetros de uso más frecuente (Hologic QDR 1000, Hologic QDR 2000, Norland y Lunar). Los valores que aparecen asociados a una DMO por debajo de 2 desviaciones estándar para el caso del Lunar se-rían inferiores a 0,92 g/cm2 y, para el Hologic o el Norland21, por debajo de 0,80 g/cm2. Para la extracción de los datos de cambios en la DMO se recogieron los obtenidos con el sistema Hologic, el más frecuentemente utilizado.
Análisis estadísticos
Para el análisis de datos, los estudios se agruparon en función de su duración en 2 grupos: a corto plazo (CP), < 24 meses, y a largo plazo (LP), >= 24 meses. Cuando un estudio a LP brindó datos correspondientes a un momento anterior a 24 meses, también se incluyó dichos datos en el análisis a CP. También se establecieron los siguientes grupos, según las dosis administradas: para risedronato 2,5 mg (o cíclico) y 5 mg; para raloxifeno, menos de 60 mg y 60 mg o más. Por último, se diferenciaron otros 2 grupos: uno que combinaba los resultados con las dosis recomendadas (5 mg para risedronato y 60 mg para raloxifeno) a LP (DRLP) y otro denominado «grupo global», que incluyó los estudios a corto y largo plazo y con todas las dosis. Es precisamente la distinción entre los resultados de la aplicación de las dosis actualmente recomendadas y los resultados de aplicación de diversas dosificaciones, bajo la óptica del metaanálisis, uno de los puntos centrales de este trabajo. En la figura 1 se resumen los grupos analizados. En los estudios que no aportaron los abandonos del tratamiento para cada grupo, se hizo una distribución de las pérdidas totales descritas por los autores de manera proporcional al tamaño de cada grupo de tratamiento. Las pérdidas no fueron consideradas «fracasos» (aparición de fractura), por lo que el análisis no se puede considerar por intención de tratamiento.
Figura 1. Agrupación de los estudios incluidos para el metaanálisis.
Para el cálculo de las incidencias de fracturas, cuando un paciente presentó más de una fractura por región, se consideró sólo una fractura, es decir: el paciente como evento. Cuando un artículo no proporcionó algún valor de desviación estándar (DE) para la DMO, se obtuvo el valor representado en la gráfica, si era el caso, mediante 2 revisores independientes y consensuando el resultado; en caso de existir discrepancia, intervino un tercer revisor. En todos los casos, se consideró la plausibilidad del valor obtenido (permanencia dentro del rango determinado por los otros valores de las series de datos incluidos en el análisis). En caso de presentarse este mismo problema para algún valor esperado en la serie analizada, se procedió de igual manera. Cuando no se dispuso de gráfico de referencia para la estimación de la DE asociada a alguna media de cambio en DMO, pero sí de estimaciones de DE en pacientes con similares características de tratamiento fármaco, dosis, grupo (preventivo/tratamiento) y tiempo de tratamiento, se asignó la DE promedio (ponderada por el tamaño del estudio) a dicha media.
Para el cálculo de la diferencia media ponderada (DMP) de la DMO en el metaanálisis, se usó el método descrito por Mulrow y Oxman20. Las estimaciones se efectuaron mediante el método modificado de Glass (estimador no sesgado). Para evaluar la posibilidad de combinar las medidas de los resultados en los diversos estudios se utilizó el test Q de combinabilidad con n-!=1 grados de libertad (cantidad de estudios a incluir menos uno) y la probabilidad correspondiente22-24. A pesar de que este análisis estadístico tiene menor potencia que un test de homogeneidad, habitualmente se incluye como un componente más del método de análisis de DerSimonian-Laird (para un modelo de efectos aleatorios, véase Gavaghan et al25).
El método principal que fundamenta el análisis es el método de efectos aleatorios (EA), aunque se obtuvieron resultados en 2 tipos de modelos: EA y de efectos fijos (EF). Se tendrá en consideración el método de EF sólo en el caso de discrepancias entre ambos modelos. La combinabilidad de los estudios se aceptará cuando el valor de combinabilidad Q resulte ser mayor que 0,05 (Q > 0,05). El método de Mantel Haenszel (modificación de Rothman-Boice) se utilizó para el cálculo del RR en el caso de las fracturas estudiadas bajo el modelo de EF, usando la ponderación de la varianza según la fórmula de Greenland-Robins26. Para el cálculo mediante el modelo de EA se utilizó el método de DerSimonian-Laird, mientras que para el estudio de la homogeneidad se utilizó el método de la Q de combinabilidad antes citado. En todos los casos, los intervalos de confianza (IC) se obtuvieron para el 95%.
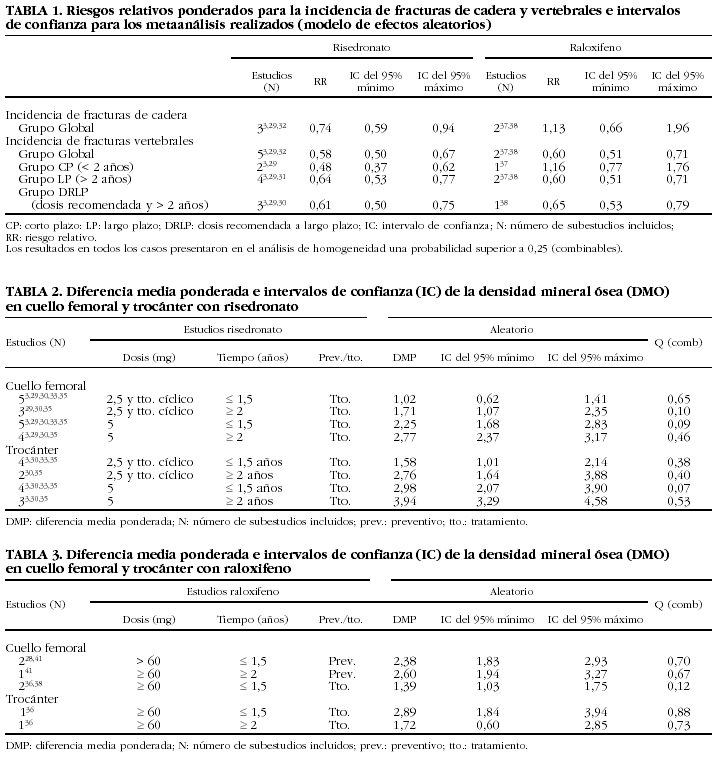
Para la ponderación en la estimación del metaanálisis se consideró que el tamaño del estudio era el obtenido al final del período de seguimiento; esto hace que los estudios que mantengan la mayor cantidad de pacientes influyan más que los que se inicien con igual tamaño pero tengan mayores pérdidas de seguimiento. En los casos en que el autor no reportaba el número de pacientes sobre el cual se efectuó la medición en un momento dado, se asignó el número que finalizó el estudio como factor de ponderación para el metaanálisis. Las tablas 1-5 incluyen los resultados de todos los metaanálisis que resultaron factibles a partir de los estudios incluidos.
Resultados
Tras la revisión sistemática y en conformidad con los criterios de inclusión, se seleccionó un total de 8 ensayos clínicos con risedronato y otros 8 con raloxifeno. De éstos, fueron excluidos 2 estudios: uno por tener un seguimiento de tan sólo 6 meses27, y otro por no reportar datos suficientes en los análisis28. Se incluyó en total 14 estudios. Los tamaños muestrales (tablas 6 y 7) tienen un papel importante en el metaanálisis. En algunos casos se han hecho metaanálisis en los cuales se ha incluido uno o 2 estudios, tal es el caso de algunos metaanálisis hechos con el estudio MORE, que incluye a varios miles de pacientes con diferentes modos de agrupación por tratamientos, lo que permite tener un tamaño muestral relativamente grande. En algún caso esto no es así (estudios con menos pacientes), por lo que el resultado del metaanálisis se debe tomar con prudencia.
Las tablas 6 y 7 muestran los datos basales de los estudios incluidos. Cuando no se pudo extraer los datos basales directamente de las publicaciones, se tomó como fuente secundaria de información los datos aportados en las tablas de las características de los estudios incluidos por el Osteoporosis Research Advisory Group (ORAG)11-13. Por lo que se refiere a risedronato, 6 ensayos son de tratamiento3,29-33 y 2 son de prevención34,35. Respecto a los estudios incluidos de raloxifeno, 3 son de tratamiento6,14,36-39 y otros 3 son de prevención40-42. Todos los estudios obtuvieron un valor mayor o igual a 3 en la escala de Jadad (véase la primera columna en tablas 6 y 7) y tuvieron una duración de 1 a 4 años, siguieron un proceso de aleatorización con un grupo placebo, fueron realizados a doble ciego y presentaron información (en algún caso incompleta, como se puede constatar en las tablas 6 y 7) sobre las pérdidas de seguimiento.
Incidencia de fracturas
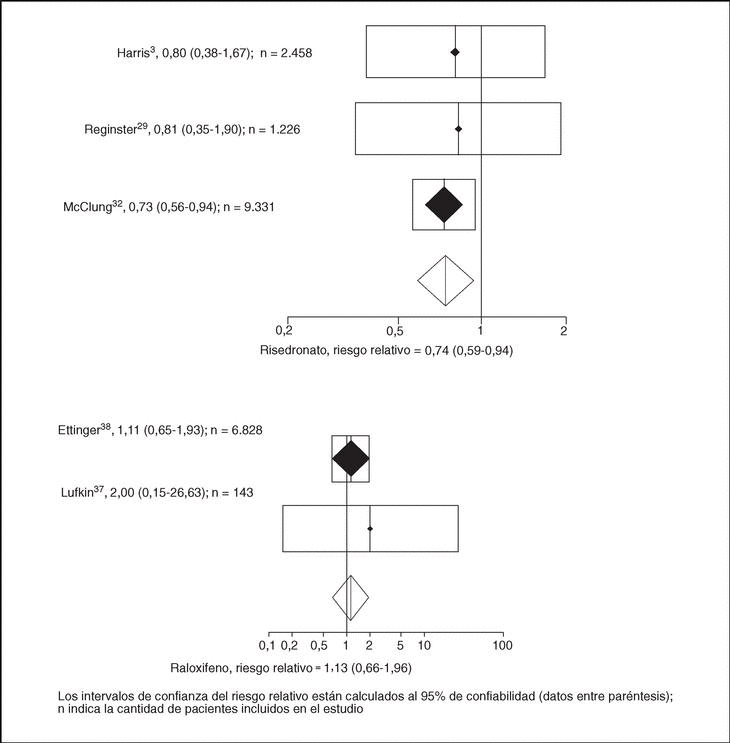
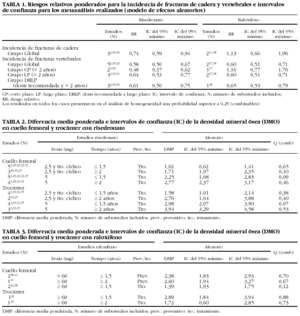
Fracturas de cadera. La tabla 1 presenta los resultados del metaanálisis de las fracturas de cadera. Teniendo en cuenta el modelo de efectos aleatorios en el grupo, con risedronato la probabilidad de combinabilidad de los estudios fue de 0,8, por lo que se hizo el metaanálisis y se obtuvo un RR de 0,74 (IC del 95%, 0,59-0,94), con raloxifeno la probabilidad p para la combinabilidad de los estudios resultó de 0,74, por lo que estadísticamente se combinaron los estudios y se alcanzó un RR de 1,13 (IC del 95%, 0,66-1,96). De hecho, los 2 estudios incluidos en raloxifeno presentaron riesgos relativos superiores a 1 e IC que contenían el 1 (fig. 2).
Figura 2. Riesgo relativo de fracturas de cadera con el tratamiento con risedronato y raloxifeno (efectos aleatorios).
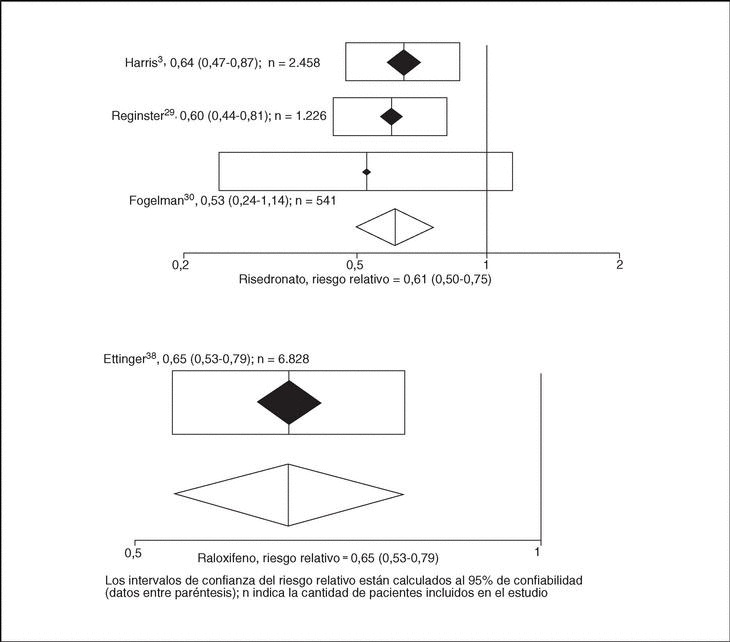
Fracturas vertebrales. En la tabla 1 se presentan además los resultados obtenidos en los metaanálisis de las agrupaciones de los estudios (grupos DRLP, CP, LP y grupo global). La p de combinabilidad con risedronato resultó superior a 0,7 en todos los casos y se obtuvo un RR de incidencia de fracturas vertebrales de 0,61 (IC del 95%, 0,50-0,75) (fig. 3), 0,48 (IC del 95%, 0,37-0,62) y 0,64 (IC del 95%, 0,53-0,77) para los grupos DRLP, CP y LP, respectivamente; mientras que con raloxifeno el RR fue de 0,65 (IC del 95%, 0,53-0,79) (fig. 3), 1,16 (IC del 95%, 0,77-1,76) y 0,60 (IC del 95%, 0,51-0,71). Respecto al grupo global, risedronato obtuvo un RR de 0,58 (IC del 95%, 0,50-0,67) y raloxifeno, de 0,60 (IC del 95%, 0,51-0,71).
Para los metaanálisis con raloxifeno, los datos fueron extraídos del estudio Multiple Outcomes of Raloxifene Evaluation (MORE)38. El estudio Lufkin37 se excluyó del metaanálisis por no ser combinable (p = 0,0028) con el estudio MORE, el de mayor tamaño muestral (7.705 pacientes). (El estudio de Lufkin presentó tanto en fractura de cadera como de vértebra unos IC que contuvieron el 1, presumiblemente influido por su pequeño tamaño muestral, a diferencia del MORE, que presentó IC que marcaban definidamente un efecto protector).
Fracturas de muñeca. El grupo global presentó en risedronato un RR de 0,67 (IC del 95%, 0,42-1,07), se incluyeron 2 estudios, los de Harris et al3 y Reginster et al29; raloxifeno presentó un RR de 0,88 (IC del 95%, 0,67-1,14) y se incluyó el estudio MORE. Ambos metaanálisis presentaron una p de combinabilidad para los grupos o subgrupos incluidos superior a 0,8.
Cambios en la DMO
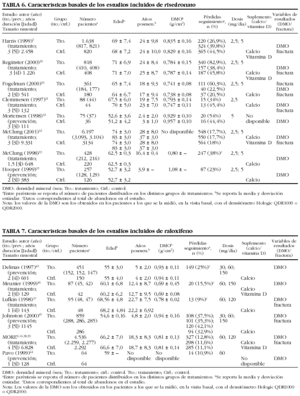
Los cambios de la DMO en cadera se resumen en las tablas 2 y 3. Ambas presentan por separado los valores de la DMP de la DMO en cuello femoral y en trocánter. Todos los estudios de risedronato con los datos necesarios para el análisis son de tratamiento y, excepto en las dosis bajas de risedronato (2,5 mg o tratamiento cíclico), en los demás casos se obtuvieron incrementos porcentuales en la DMP entre 1,02 (IC del 95%, 0,62-1,41) y 3,94 (IC del 95%, 3,29-4,58). Por lo que se refiere a raloxifeno, se han observado cambios que varían desde 1,39 (IC del 95%, 1,03-1,75) hasta 2,89 (IC del 95%, 1,84-3,94). En todos los casos, los estudios resultaron estadísticamente combinables. No se encontraron datos que permitieran hacer metaanálisis de los cambios en la DMO en muñeca.
Figura 3. Riesgo relativo de fractura de vértebra con el tratamiento con risedronato y raloxifeno a dosis recomendadas (5 y 60 mg, respectivamente).
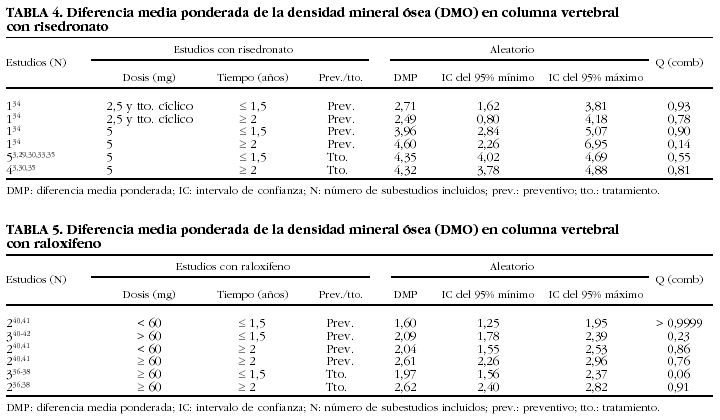
Los resultados obtenidos en el cálculo de los cambios de DMO en vértebra están reflejados en las tablas 4 y 5. En los estudios de dosis bajas de risedronato no preventivos con dosis de 2,5 mg o tratamiento cíclico (actualmente no recomendadas), se presentan diferencias estadísticamente significativas en la magnitud del efecto (la p de combinabilidad resulta inferior a 0,001), por lo que no resultan combinables. Llama la atención el grupo de 5 mg con 2 o más años de tratamiento, en el que se obtuvieron resultados en la diferencia media ponderada (DMP) (DMP = 4,32%; IC del 95%, 3,78-4,88). Hubo que excluir un estudio pues la p de combinabilidad resultó significativa. Este valor de significación lo produjo el estudio de Reginster et al29, en el que hubo cambio en la DMO del 5,70% (IC del 95%, 5,13-6,26), superior al resto de los estudios.
Respecto a raloxifeno (tabla 5), en el caso de la dosis superior a 60 mg, con una duración inferior a 1,5 años, la p de combinabilidad resulta de 0,06; aunque superior a 0,05, en un análisis más detallado se observa que los estudios de Meunier et al36 (tanto 60 mg como 150 mg) y de Lufkin et al37 (60 mg y 120 mg) están asociados a este valor tan cercano al límite de combinabilidad, bien sea porque dan unos valores superiores al resto (Meunier 60 mg, DMP = 3,9% [IC del 95%, 1,96-5,83], y Meunier 120 mg, DMP = 3,3 [IC del 95%, 1,21-5,38]), bien por incluir el IC del 95% el valor cero (Lufkin 60 mg, DMP = 0,8 [IC del 95%, 0,57-2,17], y Lufkin 120 mg, DMP = 1,1 [IC del 95%, 0,26-2,46]).
Para el grupo de más de 60 mg y con una duración de tratamiento de más de 2 años, se obtiene un cambio en la DMO de 2,62% (IC del 95%, 2,40-2,82).
Discusión
El riesgo de fractura es el indicador de eficacia más importante del resultado clínico de un tratamiento para la osteoporosis, indicador que debe reducirse, al menos en cierta medida, como resultado del incremento de la masa ósea del hueso, que provee a éste del sustrato biológico para su fortalecimiento. Se ha realizado un metaanálisis para evaluar la eficacia de risedronato y raloxifeno en el tratamiento y la prevención del riesgo de fracturas de cadera (especialmente importante tanto desde la perspectiva clínica como de la socioeconómica)43, vertebrales (las más estudiadas tanto por la frecuencia de su aparición como por el incremento del riesgo
de nuevas fracturas que su presencia supone) y de muñeca, en mujeres posmenopáusicas con osteoporosis.
Esta revisión ha tenido el objetivo de analizar el impacto de la dosis y la duración de los tratamientos en la incidencia de las fracturas de cadera, vertebrales y de muñeca, el cambio de la DMO y su efecto relativo en la prevención y el tratamiento de la osteoporosis. Para una discusión fundamentada de los resultados hay que tener presentes algunas características en los criterios de inclusión y en la búsqueda de datos que matizan esta revisión y que la diferencian, por ejemplo, de la presentada por el grupo ORAG: 1) no se incluyen los estudios de Adachi et al13 y Johnell et al28, al no proporcionar datos que permitan hacer los análisis posteriores, y se ha incluido el estudio de Delmas et al40; 2) la recogida de datos incluyó los resultados obtenidos por los ensayos a partir de los 6 meses de seguimiento desde el inicio del estudio; 3) no se exigió para la inclusión de los estudios que la mujer tuviera como mínimo 6 meses de posmenopausia; 4) no se ha realizado una búsqueda manual en las principales publicaciones de las monografías de congresos; 5) los estudios se dividieron en 2 grupos en conformidad con las dosis y, a su vez, también se dividieron en 2 en conformidad con la duración del tratamiento; 6) en el caso de que las publicaciones no proporcionasen los datos numéricos, se procedió a su extracción a partir de los gráficos o, en su defecto, a la interpolación de los datos reportados por los otros estudios incluidos con las mismas características de clasificación para el análisis; 7) para el metaanálisis se utilizaron los métodos de M-H Rothman-Boice y DerSimonian-Laird, a diferencia del estudio ORAG, que utilizó el método referido en Fleiss44; 8) en el caso de no disponer de las pérdidas de pacientes de cada grupo, se hizo una distribución proporcional de la pérdida total a la magnitud de cada grupo del estudio. Esto último ha podido incidir en el resultado del cálculo de los RR, que pueden ser ligeramente diferentes para algunos estudios o análisis y suponen una limitación de este estudio. Cuando los resultados de ambos estudios resultaron relacionables, las diferencias antes citadas no implicaron diferencias cualitativas entre las conclusiones de dichos estudios, sólo se observaron pequeñas diferencias en los decimales de algunos resultados, como se hace notar a lo largo de la discusión.
Con relación a la fractura de cadera y muñeca y los RR encontrados para risedronato en el estudio, 0,74 (IC del 95%, 0,59-0,94) y 0,67 (IC del 95%, 0,42-1,07), se observa que si bien los resultados en cadera denotan un efecto de reducción de riesgo frente a placebo, no así en muñeca, pues al 95% de confiabilidad el valor 1,07 aparece como extremo superior del intervalo. En raloxifeno encontramos los valores 1,13 (IC del 95%, 0,66-1,96) y 0,88 (IC del 95%, 0,67-1,14) para cadera y muñeca, respectivamente. Se observa que ambos IC exceden el valor límite superior 1. Estos resultados analizados en cadera apuntan a que el efecto del tratamiento es suficientemente variable en la población evaluada como para no poder sacar conclusiones en cuanto a su eficacia. En muñeca, los resultados nos llevan hacia esta misma interpretación en ambos fármacos.
Con relación al RR de fracturas vertebrales, tal y como se muestra en la tabla 1, los resultados de los diversos metaanálisis realizados, con la excepción del estudio de Lufkin et al37 en raloxifeno, confirmaron el efecto positivo en cuanto a la reducción del RR de fractura vertebral con el uso de cualquiera de los fármacos estudiados.
Se debe notar que, para el cálculo de los RR en el grupo global, las dosis de raloxifeno siempre fueron mayores o iguales a la recomendada (los estudios reportaron dosis de 60 y 120 mg), mientras que para los estudios incluidos con risedronato las dosis siempre fueron iguales o menores que la dosis recomendada (dosis de 5 mg, 5 mg cíclico o 2,5 mg).
Si bien el metaanálisis de vértebra que considera conjuntamente todos los estudios revela con toda claridad la eficacia de ambos tratamientos frente a placebo, con raloxifeno la medida de efecto RR aparece con el valor 0,60 (IC del 95%, 0,51-0,71); si se analiza estratificadamente por dosis, se puede observar que proviene de 2 valores de distinta magnitud numérica: 0,65 (IC del 95%, 0,53-0,79), como efecto del tratamiento de 60 mg, y 0,55 (IC del 95%, 0,45-0,68), como efecto de la dosis de 120 mg (el doble de la recomendada). Con risedronato sucede lo inverso: aunque la medida final de RR que se obtiene es 0,58 (IC del 95%, 0,50-0,67), ésta proviene de estudios que consideran la dosis diaria de 5 mg y estudios que consideran la dosis diaria también de 5 mg pero administrada cíclicamente, y estudios con dosis de 2,5 mg (la mitad de la dosis recomendada); en los estudios con dosis bajas se presentan valores de RR que alcanzan cifras hasta de 0,70 (IC del 95%, 0,42-1,10); sin embargo, los estudios que usan la dosis de 5 mg alcanzan como máximo un RR de 0,63 (IC del 95%, 0,47-0,87) o valores inferiores.
Para demostrar la eficacia de cada tratamiento, el tipo de análisis estadístico que se fundamenta en la recuperación de todos los ensayos clínicos previos muestra homogeneidad estadística, se usen o no las dosis actualmente recomendadas para la práctica clínica habitual. Sin embargo, para hacer una estimación más precisa de la eficacia en las condiciones de la práctica habitual, es deseable agrupar los ensayos que usaron las dosis recomendadas y observar los valores del RR que se obtienen como resultado de un metaanálisis en este grupo. En este caso, para ambos fármacos se obtuvo un efecto positivo, para risedronato se obtuvo un RR de 0,61 (IC del 95%, 0,50-0,75) y para raloxifeno, un RR de 0,65 (IC del 95%, 0,53-0,79).
Las tablas de las estimaciones del cambio en la DMO en vértebra permiten apreciar que, con la dosis recomendada y para el tiempo de 2 o más años, se obtienen valores de cambio con risedronato y con raloxifeno, que confirman cualitativamente los presentados por ORAG (4,32% [IC del 95%, 3,78-4,87] en risedronato y 2,62 [IC del 95%, 2,40-2,82] en raloxifeno)12,13, por lo que se confirma una acción beneficiosa de los fármacos como efecto del tratamiento.
En los estudios de prevención de fractura vertebral a 2 o más años con la dosis recomendada, risedronato mostró un efecto positivo con un cambio en la DMO de 4,60 (IC del 95%, 2,26-6,95), mientras raloxifeno para este mismo tipo de estudio tuvo un efecto positivo, con un cambio en la DMO de 2,61 (IC del 95%, 2,26-2,96). Esta situación coincide cualitativamente también con la presentada en el estudio de ORAG, donde la diferencia de cambio medio encontrada para risedronato en los estudios de prevención fue del 4,71% (IC del 95%, 3,74-5,67) y, para raloxifeno, de 1,72% (IC del 95%, 1,34-2,11), por lo que se confirma el beneficio ofrecido por las dosis actualmente recomendadas para ambos fármacos. En cuanto a los cambios en estudios de tratamiento a dosis recomendada, para risedronato resultaron combinables los estudios de hasta 1,5 años, y se obtuvo un cambio en la DMO de 4,35 (IC del 95%, 4,02-4,69), para los estudios de 2 o más años, el estudio de Hopper (1999), que incluyó a 155 pacientes en este subanálisis, presentó un cambio en la DMO de 1,9 con una DE de 4,4, mientras que los estudios de Fogelman (2000), Harris et al (1999) y Reginster et al (2000), incluyeron en total a 1.511 pacientes en este subanálisis, presentando los 3 valores de cambio en la DMO superiores a 4,1; esta diferencia con el estudio de Hopper afectó a la combinabilidad en este metaanálisis. En raloxifeno se obtuvo un cambio en la DMO para tratamiento a dosis recomendada de 2,62 (IC del 95%, 2,40-2,82). En todos los análisis antes mencionados los tratamientos mostraron efectos positivos sobre la DMO.
En cuanto a cadera y para los grupos de tratamiento de 2 o más años, se encontraron valores de cambio en la densidad en cuello femoral y trocánter para risedronato y raloxifeno que concuerdan cualitativamente con los presentados por el grupo ORAG para cambios en la DMO en fémur, 2,77% (IC del 95%, 2,37-3,17) para risedronato y 1,39 (IC del 95%, 1,03-1,75) para raloxifeno. Se verifica también el efecto beneficioso de ambos tratamientos en la DMO en trocánter con las dosis recomendadas actualmente, y se produce un cambio del 3,94% (IC del 95%, 3,29-4,58) para risedronato en estudios de 2 o más años, y un efecto de 1,72 (IC del 95%, 0,60-2,85) en raloxifeno.
Teniendo en cuenta la poca cantidad de estudios que brindaron información sobre los MRO y la incompleta información brindada, no se presentan resultados ni discusión sobre este punto.
En conclusión, risedronato ha demostrado reducir significativamente el RR de fractura de cadera, efecto no observado en raloxifeno. En fractura de muñeca ninguno de los 2 fármacos logró una reducción estadísticamente significativa, mientras que ambos produjeron una reducción importante de la frecuencia de fracturas vertebrales. En fémur, trocánter y vértebra ambos fármacos produjeron un aumento en la DMO.