Candida albicans y Rhodotorula mucilaginosa son levaduras de importancia clínica en la cavidad oral. En pacientes inmunocomprometidos estas levaduras pueden producir enfermedades que deben ser controladas con antimicrobianos.
ObjetivosEvaluar y comparar la eficacia antifúngica de seis enjuagues bucales comerciales frente a aislamientos de C. albicans y R. mucilaginosa.
MétodosFue evaluada in vitro la eficacia de seis enjuagues bucales formulados (solos o en combinación) con clorhexidina (CHX) 0,12%; CHX 0,1%; CHX 0,05%; cloruro de cetilpiridinio (CPC) 0,075%; CPC 0,05% y aceites esenciales. Fueron utilizados diez aislamientos de C. albicans y otros diez de R. mucilaginosa. Mediante el método de difusión en placa con agar Mueller Hinton (modificado) se midieron los halos de inhibición previa incubación a 32°C.
ResultadosLos resultados de este estudio indican que enjuagues bucales con CHX 0,1%; CHX 0,12%; CHX 0,05% + CPC 0,05%; CHX 0,12% + CPC 0,05% y CPC 0,075% ejercen un efecto antifúngico frente a C. albicans y R. mucilaginosa. CHX 0,1% dio lugar a la mayor zona de inhibición para C. albicans y R. mucilaginosa (25,65±2,39mm y 40,05±3,31mm). El enjuague con aceites esenciales no tuvo actividad antifúngica alguna. El análisis estadístico no mostró diferencia entre los enjuagues bucales CHX 0,1%; CHX 0,12% y CHX 0,12% + CPC 0,05% (p=0,0001) frente a C. albicans y R. mucilaginosa.
ConclusionesLos enjuagues bucales con CHX mostraron una mejor actividad antifúngica contra C. albicans y R. mucilaginosa que los restantes enjuagues estudiados.
Candida albicans and Rhodotorula mucilaginosa are yeasts of clinical importance in the oral cavity. In immunocompromised patients they can cause some pathologies that must be controlled with antimicrobials.
AimsTo evaluate and compare the antimicrobial efficacy of commercially available mouthrinses against strains of C. albicans and R. mucilaginosa.
MethodsThe six mouthwashes studied in vitro were formulated (alone or in combination) with chlorhexidine (CHX) 0.12%, CHX 0.1%, CHX 0.05%, cetylpyridinium chloride (CPC) 0.075%, CPC 0.05%, and essential oils. Ten C. albicans and R. mucilaginosa isolates each were studied. The agar diffusion method (Mueller Hinton II), with incubation at 32°C was used to evaluate the antifungal activity.
ResultsThe results of this study indicate that mouthwashes with CHX 0.1%, CHX 0.12%, CHX 0.05% + CPC 0.05%, CHX 0.12% + CPC 0.05% and CPC 0.075% have an antifungal effect against C. albicans and R. mucilaginosa. CHX 0.1% led to the broadest inhibition zone for C. albicans and R. mucilaginosa (25.65±2.39mm and 40.05±3.31mm). Essential oils did not show any antifungal activity. Statistical analysis showed no statistical difference between mouth rinses CHX 0.1%, CHX 0.12% and CHX 0.12% + CPC 0.05% (p=0.0001) against C. albicans and R. mucilaginosa.
ConclusionsMouthwashes with CHX showed higher antifungal activity against C. albicans and R. mucilaginosa than other mouthwashes studied.
El desequilibrio de la microbiota en la cavidad oral facilita la aparición de enfermedades en los tejidos orales blandos y duros y es fundamento básico de la odontología actual29, ya que la salud oral contribuye a la salud general y es un componente esencial de la calidad de vida39. El rol microbiano en el desarrollo de enfermedades bucodentales ha sido ampliamente descrito en la literatura8,16,26.
Candida albicans es la levadura más importante y prevalente en la mucosa oral; se asocia a candidiasis oral, principalmente en individuos inmunocomprometidos13,21. Las lesiones producidas por C. albicans pueden ser confundidas con otras lesiones de etiología diferente, por lo que su diagnóstico debe ser preciso9,30. Otra levadura aislada en la cavidad oral, de menor patogenicidad que C. albicans, es Rhodotorula mucilaginosa, una levadura pigmentada que no solo coloniza al ser humano, sino también a otros mamíferos; también puede aislarse de suelos o lagos6. El primer reporte documentado de fungemia por R. mucilaginosa data de 1960, asociada a infecciones en catéteres venosos, aunque pocos casos clínicos han sido reportados23,43. Además, ha sido asociada a úlceras orales crónicas20 y a colonización de conductos radiculares de dientes infectados22,24. Ambas especies, C. albicans y R. mucilaginosa, son aisladas de la cavidad oral15,27. En condiciones normales estas levaduras coexisten con otros microorganismos de la microbiota oral normal y no causan enfermedad9. Sin embargo, los cambios en el entorno oral o sistémico pueden resultar en un crecimiento excesivo de estas especies, que puede conducir a una infección33. Estos cambios incluyen inmunosupresión (inducida por fármacos o enfermedad), desequilibrio en la microbiota oral (secundario a la terapia con antibióticos), hiposalivación (inducida por fármacos, enfermedad o radioterapia) y daño tisular local (por ejemplo, mucositis secundaria a quimioterapia o terapia de radiación)33. Los enjuagues bucales con actividad antifúngica son asequibles y provocan menos efectos secundarios que otros tratamientos, lo que promueve su uso como preventivos o coadyuvantes en el tratamiento de las micosis orales18,31,42. Los antifúngicos incorporados en productos de enjuague bucal han sido propuestos recientemente como coadyuvantes a los antifúngicos tópicos14 y entre ellos está el digluconato de clorhexidina (CHX), que tiene la capacidad de inhibir la adherencia de C. albicans19,44. Las propiedades de otros agentes como el cloruro de cetilpiridinio (CPC) y los aceites esenciales presentes en enjuagues bucales no han sido evaluados adecuadamente para R. mucilaginosa5.
El objetivo de este estudio fue evaluar y comparar la eficacia antifúngica de seis enjuagues bucales comerciales frente a algunos aislamientos de C. albicans y R. mucilaginosa.
Materiales y métodosDiseño del estudioPara determinar la sensibilidad antifúngica a los seis enjuagues bucales comerciales estudiados se seleccionaron diez aislamientos de C. albicans y diez de R. mucilaginosa del Banco de Cepas del Instituto de Microbiología Clínica de la Universidad Austral de Chile (aislados de pacientes con estomatitis subprotésica).
Enjuagues bucalesLos enjuagues bucales comerciales evaluados fueron los siguientes: Oralgene® (gluconato de CHX 0,1%), Perio-Aid® Tratamiento (CHX 0,12% y CPC 0,05%), Colgate® Plax (CPC 0,075%), Perio-Aid® Mantenimiento (CHX 0,05% y CPC 0,05%), Listerine® (aceites esenciales específicos) y Oralgene® (gluconato de CHX 0,12%). La tabla 1 muestra en detalle la composición de todos ellos.
Composición y marca comercial de cada uno de los enjuagues bucales estudiados
| Nombre comercial | Composición | Laboratorio fabricante |
|---|---|---|
| Oralgene® 0,10%EBuc 1 | Gluconato de clorhexidina 0,10%, vehículo aromatizado c.s.p. | Maver |
| PerioAid® TratamientoEBuc 2 | Digluconato de clorhexidina 0,12%, cloruro de cetilpiridinio 0,05%, excipientes c.s.p. | Dentaid |
| Colgate® PlaxEBuc 3 | Fluoruro de sodio 0,05%, cloruro de cetilpiridinio 0,075%, agua, glicerina, sorbitol, propilenglicol, polaxamer 407, sorbato de potasio, fluoruro de sodio, mentol, sacarina sódica, CI 17200, CI 42051 | Colgate |
| PerioAid® MantenimientoEBuc 4 | Digluconato de clorhexidina 0,05%, cloruro de cetilpiridinio 0,05%, excipientes c.s.p. | Dentaid |
| Listerine® ZeroEBuc 5 | Agua, timol, eucaliptol, salicilato de metilo, mentol, propilenglicol, laurilsulfato de sodio, sorbitol, poloxámero 407, sacarina sódica, sucralosa, benzoato de sodio, ácido benzoico, sabor CI 42053 | Johnson & Johnson |
| Oralgene®EBuc 6 | Gluconato de clorhexidina 0,12%, vehículo aromatizado sin colorantes y sin alcohol c.s.p. | Maver |
c.s.p.: cantidad suficiente para; EBuc: enjuague bucal.
Suspensión fúngica. Para cada cepa de C. albicans y de R. mucilaginosa se preparó una suspensión en suero fisiológico estéril con un estándar de turbidez determinado por espectrofotometría igual a 0,5 Mc Farland (1-5×106 UFC/ml)4.
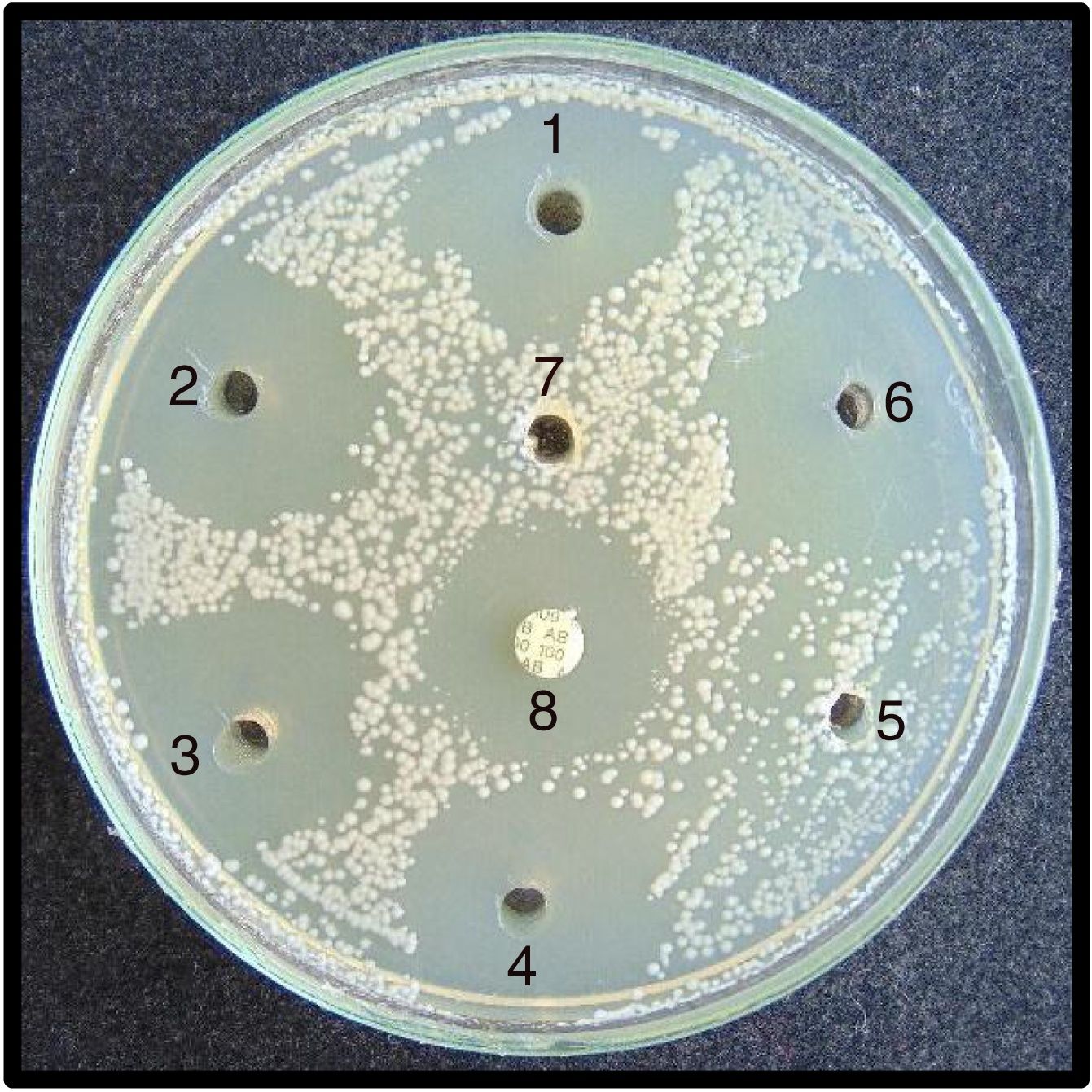
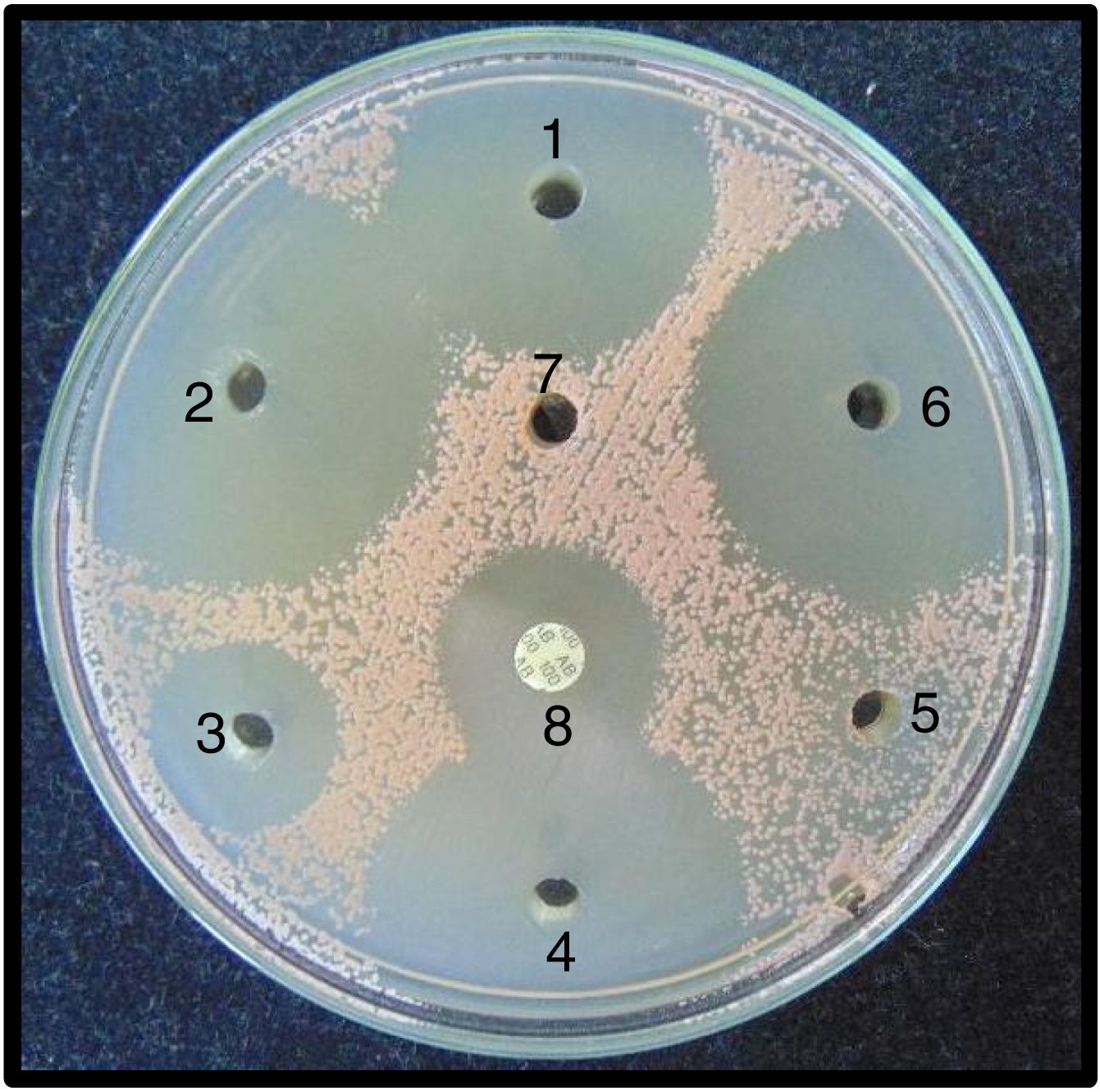
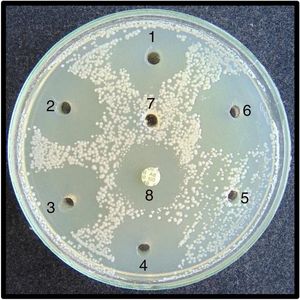
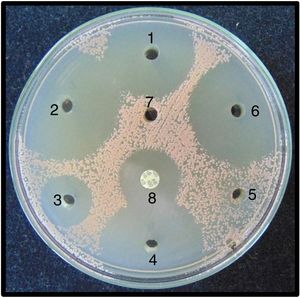
Pruebas de sensibilidad. Para las pruebas de sensibilidad se prepararon placas con 20ml de agar Mueller Hinton II (BBLTM-211438). Las placas, una vez gelificadas, fueron incubadas a 32°C durante 24 h para comprobar su esterilidad. Mediante un sacabocados estéril de acero de 5mm de diámetro se hicieron en cada placa siete agujeros a una distancia aproximada de 1 cm del borde de la placa. Tanto los aislamientos de C. albicans como los de R. mucilaginosa fueron sembrados, de manera separada, en las placas de agar Mueller Hinton mediante torundas estériles impregnadas en la suspensión de 0,5 Mc Farland de cada uno de los aislamientos. Las siembras fueron realizadas moviendo la torunda sobre la superficie del agar de manera uniforme y en tres direcciones distintas, para sembrar toda la superficie del agar. Posteriormente, se depositaron en los pocillos con una micropipeta 8μl de cada enjuague bucal para evaluar su actividad antifúngica. El orden de inoculación de los enjuagues del pocillo 1 al 6 fue como sigue: gluconato de CHX 0,1% (Oralgene®), CHX 0,12% más CPC 0,05% (Perio-Aid® Tratamiento), CPC 0,075% (Colgate Plax®), CHX 0,05% más CPC 0,05% (Perio-Aid® Mantenimiento), aceites esenciales específicos (Listerine®) y gluconato de CHX 0,12% (Oralgene®). El pocillo 7 fue inoculado con suero fisiológico estéril (control negativo). Como control positivo se utilizó un disco de anfotericina B (BioRad® 100 μg). Además, se sembraron placas con los mismos aislamientos para valorar si el fluoruro de sodio al 0,05% podía influir en la inhibición del crecimiento.
Evaluación de la actividad antifúngicaDespués de una incubación a 32°C durante 48 h para C. albicans y de 72 h para R. mucilaginosa se midieron los diámetros de los halos de inhibición formados alrededor de los pocillos con un pie de rey (calibre); las medidas, tomadas por dos observadores, fueron registradas en milímetros. Todos los ensayos se realizaron por duplicado.
Análisis estadísticoLos datos obtenidos sobre el tamaño del halo de inhibición fueron analizados mediante las pruebas Shapiro-Wilk para contrastar la normalidad y la no paramétrica U de Mann-Whitney (pareada). Se utilizó el software R y se estableció una significación estadística de α = 0,0536.
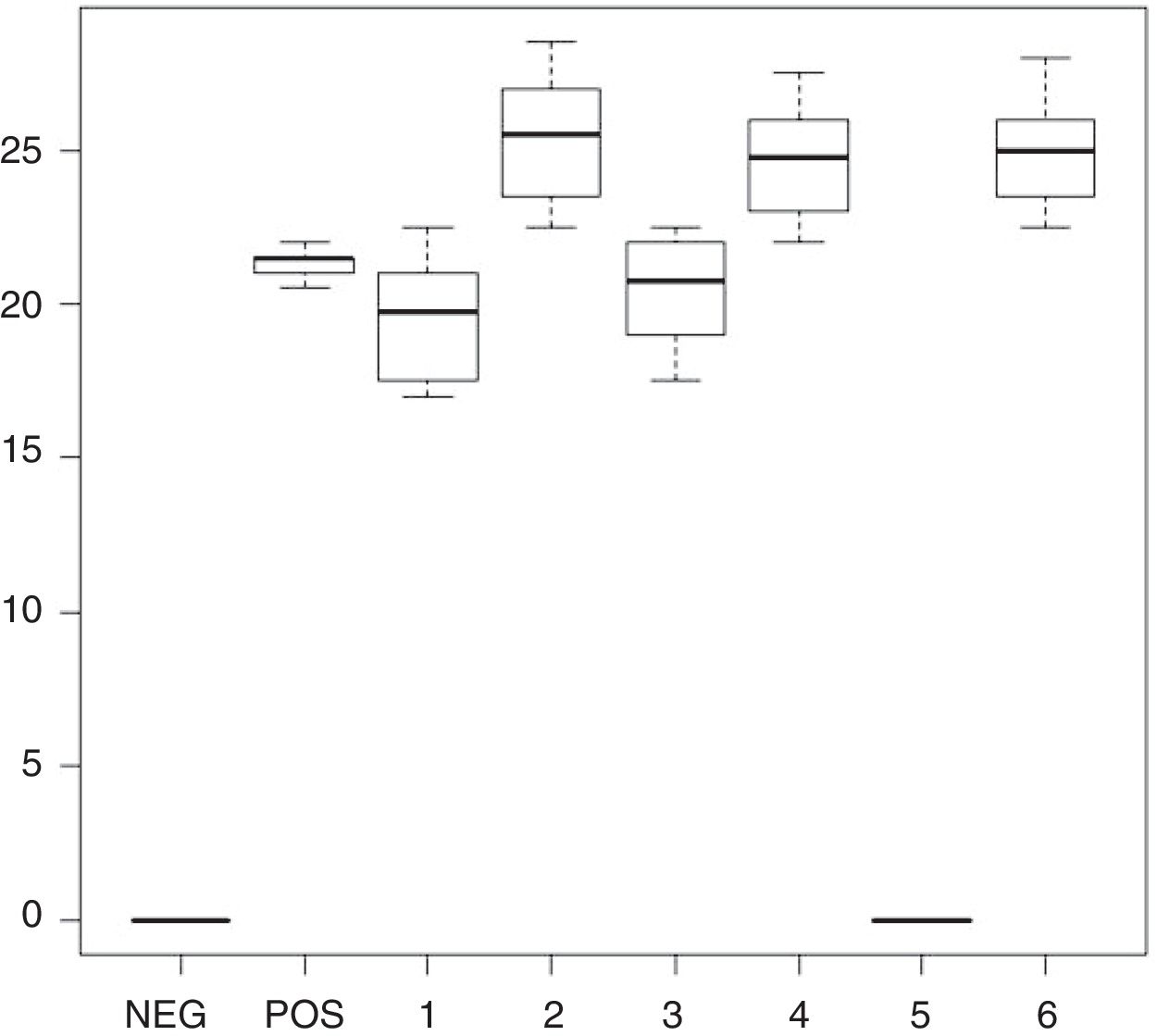
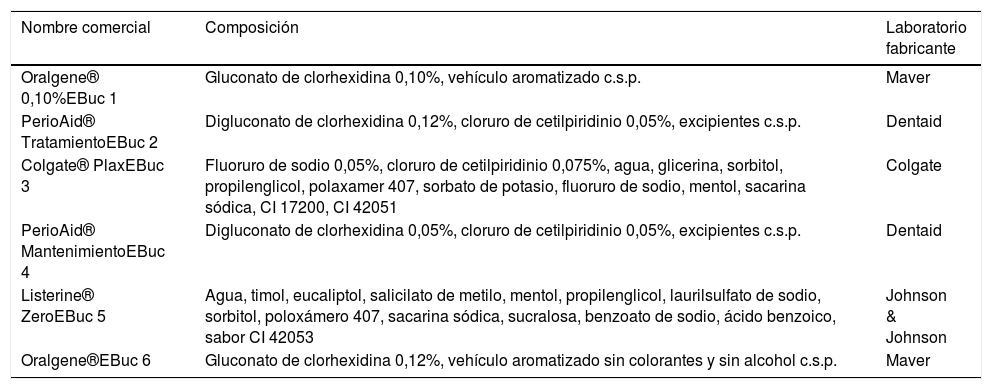
ResultadosFrente a C. albicans, los enjuagues bucales 1, 2, 3, 4 y 6 dieron lugar a áreas de inhibición que fluctuaron desde los 0mm en el enjuague 5 y los 29mm en los enjuagues 2, 4 y 6. El 5 no presentó acción inhibitoria alguna. Los promedios y desviaciones estándar de las áreas de inhibición de cada enjuague se presentan en la tabla 2. Los diámetros de inhibición producidos por ellos y el control positivo sobre C. albicans se muestran en la figura 1.
Diámetro y desviación estándar de los halos de inhibición del crecimiento de C. albicans con cada enjuague bucal
| EBuc | Halos (mm) | Valor promedio (mm) | Desviación estándar |
|---|---|---|---|
| 1 | 14-25 | 19,55 | 2,74 |
| 2 | 21-29 | 25,65 | 2,39 |
| 3 | 14-24 | 20,5 | 2,66 |
| 4 | 18-29 | 24,6 | 2,62 |
| 5 | No inhibición | No inhibición | No inhibición |
| 6 | 19-29 | 25,05 | 2,66 |
EBuc: enjuague bucal.
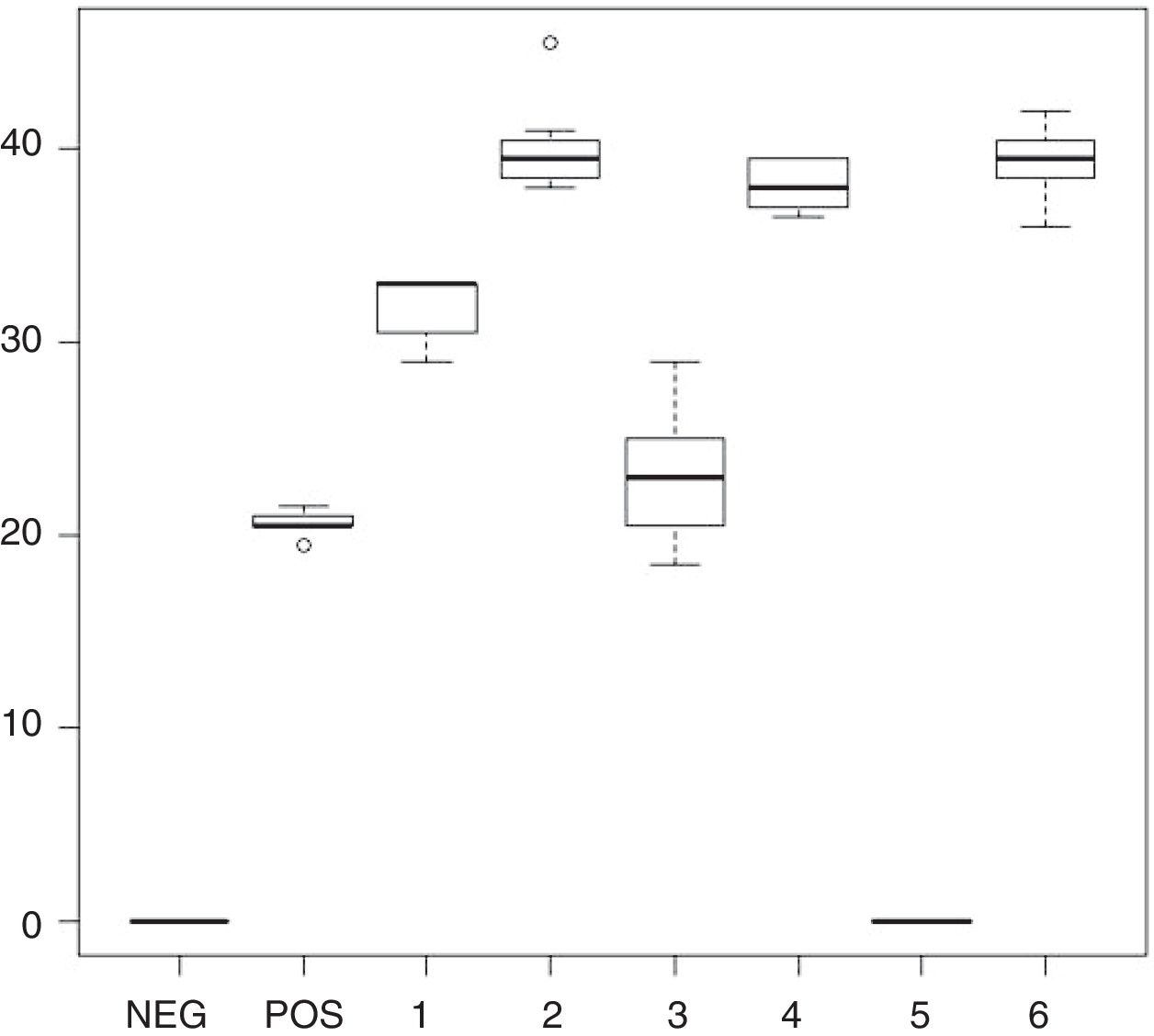
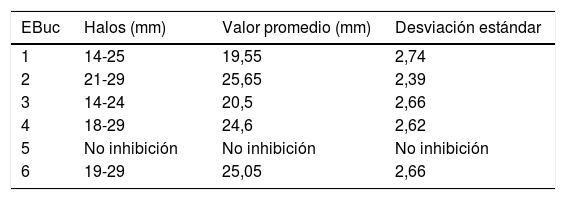
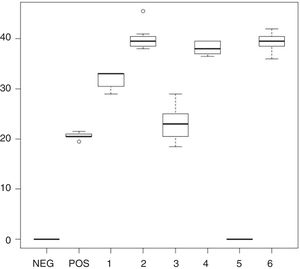
En R. mucilaginosa los halos de inhibición alrededor de los pocillos con los enjuagues 1, 2, 3, 4 y 6 fluctuaron entre 0mm en el 5 y 46mm de diámetro en el enjuague 2. Al igual que con C. albicans, con el enjuague 5 no hubo zona de inhibición. Los promedios y desviaciones estándar de las zonas de inhibición por cada uno se presentan en la tabla 3. Los diámetros de inhibición producidos por los enjuagues y el control positivo sobre R. mucilaginosa se muestran en la figura 2.
Diámetros y desviación estándar de los halos de inhibición del crecimiento de R. mucilaginosa con cada uno de los enjuagues bucales
| EBuc | Halos (mm) | Valor promedio (mm) | Desviación estándar |
|---|---|---|---|
| 1 | 28-35 | 32 | 2,15 |
| 2 | 33-46 | 40,05 | 3,31 |
| 3 | 17-30 | 23,3 | 3,79 |
| 4 | 35-41 | 38,15 | 1,89 |
| 5 | No inhibición | No inhibición | No inhibición |
| 6 | 34-44 | 39,25 | 2,73 |
EBuc: enjuague bucal.
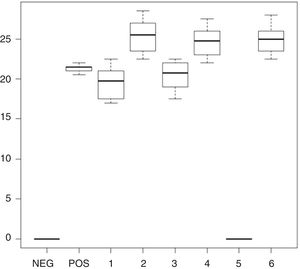
Entre los enjuagues 2, 4 y 6 no se observaron diferencias estadísticamente significativas en los diámetros de inhibición, ni para C. albicans ni para R. mucilaginosa. En el caso de Rhodotorula, se observaron diferencias significativas entre los enjuagues 1, 3 y 5. El test de Shapiro-Wilk arrojó un resultado estadísticamente significativo para la distribución no normal de los halos de inhibición. El compuesto fluoruro de sodio al 0,05% no inhibió el crecimiento de los aislamientos de Candida y Rhodotorula, por lo que no ejerce un efecto sinérgico con los compuestos CHX y CPC. Las áreas de inhibición producidas por los enjuagues sobre C. albicans y R. mucilaginosa se observan en las figuras 3 y 4, respectivamente.
Los enjuagues bucales se han usado durante siglos, pero en los últimos años sus componentes han sido sometidos a diversos estudios de investigación científica y clínica11,17,40. Asimismo, los consumidores se enfrentan en el mercado a una gran variedad de productos de este tipo y se requiere la asistencia profesional para su selección, acorde con la necesidad de cada persona37. Los agentes antimicrobianos incorporados a cada enjuague bucal han surgido como coadyuvantes a los antifúngicos tópicos14. Entre ellos se encuentran la CHX, el CPC y los aceites esenciales. La CHX es un agente antiséptico con actividad contra diferentes organismos como bacterias, virus y diferentes tipos de hongos, incluido C. albicans, lo que demuestra su amplio espectro de actividad antimicrobiana1,3,10.
Nuestro estudio muestra que los enjuagues que contienen CHX 0,12%, CHX 0,1% o CHX combinada con CPC inhiben el crecimiento de C. albicans y de R. mucilaginosa, y que su efecto es estadísticamente mayor al de enjuagues bucales que solo contienen CPC. Estos resultados son similares a los de estudios previos, en los que se describe la actividad antifúngica de la CHX12,32,34,35. Sin embargo, no hay estudios previos en los que se haya descrito la actividad antifúngica frente a R. mucilaginosa.
Aunque la mayoría de las publicaciones se han centrado en la eficacia de CHX contra C. albicans, nuestro estudio es el primero en reportar actividad antifúngica frente a R. mucilaginosa. Fu et al.12 encontraron en un estudio in vitro que los enjuagues bucales que contienen CHX y CPC son efectivos contra microorganismos en forma planctónica procedentes de saliva y que tienen actividad frente a C. albicans, en la que superan incluso al fluconazol, por lo que podrían ser usados como una alternativa terapéutica en la candidiasis oral. Quirynen at al.32, en un estudio in vitro de enjuagues bucales de CHX con concentraciones de 0,12% y 0,1% frente a aislamientos de C. albicans aislados de pacientes con periodontitis, concluyen que no existen diferencias significativas entre ambas concentraciones, resultados que coinciden con los obtenidos en el presente estudio, que solo muestra diferencias significativas en los enjuagues bucales con CHX 0,05% y CPC 0,05% (PerioAid® Mantenimiento). Los enjuagues analizados que contienen CPC presentaron actividad antifúngica, hallazgo que coincide con lo descrito por Radford et al.34 en su estudio de la actividad antimicrobiana de un enjuague bucal que contenía CPC 0,05%: concluyeron que podía evitar la colonización por enterococos y levaduras en la cavidad oral. Por otra parte, Giuliana et al.14, al estudiar la actividad antimicrobiana sobre distintas especies de bacterias y levaduras (entre ellas, C. albicans) de otro enjuague bucal que contenía CPC 0,05%, determinaron que el enjuague presentaba una actividad antifúngica superior incluso a los enjuagues bucales con CHX 0,2%.
Por otro lado, Talebi et al.38 determinaron in vitro el efecto de enjuagues bucales químicos y naturales frente a C. albicans y encontraron diferencias significativas por una mejor actividad de CPC en comparación con CHX y otros compuestos de origen natural. Estos resultados difieren de los encontrados en nuestro estudio, en el que los enjuagues con CHX presentaron un efecto significativamente mayor al de CPC (Colgate® Plax, PerioAid® Tratamiento, PerioAid® Mantenimiento) tanto para C. albicans como para R. mucilaginosa; sin embargo, están en concordancia con los obtenidos por Almas et al.2, que determinaron que CPC presenta actividad antifúngica, aunque estadísticamente menor a la CHX, y el estudio de Teh et al.40, quienes determinaron el efecto sinérgico de CPC y aceites esenciales contenidos en un enjuague bucal con actividad frente a C albicans.
Fu et al.12 investigaron in vitro el efecto inhibitorio sobre C. albicans y C. krusei de enjuagues bucales comerciales y concluyeron que aquellos que contienen CPC son efectivos, aunque su actividad antifúngica fue menor a la CHX, pero superior a la de los aceites esenciales. Esto coincide con lo publicado en la literatura por otros autores1,7 y con los hallazgos del presente estudio. El enjuague bucal Colgate® Plax, que contiene CPC 0,075%, fue incluido en nuestro estudio, pero su actividad antifúngica no ha sido estudiada en trabajos similares.
El enjuague bucal Listerine® Zero contiene en su composición varios aceites esenciales extremadamente volátiles, como el mentol, el eucaliptol y el timol, que podrían tener actividad antifúngica, y su mecanismo de acción contra células bacterianas implica la desnaturalización de las proteínas, con el consiguiente daño sobre la membrana celular y la fuga de los componentes intracelulares41. En este estudio no se observó actividad inhibitoria de Listerine® Zero frente a C. albicans ni R. mucilaginosa. Este hallazgo contrasta con lo publicado por Ramage et al.35, que describen en Listerine® un efecto antifúngico similar al de la hexetidina 0,1% sobre aislamientos de C. albicans tomados de pacientes con candidiasis oral. Un estudio similar fue realizado por Meiller et al.25, quienes observaron una mejor eficacia de CHX y Listerine®, en comparación con otros enjuagues bucales, frente a levaduras, entre ellas, C. albicans. Por su parte, Fu et al.12, en un estudio in vitro sobre la eficacia de enjuagues bucales sobre biopelículas, observaron actividad antifúngica de Listerine®, aunque estadísticamente inferior a la de otros enjuagues que contienen CHX o CPC. Paulone et al.28, en un estudio sobre la actividad antifúngica de siete enjuagues bucales, concluyeron que Listerine® Zero no presentaba actividad antifúngica contra C. albicans debido, al parecer, a la alta volatilidad de sus componentes, como el mentol y el eucaliptol. Sin embargo, no existe evidencia que sustente esta hipótesis, por lo que resultaría interesante efectuar estudios al respecto. Los resultados de Paulone et al.28 coinciden con los obtenidos en el presente estudio.
En conclusión, los resultados indican que los enjuagues bucales que contienen CHX y CPC tienen efecto inhibitorio sobre C. albicans y R. mucilaginosa. Los enjuagues bucales que contienen CHX (PerioAid® tratamiento, PerioAid® Mantenimiento, Oralgene® 0,12% y Oralgene® 0,1%) son estadísticamente más eficaces que los que contienen solo CPC (Colgate® Plax). Por otro lado, Listerine® (con aceites esenciales) no mostró efecto antifúngico alguno contra estas levaduras. Además, dado que nuestros datos se generaron in vitro, se necesitarían ensayos clínicos in vivo para validar estos resultados.
Conflicto de interesesLos autores manifiestan que no existen de manera directa ni indirecta conflictos de interés.