La diabetes mellitus es un problema de salud pública en México. La tendencia de la enfermedad es creciente y del año 2000 al 2017 se confirmaron 7,32 millones de casos nuevos. Las micosis pulmonares son una de las posibles complicaciones de mayor gravedad.
ObjetivosDescribir la frecuencia y las características clínicas de pacientes con diagnóstico de micosis pulmonar e identificar los factores de riesgo implicados en esta entidad.
MétodosEstudio de casos-controles pareado 1:1-3 para género y edad (± 5 años). Se incluyeron pacientes con micosis pulmonares (mucormicosis, histoplasmosis, coccidioidomicosis, blastomicosis, aspergilosis, criptococosis, paracoccidioidomicosis) y se estudiaron los factores de riesgo presentes en cada uno de ellos.
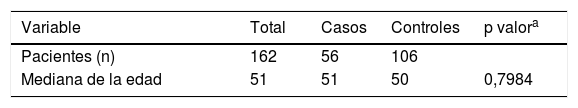
ResultadosDe los 162 pacientes, 56 presentaban una micosis pulmonar y 106 fueron controles; la mediana de la edad fue 51 y 50 años para los casos y controles, respectivamente. En el modelo de regresión logística múltiple los pacientes con diabetes mellitus presentaron una razón de momios (RM) de 8,3, p<0,001, y el antecedente de tuberculosis una RM de 8,8, p <0,001.
ConclusionesLos resultados muestran que el 52% de los casos con micosis pulmonares tuvieron la diabetes mellitus como factor de riesgo, siendo relevante para estas micosis, que se diagnostican en etapas avanzadas y tienen una alta mortalidad.
Diabetes mellitus is a public health problem in Mexico, and the trend of the disease is increasing. From 2000 to 2017, 7.32 million new cases were diagnosed, with pulmonary mycoses being one of the most serious complications.
AimsTo describe the frequency and the clinical characteristics of patients diagnosed with pulmonary mycoses, and to identify the risk factors associated with this entity.
MethodsCase–control study, paired by gender (1:1-3) and age (± 5 years), that analyzed patients with pulmonary mycosis (mucormycosis, histoplasmosis, coccidioidomycosis, blastomycosis, aspergillosis, cryptococcosis, paracoccidioidomycosis) and studied the risk factors present in each patient.
ResultsFrom the 162 patients studied, 56 suffered pulmonary mycosis and 106 were controls. The median of the age was 51 and 50 years for the cases and for the controls, respectively. Multiple logistic regression analysis showed that patients with diabetes mellitus had an odds ratio of 8,3 (p < 0.001), and patients with a history of tuberculosis had an odds ratio of 8,8 (p < 0.001).
ConclusionsOur results show that 52% of the patients with pulmonary mycoses had a history of diabetes mellitus. Diabetes mellitus is a relevant risk factor for pulmonary mycoses, which are usually diagnosed in advanced stages and have a high mortality.
En los últimos años, los valores de prevalencia a nivel mundial de la diabetes mellitus (DM) se han incrementado. En México es un problema de salud pública, siendo la 11.ª causa de morbilidad y la segunda causa de mortalidad en la población adulta. La tendencia es creciente: del año 2000 al 2017 se confirmaron 7,32 millones de casos nuevos, con una prevalencia del 9,4%9,16,18,19,23,24.
Las micosis pulmonares, con una alta mortalidad, han aumentado globalmente debido a las enfermedades crónicas degenerativas e inmunosupresoras. En México las micosis no son de notificación obligatoria, por lo que no se cuenta con datos sobre la incidencia y prevalencia13,22. Las infecciones del tracto respiratorio incrementan el número de hospitalizaciones en pacientes con DM, siendo las infecciones por hongos una de las principales causas10. Una vez inhaladas las esporas se inicia la interacción con los macrófagos presentes en el pulmón, lo que genera la producción de TNF-α, IL-1, 6 y 12 e INF-γ, y el desarrollo de una respuesta Th2, con activación de linfocitos T CD4 y CD8 que eliminan la infección. Los pacientes diabéticos presentan valores reducidos de IL-1 y TNF-α con disminución de la respuesta inmunológica expresada por una baja migración de células fagocíticas al sitio de inflamación, lo que los hace susceptibles a infecciones oportunistas6,10.
Las micosis pulmonares endémicas son la histoplasmosis, la coccidioidomicosis, la paracoccidioidomicosis, la blastomicosis y la esporotricosis, con predominio en ciertas regiones del mundo, y que pueden afectar también a pacientes inmunocompetentes. Las micosis oportunistas, como la mucormicosis, la aspergilosis, la candidiasis y la criptococosis, se presentan principalmente en pacientes con VIH/sida, pacientes con neoplasias y aquellos en tratamiento continuado de corticoides. Se han descrito diferentes factores de riesgo para el desarrollo de este tipo de infecciones, como la DM, las enfermedades del tejido conectivo, la enfermedad renal crónica y el antecedente de tuberculosis5,12,14,17.
Este estudio tiene por objetivo describir la frecuencia y las características clínicas de pacientes con diagnóstico de micosis pulmonar e identificar los factores de riesgo implicados en esta entidad.
Material y métodosSe llevó a cabo un estudio retrospectivo, observacional, de tipo analítico de casos y controles en un hospital de asistencia pública de la ciudad de México en el periodo comprendido del año 2000 al 2015. Se realizó un protocolo de diagnóstico de micosis pulmonares en pacientes con factores de riesgo de inmunosupresión y que presentaran características clínicas y radiológicas compatibles con compromiso pulmonar. Los casos y los controles fueron pareados 1:1-3 para género y edad (± 5 años). Se consideraron casos aquellos pacientes que presentaron un cultivo positivo para uno de los siguientes patógenos: Histoplasma capsulatum, Aspergillus fumigatus, Coccidioides immitis, Cryptococcus neoformans, Blastomyces dermatitidis, Rhizopus oryzae, Actinomyces israelii y Paracoccidioides brasiliensis. Los controles fueron conformados por pacientes con presencia de neumonía o tuberculosis pulmonar en quienes se descartó la presencia de micosis.
Las muestras para cultivo de hongos fueron obtenidas de secreciones bronquiales mediante broncoscopia y las muestras de tejido pulmonar y pleural mediante toracotomía y mediastinoscopia. El tejido obtenido se sembró en medio agar glucosado de Sabouraud y se incubó durante 7 días a 28°C; los cultivos se observaron macroscópica y microscópicamente para valorar la presencia de levaduras y se realizaron tinciones con ácido periódico de Schiff, hierro coloidal y azul de algodón.
Se calcularon las frecuencias absolutas y las relativas totales de variables socio demográficas y algunas comorbilidades. La variable edad es presentada con su mediana, además de que se realiza una prueba de rangos de Wilcoxon ya que no cumple con el supuesto de normalidad. En las otras variables dicotómicas se realiza la prueba Chi cuadrado de Pearson para ver si existe asociación en la distribución entre casos y controles. Se realizó un modelo de regresión logística condicional para identificar factores de riesgo asociados a micosis pulmonar: género, edad, DM2, antecedente de tuberculosis pulmonar, VIH/sida, antecedente de enfermedad renal, insuficiencia hepática, desnutrición y antecedente de trasplante. En el modelo únicamente se incluyeron las variables que resultaron ser estadísticamente significativas (p <0,05).
ResultadosDe los 162 pacientes estudiados, 56 presentaban micosis pulmonar. Los microorganismos aislados fueron H. capsulatum (14 casos; 25%), A. fumigatus (11 casos; 19,6%), C. immitis (10 casos; 17,85%), C. neoformans (7 casos; 12,5%), B. dermatitidis (6 casos; 10,7%), R. oryzae (3 casos; 5,4%), A. israelii (3 casos; 5,4%) y P. brasiliensis (2 casos; 3,6%). De los 106 pacientes restantes (controles sin micosis), 70 (66%) presentaban neumonía y 33 (31,13%) tuberculosis pulmonar activa diagnosticada de manera reciente y en tratamiento farmacológico. La mediana de la edad fue de 51 y 50 años para los casos y los controles, respectivamente. En la tabla 1 se presentan los datos socio-demográficos. El género masculino fue el predominante (71,6%), con un 75% y un 69,8% para casos y controles, respectivamente (p=0,486). Veintinueve (51,8%) de los pacientes con micosis pulmonar tenía diagnóstico previo de DM2; 23 (79,3%) de estos pacientes presentaron glucemias superiores a 300mg/dl y valores de HbA1c del 15%. En 6 (20,7%) de los casos se presentó microangiopatía diabética. Cuarenta y cuatro (78,6%) de los casos no tenía antecedente de tuberculosis, mientras que 12 (21,4%) sí presentaban esta enfermedad.
Datos sociodemográficos y comorbilidades según casos y controles
| Variable | Total | Casos | Controles | p valora | |
|---|---|---|---|---|---|
| Pacientes (n) | 162 | 56 | 106 | ||
| Mediana de la edad | 51 | 51 | 50 | 0,7984 |
| Variable | n (%) | ||||
| Total | Casos | Controles | p valorb | ||
| Sexo | |||||
| Mujer | 46 (28,4) | 14 (25) | 32 (30,2) | ||
| Hombre | 116 (71,6) | 42 (75) | 74 (69,8) | 0,486 | |
| Diabetes mellitus tipo 2 | |||||
| No | 121 (74,7) | 27 (48,2) | 94 (88,7) | ||
| Sí | 41 (25,3) | 29 (51,8) | 12 (11,3) | <0,001 | |
| Antecedentes de tuberculosis (cavernas) | |||||
| No | 147 (90,7) | 44 (78,6) | 103 (97,2) | ||
| Sí | 15 (9,3) | 12 (21,4) | 3 (2,8) | <0,001 | |
| VIH/sida | |||||
| No | 143 (88,3) | 43 (76,8) | 100 (94,3) | ||
| Sí | 19 (11,7) | 13 (23,2) | 6 (5,7) | 0,001 | |
| Desnutrición | |||||
| No | 126 (77,8) | 24 (42,9) | 102 (96,2) | ||
| Sí | 36 (22,2) | 32 (57,1) | 4 (3,8) | <0,001 | |
| Trasplante | |||||
| No | 156 (96,3) | 51 (91,1) | 105 (99,1) | ||
| Sí | 6 (3,7) | 5 (8,9) | 1 (0,9) | 0,01 | |
| Fallo hepático | |||||
| No | 143 (88,3) | 40 (71,4) | 103 (97,2) | ||
| Sí | 19 (11,7) | 16 (28,6) | 3 (2,8) | <0,001 | |
| Enfermedad renal | |||||
| No | 140 (86,4) | 38 (67,9) | 102 (96,2) | ||
| Sí | 22 (13,6) | 18 (32,1) | 4 (3,8) | <0,001 |
La variable edad es presentada como la mediana. Los datos para las variables dicotómicas son presentados como la frecuencia absoluta y relativa (porcentaje).
En la tabla 2 se muestran los resultados del análisis de regresión logística de factores de riesgo asociados a micosis pulmonar. En los pacientes con DM2 la razón de momios (RM) fue de 8,3 (IC del 95%, 3,5-19,4); en el caso de la tuberculosis, este valor era de 8,8 (IC del 95%, 2,1-37,5). Estos datos nos indican que la DM2, así como la tuberculosis, se asocian con la presencia de micosis pulmonar. Las variables VIH/sida, desnutrición, fallo hepático y enfermedad renal crónica fueron analizadas en el modelo de regresión logística pero no resultaron ser estadísticamente significativas. En los casos encontrados con antecedente de trasplante, enfermedad renal crónica, HIV/sida, insuficiencia hepática y desnutrición los resultados no fueron estadísticamente significativos.
Modelo de regresión logística de factores de riesgo asociados a micosis pulmonar
| Variable | RM | IC del 95% | p valor |
|---|---|---|---|
| Sexo | |||
| Mujer | 1,00 | ||
| Hombre | 1,26 | 0,53-2,97 | 0,605 |
| Edad | 0,98 | 1,16-2,30 | 0,185 |
| Diabetes mellitus tipo 2 | |||
| No | 1,00 | ||
| Sí | 8,26 | 3,52-19,36 | <0,001a |
| Antecedentes de tuberculosis | |||
| No | 1,00 | ||
| Sí | 8,78 | 2,06-37,50 | 0,003a |
IC: intervalo de confianza; RM: razón de momios.
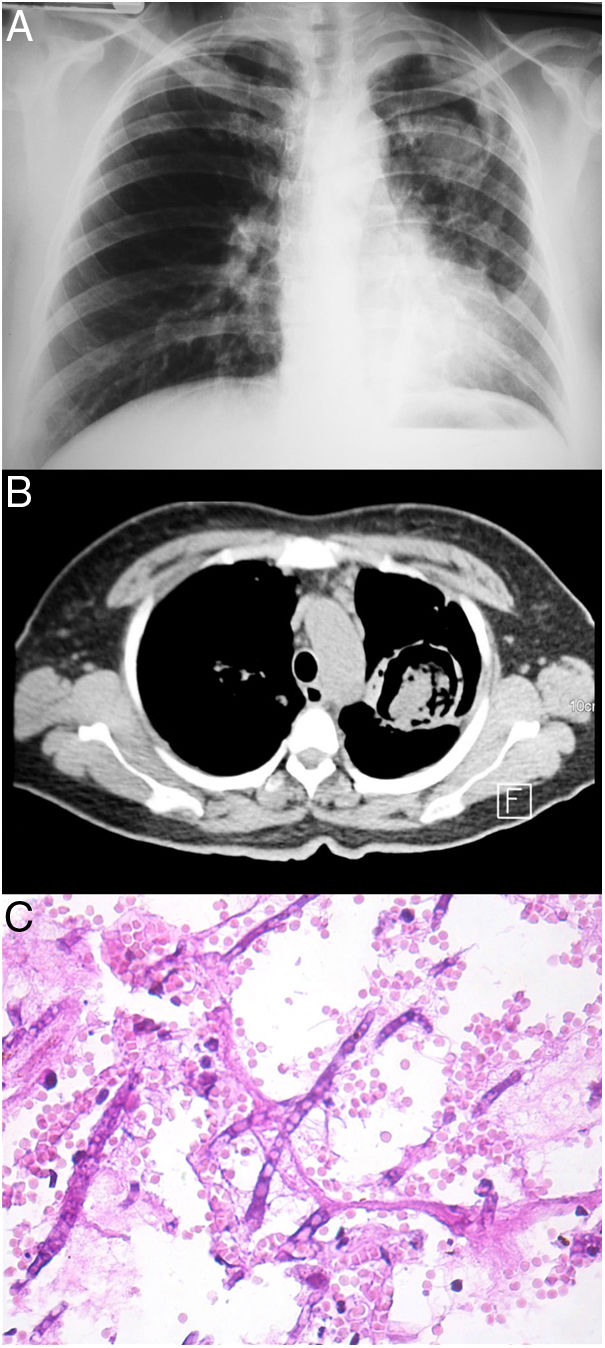
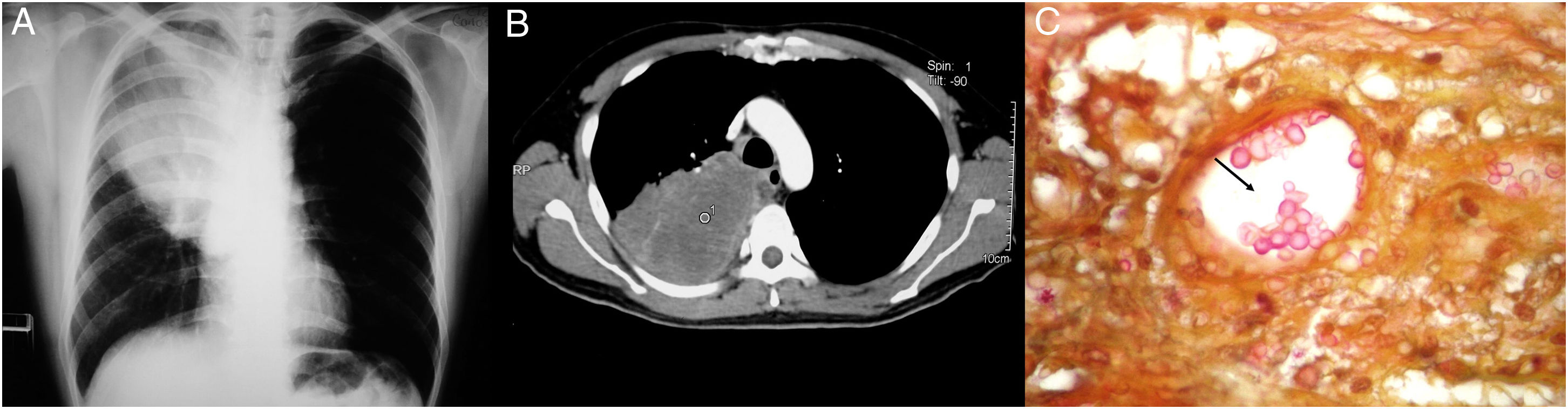
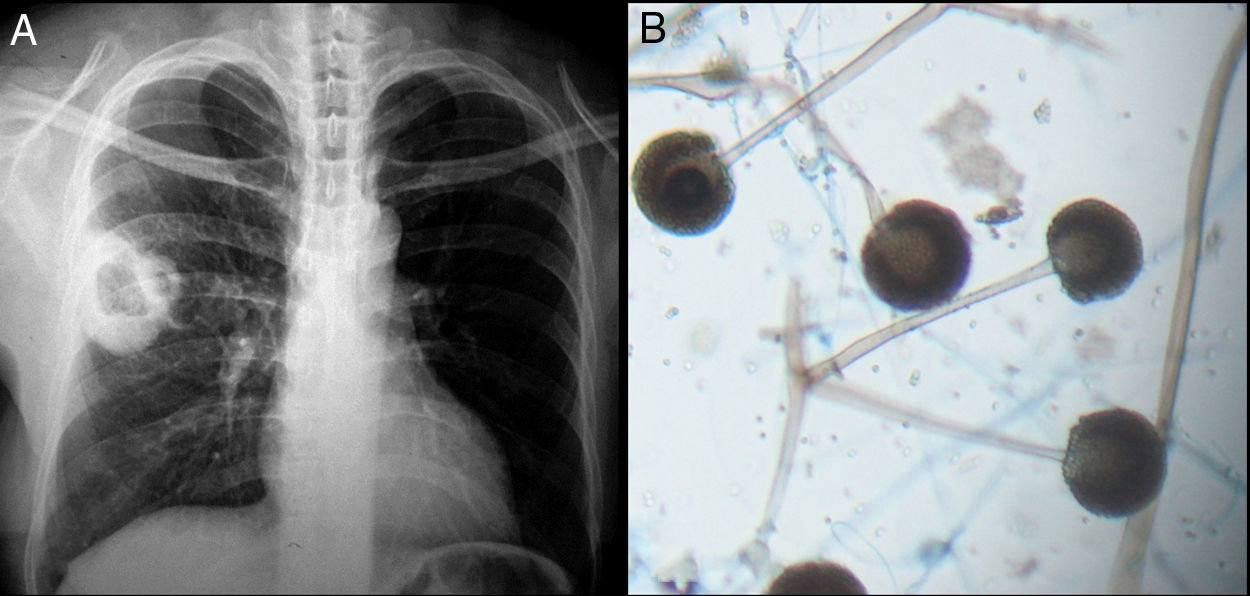
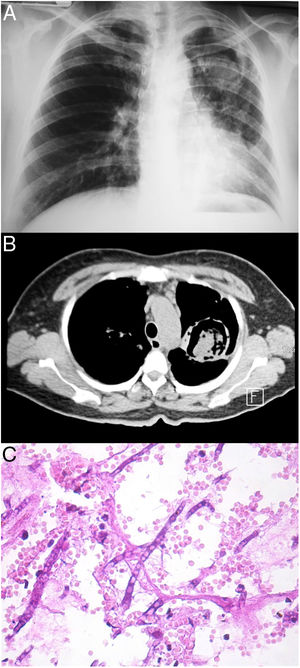
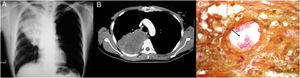
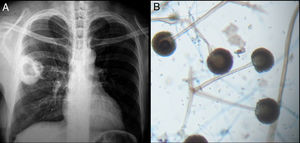
Todos los pacientes diagnosticados con micosis pulmonares recibieron tratamiento con anfotericina B, fluconazol o itraconazol, con una respuesta favorable en 45 (80%) casos. En la figura 1 se muestran los hallazgos radiológicos de un paciente con aspergilosis pulmonar y en la figura 2 los de un caso de criptococosis pulmonar. Finalmente, en la figura 3 se muestran varias imágenes correspondientes a un caso de mucormicosis,
Hallazgos radiológicos y patológicos de un caso de infección por Aspergillus fumigatus. a) Radiografía de tórax con el signo de media luna localizado en la región intercleidohiliar izquierda. b) Tomografía simple de tórax con el signo del halo clásico en el aspergiloma. c) Corte histológico de pulmón con tinción PAS; se observan hifas septadas que forman ángulos de 45° (40×).
Hallazgos radiológicos y patológicos de un caso de infección por Cryptococcus neoformans. a) Radiografía de tórax con opacidad homogénea de bordes mal definidos, localizada en la región intercleidohiliar y parahiliar derecha. b) Tomografía simple de tórax con imagen hiperdensa en lóbulo medio de pulmón derecho. c) Corte histológico de pulmón con tinción de hierro coloidal; se observan estructuras esféricas en bicapa en relación con un vaso sanguíneo (40×).
Hallazgos radiológicos y patológicos de un caso de infección por Rhizopus oryzae. a) Radiografía de tórax con opacidad heterogénea de bordes definidos en región hiliar derecha. b) Corte histológico de pulmón con tinción azul de algodón; pueden observarse rizoides, filamentos y esporangios.
La DM2ha aumentado su prevalencia en la última década y se prevé un incremento exponencial del 24,7% para el año 20308. En el hospital de concentración donde se realizó el estudio, el 2,6% del total de las consultas anuales correspondieron a pacientes diabéticos20.
Las micosis pulmonares se relacionan frecuentemente con enfermedades inmunosupresoras5,12. En el estudio realizado los pacientes con VIH/sida, trasplantes, insuficiencia hepática, enfermedad renal crónica y desnutrición englobaron el 5% de los casos, por lo que estas condiciones clínicas no marcaron una diferencia estadísticamente significativa, a diferencia de otros grupos estudiados. En nuestro estudio, se encontró que el factor de riesgo más importante para adquirir micosis pulmonar fue la DM2 (RM de 8,3; IC del 95%, 3,5-19,4); el descontrol metabólico y el mal apego al tratamiento con hipoglucemiantes fue una constante. La DM2 se asocia a una respuesta reducida de células T, neutrófilos y de la inmunidad humoral, dando lugar a la aparición de enfermedades oportunistas. El estado de hiperglucemia persistente aumenta la virulencia de los microorganismos y propicia la apoptosis de los leucocitos polimorfonucleares, situación que probablemente influyó en los casos estudiados, ya que observamos que en nuestro estudio el 79,3% de los pacientes diabéticos con micosis pulmonar presentaron valores de glucosa sérica superiores a 300 mg/dl y HbA1c del 15%2,21.
Otro factor de riesgo asociado a micosis pulmonar fue el antecedente de tuberculosis. Las personas con diabetes tienen un riesgo mayor de desarrollar tuberculosis activa en comparación con las personas que no tienen diabetes; a su vez, la tuberculosis aumenta el riesgo de micosis pulmonar, similar a lo encontrado en nuestro estudio (RM 8,8; IC del 95%, 2,1-37,5)10,22. Las variables desnutrición, fallo hepático, enfermedad renal y VIH/sida no fueron incluidas en el modelo de regresión logística ya que no resultaron estadísticamente significativas.
En cuanto a las características de la población estudiada, la mediana de la edad fue 51 años, con un predominio del sexo masculino, situación similar a la reflejada en la literatura3,7,11. La coccidioidomicosis y la paracoccidioidomicosis son endémicas del continente americano, la histoplasmosis predomina en América Central y América del Sur, mientras que la blastomicosis lo hace en el centro y sureste de Estados Unidos, con extensión a algunas regiones de Asia y África. La aspergilosis tiene una distribución mundial y Aspergillus es uno de los patógenos más frecuentemente aislado en pulmón1,3,7,12. Debido al alto índice de migración, en nuestra serie no se pudo determinar si las micosis de nuestros casos estaban relacionadas con la endemicidad. En estudios previos con pacientes diabéticos y micosis pulmonares el principal agente aislado es R. oryzae, seguido por A. fumigatus10,15. Estos datos no coinciden con los hallazgos de nuestro estudio, en el que H. capsulatum ha sido el hongo más aislado.
En pacientes que desarrollan este tipo de infecciones, establecer una sospecha diagnóstica no es fácil debido a que los cuadros clínicos son similares a aquellos de las neumopatías más frecuentes: tos productiva insidiosa al inicio, dolor torácico, disnea y hemoptisis en algunas ocasiones. En las formas crónicas de la enfermedad se presenta astenia, adinamia y pérdida de peso5,12. En estos pacientes se debe hacer una historia clínica detallada, con énfasis en las comorbilidades, el estado inmunológico y la posible exposición a estos agentes. Posteriormente, se debe realizar una serie de estudios, entre los que la tomografía axial computarizada de tórax se considera el estándar de oro para la detección de este tipo de infecciones. Con esta prueba pueden detectarse nódulos, bronquiectasias, infiltrados o cavitaciones. Deben realizarse también exámenes microbiológicos, cultivos específicos, detección de galactomanano o PCR, entre otros, que ayuden a establecer el diagnóstico correcto4,17.
El tratamiento debe realizarse con base en los hallazgos clínicos, radiológicos y tomográficos, así como con base en los resultados de estudios microbiológicos. Los principales fármacos usados son el voriconazol, la anfotericina B, la caspofungina, el itraconazol y el fluconazol; además, debe tratarse la comorbilidad que presenta el paciente. El tratamiento antimicótico dependerá del microorganismo involucrado y puede ir desde las 6-12 semanas hasta los 6 meses, con valoraciones frecuentes por parte del personal médico5. Muchos de los pacientes no responden al tratamiento adecuadamente. En nuestra serie, 11 pacientes fallecieron en el curso de su hospitalización al no responder al tratamiento farmacológico. Pasados los 6 meses de seguimiento, 3 pacientes fallecieron por complicaciones de DM y 2 por VIH/sida; la falta de sospecha a la llegada del paciente retrasa el diagnóstico y conduce a una rápida progresión de la enfermedad. El estado de inmunosupresión que produce la DM2 y, a su vez, el control de la misma no solo influyen en los patógenos involucrados, sino en la gravedad de la infección y la posibilidad de diseminación sistémica. En este estudio se muestra que el 51,8% de los casos con micosis pulmonares tuvieron el antecedente de DM2, un factor de riesgo relevante para micosis pulmonares que se diagnostican en etapas avanzadas y que conlleva una alta mortalidad. Es importante mantener una vigilancia y valoración constante en los pacientes con DM y enfermedades respiratorias para así establecer un diagnóstico oportuno y un tratamiento adecuado. La notificación de esta enfermedad ayudaría a tener estadísticas más certeras que permitan entender el comportamiento de la misma.
FinanciaciónNinguna.
Conflicto de interesesLos autores de este artículo declaran no tener conflicto de intereses.
A Marco Gudiño Zayas y al Dr. Juan Soriano Rosas, por su ayuda en la edición y la descripción de las fotografías.