Candida albicans posee una variedad de factores de virulencia, entre los que se encuentran las enzimas aspartil proteinasas, que constituyen un factor determinante en la patogénesis de esta levadura en pacientes inmunodeprimidos.
ObjetivosEl propósito de este estudio fue determinar la actividad de la proteinasa de cepas de C. albicans aisladas de la cavidad oral de pacientes inmunodeprimidos con cáncer, diabéticos y seropositivos a VIH, con candidiasis oral y sujetos sanos.
MétodosSe analizaron 250 cepas de C. albicans distribuidas en 5 grupos diferentes: pacientes con cáncer, diabéticos, seropositivos a VIH, con candidiasis oral y sujetos sanos.
ResultadosEl 46% de las cepas provenientes de pacientes con cáncer, el 54% de VIH, el 60% de diabéticos, el 70% de candidiasis oral y el 42% de sujetos sanos presentaron actividad proteolítica. Las cepas de los pacientes inmunodeprimidos y con candidiasis oral presentaron una mayor actividad proteolítica que las de los sujetos sanos. Se encontró diferencia estadísticamente significativa entre los grupos de candidiasis-sanos, candidiasis-VIH y diabéticos-sanos. No se encontraron diferencias estadísticamente significativas entre las cepas de los pacientes con candidasis oral, diabéticos y con cáncer; tampoco entre los pacientes diabéticos y con VIH, ni entre los pacientes con cáncer, VIH y sujetos sanos.
ConclusionesCon estos hallazgos se puede inferir que a pesar de que las enzimas aspartil proteinasas juegan un papel importante en la patogénesis de C. albicans, su actividad depende de las condiciones del huésped.
Candida albicans has a variety of virulence factors, including secreted aspartyl proteases, which are determinant factors in the pathogenesis of this yeast in immunocompromised patients.
AimsProteinase activity was identified in C. albicans strains isolated from the oral cavity of immunocompromised patients with cancer, diabetes and HIV+, with oral candidiasis and in healthy subjects.
MethodsTwo hundred and fifty C. albicans strains were analyzed, distributed in 5 different groups: patients with cancer, diabetes, HIV+, with oral candidiasis and healthy subjects.
ResultsProteolytic activity was identified in 46% of the strains from cancer patients, 54% from HIV+ patients, 60% from diabetics, 70% from oral candidiasis patients, and 42% from healthy subjects. Activity was higher in strains from immunocompromised and oral candidiasis patients than in healthy subjects. Differences were observed between the candidiasis-healthy, candidiasis-HIV+, and diabetic-healthy groups. No differences were observed between the oral candidiasis, diabetes and cancer patients, between the diabetes and HIV+ patients, or between the cancer patients, HIV+ patients and healthy subjects.
ConclusionsThe present results suggest that although secreted aspartyl proteases are important in the pathogenesis of C. albicans, their activity depends on host conditions.
Las especies del género Candida son patógenos oportunistas que viven como comensales en la cavidad oral en una proporción significativa de sujetos sanos2. Las razones de su existencia como parte de la microbiota de las personas sanas son todavía desconocidas4.
Ciertos factores favorecen la colonización oral por especies de Candida y el desarrollo de la infección oportunista llamada candidiasis oral, siendo Candida albicans la especie más prevalente de todas; sin embargo, otras especies, como Candida tropicalis, Candida glabrata y Candida parapsilosis, han mostrado recientemente una mayor importancia con relación a esta enfermedad26,27. Entre los factores predisponentes para la colonización por Candida se encuentran la hospitalización, las disfunciones metabólicas, las interacciones con la microbiota bacteriana, el sida, el cáncer, la diabetes, la leucemia, la edad (niños y ancianos), la utilización de antibióticos de amplio espectro y el tratamiento quimioterápico, entre otros. Estos factores contribuyen al incremento de las infecciones por este microorganismo a nivel mundial, facilitando la conversión de Candida de la forma comensal a la patógena4,7,15,19,23,24,28.
Por otro lado, también se ha visto que diversos factores de virulencia de Candida contribuyen a su patogenicidad, incluyendo la capacidad para adherirse a células epiteliales y biomateriales, la producción de enzimas hidrolíticas extracelulares como las aspartil proteinasas secretorias (Saps) y las fosfolipasas (PL), y la producción de hemolisinas6,20.
Las Saps son una familia de enzimas capaces de degradar diversos tipos de sustratos fisiológicamente importantes, entre los que se encuentran componentes celulares de las mucosas y elementos del sistema inmune6,20. Estudios experimentales han demostrado que la elevada producción de Saps por C. albicans mejora la capacidad del microorganismo para colonizar y penetrar tejidos y evadir el sistema inmune del huésped5,6,19.
El presente estudio compara la expresión in vitro de las Saps en cepas de C. albicans aisladas de 5 grupos diferentes: 1) sujetos sanos; 2) diabéticos; 3) portadores de VIH; 4) pacientes con cáncer, y 5) pacientes con candidiasis oral.
Materiales y métodosSujetos de estudioDoscientas cincuenta cepas de C. albicans fueron obtenidas de igual número de pacientes residentes en la ciudad de Mérida, Yucatán, México; todos los sujetos participaron de manera voluntaria en este estudio, distribuidos en 5 grupos de 50 pacientes cada uno: pacientes con VIH, con cáncer, diabéticos, con candidiasis oral y sujetos sanos. A excepción de los pacientes que presentaron candidiasis bucal, el resto eran portadores asintomáticos de C. albicans. Todos los pacientes con candidiasis oral fueron diagnosticados de candidiasis seudomembranosa, según los criterios descritos por McCullough y Savage16.
Toma de muestra y aislamiento e identificación de Candida albicansLas muestras fueron recogidas con un hisopo estéril que se frotó rotatoriamente sobre la mucosa oral y el dorso de la lengua de cada uno de los pacientes, y procesadas en un tiempo máximo de 2h después de la toma en el Departamento de Microbiología Oral y Biología Molecular de la Facultad de Odontología de la Universidad Autónoma de Yucatán. Todas las muestras fueron cultivadas en agar dextrosa Sabouraud (Difco®) en condiciones aerobias a 37°C durante 48h. Posteriormente, los aislamientos obtenidos fueron presuntivamente identificados por la coloración verde de las colonias sobre el medio de cultivo CHROMagar® Candida (BBL, Becton, Dickinson and Company), incubado en condiciones aerobias durante 48h a 37°C, de acuerdo con las instrucciones del fabricante9.
Identificación molecularLa extracción del ADN de las levaduras se realizó por el método de extracción rápida de ebullición-congelamiento, descrito previamente8.
La identificación molecular de las cepas aisladas se llevó a cabo por el método de PCR múltiple, según el procedimiento descrito previamente por Yang et al.31. Se utilizó un par de oligonucleótidos específicos para la especie C. albicans que amplifican un fragmento de 175pb del gen 25S ARNr, denominados: CAL5 (5′-TGTTGCTCTCTCGGGGGCGGCCG-3′) y NL4CAL (5′-AAGATCATTATGCCAACATCCTAGGTA/TAA-3′), y el par de oligonucleótidos RNAF (5′-GCATATCAATAAGCGGAGGAAAAG-3′) y RNAR (5′-GGTCCGTGTTTCAAGACG-3′) que amplifican un fragmento de 610pb del gen 25S ARNr del género Candida, que también sirvió como control positivo.
La mezcla de reacción de PCR se preparó con 0,8pmol de cada uno de los oligonucleótidos específicos, 2,5mM de MgCl2, tampón PCR (10mM de Tris-HCl, 10mM de KCl), 0,2mM de la mezcla de dNTP, 2,5U de Taq ADN polimerasa, 10ng del ADN en estudio y agua destilada hasta completar 25μL. La reacción de amplificación se llevó a cabo con un ciclo inicial a 95°C durante 6min, seguido de 30 ciclos de 30s a 94°C, 30s a 58°C y 30s a 72°C, con una incubación final de 10min a 72°C25,31.
Todos los productos de la PCR fueron analizados por medio de electroforesis en geles de agarosa al 1%, utilizando el tampón TBE 1X (Tris 1M, ácido bórico 0,9M, EDTA 0,01M) a 100V durante 1h. Los geles fueron teñidos con 0,5mg/ml de bromuro de etidio durante 15min. Posteriormente, las bandas fueron visualizadas en un transiluminador de luz UV. El tamaño del fragmento del ADN amplificado fue determinado por comparación con un marcador de peso molecular de 100pb15. La cepa de C. albicans ATCC 10231 fue utilizada como control positivo.
Cuantificación de la actividad proteinasaPara determinar la actividad proteolítica se llevó a cabo la técnica descrita por Ozkan et al.22, que consistió en dejar crecer los cultivos de C. albicans durante toda la noche en el medio líquido Sabouraud a 36°C y en agitación a 200rpm en una incubadora orbital. Posteriormente, las células se recogieron por centrifugación a 2.500rpm durante 10min, se realizaron 2 lavados con solución de tampón fosfato (pH 7,2) y se resuspendieron hasta alcanzar una concentración de 1×108células/ml. Se colocaron 10μl de la suspensión sobre el medio agar suero albúmina bovina (1% agar, 0,1% KH2PO4, 0,5% MgSO4, 1% glucosa y 0,16% de albúmina sérica bovina, pH 5,0). Las placas se incubaron a 37°C durante 5 días y luego fueron fijadas con ácido tricloroacético al 20% y se tiñeron con amido black al 1,25%; la decoloración se realizó con ácido acético al 15%.
Se midieron los diámetros de las colonias y las zonas claras alrededor de cada una de ellas y los valores fueron usados para calcular el índice de actividad enzimática (Pz) siguiendo la metodología de Price et al., descrita por Oksuz et al.21. Los índices de Pz pueden tomar valores que van de 0 a 1; valores menores de 0,69 son considerados como de fuerte actividad, valores comprendidos entre 0,70 y 0,79 son considerados de actividad moderada, los que se encuentren entre 0,80 y 0,89 como una actividad débil, los que estén entre 0,9 y 0,99 son considerados como de actividad muy débil, y un valor igual a 1 se considera sin actividad. Todos los ensayos se realizaron por triplicado y en 2 ocasiones diferentes, usándose la cepa de C. albicans ATCC 10231 como control positivo21.
Análisis estadísticoLa actividad proteinasa de cada grupo se comparó mediante la prueba del análisis de la varianza. Valores de p<0,05 fueron considerados estadísticamente significativos.
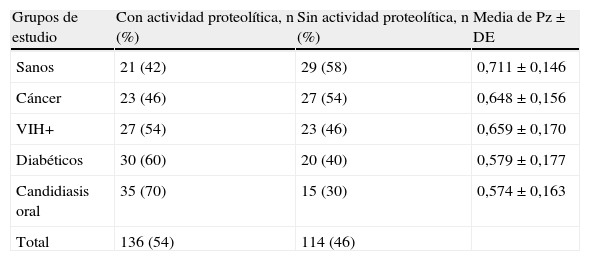
ResultadosLa totalidad de las 250 cepas de C. albicans (50 de cada grupo) fueron identificadas por PCR. Del total de cepas estudiadas, 136 (54%) presentaron actividad proteolítica. La distribución de las cepas proteolíticas de C. albicans de cada grupo de pacientes se muestra en la tabla 1. Se encontró que el grupo de estudio con mayor porcentaje de cepas con actividad proteolítica fue el de candidiasis oral, con el 70% (35/50), y el de menor número de cepas con actividad correspondió al grupo de pacientes sanos, con el 42% (21/50).
Distribución de las cepas de Candida albicans con actividad proteolítica y promedios de los diferentes grupos de pacientes
| Grupos de estudio | Con actividad proteolítica, n (%) | Sin actividad proteolítica, n (%) | Media de Pz±DE |
| Sanos | 21 (42) | 29 (58) | 0,711±0,146 |
| Cáncer | 23 (46) | 27 (54) | 0,648±0,156 |
| VIH+ | 27 (54) | 23 (46) | 0,659±0,170 |
| Diabéticos | 30 (60) | 20 (40) | 0,579±0,177 |
| Candidiasis oral | 35 (70) | 15 (30) | 0,574±0,163 |
| Total | 136 (54) | 114 (46) |
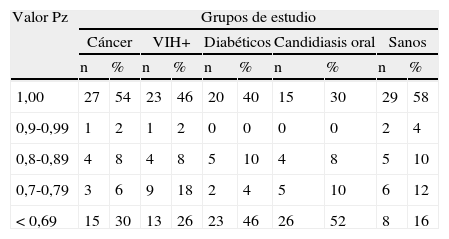
Las cepas de cada grupo de pacientes se clasificaron de acuerdo con sus índices de Pz, encontrándose que el 30% de las cepas de los pacientes con cáncer, el 26% de las de los pacientes con VIH, el 46% de las de los pacientes diabéticos, el 52% de las de los pacientes con candidiasis oral y el 16% de las de los sujetos sanos mostraron una alta actividad proteolítica, con valores de Pz<0,69 (ver tabla 2).
Distribución de la actividad proteinasa de acuerdo con los índices de actividad enzimática de las cepas de Candida albicans de los diferentes grupos de estudio
| Valor Pz | Grupos de estudio | |||||||||
| Cáncer | VIH+ | Diabéticos | Candidiasis oral | Sanos | ||||||
| n | % | n | % | n | % | n | % | n | % | |
| 1,00 | 27 | 54 | 23 | 46 | 20 | 40 | 15 | 30 | 29 | 58 |
| 0,9-0,99 | 1 | 2 | 1 | 2 | 0 | 0 | 0 | 0 | 2 | 4 |
| 0,8-0,89 | 4 | 8 | 4 | 8 | 5 | 10 | 4 | 8 | 5 | 10 |
| 0,7-0,79 | 3 | 6 | 9 | 18 | 2 | 4 | 5 | 10 | 6 | 12 |
| <0,69 | 15 | 30 | 13 | 26 | 23 | 46 | 26 | 52 | 8 | 16 |
El grupo con candidiasis oral fue el de mayor actividad, con un valor Pz promedio de 0,574, seguido del de pacientes diabéticos con 0,579, y el grupo con menor actividad proteolítica (sujetos sanos) con 0,711 (ver tabla 1). Se realizó la prueba estadística del análisis de la varianza para comparar los distintos grupos de pacientes, encontrándose que existe diferencia estadísticamente significativa (p<0,05) en la actividad proteolítica entre los grupos de candidiasis oral y sujetos sanos, el grupo de candidiasis oral y el de VIH+, y el grupo de diabéticos con el de sujetos sanos.
DiscusiónLa colonización por C. albicans puede llevar a la infección sistémica cuando el huésped presenta factores de riesgo, como el uso de antibióticos de amplio espectro, esteroides u otros agentes inmunosupresores, diabetes mellitus, sida, pacientes con cáncer sometidos a quimioterapia o radioterapia, y sometidos a trasplante de órganos1.
C. albicans es un microorganismo patógeno facultativo que ha desarrollado una serie de factores de virulencia entre los que se encuentran la secreción de Saps, que facilitan la invasión de los tejidos y la evasión de los mecanismos de defensa del huésped13. La secreción de Saps ha sido asociada a la patogenicidad de C. albicans, ya que cepas aisladas de pacientes con candidiasis bucal han mostrado mayor actividad proteolítica que las aisladas de la cavidad oral de portadores sanos11.
Se han llevado a cabo diversos estudios para determinar la actividad proteolítica de cepas aisladas de diferentes grupos de pacientes1,10,12,13,21. En México, no existen estudios publicados acerca de la actividad proteolítica de C. albicans. El presente trabajo se llevó a cabo para determinar la actividad in vitro de las Saps de cepas de C. albicans aisladas de 5 grupos de pacientes: pacientes con cáncer, con VIH, diabéticos, con candidiasis oral y sujetos sanos. Se encontró que el 46% de los pacientes con cáncer, el 54% de los pacientes con VIH, el 60% de los pacientes diabéticos, el 70% de los pacientes con candidiasis oral y el 42% de los pacientes sanos presentaron cepas de C. albicans con actividad proteolítica. Estudios similares han publicado que el 100% de las cepas provenientes de pacientes con VIH, cáncer10, diabetes30 y con candidiasis oral6 presentaron actividad proteolítica; en sujetos sanos se ha publicado que el 50% de las cepas presenta dicha actividad21. Estas diferencias en los resultados probablemente se deban al tipo de infección presente en los sujetos de estudio y a las metodologías empleadas para determinar la actividad proteolítica. En este estudio, a excepción del grupo con candidiasis oral, todos los pacientes eran portadores sanos (ninguno presentó sintomatología de la enfermedad).
Al comparar los grupos de estudio de acuerdo con la actividad de la proteinasa, se observó que un mayor número de cepas (52%) de los pacientes con candidiasis oral presentaron una actividad proteolítica alta con respecto a los demás grupos de pacientes. De igual manera, al comparar la actividad de la proteinasa entre los diferentes grupos, se encontró que los pacientes con candidiasis oral, diabéticos, con cáncer y VIH presentaron una actividad alta con una media menor a 0,69 en comparación con los sujetos sanos, que presentaron una media de 0,711. Estos resultados concuerdan con los encontrados por otros autores, en donde se ha publicado que cepas de C. albicans provenientes de pacientes inmunodeprimidos y con candidiasis oral presentan mayor actividad de la proteinasa que las de los sujetos sanos11,17,29.
Al analizar la actividad proteolítica entre los diferentes grupos, se observó que aquel con candidiasis oral presentó mayor actividad, con una media de 0,574, y una diferencia estadísticamente significativa entre este grupo de pacientes y aquellos con VIH y los sujetos sanos, que presentaron una media de 0,659 y 0,711, respectivamente. El mismo resultado se obtuvo al comparar la actividad proteolítica de las cepas de los pacientes diabéticos (0,579) con la de los sujetos sanos. Un estudio realizado por Tsang et al. señala que las cepas de C. albicans aisladas de pacientes diabéticos mostraron una mayor actividad proteolítica que las cepas aisladas de sujetos sanos, y menciona que esta actividad podría estar relacionada con características propias de estos pacientes, como el pH ácido y la reducción del flujo salival30. Por el contrario, Manfredi et al. no encontraron diferencias entre las cepas aisladas de pacientes diabéticos y sujetos sanos, sin embargo, concluyen que en pacientes diabéticos, parece ser que la diabetes mellitus podría influir en el mejoramiento de la expresión de los factores de virulencia de C. albicans12. Por otro lado, nosotros no encontramos diferencias en la actividad de la proteinasa entre las cepas de los pacientes con candidasis oral, diabéticos y con cáncer; tampoco entre los pacientes diabéticos y con VIH, ni entre los pacientes con cáncer, VIH y sujetos sanos. La patogenicidad de C. albicans, además de a sus factores de virulencia, está asociada al estado inmunitario del huésped29. Se cree que los factores dependientes del huésped tienen suma importancia en la patogenicidad de esta levadura, y que causa la enfermedad cuando las defensas del huésped se encuentran debilitadas3. La virulencia de C. albicans no está asociada a un solo factor de virulencia, sino a la combinación de ellos, como son los fosfolípidos, la producción de biofilm, las hemolisinas, etc.18. De acuerdo con lo anterior, se evidencia que la patogenicidad de C. albicans es un fenómeno complejo que incluye la colonización, la adhesión, la invasión y el daño a las células del huésped, la composición de la pared celular de Candida y la producción por esta levadura de toxinas y enzimas proteolíticas; pero estos factores pueden variar según las condiciones de los grupos de estudio, las características del microorganismo y las condiciones ambientales que rodean al huésped14.
Por todo esto, consideramos que sería importante llevar a cabo estudios de expresión genética para conocer el comportamiento de los genes SAP presentes en estos grupos de pacientes, con el fin de ampliar el conocimiento acerca del papel que juegan las Saps en la patogenicidad de C. albicans.
Por lo tanto, se concluye que la patogenicidad de C. albicans no depende únicamente de la producción de las Saps, sino también del estado inmunológico del huésped.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.