La onicomicosis presenta una prevalencia estimada del 2,6% en España5,16 y en torno al 10% en Norteamérica8, Reino Unido15 o Finlandia10, siendo la causa más común de la onicopatía17.
Tradicionalmente, el examen microscópico con solución de Swartz-Lamkins (KOH 20% más tinta Parker negra a partes iguales) y el cultivo en agar de Sabouraud han sido los métodos diagnósticos de elección en las onicomicosis, a los que se han añadido la biopsia ungueal y el estudio histopatológico mediante la tinción con PAS, la tinción con calcoflúor, o incluso técnicas de biología molecular. Estos nuevos procedimientos han intentado suplir los problemas de sensibilidad y especificidad de los primeros a cambio de un mayor coste económico, retraso en el diagnóstico o aparición de distrofia ungueal secundaria9.
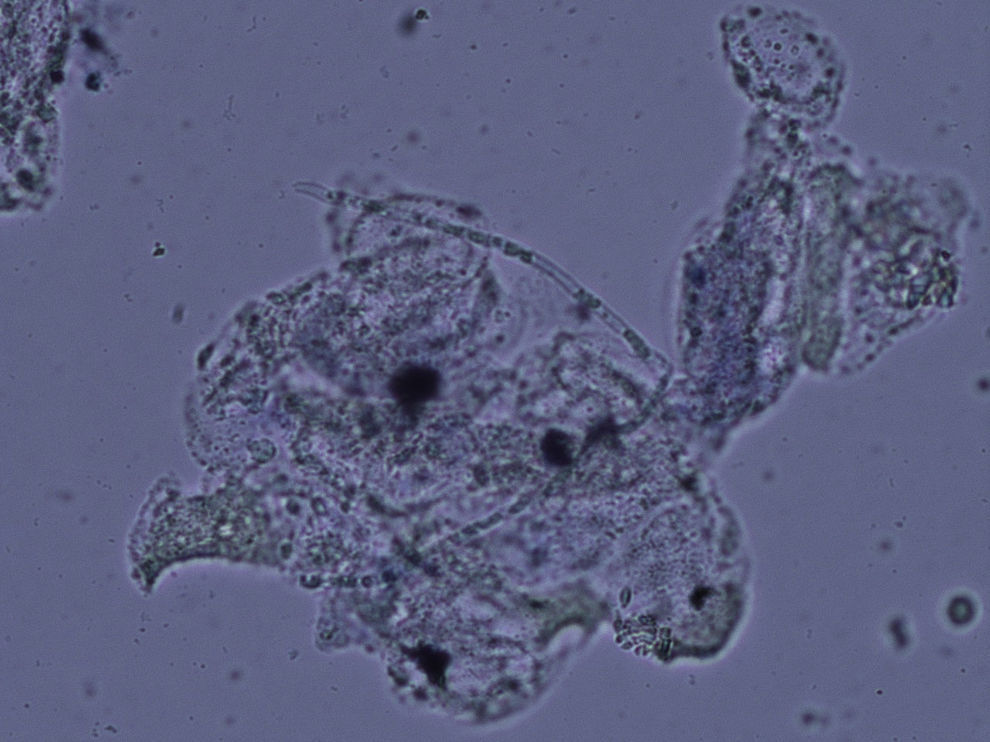
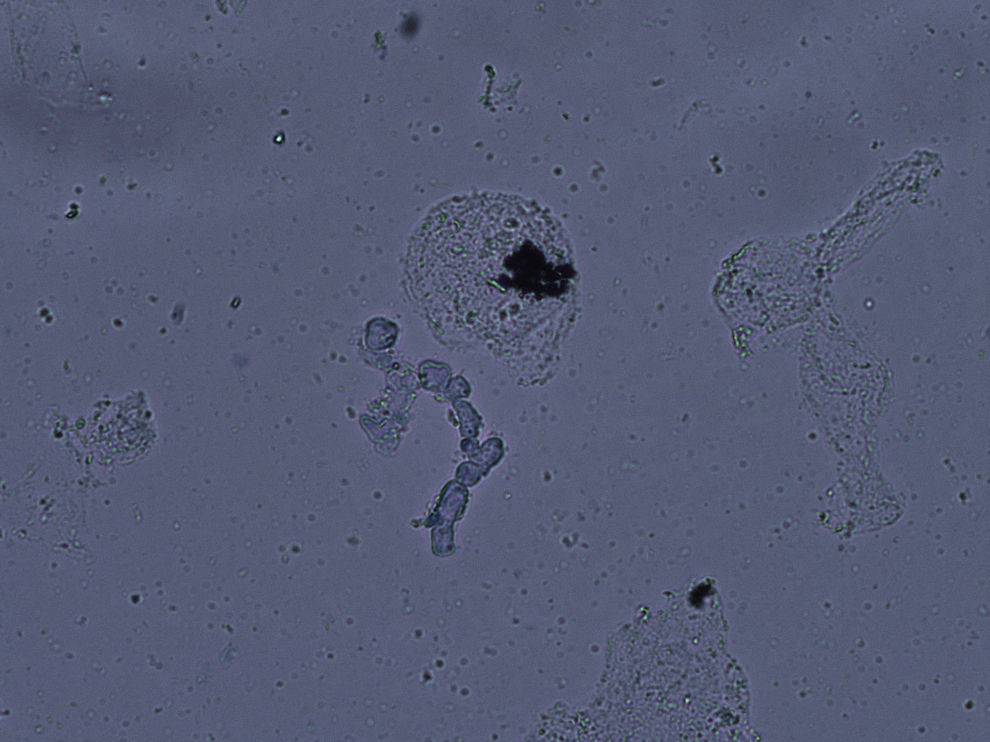
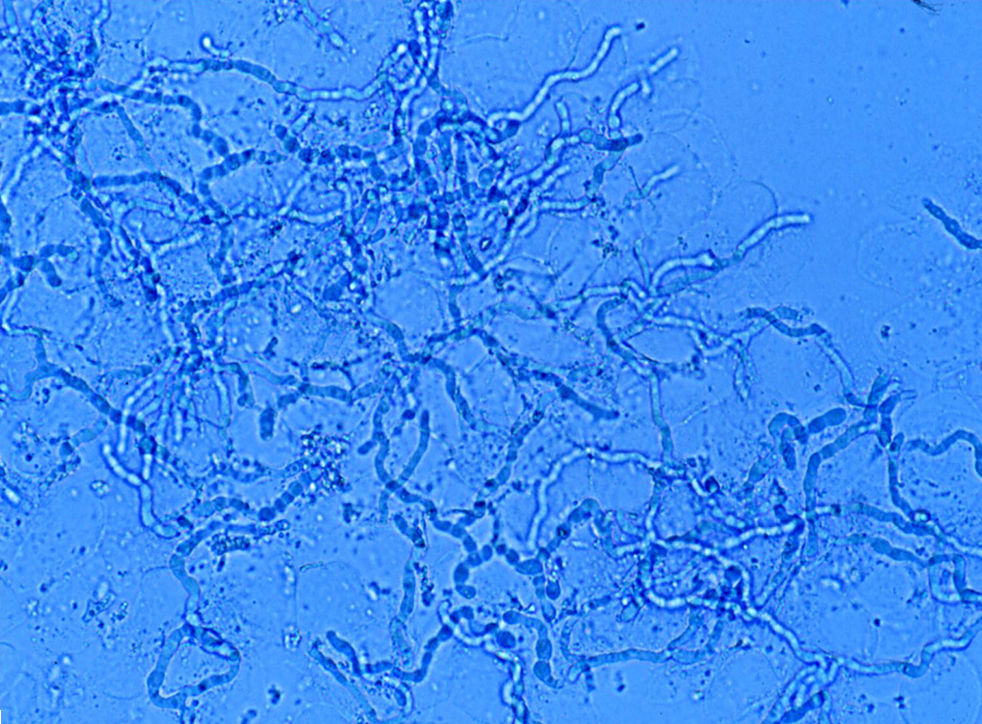
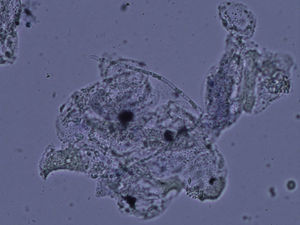
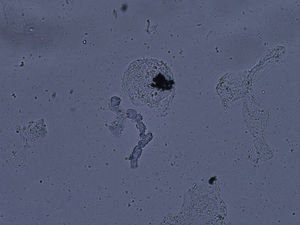
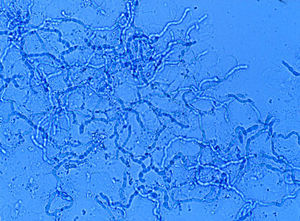
La experiencia generalizada de los dermatólogos en el diagnóstico de las onicomicosis es que muchos casos clínicamente típicos no se confirman mediante cultivo17. No ocurre esto en otras micosis superficiales, ya que los resultados de los cultivos son fidedignos en tinea capitis y en las tiñas que afectan a piel lampiña3. La explicación se encuentra en la presencia de células fúngicas desvitalizadas en las onicomicosis, ya que al ser la uña un material extremadamente duro el hongo presenta problemas de viabilidad, y en el examen directo podemos observar hifas parcial o totalmente huecas, con áreas ausentes de protoplasma (fig. 1). En otras ocasiones la difícil supervivencia del hongo en la uña da lugar a hifas aberrantes (fig. 2) incapaces de crecer en cultivo, y en otras ocasiones la alteración morfológica de la hifa es secundaria a tratamientos previos. Estas hifas aberrantes no se aprecian en el examen directo del resto de dermatomicosis (fig. 3). En otras ocasiones los falsos negativos de los cultivos micológicos pueden deberse a una incorrecta o insuficiente toma de muestra o al empleo de un medio de cultivo inadecuado.
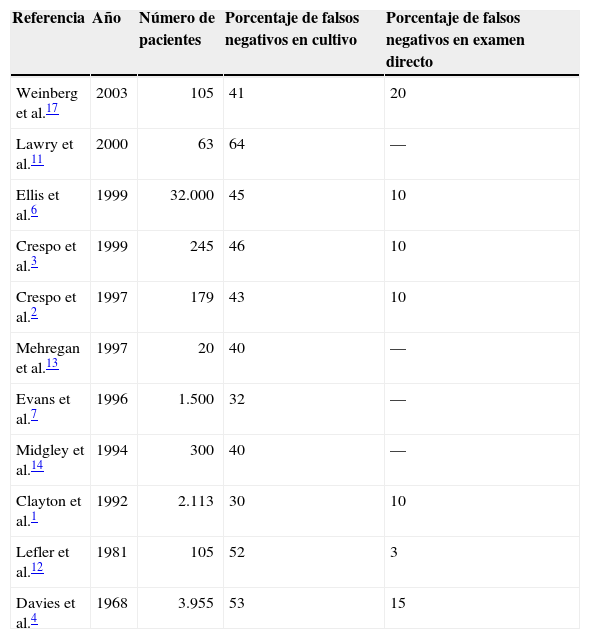
En estudios previos1-4,6,11-14,17 se han comparado los métodos diagnósticos de las onicomicosis (tabla 1), mostrando tasas de falsos negativos en cultivos que varían del 32-64% frente al 10-15% de falsos negativos en examen directo o incluso menores para observadores experimentados. En trabajos realizados previamente en nuestro hospital2,3 entre los años 1997 y 1999, al procesar las muestras con examen directo y siembra en 2 medios de cultivo de Sabouraud con y sin actidiona, observamos que de no llevarse a cabo el examen directo se quedarían sin diagnosticar el 43% de los casos de tinea unguium. Sin embargo, el porcentaje de falsos negativos si se realiza el examen directo es de solo un 10%.
Estudios que han comparado el porcentaje de falsos negativos en cultivo y en examen directo en pacientes con onicomicosis
| Referencia | Año | Número de pacientes | Porcentaje de falsos negativos en cultivo | Porcentaje de falsos negativos en examen directo |
|---|---|---|---|---|
| Weinberg et al.17 | 2003 | 105 | 41 | 20 |
| Lawry et al.11 | 2000 | 63 | 64 | — |
| Ellis et al.6 | 1999 | 32.000 | 45 | 10 |
| Crespo et al.3 | 1999 | 245 | 46 | 10 |
| Crespo et al.2 | 1997 | 179 | 43 | 10 |
| Mehregan et al.13 | 1997 | 20 | 40 | — |
| Evans et al.7 | 1996 | 1.500 | 32 | — |
| Midgley et al.14 | 1994 | 300 | 40 | — |
| Clayton et al.1 | 1992 | 2.113 | 30 | 10 |
| Lefler et al.12 | 1981 | 105 | 52 | 3 |
| Davies et al.4 | 1968 | 3.955 | 53 | 15 |
En la revisión de casos procesados en el laboratorio de micología de septiembre de 2012 a septiembre de 2013 comprobamos que estos porcentajes apenas han variado, pues existe un 44% de falsos negativos en cultivo para tinea unguium, frente a solo el 8% de falsos negativos con examen directo, lo que demuestra la superioridad del examen directo como técnica diagnóstica en las onicomicosis, ya que, en caso de no realizar esta técnica un elevado porcentaje de pacientes se quedarán sin diagnóstico, prácticamente uno de cada 2 pacientes. Además, podemos sumar las diferentes ventajas del examen directo: su inmediatez, su bajo coste y su escaso aparataje. Con una simple preparación de KOH al 20% y tinta Parker negra a partes iguales podemos confirmar el diagnóstico en el plazo de unos minutos, mientras que el cultivo exige entre una y 3 semanas. Sin embargo, el consumo de tiempo y la experiencia que requiere la realización del examen directo lleva en muchos casos a la única realización del cultivo por parte de médicos de familia, podólogos o dermatólogos.
En conclusión, el examen directo debe posicionarse como la técnica diagnóstica de elección en las onicomicosis, dada la elevada tasa de falsos negativos encontrada en los cultivos, que ronda el 40% de los casos, secundaria a la inviabilidad del hongo o incorrecto procesamiento de las muestras. Sin embargo, es recomendable realizar cultivo junto al examen directo, ya que el primero nos permite identificar el agente etiológico, aporta datos epidemiológicos y permite determinar la sensibilidad a los antifúngicos disponibles.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.