La vulvovaginitis candidiásica es una infección frecuente en mujeres jóvenes que se acompaña de alta morbilidad y elevados gastos sanitarios.
ObjetivosLas candidiasis vaginales causadas por Candida glabrata constituyen un reto terapéutico dada la resistencia adquirida por muchas cepas de esta especie a los antifúngicos azólicos.
MétodosEn este trabajo presentamos 2 casos de candidiasis vaginal complicada por Candida glabrata resistentes a fluconazol y tratadas con voriconazol.
ResultadosLas 2 pacientes mejoraron tras la administración de voriconazol, 400mg/12h el primer día y posteriormente 200mg/12h durante 14 días, con desaparición de la sintomatología y la negativización de los cultivos.
ConclusionesEn conclusión, los resultados obtenidos nos llevan a sugerir el uso del voriconazol como alternativa terapéutica en este tipo de candidiasis que, aunque no comprometen la vida, llevan asociada una elevada morbilidad.
Vulvovaginal candidosis is a common infection in young women, and it is associated with high morbidity and high health costs.
AimsVulvovaginal candidosis caused by Candida glabrata is a therapeutic challenge due to the acquired resistance of many strains of this species to azole antifungals.
MethodsWe present two cases of vaginal candidosis complicated by fluconazole-resistant Candida glabrata, and treated with voriconazole.
ResultsBoth patients improved after administration of voriconazole, 400mg/12h the first day and then 200mg every 12h for 14 days. Their symptoms disappeared and cultures became negative.
ConclusionsThese results suggest voriconazole can be used as a therapeutic alternative for this type of candidosis which, although not life threatening, is associated with a high morbidity.
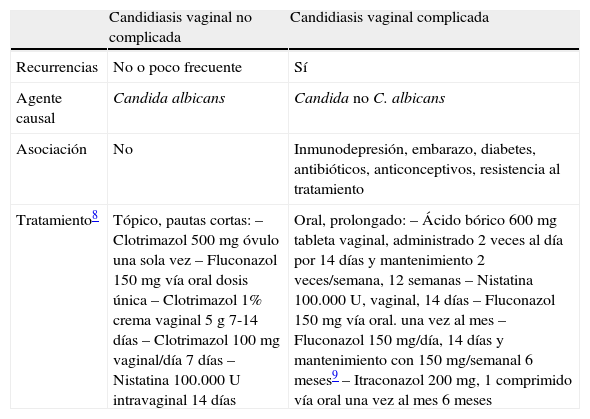
La vulvovaginitis candidiásica es una infección frecuente en mujeres jóvenes que se acompaña de una alta morbilidad y elevados costes sanitarios. Se caracteriza por una inflamación de la vulva y vagina secundaria generalmente a condiciones fisiológicas alteradas que determinan una disminución de la inmunidad local (véase la tabla 1). El 75% de las mujeres tendrá al menos un episodio de vulvovaginitis candidiásica en su vida1 y de ellas un 5-8% desarrollará vulvovaginitis crónica recurrente (VVC), entendiéndose esta como 4 o más infecciones sintomáticas al año8. Las recurrencias suelen producirse en los 3meses siguientes al primer episodio. Entre el 10 y el 33% de estas formas recurrentes las producen especies distintas de Candida albicans, como Candida glabrata2, Candida tropicalis, Candida krusei o Candida parapsilopsis.
Diferencias entre candidiasis vaginal complicada y no complicada
| Candidiasis vaginal no complicada | Candidiasis vaginal complicada | |
| Recurrencias | No o poco frecuente | Sí |
| Agente causal | Candida albicans | Candida no C. albicans |
| Asociación | No | Inmunodepresión, embarazo, diabetes, antibióticos, anticonceptivos, resistencia al tratamiento |
| Tratamiento8 | Tópico, pautas cortas:– Clotrimazol 500mg óvulo una sola vez– Fluconazol 150mg vía oral dosis única– Clotrimazol 1% crema vaginal 5g 7-14días– Clotrimazol 100mg vaginal/día 7días– Nistatina 100.000U intravaginal 14días | Oral, prolongado:– Ácido bórico 600mg tableta vaginal, administrado 2veces al día por 14días y mantenimiento 2 veces/semana, 12semanas– Nistatina 100.000 U, vaginal, 14 días– Fluconazol 150mg vía oral. una vez al mes– Fluconazol 150 mg/día, 14días y mantenimiento con 150mg/semanal 6meses9– Itraconazol 200mg, 1comprimido vía oral una vez al mes 6meses |
Las candidiasis vaginales causadas por C. glabrata constituyen un reto terapéutico, dada su resistencia a algunos antifúngicos azólicos2.
Presentamos 2casos de candidiasis vaginal complicada por C. glabrata resistentes a fluconazol y tratados con voriconazol.
Casos clínicosPrimer casoMujer de 21años, con antecedentes de candidiasis vaginal crónica de 2años de evolución, con importante prurito vaginal y anal, y disuria. Tras haber realizado diferentes pautas de azoles tópicos sin éxito e itraconazol 200mg durante 2semanas, es derivada a Dermatología. Se solicita analítica incluyendo serología para VIH, que resultó negativa. En el cultivo se aísla C. glabrata y el fungigrama confirma resistencia a fluconazol, itraconazol y miconazol, y sensibilidad a voriconazol y anfotericina B. Dada la sensibilidad dependiente de la dosis de esta especie al fluconazol, se planifica tratamiento con fluconazol 800mg el primer día, seguido de fluconazol 600mg/día durante 14días y posterior mantenimiento con fluconazol 600mg/semanal. Se combina con óvulos de nistatina 300.000U durante 14días y medidas higiénicas (evitar tampones, ropa oclusiva, etc.). Ante la escasa mejoría, al tercer mes de tratamiento se sustituye la nistatina por óvulos de ácido bórico 600mg/12h durante 14días y posteriormente 2veces por semana. Tras 6 meses de tratamiento con fluconazol, la sintomatología persiste, los cultivos continúan positivos y sigue aislándose C. glabrata. Se inicia entonces tratamiento con voriconazol 400mg/12h el primer día y posteriormente 200mg/12h durante 14días, con desaparición total de los síntomas. La mejoría clínica y la ausencia de cultivos positivos persisten tras 8meses la finalización del tratamiento.
Segundo casoMujer de 34años de edad, sin antecedentes clínicos de interés, que tras cesárea comienza con vulvovaginitis recurrente tratada con medidas higiénicas, miconazol tópico, óvulos de Lactobacillus, óvulos de ácido bórico, fluconazol 150mg/mensual durante 3años y diferentes pautas de itraconazol por vía oral por parte de Ginecología, sin éxito. Serología negativa para el VIH. En los diferentes cultivos realizados durante estos años se aisló siempre C. glabrata. Se realiza un estudio de sensibilidad de la cepa mediante E-test, resultando ser sensible a caspofungina, flucitosina y voriconazol, y resistente a fluconazol e itraconazol. Se instaura entonces tratamiento con voriconazol 400mg/12h el primer día y posteriormente 200mg/12h durante 14días. Sin embargo, al segundo día de tratamiento la paciente refiere fotofobia y taquicardia que ceden espontáneamente al cuarto día. Tras 14días de tratamiento existe mejoría clínica y se negativizan los cultivos. Después de 6años no ha habido nuevas recurrencias.
DiscusiónEl tratamiento en la candidiasis complicada debe ser prolongado, de 7a 14días, por vía oral10. Son múltiples los regímenes terapéuticos propuestos8. La terapia de mantenimiento con fluconazol 150mg semanal consigue evitar la recurrencia en el 90% de los casos tras 6meses. Sin embargo, la cura a largo plazo parece difícil de lograr4.
No se conoce la duración óptima de la terapia supresora y la fisiopatología de la cronicidad y recurrencia es incierta. Estas dificultades terapéuticas se agravan ante especies del género Candida resistentes a los antifúngicos habituales5,6,8,.
No existe suficiente información en las guías clínicas para el manejo de la VVC por C. glabrata, ya que en la mayoría de los ensayos clínicos de vaginitis los casos por C. glabrata son excluidos o representan un número insuficiente para extraer conclusiones, incluso en grandes series1,10. Por ello, la respuesta clínica a los tratamientos convencionales y orales no es bien conocida. Realmente, la experiencia en el manejo de pacientes con C.glabrata se basa en la aportación de casos aislados derivados a clínicas especializadas tras la escasa respuesta a un gran número de tratamientos tópicos y orales. Los estudios in vitro revelan una baja sensibilidad de C.glabrata a fluconazol y algunos del resto de azoles comparada con C. albicans3,5,6,. El tratamiento con ácido bórico, 600mg/día intravaginal durante 14días, se ha mostrado eficaz en las vaginitis por Candida no albicans que han fracasado con diferentes pautas de azoles, consiguiendo tasas de erradicación del 70%7,9. Asimismo, se han ensayado tratamientos con nistatina tópica y flucitosina con resultados variables; sin embargo, esta última no se comercializa en España9. El voriconazol es un nuevo antifúngico que se ha desarrollado para afrontar la necesidad creciente de nuevos y eficaces tratamientos contra las micosis invasoras. Este nuevo antifúngico ha demostrado resultados alentadores in vitro frente a C.glabrata4–6. El empleo del voriconazol está autorizado en candidiasis invasivas graves resistentes a fluconazol, las aspergilosis invasoras y en infecciones fúngicas graves por Scedosporium. En la actualidad, se está planteando como una alternativa terapéutica en estomatitis candidiásicas por C. glabrata resistentes a fluconazol en humanos4, y probablemente en el futuro se posicione como una de las principales alternativas terapéuticas en la VVC por C. glabrata, pero será necesario un mayor número de casos para poder extraer conclusiones clínicas, pues por el momento solo hay estudios en ratones3.
En conclusión, aportamos los 2primeros casos de vulvovaginitis candidiásica recurrente por C.glabrata tratadas con éxito con voriconazol. Los elevados costes de los prolongados tratamientos convencionales y la resistencia a los mismos aconsejan proponer el voriconazol como alternativa terapéutica en candidiasis que, aunque no comprometan la vida, llevan asociada una elevada morbilidad.