El término candidiasis invasora (CI) engloba una amplia variedad de enfermedades graves oportunistas, que incluye candidemia, endocarditis, meningitis, endoftalmitis y afectación de diversos órganos profundos; excluye las infecciones superficiales y formas menos graves de enfermedad, como las candidiasis orofaríngeas y esofágicas41.
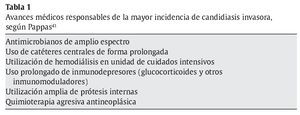
La CI es una enfermedad consecuencia de los avances médicos y tecnológicos aparecidos en los últimos años, y no es de extrañar que su incidencia sea mayor en los hospitales terciarios de países desarrollados41,42,63 (tabla 1).
En los países desarrollados, la CI es la micosis profunda oportunista más frecuente41,42,63.
La CI tiene un impacto importante en la morbimortalidad41,42, con una mortalidad atribuible directa que oscila entre el 15 y el 35% en adultos y entre el 10 y el 15% en neonatos y niños20.
Asimismo, el impacto de la CI en los costes es muy elevado, y se ha calculado que en pacientes adultos cada episodio tiene un gasto aproximado de 40.000 dólares18.
Candida forma parte de la microbiota de piel, mucosas y aparatos digestivos y genital del hombre, por lo que la existencia de cultivos positivos no diferencia entre colonización, infección y enfermedad profunda11. La dificultad para diagnosticarla hace que la verdadera incidencia de CI sea poco conocida. Su diagnóstico es un reto para el clínico (neonatólogos, pediatras, intensivistas, infectólogos, hematólogos, etc.) debido a que su expresión clínica es inespecífica, y con frecuencia silente, o bien aparecen los signos y los síntomas cuando la enfermedad lleva un curso clínico prolongado. Un factor sobreañadido es que en los pacientes con CI hay otras morbilidades46.
En la patogenia de la CI, hay 3 factores fundamentales: a) carga fúngica elevada o colonización, como consecuencia de la administración de antibióticos de amplio espectro; b) rotura de la integridad de la barrera cutáneo-mucosa por el uso prolongado de catéteres, cirugía, traumatismos, mucositis asociada a citotóxicos y radiación, y c) disfunción de la inmunidad que conlleva diseminación a tejidos profundos.
Es importante tener en cuenta que, para conocer la verdadera epidemiología de la CI, habría que basarse en estudios necrópsicos, dada la dificultad diagnóstica micológica y clínica de ésta25. Las necropsias son esenciales si se quiere disponer de datos epidemiológicos sólidos y fidedignos. Sin embargo, actualmente, el porcentaje de autopsias realizadas en los hospitales es muy bajo25.
Casi todos los estudios epidemiológicos se basan en datos proporcionados por los hemocultivos (candidemia) y, sin embargo, es importante tener en cuenta que las candidemias representan sólo entre el 10 y el 40% de los casos probados de CI.
Es importante hacer estudios epidemiológicos debido a varias razones: a) los grupos de riesgo son cambiantes; b) actualmente se dispone de más fármacos antifúngicos; c) las guías terapéuticas evolucionan y cambian las indicaciones; d) Las especies infectantes de Candida varían en el tiempo, y e) la prevalencia de las especies es distinta en los diferentes países, e incluso localmente pueden aparecer brotes nosocomiales hospitalarios por transmisión horizontal (debidos a distintas especies y/o factores).
La mayoría de los estudios publicados se basan en candidemias aparecidas en los hospitales. Sólo una minoría de estudios se basan en candidemias adquiridas en la comunidad. En este último caso, se debe a la utilización de tratamiento intravenoso domiciliario, hecho frecuente en Estados Unidos.
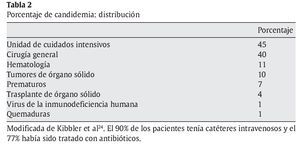
En la tabla 2 se recoge la distribución de candidemia por grupos de pacientes (basada en un estudio prospectivo realizado en 6 hospitales de Inglaterra y Gales)24. Según este estudio, la incidencia fue de 18,7 casos por 100.000 habitantes.
En esta revisión expondremos la epidemiología de la CI en distintas subpoblaciones: a) neonatos; b) población pediátrica (neutropénicos, pacientes críticos y receptores de trasplante); c) pacientes críticos adultos no neutropénicos; d) receptores de trasplantes de órgano sólido, y e) pacientes oncohematológicos adultos y/o receptores de precursores hematopoyéticos.
Epidemiología de la candidiasis invasora en el neonato
Hace 2 décadas, Odds34 afirmaba en su clásico libro de texto que la CI era rara en el recién nacido, excepto en el prematuro de peso muy bajo, y como factores de riesgo se mencionaba la intubación, catéteres intravasculares y tratamiento con antibióticos de amplio espectro, conjuntamente con alteraciones congénitas (sin especificar) e inmadurez de la inmunidad.
Veinte años después, se conocen mejor los factores de riesgo y la epidemiología de la CI neonatal. La identificación de estos factores es muy importante para instaurar tratamiento antifúngico adelantado y tratamiento empírico antifúngico. En el caso de instaurar profilaxis, los factores de riesgo deben identificarse desde el momento del nacimiento.
Las infecciones debidas a Candida son las más prevalentes de las infecciones fúngicas en neonatos, y la candidemia ocupa el tercer lugar en prevalencia en los aislamientos de hemocultivos en la unidad de cuidados intensivos (UCI) neonatal (UCIN). La candidemia neonatal tiene como consecuencia la diseminación a diversos lugares anatómicos profundos4.
La incidencia de candidiasis neonatal en niños de peso muy bajo (< 1.000 g) oscila entre el 7 y el 20%, y tan sólo es del 1% en neonatos con peso superior a 1.500 g60.
En España, en un estudio prospectivo realizado en Barcelona en UCIN durante los años 2002-2003, se estimó que la incidencia anual de la candidemia en neonatos era de 32,6 casos por cada 100.000 nacimientos y de 1,1 por cada 100 altas de UCIN, y casi todos los casos aparecieron en neonatos con peso muy bajo, con una mortalidad del 21%51.
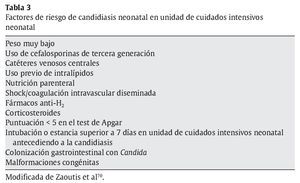
En la tabla 3 se recogen los factores de riesgo de la candidiasis neonatal, según Zaoutis y Walsh70.
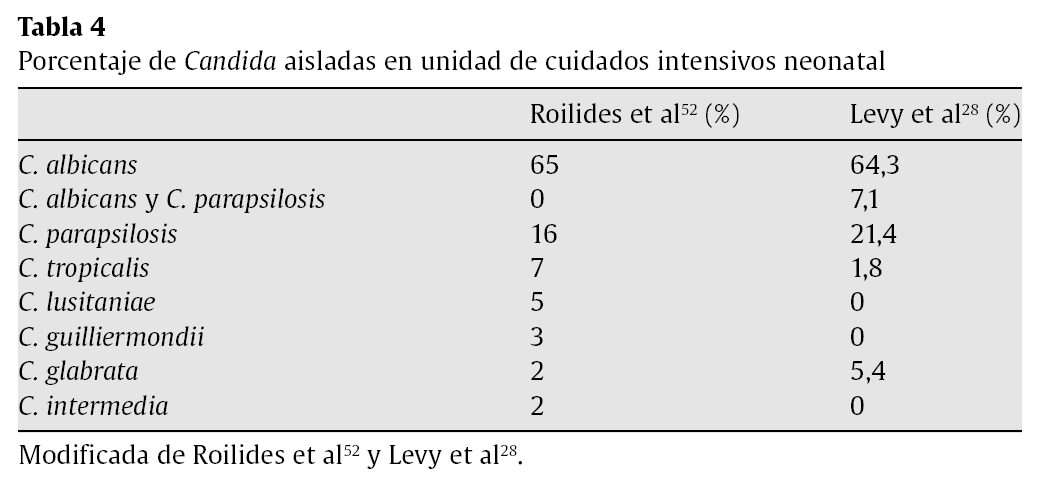
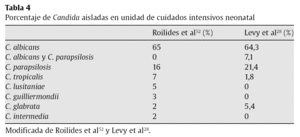
En cuanto a la distribución de las especies infectantes de Candida, ha habido un aumento de las especies de Candida diferentes de C.albicans, especialmente de Candida parapsilosis, siendo ésta la especie más prevalente después de C. albicans según se puede observar en la tabla 4, adaptada de Roilides et al52 y Levy et al28.
La transmisión horizontal de C. parapsilosis (a través de las manos del personal sanitario) está documentada en esta población29. La mayoría de los casos se asocian al catéter, por lo que la retirada de éstos es curativa y se asocia a una mortalidad menor49.
Epidemiología de la candidiasis invasora en edad pediátrica (neutropénicos, pacientes críticos y receptores de trasplante)
En población pediátrica, los niños con enfermedades oncohematológicas, receptores de trasplantes, así como niños con nutrición parenteral total (NPT), tienen riesgo de desarrollar CI6,7,53.
En un estudio retrospectivo en niños con leucemia aguda, Castagnola et al7 encontraron en población pediátrica una incidencia de enfermedad fúngica invasora (EFI) del 0,021 en leucemias linfoblásticas y del 0,048 en las no linfoblásticas, y las debidas a levaduras representan el 45% (la mayoría causadas por especies de Candida diferentes de C. albicans).
Asimismo, Rosen et al53 en un estudio unicéntrico realizado en más de 1.000 niños con enfermedades oncológicas encontraron EFI en el 5% de los pacientes, ocasionando Candida más del 60% de ellas, siendo en el 62% de los niños la neutropenia el principal factor de riesgo.
En los niños receptores de precursores hematopoyéticos, Candida spp. causa el 30% de las EFI8, y en los receptores de trasplante de órgano sólido, los receptores de hígado son los que tienen un riesgo mayor de EFI debido a Candida65, ya que ésta es la causa del 90% de las EFI en dicha población.
Hay que tener en cuenta que la introducción del fluconazol (en tratamiento empírico y profiláctico) en los últimos 20 años ha traído como consecuencia, tanto en niños como en adultos, un cambio en la epidemiología de las EFI en pacientes oncohematológicos y receptores de trasplante de precursores hematopoyéticos, con un descenso de la incidencia de las debidas a levaduras, y han aparecido candidiasis de brecha resistentes a fluconazol, como Candida krusei y Candida glabrata31,32. En los pacientes con trasplante de precursores hematopoyéticos con tratamiento profiláctico con fluconazol o quinolonas, la bacteriemia y la enfermedad por citomegalovirus son factores de riesgo de candidemia32. En los receptores de trasplante hepático, la incidencia de CI ha bajado de forma considerable, fundamentalmente debido a los avances técnicos quirúrgicos, pues incluso sin profilaxis antifúngica la incidencia de CI se sitúa en torno al 5%. Los factores de riesgo de CI son el fallo renal, altos requerimientos transfusionales durante la intervención, retrasplante, complicaciones quirúrgicas postrasplante que requieren laparotomía y coledocoyeyunostomía.
En población pediátrica no neutropénica en UCI pediátrica (UCIP), hay diferencias en la epidemiología, especies de Candida infectantes y diferencia en las enfermedades subyacentes cuando se comparan con los pacientes críticos adultos, siendo en aquellos importante la coexistencia de anomalías congénitas15. La candidemia en el paciente pediátrico aumenta los costes de forma significativa, así como la duración de la estancia hospitalaria69.
La incidencia de CI en esta población en UCIP se sitúa en 43 casos por 100.000 admisiones pediátricas69.
En la década de 1990, la incidencia de candidemia en población pediátrica distintivamente era menor que en adultos61. Posteriormente, en los últimos años, su incidencia en niños ha aumentado en paralelo con la población adulta1. En Europa, en un estudio multicéntrico basado en datos de 20 UCIP, se estableció que Candida era la causa del 9% de las infecciones, y representaba el tercer patógeno más frecuente después de las bacteriemias (68%) y virus (22%)48. En Estados Unidos, en un estudio en 35 UCIP, Candida fue el segundo patógeno más frecuente, con una incidencia del 17,3%, después de estafilococo coagulasa negativo (21%)42.
Los factores de riesgo de candidemia y CI en niños ingresados en UCIP son similares a los que a continuación expondremos en población adulta, aunque en niños es más frecuente la intubación intratraqueal (el 69 frente al 48%) y la NPT (el 79 frente al 50%)42. La colonización multifocal mucosa coloca a los niños en riesgo más alto de desarrollar CI, aunque esto es objeto de un debate interminable58.
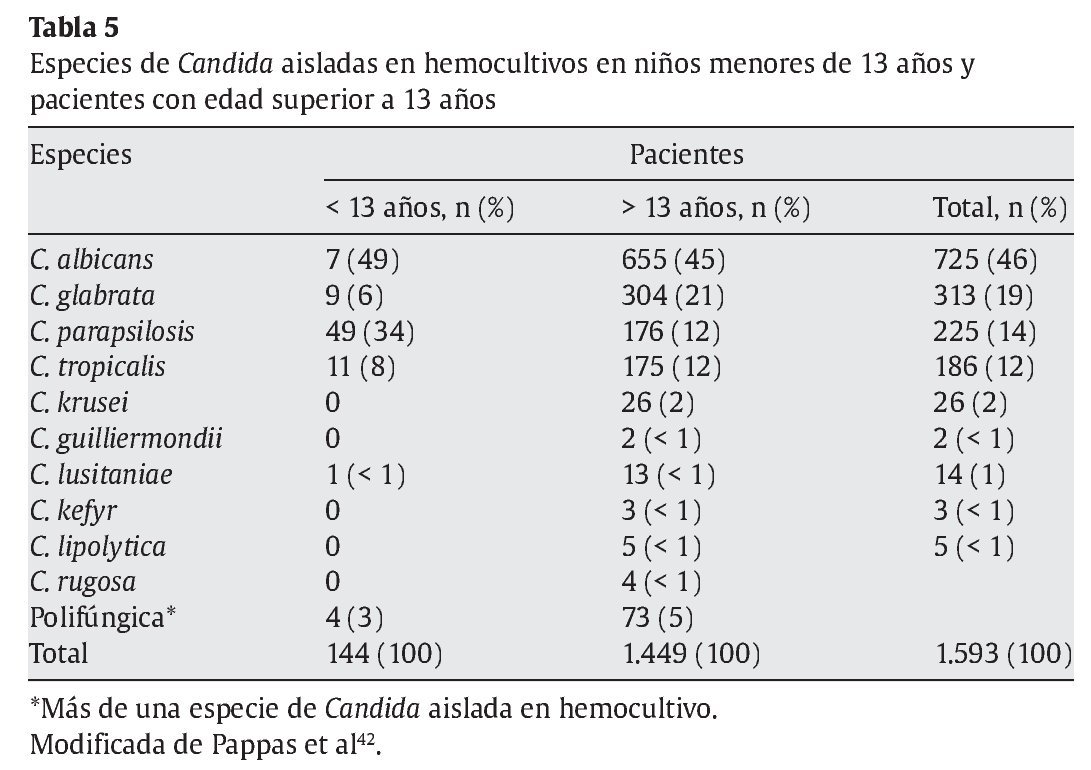
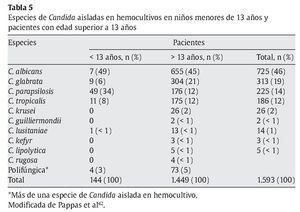
En cuanto a las especies infectantes, las especies de Candida diferentes de C. albicans son las más prevalentes en niños, especialmente C. parapsilosis. En la tabla 5 se encuentran las especies aisladas en hemocultivos en población pediátrica y pacientes mayores de 13 años de edad42, en una cohorte de 1.593 pacientes.
Epidemiología de la candidiasis invasora en el paciente crítico adulto no neutropénico
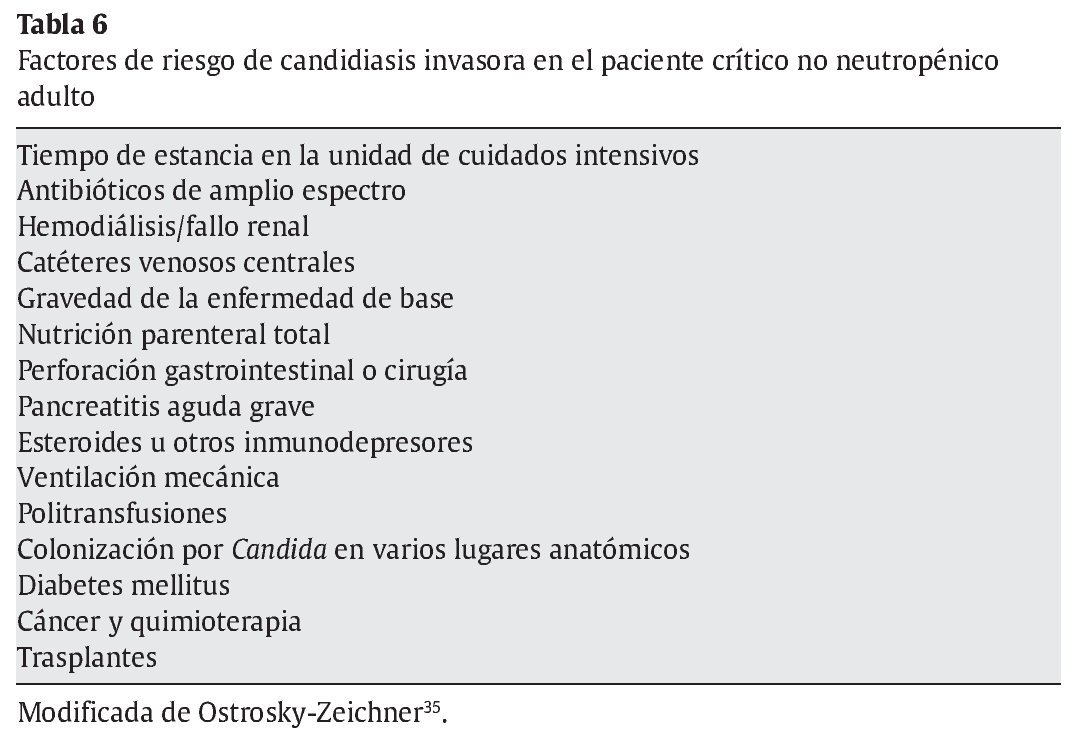
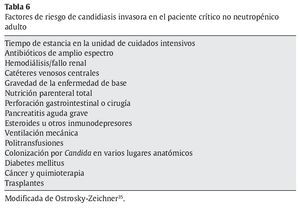
En la tabla 6 se recogen los factores de riesgo de CI en el paciente crítico adulto no neutropénico35. El significado de la colonización por Candida en adultos es objeto de debate continuo. Cuando hay colonización (especialmente en varios lugares anatómicos), sólo es un factor de riesgo y no equivale a enfermedad que requiera tratamiento, puesto que ningún estudio ha demostrado que haya un beneficio al instaurar tratamiento en pacientes colonizados35. El factor de riesgo independiente más importante de CI es la estancia prolongada en UCI39,50. En la primera semana de estancia en UCI, la incidencia de CI es baja y empieza a aumentar después y su incidencia es mayor el día 2150. La pancreatitis aguda grave también es un factor de riesgo independiente de CI, ya que la incidencia de esta última es elevada, en torno al 25-35%66.
Hay que resaltar que es objeto de debate si los distintos factores de riesgo tienen una relación por la que causan específicamente CI por distintos mecanismos patofisiológicos, o simplemente son marcadores de la gravedad de la enfermedad, que a su vez predisponen a los pacientes a la CI.
Ante un paciente crítico determinado, cabría hacerse la pregunta siguiente: ¿quién va a desarrollar CI? Una estrategia práctica sería identificar inicialmente a los pacientes con riesgo alto de CI39. Según un estudio retrospectivo que incluye a 2.890 pacientes, los factores que concurren los primeros 4 días de estancia en la UCI son los siguientes: a) diabetes mellitus; b) hemodiálisis de novo; c) NPT, y d) antibióticos de amplio espectro.
Estos 4 factores englobarían el 78% de todos los casos de CI, siempre que no hayan recibido tratamiento antifúngico y se hayan identificado estos 4 factores de riesgo durante los primeros 4 días de estancia en la UCI38.
En España, León et al27 han desarrollado un sistema de puntuación (score) con la finalidad de identificar a los candidatos en UCI para establecer tratamiento antifúngico temprano en pacientes críticos colonizados por Candida40. En este estudio multicéntrico, se incluyeron más de 1.600 pacientes críticos, no neutropénicos, con varios factores de riesgo, y mediante estudio estadístico los que tenían un sistema de puntuación superior a 2,5 tenían un riesgo alto de desarrollar CI.
Recientemente, Ostrosky-Zeichner et al36, después de analizar de forma retrospectiva a 649 pacientes críticos no neutropénicos colonizados con Candida, han presentado los resultados preliminares de una regla de predicción clínica para identificar a los pacientes con riesgo de desarrollar CI.
Un campo en desarrollo para identificar a pacientes críticos con riesgo de CI es la utilización de marcadores de CI, a partir de la positividad de éstos para establecer un tratamiento antifúngico anticipado40,62. Así, por ejemplo, en un estudio retrospectivo en pacientes críticos quirúrgicos colonizados con Candida, se trató a los pacientes de forma empírica con fluconazol por fiebre refractaria al tratamiento antibiótico, y los que tenían β-1,3-D-glucano positivo en sangre respondieron significativamente mejor que los que tenían la prueba negativa62.
La incidencia general de CI en los pacientes críticos se sitúa en torno al 2%50, aunque, como ya hemos comentado, hay subgrupos de pacientes de riesgo alto, como por ejemplo los pacientes con perforación gastrointestinal recurrente, en los que la incidencia es muy elevada y se sitúa en torno al 35%14,37. En Estados Unidos, Candida causa alrededor del 10% de las sepsis en UCI, siendo el patógeno que se aísla en tercer lugar68.
En la década de 1980, aumentó la incidencia de CI, y posteriormente apareció una disminución en UCI; sin embargo, esta disminución no fue uniforme30,44,64.
Se admite que entre el 33 y el 55% de las candidemias aparecen en UCI2,12,24,44,64.
Las candidemias tienen una mortalidad atribuible alta, que se sitúa en torno al 50% (rango 30-65%)2,5,12,20,24,42,69.
En cuanto a las especies infectantes, C. albicans era la principal especie causante de CI hace 20 años y en estos últimos años las especies de Candida diferentes de C.albicans han ido aumentando26,41,42,44,51,63,68. Aunque es objeto de debate, la opinión más extendida es que el uso profiláctico y empírico de fluconazol ha contribuido a este cambio32. Desde hace unos años, C. albicans muestra una tendencia a producir menos CI, mientras que C. tropicalis y C. parapsilosis muestran una tendencia opuesta44. También hay una distribución geográfica de las especies, así C. albicans representa el 37% en América Latina y el 70% en Noruega, habiendo aumentado C. glabrata en Estados Unidos (20-24%), siendo la frecuencia de esta especie muy baja en América Latina44, la cual en Europa oscila entre el 9 y el 10%44. Estas variaciones de C. glabrata se han atribuido al uso de los azoles y a otros factores44, como la edad, enfermedades subyacentes, etc. C. parapsilosis y C. tropicalis predominan en América Latina.
La mortalidad en las infecciones debidas a especies de Candida diferentes de C. albicans es más elevada que en las producidas por C. albicans13.
Tiene importantes implicaciones terapéuticas identificar las especies de Candida diferentes de C. albicans en el caso de CI, porque algunas especies como C. krusei son inherentemente resistentes al fluconazol o pueden adquirir resistencias secundarias, como es el caso de C. gl abrata.
Se conoce la importancia fundamental que tiene instituir el tratamiento antifúngico en las 12-24 h de aislamiento en hemocultivos de Candida, porque la mortalidad desciende de forma significativa en relación con la rapidez del inicio del tratamiento antifúngico16,19,21,33,43. El reconocimiento rápido de la especie infectante en hemocultivos16,22 es pues muy importante, con el objeto de adelantar la instauración del tratamiento. La observación de que una especie potencialmente resistente, como es C. glabrata, crece más rápidamente en medios anaerobios que en los aerobios resulta tener utilidad para el tratamiento temprano45. Desde un punto de vista clínico, también se ha intentado diferenciar las especies de Candida diferentes de C. albicans10,13,56, aunque estos estudios no hayan resultado totalmente esclarecedores.
Asimismo, se ha reconocido como factor de riesgo de especies de Candida diferentes de C. albicans la utilización de fluconazol2,56, de caspofungina17, así como la cirugía gastrointestinal y el tratamiento antifúngico asociado en pacientes críticos con candidemia47.
Epidemiología de la candidiasis invasora en receptores de trasplante de órgano sólido
En los receptores de trasplante de órgano sólido, las distintas especies de Candida son la causa de la mayor parte de las EFI59, a excepción de los receptores de trasplante de pulmón, en los que Aspergillus es la causa de la gran mayoría de las EFI59.
Los receptores de trasplante hepático con 2 o más factores de riesgo tienen una probabilidad alta de desarrollar CI, en torno al 23%67, siendo entre los pacientes trasplantados los que tienen la incidencia más alta de CI. En este subgrupo de población, hace unos años, la incidencia de CI era más alta, pero el perfeccionamiento y el avance de las técnicas quirúrgicas han hecho que descienda esta incidencia en este subgrupo de población57. Los factores de riesgo son el retrasplante, creatinina > 2 mg/dl, coledocoyeyunostomía, uso intraoperatorio de más de 40 unidades de sangre y colonización por Candida detectada en los 2 días anteriores y 3 días posteriores al trasplante57. La incidencia de EFI en receptores de traspl ante de corazón, páncreas y de intestino (entre el 10 y el 60%) es mayoritariamente debida a Candida (72-100%)55.
En los receptores de trasplante renal, páncreas e intestino delgado, los factores de riesgo de CI son comunes o superponibles a los ya enumerados en el caso de trasplante renal, y en el caso de páncreas se añaden como factores de riesgo: la trombosis vascular del injerto, la pancreatitis posreperfusión y el alentuzumab. En los trasplantes de intestino delgado, los factores de riesgo son el rechazo o la disfunción del injerto, la interrupción de las anastomosis y una inmunodepresión mayor55,57.
Debido a la introducción de profilaxis antifúngica y al tratamiento empírico en los receptores de trasplante de órgano sólido, han aparecido especies de Candida diferentes de C. albicans23,59, muchas de ellas resistentes, como C. glabrata y C. krusei.
Epidemiología de la candidiasis invasora en pacientes oncohematológicos adultos y/o receptores de precursores hematopoyéticos
La prevalencia y/o la mortalidad de CI ha disminuido en los últimos años, y en cambio se ha producido un aislamiento mayor de especies no albicans en pacientes oncohematológicos. Así, por ejemplo, en un estudio basado en necropsias en el Hospital Oncológico Anderson de Estados Unidos, efectuado entre 1989 y 2003, se observó un predominio de C. glabrata (31%) y C. krusei (24%) en los pacientes con malignidad hematológica y en tumores sólidos. C. glabrata y C. krusei causaron el 18 y el 2%, respectivamente, en estos últimos9. El factor más importante era la neutropenia, mientras que los catéteres venosos eran el origen de candidemia, más frecuente en pacientes con tumores sólidos que en oncohematológicos (el 36 frente al 13%)9. El aumento de prevalencia de C. glabrata y C. krusei es objeto de debate; entre otros, los factores que se citan son la edad, la localización geográfica y el amplio uso de fluconazol en profilaxis en pacientes con leucemia mieloide aguda y receptores de precursores hematopoyéticos32. Este último punto es objeto de controversia, porque este cambio ya se había observado antes de la introducción del fluconazol o en pacientes que no se habían tratado con este antifúngico32. En España, en un estudio de la Red de Estudio de Infección en el Trasplante (RESITRA)54, realizado en pacientes receptores de precursores hematopoyéticos, se encontró menos del 5% de CI en una cohorte de 1.318 pacientes. La introducción del fluconazol en profilaxis hizo que la incidencia de CI se situara en torno al 5% (similar a lo encontrado en el estudio de RESITRA)3. Los factores de riesgo relacionados con CI son la colonización gastrointestinal, la enfermedad por citomegalo-virus y el episodio previo de bacteriemia32.
Conclusiones
Antes de la década de 1990, la atención se centraba en pacientes oncohematológicos, por el elevado riesgo de candidemia. Últimamente, los pacientes críticos no neutropénicos, especialmente con estancia prolongada en UCI quirúrgica, han emergido como una subpoblación con riesgo importante de CI. Igualmente, son objeto de atención los receptores de trasplante de órgano sólido con fallo renal, postoperatorio complicado, edad avanzada, con aumento de inmunodepresión e infecciones bacterianas repetidas. En estos últimos años, los avances en neonatología han traído también como consecuencia un aumento de CI.
Por todo lo expuesto, la CI es un problema persistente, ya que la mortalidad no ha cambiado en los últimos años.
Los estudios epidemiológicos demuestran que han emergido especies de Candida resistentes al tratamiento con fluconazol (especies de Candida diferentes de C. albicans), con distribución geográfica variable.
Se están haciendo esfuerzos por hacer estudios prospectivos en las distintas subpoblaciones y para establecer una estratificación del riesgo.
Agradecimientos
Subvenciones y becas: Fondo de Investigaciones Sanitarias, beca PI070107 (a AdP), Fundación Mutua Madrileña Automovilística (a AdP) y beca médica de Pfizer, España (a AdP).
Declaraciones de los autores
Los autores no tienen nada que declarar.
Historia del artículo:
Recibido el 27 de enero de 2009 Aceptado el 9 de febrero de 2009
*Autor para correspondencia.
Correo electrónico: apalacioh.hdoc@salud.madrid.org (A. del Palacio).