Se realizó un estudio retrospectivo desde septiembre de 2001 a septiembre de 2003 de las fungemias por levaduras en el Hospital Nacional de Pediatría Prof. Dr. J. Garrahan, de Buenos Aires.
ObjetivosConocer la distribución de las especies de levaduras de interés médico y evaluar el perfil de sensibilidad in vitro a los antifúngicos.
MétodosSe determinó la concentración mínima inhibitoria (CMI) según el documento M27-A2 del CLSI, y además, las curvas de letalidad frente a la anfotericina B.
Resultados-ConclusionesSe aislaron Candida parapsilosis (32,6% de los aislamientos), Candida albicans (26,5%), Candida tropicalis (24,5%), y otras especies de levaduras (16,4%). Los aislamientos de Candida fueron sensibles a los antifúngicos evaluados pero se detectaron, mediante el uso de curvas de letalidad, cepas tolerantes a la anfotericina B.
A retrospective study on the epidemiology of fungaemia due to yeasts of medical importance at the Hospital Nacional de Pediatría Prof. Dr. J. Garrahan, Buenos Aires was conducted between September 2001 and September 2003.
ObjectivesTo learn the distribution of yeast species and to evaluate their in vitro antifungal susceptibility profile.
MethodsThe minimum inhibitory concentration (MIC) was determined according to the CLSI M27-A2 procedure, and time kill curves against amphotericin B were also performed.
Results-ConclusionsThe species isolated were Candida parapsilosis (32.6% of isolates); Candida albicans (26.5%), Candida tropicalis (24.5%), and other yeasts (16.4%). Candida isolates were susceptible to the antifungals evaluated, but amphotericin B-tolerant isolates were detected using time kill curves.
La candidemia es la infección fúngica nosocomial más frecuente en el medio hospitalario. Sin embargo, su incidencia global es difícil de precisar. Si bien Candida albicans representa, en general, el 50% de las levaduras aisladas, se observa un aumento de nuevas especies emergentes3,4,9,10,18,23,24. En pediatría son escasos los reportes en los que se evalúan los factores de riesgo de mortalidad en las candidemias nosocomiales2,21. Dada la importancia de esta patología, se realizó un estudio retrospectivo sobre la epidemiología de las fungemias en el Hospital Nacional de Pediatría Dr. J. Garrahan, de Buenos Aires, Argentina. Los objetivos fueron determinar la incidencia de las especies implicadas y evaluar los patrones de sensibilidad in vitro a los fármacos antifúngicos.
Materiales y métodosSe realizó un estudio retrospectivo en el que se incluyeron los pacientes que fueron hospitalizados en el Hospital Dr. J. Garrahan entre septiembre de 2001 y septiembre de 2003 y que desarrollaron fungemia por levaduras durante ese periodo.
Las muestras fueron tomadas de hemocultivo periférico y procesadas por métodos automatizados (BacT/Alert, BioMérieux, EE.UU.) y manuales (Isolator 1.5, Wampole Laboratories, EE.UU.)8. La identificación de la especie en cada caso se realizó mediante el API 20C AUX (BioMérieux, Francia) y con estudios adicionales de las características morfológicas, fisiológicas y sexuales según técnicas estandarizadas13.
Se utilizó el método de referencia M27-A2 del Clinical and Laboratory Standards Institute (CLSI)16 para valorar la actividad in vitro de la anfotericina B (AMB) (Sigma-Aldrich, EE.UU.), el fluconazol (FCZ) (Pfizer, Argentina) y el itraconazol (ITZ) (Janssen, Argentina). En todas las pruebas se incluyeron las cepas control de calidad Candida parapsilosis ATCC 22019 y Candida krusei ATCC 625816. Se realizaron curvas de letalidad para evaluar la cinética de actividad fungicida de AMB in vitro a una concentración final de 1mg/l siguiendo el método descrito por Klepser12 con siete cepas de C. parapsilosis, tres de Candida tropicalis y dos de Pichia anomala, seleccionadas de pacientes con evolución clínica desfavorable. El inóculo se preparó a partir de un cultivo de 24h y se ajustó a 1 de la escala McFarland (107UFC/ml). A distintos tiempos de incubación (0; 6; 12; 24; 48 y 72h) se tomaron alícuotas de las suspensiones, con y sin antifúngicos, y se hicieron las diluciones correspondientes en solución 0,15M de cloruro de sodio estéril (solución salina 0,85%) (101; 102; 103; 104)12. Después de incubar durante 24 a 48h se efectuó el recuento de colonias (UFC/ml). Las curvas de letalidad fueron transformadas a log10 (UFC/ml) en función del tiempo, con el fin de evaluar la reducción del inóculo con respecto a los pocillos control (actividad fungicida) durante los tiempos establecidos para las lecturas. El análisis de los datos epidemiológicos se realizó con el programa estadístico R19. El análisis de las frecuencias en tablas de contingencia se realizó con el test exacto de Fisher mediante el procedimiento Fisher test de R1.
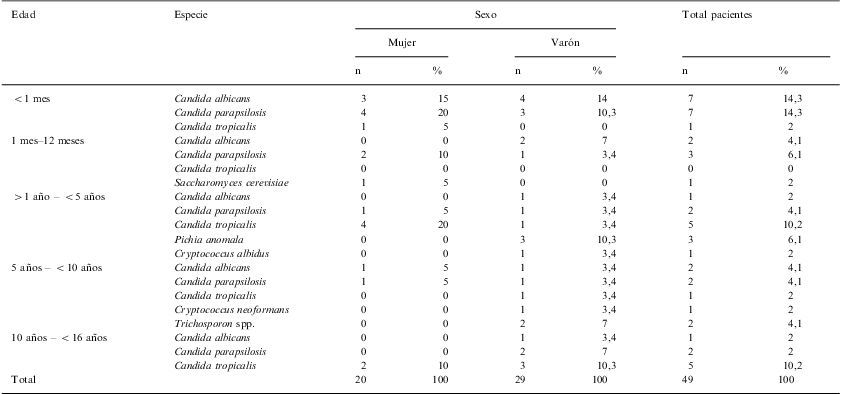
Resultados y discusiónSe estudiaron 48 pacientes en los que se diagnosticaron 49 episodios de fungemia. La edad promedio fue de tres años, y hubo una asociación significativa de fungemia con el sexo masculino (56,3%, p<0,05). El 42,8% de las fungemias se diagnosticó en niños menores de un año. Candida parapsilosis fue la especie aislada con mayor frecuencia (n=16; 32,6%), seguida de C. albicans (n=13; 26,5%) y C. tropicalis (n=12; 24,5%), contrastando con otros trabajos en los que C. albicans era predominante (60%) en una población exclusivamente neonatal17 o global en el ámbito hospitalario5,10,11. Se aislaron además Cryptococcus albidus (n=1; 2%), Cryptococcus neoformans (n=1; 2%), Trichosporon spp. (n=2; 4,2%), Pichia anomala (n=3; 6,1%) y Saccharomyces cerevisiae (n=1; 2%) (tabla 1). Estos microorganismos se han convertido en patógenos emergentes que deberían ser considerados en toda muestra clínica significativa7,14,18. Veinte de los casos (40,8%) procedían de la sala de neonatología, coincidiendo además con el mayor número de aislamientos de C. parapsilosis registrados en todo el hospital. De los 49 episodios de fungemia, 14 (28,5%) estuvieron asociadas a catéter. En siete pacientes se encontró otro lugar de infección; cuatro de ellos presentaron vegetaciones cardíacas por C. albicans, hubo un caso de peritonitis fúngica por C. tropicalis, y en un paciente con diagnóstico de candidiasis hepatoesplénica por C. tropicalis (y sepsis por el mismo agente causal) se aisló C. parapsilosis del hemocultivo 40 días después del primer episodio de fungemia. Al séptimo caso le fue diagnosticada una artritis séptica de cadera por C. albicans, aislándose la levadura los tres días anteriores al hemocultivo periférico.
Distribución por edad y sexo de las especies de levaduras aisladas de fungemias en los pacientes hospitalizados
| Edad | Especie | Sexo | Total pacientes | ||||
| Mujer | Varón | ||||||
| n | % | n | % | n | % | ||
| <1 mes | Candida albicans | 3 | 15 | 4 | 14 | 7 | 14,3 |
| Candida parapsilosis | 4 | 20 | 3 | 10,3 | 7 | 14,3 | |
| Candida tropicalis | 1 | 5 | 0 | 0 | 1 | 2 | |
| 1 mes–12 meses | Candida albicans | 0 | 0 | 2 | 7 | 2 | 4,1 |
| Candida parapsilosis | 2 | 10 | 1 | 3,4 | 3 | 6,1 | |
| Candida tropicalis | 0 | 0 | 0 | 0 | 0 | 0 | |
| Saccharomyces cerevisiae | 1 | 5 | 0 | 0 | 1 | 2 | |
| >1 año – <5 años | Candida albicans | 0 | 0 | 1 | 3,4 | 1 | 2 |
| Candida parapsilosis | 1 | 5 | 1 | 3,4 | 2 | 4,1 | |
| Candida tropicalis | 4 | 20 | 1 | 3,4 | 5 | 10,2 | |
| Pichia anomala | 0 | 0 | 3 | 10,3 | 3 | 6,1 | |
| Cryptococcus albidus | 0 | 0 | 1 | 3,4 | 1 | 2 | |
| 5 años – <10 años | Candida albicans | 1 | 5 | 1 | 3,4 | 2 | 4,1 |
| Candida parapsilosis | 1 | 5 | 1 | 3,4 | 2 | 4,1 | |
| Candida tropicalis | 0 | 0 | 1 | 3,4 | 1 | 2 | |
| Cryptococcus neoformans | 0 | 0 | 1 | 3,4 | 1 | 2 | |
| Trichosporon spp. | 0 | 0 | 2 | 7 | 2 | 4,1 | |
| 10 años – <16 años | Candida albicans | 0 | 0 | 1 | 3,4 | 1 | 2 |
| Candida parapsilosis | 0 | 0 | 2 | 7 | 2 | 2 | |
| Candida tropicalis | 2 | 10 | 3 | 10,3 | 5 | 10,2 | |
| Total | 20 | 100 | 29 | 100 | 49 | 100 | |
La candidemia produce una mortalidad que oscila entre el 40 y el 60%11,20. Comparadas con las bacteriemias, las candidemias ocasionan una mayor tasa de mortalidad (3,6 veces)2. En nuestro estudio, la mortalidad global por causas inherentes a la fungemia fue del 20,8%, siendo más baja que la comunicada por otros autores15,22. Con respecto al tratamiento, 46 de los 48 pacientes (95,8%) recibieron AMB. Ocho fallecieron a pesar del tratamiento.
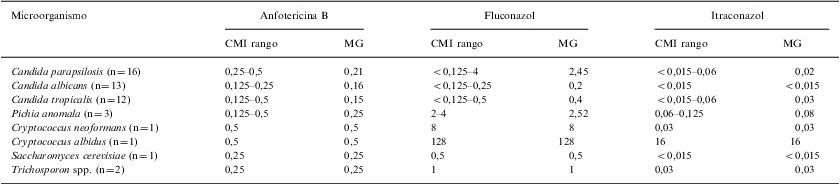
Las especies de Candida junto con Pichia anomala y S. cerevisiae fueron sensibles a los antifúngicos testados. En general, el rango de CMI en mg/l fue de 0,125–0,5; <0,125–4 y <0,015–0,06 para AMB, FCZ e ITZ, respectivamente. C. albidus mostró una menor sensibilidad a FCZ (128mg/l) e ITZ (16mg/ml) (tabla 2), estos hallazgos coinciden con datos de otros autores15. Cuando se realizó la curva de letalidad frente a AMB, se observó un efecto fungicida a las 24h para las dos cepas de P. anomala evaluadas (sensibles); no obstante, las diez cepas de Candida spp. (CMI 0,125–0,5mg/l) fueron tolerantes a la AMB y permanecieron viables aún a las 72h de exposición al antifúngico. Si bien la CMI permite detectar la aparición de resistencia a los azoles en general, parecería no ser adecuada para discriminar los aislamientos sensibles de los resistentes a la AMB. Así, para los fármacos con actividad fungicida, como la AMB, el ensayo de curvas de letalidad permitiría distinguir las categorías de resistencia o tolerancia de los aislamientos frente a este polieno. Por consiguiente, los resultados serían más apropiados como ayuda en la decisión de un tratamiento más efectivo6. Estos hallazgos, aunque preliminares, nos alientan a continuar investigando para contribuir al conocimiento de los patógenos emergentes, la prevención y el correcto manejo de esta alarmante patología que es la infección fúngica nosocomial, y la vigilancia de la sensibilidad/resistencia a los antifúngicos, a la vez que ponderamos la utilidad de las curvas de letalidad para la elección del tratamiento más adecuado6,12.
Distribución por especies de los valores de CMI y su media geométrica en mg/l para los antifúngicos evaluados
| Microorganismo | Anfotericina B | Fluconazol | Itraconazol | |||
| CMI rango | MG | CMI rango | MG | CMI rango | MG | |
| Candida parapsilosis (n=16) | 0,25–0,5 | 0,21 | <0,125–4 | 2,45 | <0,015–0,06 | 0,02 |
| Candida albicans (n=13) | 0,125–0,25 | 0,16 | <0,125–0,25 | 0,2 | <0,015 | <0,015 |
| Candida tropicalis (n=12) | 0,125–0,5 | 0,15 | <0,125–0,5 | 0,4 | <0,015–0,06 | 0,03 |
| Pichia anomala (n=3) | 0,125–0,5 | 0,25 | 2–4 | 2,52 | 0,06–0,125 | 0,08 |
| Cryptococcus neoformans (n=1) | 0,5 | 0,5 | 8 | 8 | 0,03 | 0,03 |
| Cryptococcus albidus (n=1) | 0,5 | 0,5 | 128 | 128 | 16 | 16 |
| Saccharomyces cerevisiae (n=1) | 0,25 | 0,25 | 0,5 | 0,5 | <0,015 | <0,015 |
| Trichosporon spp. (n=2) | 0,25 | 0,25 | 1 | 1 | 0,03 | 0,03 |
CMI: concentración mínima inhibitoria; MG: media geométrica.
Los autores declaran no tener ningún conflicto de intereses.
Una beca para la Investigación Médica otorgada por la Fundación Roemmers facilitó este estudio de colaboración entre el Hospital de Pediatría Prof. Dr. J. P. Garrahan y el INEI, ANLIS Dr. Carlos G. Malbrán.