Evaluar factores de virulencia implicados en el proceso de adhesión, como la hidrofobicidad de la superficie celular (HSC), capacidad de adherencia a plástico y a células epiteliales bucales (CEB), así como formación de biocapa, en 17 cepas de Candida albicans aisladas de aspirados bronquiales de pacientes críticos.
MétodoSe determinó la HSC de las cepas utilizando el método MATH, test de adheresión microbiana a hidrocarburos. El estudio de adherencia al plástico se llevó a cabo en placas de microtitulación según la técnica de Christensen. Se estudió la formación de biocapa sobre placas de microtitulación de poliestireno según el método de Ramage. La adherencia a CEB se valoró cuantificando el porcentaje de levaduras adheridas a células.
ResultadosTodas las cepas estudiadas mostraron factores implicados directamente en la adherencia existiendo variabilidad en el grado de expresión de los mismos. Un 52,9% de las cepas presentaron niveles medio-altos de HSC. El 35,3% de las cepas tenían valores altos de adherencia a plástico. Las cepas más hidrofóbicas fueron las más adherentes a plástico, encontrándose un coeficiente de correlación de 0,76. De las 12 cepas productoras de biocapa, 6 de ellas eran altamente productoras. Estas cepas presentaban también altos niveles de HSC y adherencia a plástico con resultados significativos. Todas las cepas estudiadas se adhirieron a CEB dentro de un amplio rango de resultados, desde 45 a 157 lev/100 CEB, sin correlación significativa con el resto de parámetros estudiados, aunque la HSC se mostró como un requisito previo indispensable para la adherencia a células.
ConclusiónLa HSC es una característica variable en C. albicans y está directamente relacionada con la adherencia a plástico y con la formación de biocapa. La facilidad de valoración de la HSC nos permite su cuantificación y posibilita su utilización como indicador de la presencia de otros determinantes de patogenicidad.
To evaluate virulence factors involved in the adhesion process, such as cell surface hydrophobicity (CSH), adherence to plastic capacity, adherence capacity to buccal epithelial cells (BEC), and biofilm formation, in 17 strains of C. albicans isolated from bronchial aspirates of critically ill patients.
MethodThe CSH of the strains of C. albicans was determined using the MATH method, a microbial adhesion to hydrocarbons test. The study of adherence to plastic was performed in microtitre plates in accordance with Christensen's technique. Biofilm formation was studied in polystyrene microtitre plates, according to the method of Ramage. Adherence to BEC was evaluated by quantifying the percentage of adhered yeasts to cells.
ResultsAll the strains studied showed factors directly involved in adhesion, with variability in the degree of expression among them. Medium-high levels of CSH were found in 52.9% of the strains. The percentage of strains with high values in adherence to plastic was 35.3%. The most hydrophobic strains were the most adherent to plastic, with a correlation coefficient of 0.76. Of the 12 biofilm-producing strains, 6 were high producers. These strains had also high levels of CSH and adherence to plastic, with significant results. All the strains studied adhered to BEC, with results ranging widely from 45 to 157 yeasts/100 BEC, with no significant correlation with the rest of the parameters studied, although CSH was seen to be an indispensable prior requisite for adherence to cells.
ConclusionCSH is a variable characteristic in C. albicans and is directly related to adherence to plastic and biofilm formation. Ease in evaluating CSH permits its quantification, and could be used as an indicator of the presence of other determinants of pathogenicity.
La infección nosocomial por Candida albicans es actualmente una de las más frecuentes por hongos oportunistas, tiene una elevada mortalidad en pacientes críticos4, y presenta una patogenia compleja. La infección depende tanto de la efectividad de los mecanismos defensivos del hospedador como de los factores de virulencia del hongo. C. albicans es la especie más comúnmente aislada al ser la que con más frecuencia coloniza a la población al contar con una serie de factores de virulencia que le permiten la invasión de tejidos17. Entre ellos, juegan un papel importante la patogenicidad, la capacidad de adherencia y la formación de biocapa.
La adherencia de C. albicans a las células del huésped o a biodispositivos constituye el primer paso necesario para la colonización y desarrollo de la infección15. El proceso ocurre en varias fases. La primera, inespecífica, basada en fuerzas de atracción y repulsión entre las que destaca la hidrofobicidad de las superficies12, permite iniciar la colonización. A continuación, se establecen interacciones específicas entre proteínas de la pared celular de las levaduras que actúan como adhesinas y los receptores de las células epiteliales23. La mayoría de las funciones biológicas relacionadas con la patogenicidad y con la virulencia de C. albicans residen en la pared celular fúngica, jugando un papel fundamental en la interfase levadura-hospedador1. Una vez adheridos, muchos microorganismos son capaces de formar una biocapa, estructura tridimensional de levaduras e hifas envuelta en una matriz exopolimérica, estableciendo un sistema de vida que les protege7 y favorece su supervivencia al impedir su erradicación18.
El objetivo de este trabajo es evaluar conjuntamente factores de virulencia de C. albicans implicados en el proceso de adherencia y formación de biocapa y su relación con la hidrofobicidad de la superficie celular (HSC) de las levaduras. En este trabajo estudiamos en cepas de C. albicans aisladas de aspirados bronquiales de pacientes críticos la HSC, la capacidad de adherencia a plástico, a células epiteliales bucales (CEB) y la formación de biocapa.
Material y métodosMicroorganismos. Se utilizaron 17 cepas de C. albicans aisladas de aspirados bronquiales de pacientes diferentes, de la unidad de cuidados intensivos (UCI) del Complejo Hospitalario Universitario Infanta Cristina de Badajoz y la cepa control de colección aislada de broncoaspirado C. albicans ATCC 10231. La identificación se realizó según las técnicas habituales de laboratorio.
Las cepas, conservadas en viales Microbanc (Prolab, Ontario, Canadá) a −80°C, se sembraron en placas de Sabouraud, realizándose al menos dos subcultivos en medio RPMI 1640 (Sigma, España) suplementado con 2% de glucosa para las distintas valoraciones.
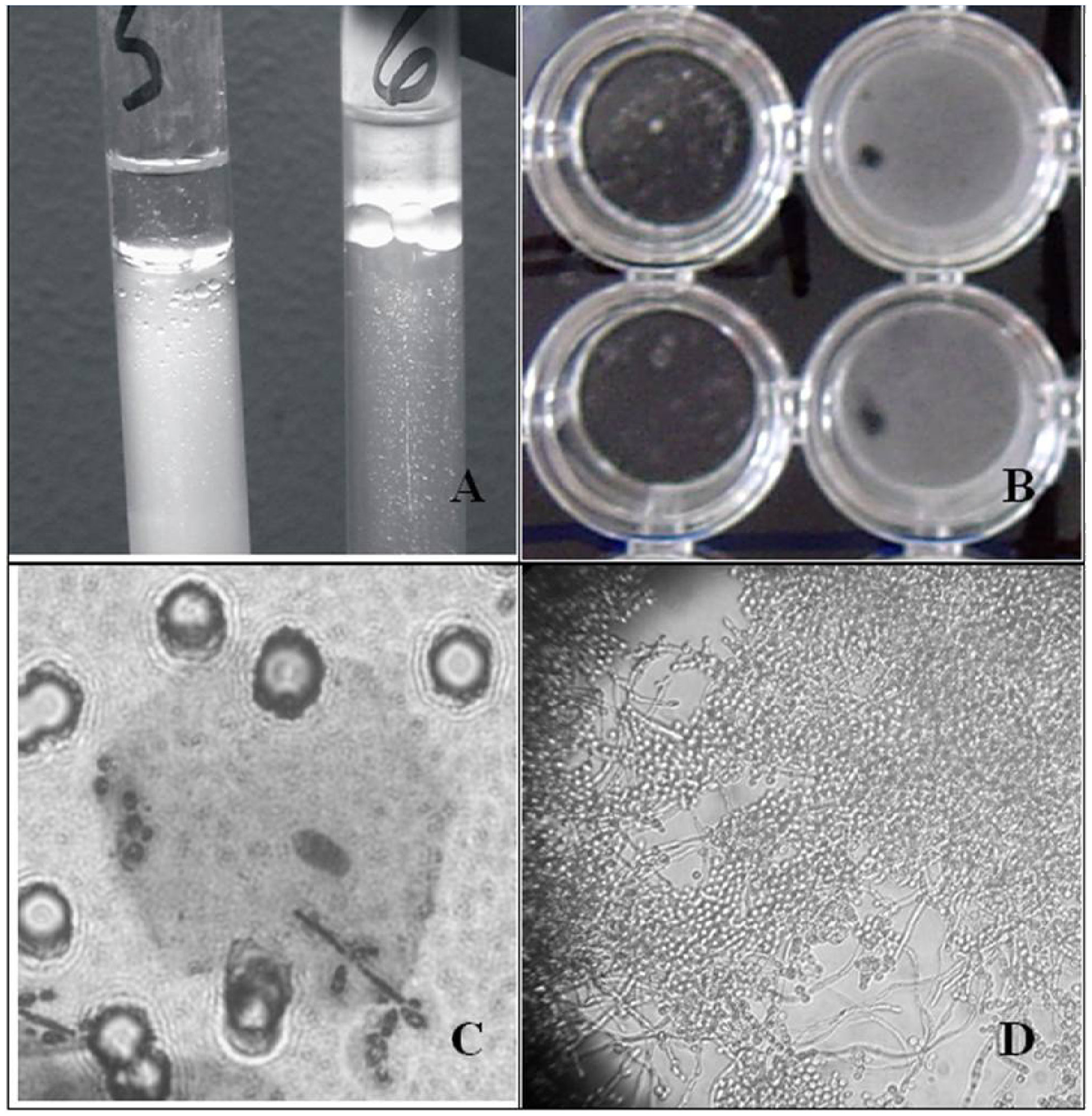
Hidrofobicidad de superficie celular (HSC). Se determinó la HSC utilizando el método bifásico agua-hidrocarburo MATH (test de adhesión microbiana a hidrocarburos) descrito por Rosenberg et al20 modificado por Hazen y Hazen10. Las levaduras se incubaron en agitación 24h a 37°C en matraces con medio RPMI 1640 suplementado con 2% de glucosa. Se lavaron tres veces y se prepararon suspensiones en tampón fosfato (PBS: PO4HK2-1,04g/l; PO4H2K-0,54g/l; Cl Na-8,77g/l; pH 7,2) con una densidad óptica de 0,4 a 490nm (DO490). Se añadió 1ml de xilol a cada tubo con 3ml de la suspensión preparada, se agitaron durante 1min y se dejaron separar las dos fases, midiéndose de nuevo la DO de la fase acuosa. La HSC se calculó como el porcentaje de reducción de la turbidez de la fase acuosa inicial, al quedar las células hidrofóbicas retenidas en el xilol (fig. 1A).
Adherencia sobre materiales plásticos. El estudio de adherencia se llevó a cabo según la técnica descrita por Christensen et al6. De la suspensión preparada para la HSC (DO490 0,4 en PBS), se depositaron alícuotas de 250μl en pocillos de placas de poliestireno de fondo plano (Greiner, Alemania) y se incubaron sin agitación a 37°C. A las 24h los pocillos se lavaron tres veces con PBS frío y se leyó en el espectrofotómetro a 490nm la DO de las células que estaban adheridas a los mismos (fig. 1B). Se estableció como punto de corte una DO490 de 0,53.
Formación de biocapa. Se estudió la formación de biocapa sobre placas de microtitulación de poliestireno de 96 pocillos con fondo plano (Greiner) según el método descrito por Ramage et al19. Se distribuyeron en los pocillos 250μl de una suspensión estandarizada de 106levaduras/ml en RPMI 1640, incubándose 24h a 37°C en atmósfera húmeda. Posteriormente se eliminaron las células planctónicas, lavando tres veces con PBS frío. Se realizó una medida de la biocapa formada, cuantificando la reacción colorimétrica producida por la reducción enzimática del XTT [2,3-bis (2-metoxi-4-nitro-5-sulfofenil)-2H-tetrazolio-5-carboxianilida] (Sigma, España). Para ello se añadió a cada pocillo 250μl de una solución de 0,5g/l de XTT en lactato de Ringer, añadiéndole metadiona en el momento del ensayo (Sigma, 10mM en acetona) hasta una concentración 1μM. Se incubaron las placas en oscuridad a 37°C durante una hora y se leyó la reacción colorimétrica formada extrayendo 100μl del reactivo añadido, transfiriéndolo a una nueva placa para la lectura de su densidad óptica (DO490-XTT).
Previamente se realizó un examen microscópico-fotográfico de la biocapa formada utilizando un microscopio Leitz Diaplan® de campo claro dotado con un objetivo 40x capaz de trabajar a larga distancia (fig. 1D).
Adherencia a células epiteliales bucales (CEB). Se determinó según el método descrito por Blanco et al3. A partir de cultivos de las cepas en medio RPMI 1640 a 37°C durante 24h y de una muestra de CEB, obtenida por hisopado de la mucosa bucal de un donante sano, se prepararon suspensiones en PBS de 107lev/ml y 105CEB/ml, incubándose 2ml de una mezcla a partes iguales en rotor durante 1h. Esta mezcla era filtrada utilizando filtros de 13mm de diámetro de policarbonato con 10μm de poro (Millipore, España) para retener las CEB con las levaduras adheridas. Los filtros, una vez fijados a portaobjetos, se teñían con cristal violeta. La determinación del número de levaduras adheridas a CEB se realizó mediante recuento microscópico con el objetivo de inmersión, refiriéndose el resultado a número de levaduras por 100 CEB (fig. 1C), contando solo células aisladas.
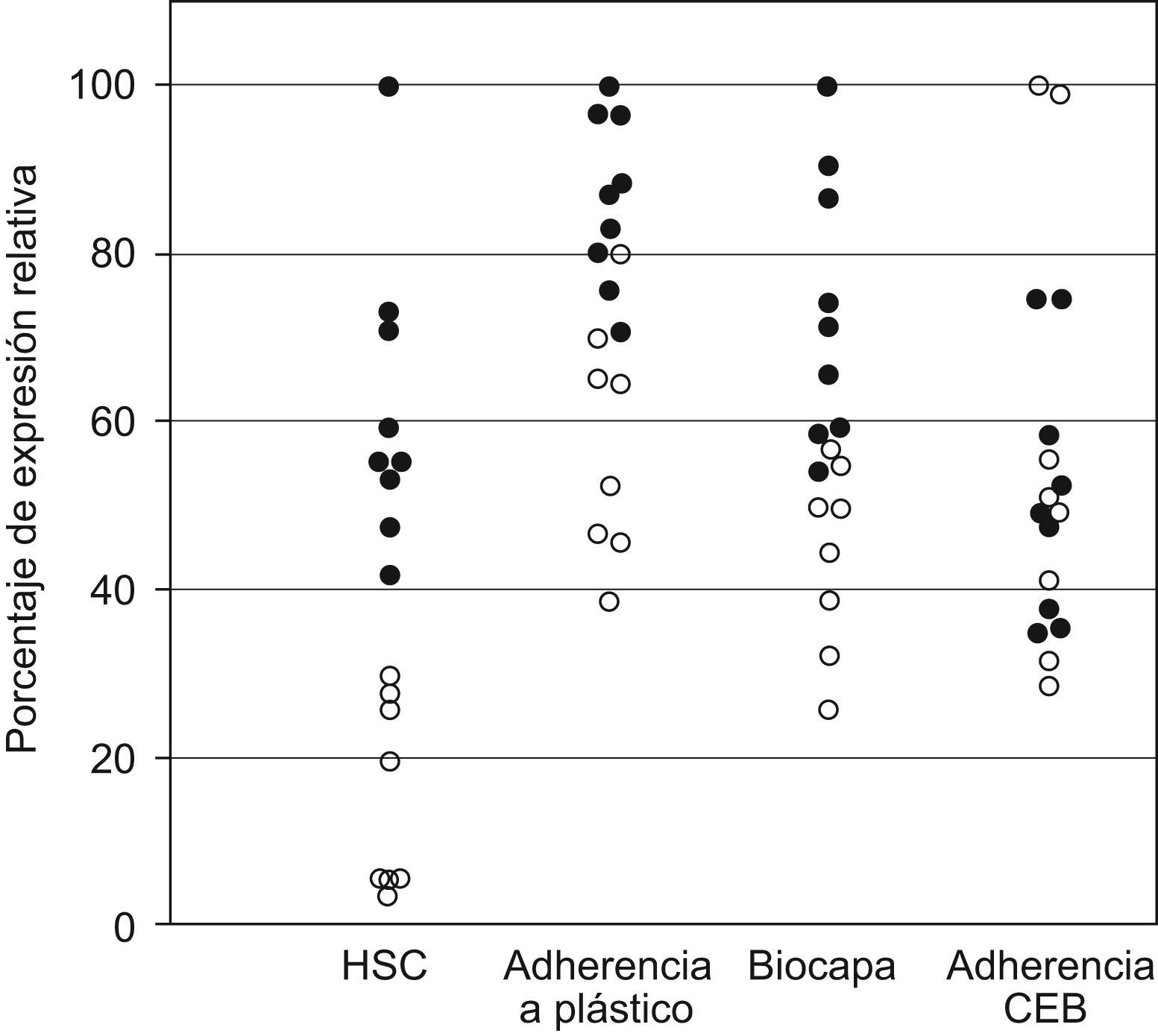
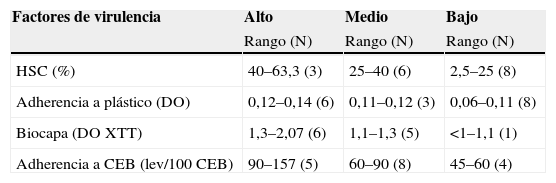
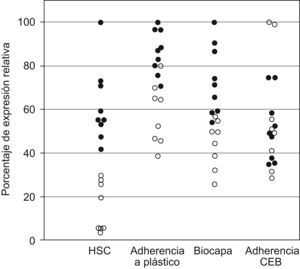
ResultadosLas 17 cepas obtenidas de broncoaspirados mostraron factores implicados directamente en la adhesión, existiendo variabilidad en el grado de expresión de los mismos. En la tabla 1 se recogen los resultados de cada uno de los parámetros estudiados, indicando rango y número de cepas incluidas en cada rango. En la figura 2 se representan los datos individuales convirtiendo los valores numéricos en porcentaje de expresión relativa, adjudicando el 100% al máximo valor obtenido. Todos los experimentos se realizaron al menos por triplicado en días diferentes.
Distribución de las 17 cepas de C. albicans aisladas de broncoaspirados según niveles de HSC, capacidad de adherencia a plástico, formación de biocapa y adherencia a células epiteliales bucales
| Factores de virulencia | Alto | Medio | Bajo |
| Rango (N) | Rango (N) | Rango (N) | |
| HSC (%) | 40–63,3 (3) | 25–40 (6) | 2,5–25 (8) |
| Adherencia a plástico (DO) | 0,12–0,14 (6) | 0,11–0,12 (3) | 0,06–0,11 (8) |
| Biocapa (DO XTT) | 1,3–2,07 (6) | 1,1–1,3 (5) | <1–1,1 (1) |
| Adherencia a CEB (lev/100 CEB) | 90–157 (5) | 60–90 (8) | 45–60 (4) |
CEB: células epiteliales bucales; HSC: hidrofobicidad de la superficie celular.
HSC, adherencia a plástico, biocapa formada y adherencia a CEB de C. albicans. Se toma como referencia la HSC y se representa en todas las series como (¿) el 50% de las cepas mas hidrofóbicas y como (○) el resto de las cepas. Se calcula el porcentaje de expresión relativa adjudicando el 100% en cada serie al máximo valor alcanzado por una cepa: para HSC=63,3; para adherencia a plástico DO=0,14; biocapa DO XTT=2,07; adherencia a CEB=157lev/100CEB.
La hidrofobicidad de las 17 cepas obtenidas de broncoaspirados fluctuó en un rango desde 2,5 hasta 63,3% de HSC. Un 52,9% de las cepas presentaron niveles medio-altos de HSC (HSC >25%) en RPMI 1640 a 37°C, representando esas cepas como círculos negros en la figura 2 en todos los parámetros estudiados.
Todas las cepas fueron adherentes a plástico incubadas a 37°C en medio RPMI 1640 (Rango DO 0,06–0,14), presentando el 35,3% de las cepas valores altos de adherencia (DO>0,12), encontrándose un coeficiente de correlación con los niveles de HSC de 0,76 (p<0,01).
De la 17 cepas, 12 fueron productoras de biocapa (66,6%; Rango DO XTT 1,0–2,07), siendo altamente productoras 6 de ellas (35,3%; DO XTT>1,3). Estas cepas presentaban también altos niveles de HSC y adherencia. Las 4 cepas restantes dieron valores bajos (DO XTT 0,4–1), valores que correspondían a levaduras adheridas sin biocapa formada. El coeficiente de correlación entre biocapa formada con HSC fue de 0,70 y con la adherencia a plástico de 0,57 (p<0,01).
Todas las cepas se adhirieron a CEB dentro de un amplio rango de resultados desde 45 a 157lev/100CEB, con un valor medio de 84,7±32,9lev/100 CEB. Un 29,4% de ellas presentaron altos niveles (>90 levaduras en 100 CEB). Al estudiar la correlación entre la adherencia a CEB de las cepas de C. albicans con el resto de parámetros estudiados no se encontraron resultados estadísticamente significativos con los niveles de HSC ni con la adherencia a plástico ni con la producción de biocapa.
La cepa patrón C. albicans ATCC 10231 presentaba niveles bajos de HSC (9,5%), de adherencia a plástico (DO 0,109) y formación de biocapa (DO XTT 0,40) y un nivel medio de adherencia a CEB (72,5lev/100 CEB).
DiscusiónEl estudio de factores de virulencia en Candida spp. ha recibido especial atención en los últimos años13. La capacidad de adherencia de C. albicans se considera un importante factor de patogenicidad al permitir la colonización y posterior desarrollo de la infección. En ella están implicados mecanismos de diferente naturaleza, unos que establecen uniones de carácter físico-químico que acercan el patógeno a la superficie del huésped y otros de naturaleza específica y que implican la presencia de adhesinas y receptores en el substrato. La formación de una biocapa, una vez adheridas las levaduras, será un punto crucial en la virulencia de Candida11. Tumbarello et al22 han observado que la producción de biocapa por Candida se asocia a una mortalidad más elevada en pacientes con candidemia, probablemente al impedir la erradicación completa de este microorganismo del torrente circulatorio.
La HSC es un carácter variable en C. albicans, en el que pueden influir tanto características ambientales2 como el origen de las cepas aisladas9. En el medio RPMI 1640, y a 37°C, C. albicans crece desarrollando un carácter hidrofóbico variable entre las cepas. Ello posibilita semicuantificar el grado de HSC y relacionarlo con los otros factores analizados en este trabajo.
Entre la capacidad de adherencia a plástico y los niveles de HSC encontramos una correlación muy significativa que evidencia el grado de relación existente entre ambos procesos. La relación hidrofobicidad-adherencia a plástico ha sido descrita por numerosos autores3,12. La caracterización de la superficie celular hidrofóbica y la naturaleza del sustrato ha sido utilizada como valor predictivo para la capacidad de adherencia21.
La mayoría de nuestras cepas (66,6%) fueron productoras de biocapa, siendo este porcentaje muy superior al 11,8% encontrado por Gokce et al8. Esta discrepancia puede ser explicada en base al diferente medio utilizado, ya que C. albicans en RPMI 1640 es hidrofóbica, mientras que en Sabouraud—medio utilizado por Gokce et al8— es hidrofílica. Nuestros resultados ofrecen una correlación estadísticamente significativa entre formación de biocapa con la HSC y la adherencia a plástico. Efectivamente, algunos autores encuentran correlación directa entre HSC y biocapa5,14, mientras que otros autores afirman que depende del origen de la cepa estudiada9. Podemos afirmar que en nuestro trabajo, las cepas mas hidrofóbicas produjeron mayores biocapas.
Todas las cepas estudiadas se adhirieron a CEB, sin correlación significativa con el grado de HSC, ni con los niveles de adherencia a plástico, ni con la formación de biocapa. Estos resultados están aparentemente en contradicción con los obtenidos por Jabra-Risk et al12, que encuentran que las cepas de C. albicans incubadas en Sabouraud a 37°C no se adhieren a células epiteliales, pero sí lo hacen las cepas de C. dubliniensis. La no adhesión encontrada por estos autores puede ser explicada en base al distinto medio utilizado, ya que C. albicans incubada en Sabouraud a 37°C es hidrofílica mientras que C. dubliniensis es hidrofóbica3. Por el contrario la incubación en RPMI 1640, medio utilizado en este trabajo, origina levaduras con carácter hidrofóbico que posibilita la adherencia. Efectivamente, cuando hemos utilizado cepas de C. albicans incubadas en otros medios como YPD o Sabouraud, medios en los que las levaduras crecen hidrofílicas a 37°C, la adherencia a CEB fue prácticamente inexistente (datos no mostrados). Nuestros resultados parecen indicar que la HSC es un requisito necesario para adherirse a células, pero son otros mecanismos los que influyen en el nivel de la misma. Okawa et al16 encuentran que HSC y adherencia a células están directamente relacionadas con la patogenicidad de las cepas.
En conclusión, la HSC es una característica variable en C. albicans y está directamente relacionada con la adherencia a plástico y con la formación de biocapa. La facilidad de valoración de la HSC nos permite la cuantificación de un factor de virulencia que podría ser utilizado como indicador de la presencia de otros determinantes de patogenicidad de valoración más compleja. No obstante, es necesario ampliar la muestra estudiada para poder confirmar su significación estadística.
FinanciaciónEsta investigación ha sido financiada con el proyecto PRI09A021 de la Junta de Extremadura, FEDER y el CIBER BBN, Badajoz, España.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.
Agradecemos a Guadalupe Gómez-Landero su ayuda técnica en el laboratorio.