El paisaje epidemiológico de las micosis invasoras está en continua evolución, hecho que tiene implicaciones importantes en el diagnóstico y el tratamiento. El número de estas infecciones sigue siendo alto, particularmente en recién nacidos, ancianos y pacientes ingresados en UCI, o que usan prótesis, catéteres u otros dispositivos intravenosos, o reciben diferentes tratamientos inmunosupresores o quimioterapia antineoplásica, o en los receptores de trasplantes. Además, pueden estar asociadas a la infección por el VIH. Muchas micosis se adquieren por inhalación, contacto o ingestión, pero los hongos también pueden acceder al torrente sanguíneo a través de agujas y catéteres.
La candidiasis invasora continúa siendo la micosis más frecuente, pero se observa un cambio etiológico progresivo de Candida albicans a otras especies de Candida, como Candida parapsilosis, Candida glabrata o la especie multirresistente Candida auris. Sin embargo, la aspergilosis invasiva puede ser predominante en entornos muy específicos, como el de los receptores de trasplante de médula ósea. Además, Pneumocystis, Cryptococcus, Fusarium y Rhizopus pueden causar enfermedades devastadoras. Existen importantes variaciones etiológicas, entre hospitales y países, relacionadas con múltiples factores, como sus características locales y las enfermedades subyacentes de los pacientes, o las diferentes praxis en los servicios médicos y quirúrgicos. La mortalidad atribuida sigue siendo alta, aunque varía del 30% en la candidiasis invasora al 90-100% en determinadas presentaciones clínicas de escedosporiasis y mucormicosis. La gran complejidad de los pacientes y la creciente diversidad de hongos patógenos son desafíos importantes para mejorar el diagnóstico, crear redes de vigilancia e implementar medidas de control de estas micosis.
The landscape of invasive mycoses is in a continuous evolution with important implications for their diagnosis and treatment. The overall burden remains high, particularly in neonates and the elderly, patients admitted to intensive care units, using prostheses, catheters or other intravenous devices, those receiving different immunosuppressant treatments or antineoplastic chemotherapy, or transplant recipients. In addition, opportunistic mycoses can be associated with HIV infection. Many fungal infections are acquired by inhalation, direct contact or ingestion, but fungi can also enter into the bloodstream through needles or catheters.
Invasive candidiasis remains the most frequent mycosis, but its aetiology progressively shifts from Candida albicans to other species of Candida, such as Candida parapsilosis, Candida glabrata, or the multiresistant Candida auris. However, aspergillosis can be predominant in specific conditions, such as bone marrow transplant recipients. Moreover, Pneumocystis, Cryptococcus, Fusarium and Rhizopus can cause devastating illnesses. There are significant variations among hospitals and countries that are related to many factors, such as local characteristics of mycoses and patients, or different practices between medical and surgical wards. The attributed mortality remains high, ranging from 30% in invasive candidiasis to 90-100% in some clinical presentations of scedosporiosis and mucormycosis. The extremely complexity of patients and the growing diversity of pathogenic fungi are major challenges for improving diagnosis, creating surveillance networks, and implementing control measures for these invasive infections.
Nuestro planeta está habitado por cientos de miles de especies de hongos, y es muy posible que falten por identificar alrededor de un millón de especies nuevas. La inmensa mayoría de estos hongos desempeñan un papel importante en el reciclado de la materia orgánica en descomposición y contribuyen de forma eficiente a que los sistemas estén equilibrados. Sin embargo, un número escaso de centenares de especies pueden comportarse como hongos patógenos oportunistas y causar enfermedades. Apenas unas decenas son patógenos verdaderos, capaces de provocar micosis superficiales leves o invadir y dañar tejidos y órganos internos que causan infecciones invasoras de mortalidad elevada. Candida, Aspergillus, Cryptococcus, Pneumocystis e Histoplasma son la causa del 90% del millón y medio de muertes anuales que se estima están asociadas con las micosis invasoras, un número que es similar al de los fallecimientos causados por paludismo y tuberculosis1,7,9,13,46,55.
Existen importantes variaciones temporales y geográficas en la epidemiología de las micosis invasoras. Es importante conocer con mayor precisión qué grupos de pacientes están en una situación de riesgo mayor y qué enfermedades subyacentes, factores médico-quirúrgicos y hábitos son los que predisponen a padecerlas. Entre las personas en un riesgo mayor de sufrir una micosis invasora destacan los infectados por el VIH y otros pacientes con inmunodeficiencias graves, los niños prematuros o recién nacidos de bajo peso por su inmadurez inmunitaria, los ancianos por su inmunosenescencia, los enfermos en estado grave ingresados en unidades de cuidados intensivos, aquellos que necesitan el uso de prótesis, catéteres u otros dispositivos intravenosos, los pacientes con quemaduras graves, los que han sufrido intervenciones quirúrgicas extensas, sobre todo del aparato digestivo, los receptores de trasplantes de progenitores hematopoyéticos o de órganos sólidos, y los tratados de forma prolongada con bioterapia, fármacos antineoplásicos, antibióticos de amplio espectro, corticoides, inmunosupresores u otros fármacos que alteran las barreras anatómicas, la microbiota y las defensas innatas o adaptativas (tabla 1)6,7,9,27,29,40,41,46.
Factores y enfermedades que predisponen a desarrollar una infección fúngica invasora
| Factor | Micosis |
|---|---|
| Exposición ambiental | AspergilosisMicosis endémicasHialohifomicosisFeohifomicosis |
| Rotura de las barreras anatómicas (cirugía, catéteres, quimioterapia, ventilación asistida, hemodiálisis, diálisis peritoneal, traumatismo, etc.) | CandidiasisAspergilosisInfección por Malassezia |
| Alteración o supresión de la microbiota por el tratamiento antimicrobiano | CandidiasisAspergilosis |
| Neutropenia y deficiencias en la fagocitosis | CandidiasisAspergilosisTricosporonosisGeotricosisHialohifomicosisFeohifomicosis |
| Inmunodeficiencia celular (sida, recepción de órganos trasplantados, bioterapia, etc.) | AspergilosisCandidiasisCriptococosisNeumocistosisHistoplasmosisCoccidioidomicosis |
| Inmadurez inmunitaria e inmunosenescencia | Candidiasis |
| Diabetes y otras enfermedades metabólicas | MucormicosisCandidiasis |
El escenario actual de las micosis invasoras nos muestra una población de pacientes inmunodeprimidos en continuo aumento, y una profilaxis y un tratamiento de las candidiasis invasoras causadas por Candida albicans cada vez más eficaces, junto con un incremento de las infecciones por otras especies de Candida, Aspergillus, mucorales, Fusarium, Lomentospora/Scedosporium, Cryptococcus y otros hongos levaduriformes. La etiopatogenia de estas micosis emergentes es menos conocida, y su diagnóstico y tratamiento son mucho más complicados1,17,42,47. Un ejemplo de esta compleja situación es la preocupante aparición de brotes nosocomiales de infecciones graves causadas por Candida auris, un hongo multirresistente a los fármacos antifúngicos de uso habitual, que muestra una elevada capacidad de adaptación y persistencia en el medio hospitalario15,42.
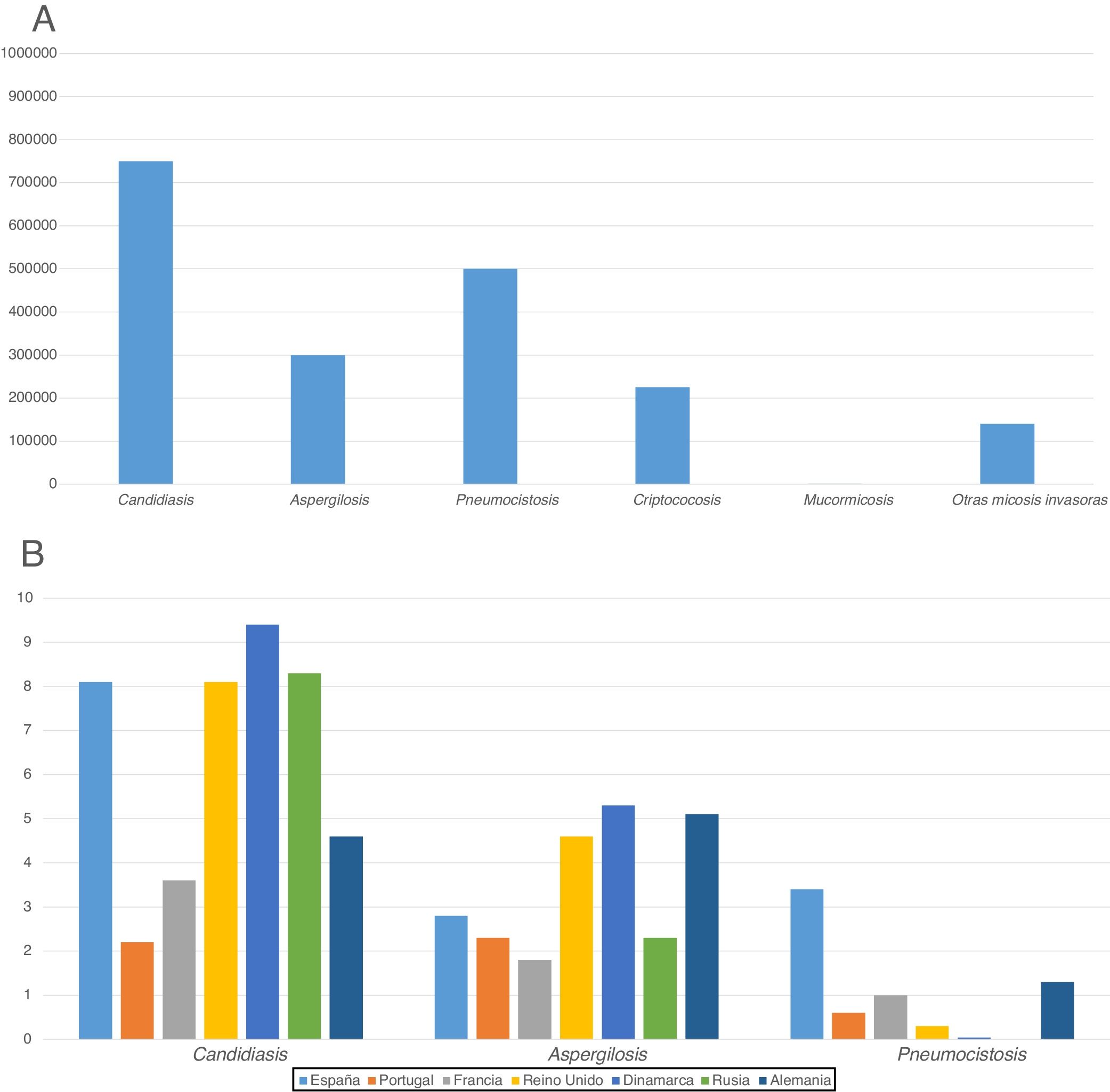
Además, el hecho de que las micosis invasoras no sean consideradas enfermedades de declaración obligatoria impide conocer las cifras reales de morbimortalidad causadas por estas infecciones en cada país y dificulta el esclarecimiento de muchos de los factores y variables que influyen en su prevalencia. En este sentido, es muy interesante el trabajo de estimación del número de casos anuales de micosis en diferentes países llevado a cabo por Bongomin et al. dentro del programa LIFE7. Aunque la definición de micosis de índole grave que han utilizado es bastante subjetiva en estos trabajos se estima que entre un 1 y un 3% de la población mundial las padece, con una gran variación entre países. Probablemente, la incidencia anual estimada de la candidiasis invasora de 2-20 casos por cada 100.000 habitantes se acerca bastante a la realidad. Las incidencias mayores se encontrarían en países como España, Dinamarca o Estados Unidos, donde diversos estudios poblacionales han encontrado cifras similares3,17,27,44. La incidencia parece más baja para la criptococosis meníngea y diseminada y la aspergilosis invasora (1 a 6 casos), pero se observan grandes variaciones epidemiológicas entre países y centros hospitalarios de un mismo país relacionadas con las condiciones socio-sanitarias, las enfermedades y sus factores de riesgo subyacentes la praxis médica en los diferentes servicios hospitalarios, etc. (fig. 1). La incidencia anual de las micosis invasoras menos frecuentes todavía es más difícil de establecer, aunque se estima que se producen 0,2 casos anuales de mucormicosis y entre 0,1 y 0,2 casos de hialohifomicosis y feohifomicosis. La mortalidad atribuida a las micosis invasoras se mantiene demasiado alta: entre el 20 y el 40% en la candidiasis invasora, más del 50% en la aspergilosis invasora y más del 90% en algunas mucormicosis y escedosporiasis7,21,24,25,38,44,49,52.
Incidencia anual estimada de las principales micosis invasoras: A) Global. B) En algunos países europeos (por cada cien mil habitantes)7,21,24,38,49,52.
Un reducido grupo de hongos, como Candida y Malassezia, forman parte de la microbiota humana. Sin embargo, provocan micosis endógenas cuando las condiciones fisiológicas adecuadas se alteran en favor del microorganismo. La mayoría de las especies de Candida que habitan en el ser humano colonizan las superficies corporales desde los primeros días de vida. La boca y el aparato digestivo están colonizados por Candida en el 30-50% de las personas, siendo más frecuente en lactantes, ancianos con prótesis dentales, personas que han recibido un tratamiento con antibióticos o quimioterapia, personas con diabetes mal controlada, pacientes hospitalizados y personas infectadas por el VIH. C. albicans puede aislarse en el aparato genital del 10-40% de las mujeres sin candidiasis vulvovaginal. La colonización del aparato digestivo es el origen endógeno de la mayoría de las candidiasis invasoras. La alteración de las barreras anatómicas y fisicoquímicas por intervenciones quirúrgicas, inserción de catéteres intravenosos o sondas urinarias facilita la entrada de Candida en el torrente sanguíneo y su diseminación multiorgánica. Además, la modificación o supresión de la microbiota por un tratamiento con antibióticos de amplio espectro facilita la proliferación y aumento de la población celular de Candida y un desequilibrio en la inmunidad del huésped que incrementa el riesgo de translocación intestinal y el paso de Candida a la sangre (tabla 1)3,10,19,45,46,48.
Las candidiasis invasoras son la causa de morbimortalidad global más importante. Sin embargo, habría que indicar que en algunas zonas del planeta, como el África subsahariana y determinadas áreas de América, sus habitantes sufren micosis graves sobreañadidas habitualmente a la infección por el VIH, como la meningoencefalitis criptocócica o diferentes presentaciones de histoplasmosis diseminada. En estos enfermos con infección por el VIH, las micosis invasoras han disminuido de manera drástica en aquellas naciones con mejores condiciones sociosanitarias gracias a la generalización del tratamiento efectivo con fármacos antirretrovirales40,41,48,55.
La incidencia de la candidiasis invasora aumentó en las décadas de 1980 y 1990, probablemente como consecuencia de las terapias inmunosupresoras usadas en el tratamiento de las neoplasias y en el trasplante de órganos. Aunque su incidencia se mantiene estable en la actualidad, la mortalidad asociada no ha descendido en enfermos críticos ni en pacientes con neutropenia profunda o con otras inmunodeficiencias. Candida continúa siendo uno de los cinco agentes patógenos aislados con mayor frecuencia en hemocultivos en muchos hospitales terciarios. Este es un dato relevante porque la candidemia es solo la punta del iceberg de las candidiasis invasoras, ya que Candida solo se recupera del 25-70% de los hemocultivos de los pacientes que la sufren3,27,39,48,60.
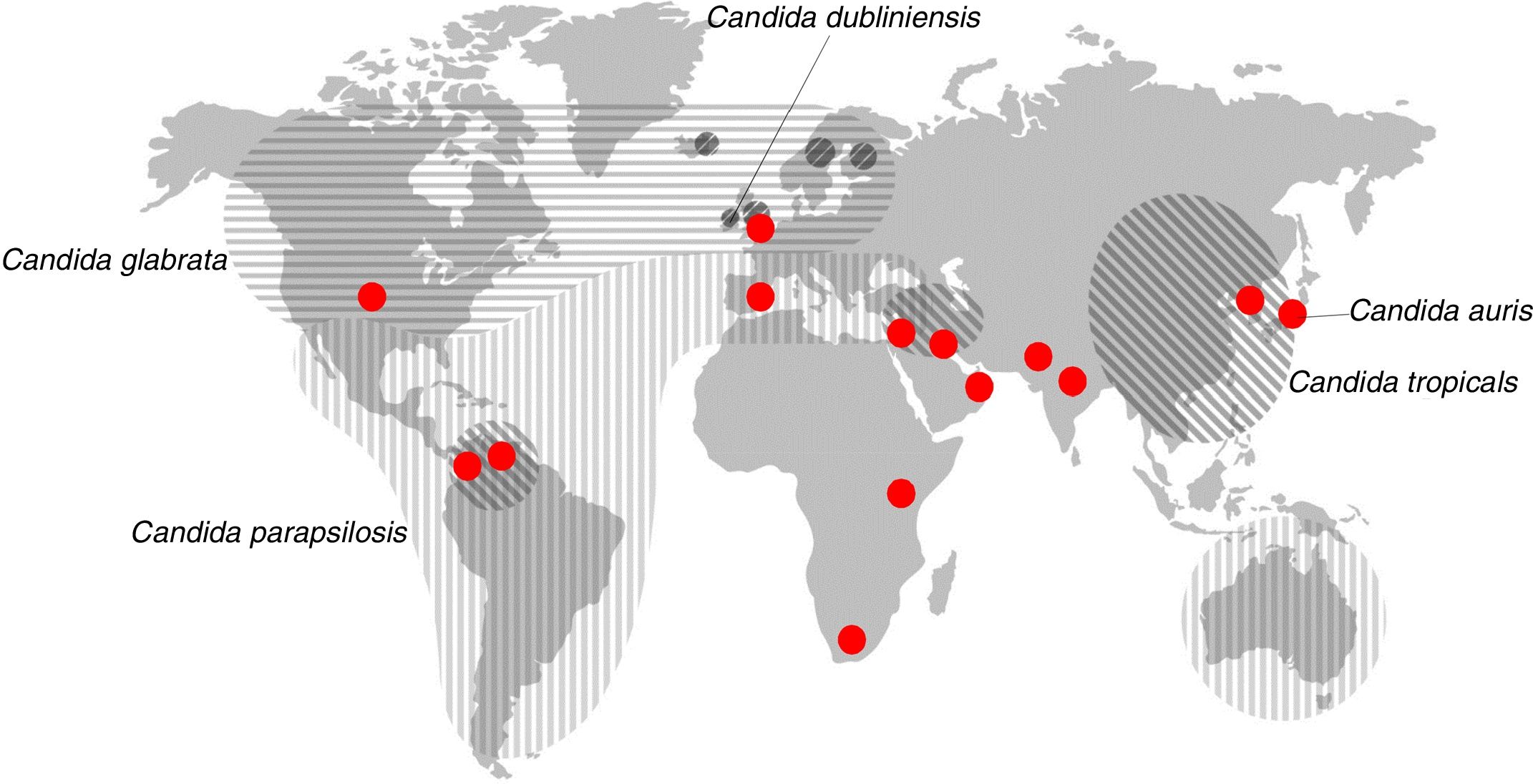
También puede producirse una transmisión exógena de Candida a través de materiales y objetos contaminados, por el personal sanitario y entre pacientes. Suele asociarse a la nutrición parenteral, al uso intravenoso de fármacos, al reemplazamiento de válvulas cardiacas, prótesis o al trasplante de órganos (tabla 1). El ingreso en la UCI y la prolongación de la estancia hospitalaria son factores independientes de riesgo de padecer candidiasis invasora y de transmisión nosocomial de Candida. Es importante señalar que un tercio de las candidiasis invasoras se diagnostican en enfermos que reciben cuidados sanitarios en su domicilio que necesitan nutrición parenteral, quimioterapia, hemodiálisis o diálisis peritoneal ambulatoria crónica. Alrededor del 95% de las candidiasis invasoras están causadas por cinco especies de Candida: C. albicans, Candida parapsilosis, Candida glabrata, Candida tropicalis y Candida krusei (fig. 2). Otras especies como Candida dubliniensis, Candida guilliermondii, Candida lusitaniae, Candida norvegensis y Candida rugosa pueden causar infecciones de manera esporádica. Las candidiasis están causadas en su mayoría (40-75%) por la especie C. albicans. Sin embargo, cada vez son más frecuentes las candidiasis invasoras causadas por C. parapsilosis, C. glabrata o C. tropicalis, que se caracterizan por su menor sensibilidad a los fármacos antifúngicos27,31,42,44,45,48.
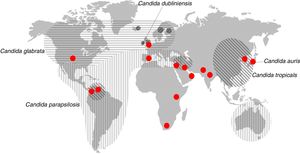
Distribución geográfica de las especies principales de Candida diferentes de Candida albicans que son la segunda causa de candidemia. Los círculos rojos representan los lugares donde se han descrito candidiasis causadas por Candida auris.Fuente: modificada de Quindós45.
En América Latina, España y otros países mediterráneos, C. parapsilosis se aísla en los hemocultivos con mayor frecuencia que C. glabrata, sobre todo en recién nacidos prematuros de bajo peso ingresados en UCI neonatales y en pacientes que reciben nutrición parenteral en asociación al uso de catéteres intravasculares. Las candidiasis invasoras causadas por C. parapsilosis tienen menor mortalidad (20%) y su origen exógeno permite adoptar medidas preventivas eficaces. C. glabrata es un patógeno cada vez más frecuente en América del Norte y en los países del centro y norte de Europa. C. glabrata, C. tropicalis y C. krusei se aíslan con mayor frecuencia en ancianos, pacientes con neoplasias hematológicas y receptores de trasplante de progenitores hematopoyéticos con neutropenia profunda o prolongada. La etiología de las candidiasis se complica aún más si tenemos en cuenta que C. glabrata engloba por lo menos a tres especies, Candida glabrata sensu stricto, Candida bracarensis y Candida nivariensis, y algo similar ocurre con C. parapsilosis, que integra a Candida parapsilosis sensu stricto, Candida metapsilosis y Candida orthopsilosis. En el reciente estudio epidemiológico español Fungemyca, C. orthopsilosis era la quinta causa de candidemia, por delante de C. krusei, un hecho que tiene especial relevancia clínica31,39,40,44,58. Se puede consultar una revisión reciente en la que se detallan las variaciones geográficas de la etiología de las candidiasis invasoras45.
En los últimos años, varias agencias han emitido alertas sanitarias ante la aparición y expansión de C. auris, una especie emergente que causa infecciones, muchas veces en forma de brotes, relacionadas con los cuidados de la salud, sobre todo en UCI y las unidades de reanimación, y cuya mortalidad puede llegar a superar el 40%16,20,59. Esta especie es resistente al fluconazol y algunas cepas han mostrado multirresistencia a otros fármacos, como el voriconazol, la anfotericina B e, incluso, las equinocandinas28. C. auris se aisló por primera vez en 2009 de una paciente japonesa de 70 años que padecía una infección del oído (de ahí el epíteto auris)53.
Después de la descripción del primer caso, se ha comprobado que algunas candidiasis en Corea del Sur (2008), atribuidas etiológicamente a otras especies de Candida, habían sido causadas por C. auris34. Además, se han descrito nuevos casos de candidiasis invasora entre 2011 y el momento actual en Corea del Sur, India, Pakistán, Sudáfrica, Kenia, Kuwait, Venezuela, Reino Unido, Colombia, España, Israel y Estados Unidos (fig. 2)5,8,11,32,35,51,54.
Lockhart et al.30 han realizado un estudio retrospectivo exhaustivo reidentificando más de 15.000 aislamientos de Candida que habían sido obtenidos desde 2004 en hemocultivos. Solo encontraron cuatro aislamientos de C. auris obtenidos en 2004, 2009, y dos de 2015. Sin embargo, estos autores no encontraron más aislamientos de C. auris entre 1996 y 2009. Entre las causas de esta nueva aparición de C. auris se consideran como las más probables el mayor uso de los fármacos antifúngicos y el cambio del nicho ecológico de esta especie15,16,54.
Dos de los brotes hospitalarios de candidiasis por C. auris más importantes han ocurrido en el Royal Brompton Hospital (Londres) en 201554 y en el Hospital La Fe (Valencia) en 201651. Este último brote aún se mantiene activo. Ambos nos muestran el origen exógeno de C. auris y su gran capacidad para persistir de forma prolongada, meses o años, en el ambiente hospitalario, un hecho probablemente asociado a la existencia de brechas en las medidas de control de la infección. C. auris ha sido aislada del suelo de las habitaciones con pacientes colonizados o infectados, de las superficies del mobiliario, pantallas y teclados, y del alféizar interior de las ventanas, donde todas ellas podrían actuar como reservorios. C. auris posee unas características que la hacen más resistente que otras especies de Candida, como la tolerancia a la temperatura (viable a 42°C) y a concentraciones bajas de detergentes y antisépticos de uso hospitalario51,54,57. Varios estudios con técnicas moleculares de tipificación de los aislamientos han confirmado una transmisión de C. auris dentro del hospital a partir del ambiente y de los dispositivos médicos contaminados con esta especie, y de las manos del personal sanitario y otros trabajadores del hospital. Estos estudios moleculares han permitido establecer varios grupos homogéneos de aislamientos clínicos de C. auris relacionados geográficamente (Corea/Japón, India/Pakistán, Sudáfrica y Venezuela/Colombia) que han emergido de forma independiente, pero se están diseminando a otras regiones8,30.
Otras levaduras causan micosis cuyos cuadros clínicos pueden ser graves, como meningitis (Cryptococcus), neumonía (Pneumocystis) o enfermedad invasora diseminada (Saprochaete, Geotrichum, Rhodotorula, Saccharomyces y Trichosporon), sobre todo en poblaciones muy concretas de pacientes graves, como los que sufren neoplasias hematológicas y reciben un tratamiento de profilaxis antifúngica 1,9,13,40,55. La mayoría de las infecciones causadas por Malassezia se han descrito en recién nacidos prematuros o de bajo peso y en otros pacientes que recibían una nutrición parenteral rica en lípidos. Malassezia pachydermatis ha provocado brotes nosocomiales de fungemia en pacientes cuidados por dueños de perros con otitis externa causadas por esta10,37.
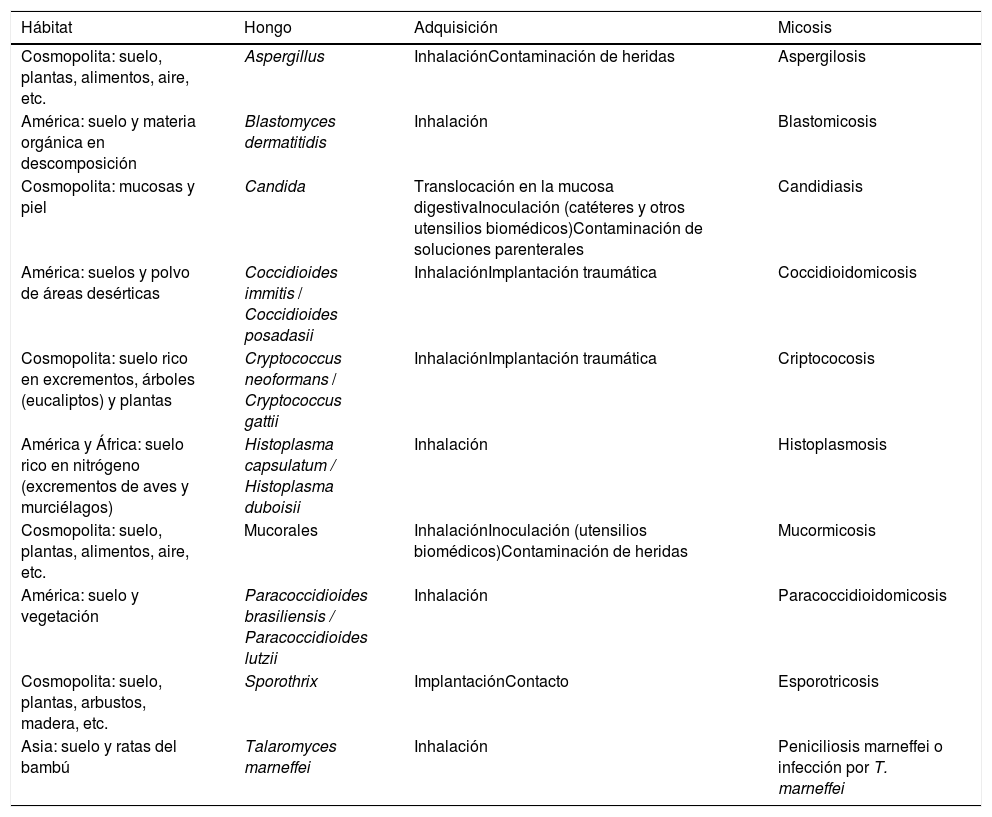
Sin embargo, la mayoría de los hongos no necesitan parasitar al ser humano ni a otros animales para sobrevivir. El reservorio telúrico, suelo enriquecido con materia orgánica y compuestos nitrogenados, es uno de los nichos ecológicos al que están perfectamente adaptados. Estos hongos actúan como agentes exógenos, bien con un carácter cosmopolita (Aspergillus, Cryptococcus, Fusarium, mucorales, Sporothrix, etc.), o bien están restringidos a determinadas regiones geográficas (hongos dimorfos como Blastomyces dermatitidis, Coccidioides immitis y Coccidioides posadasii, Paracoccidioides brasiliensis y Paracoccidioides lutzii, Histoplasma capsulatum o Talaromyces marneffei). B. dermatitidis se ha aislado en zonas boscosas con excrementos de castores, P. brasiliensis en madrigueras de armadillos, H. capsulatum en cuevas habitadas por murciélagos, y C. posadasii y C. immitis en zonas desérticas contaminadas con excrementos de murciélagos y roedores (tabla 2). Los viajes transoceánicos, las migraciones, la apertura de nuevos espacios para el asentamiento humano que provocan deforestación y otras alteraciones del entorno, junto con los cambios climáticos regionales y globales, están provocando importantes modificaciones en la distribución geográfica de las micosis. Un ejemplo es la aparición de brotes de criptococosis por Cryptococcus gattii en la isla canadiense de Vancouver (Columbia británica) y en los estados de Washington y Oregón (EE.UU.). Estas dos áreas están lejos de sus nichos ecológicos en zonas tropicales y subtropicales. Otro ejemplo es la micosis por T. marneffei (Penicillium marneffei), conocida como peniciliosis marneffei o talaromicosis, que se observa casi en exclusiva en el sudeste asiático. La ampliación de los hábitats muestra la gran capacidad adaptativa de hongos, como C. immitis o C. posadasii, a las condiciones más extremas, y resaltan el hecho de que podemos encontrarnos con hongos potencialmente patógenos en todas las latitudes y ambientes que pueden causar brotes infecciosos6,13,14,23,50.
Ecología fúngica
| Hábitat | Hongo | Adquisición | Micosis |
|---|---|---|---|
| Cosmopolita: suelo, plantas, alimentos, aire, etc. | Aspergillus | InhalaciónContaminación de heridas | Aspergilosis |
| América: suelo y materia orgánica en descomposición | Blastomyces dermatitidis | Inhalación | Blastomicosis |
| Cosmopolita: mucosas y piel | Candida | Translocación en la mucosa digestivaInoculación (catéteres y otros utensilios biomédicos)Contaminación de soluciones parenterales | Candidiasis |
| América: suelos y polvo de áreas desérticas | Coccidioides immitis / Coccidioides posadasii | InhalaciónImplantación traumática | Coccidioidomicosis |
| Cosmopolita: suelo rico en excrementos, árboles (eucaliptos) y plantas | Cryptococcus neoformans / Cryptococcus gattii | InhalaciónImplantación traumática | Criptococosis |
| América y África: suelo rico en nitrógeno (excrementos de aves y murciélagos) | Histoplasma capsulatum / Histoplasma duboisii | Inhalación | Histoplasmosis |
| Cosmopolita: suelo, plantas, alimentos, aire, etc. | Mucorales | InhalaciónInoculación (utensilios biomédicos)Contaminación de heridas | Mucormicosis |
| América: suelo y vegetación | Paracoccidioides brasiliensis / Paracoccidioides lutzii | Inhalación | Paracoccidioidomicosis |
| Cosmopolita: suelo, plantas, arbustos, madera, etc. | Sporothrix | ImplantaciónContacto | Esporotricosis |
| Asia: suelo y ratas del bambú | Talaromyces marneffei | Inhalación | Peniciliosis marneffei o infección por T. marneffei |
La mayoría de las micosis invasoras exógenas se adquieren por inhalación de conidios que si no son eliminados en el pulmón pueden multiplicarse en los alvéolos y diseminarse a otros órganos por contigüidad o por vía sanguínea. En el aire hay un elevado número de conidios fúngicos y la baja incidencia de las micosis invasoras refleja la gran eficacia de nuestros mecanismos defensivos innatos y adaptativos. Según el estado inmunitario de las personas, pueden causar infecciones asintomáticas, procesos pulmonares granulomatosos o infecciones generalizadas con una mortalidad alta. Otras vías de entrada son el contacto directo, la implantación por un traumatismo o pinchazos con espinas y astillas (mucorales, Pseudallescheria, Sporothrix, etc.), la ingesta (Microsporidium y mucorales), la cirugía, sobre todo abdominal, o el acceso a la circulación sanguínea a través de agujas, catéteres, prótesis u otros dispositivos biomédicos (Aspergillus, Geotrichum, Trichosporon, Saprochaete, etc.)6,12,26,46,50.
Cryptococcus neoformans y C. gattii son la segunda causa de enfermedad fúngica invasora por levaduras. C. neoformans es un saprobio ubicuo del suelo, vegetales, frutos y madera en descomposición, sobre todo contaminados con excrementos de palomas y de otras aves, encontrados en palomares, plazas, patios, campanarios, azoteas, etc. Además, se ha aislado de productos alimenticios, como la leche de cabras y vacas con mastitis criptocócica, y otros reservorios insospechados como las amebas (Acanthamoeba castellani) y nematodos del suelo (Caenorhabditis elegans), en los que se mantiene activo. El 90% de las infecciones por C. neoformans en sus dos variedades, C. neoformans variedad grubii (serotipo D, más propio de climas templados) y C. neoformans variedad neoformans (serotipo A, cosmopolita) se describen en pacientes con alguna inmunodeficiencia, en los que causa elevadas tasas de mortalidad. La meningitis por C. neoformans es una causa importante de muerte en el África subsahariana de personas jóvenes con inmunidad celular deficiente, como los infectados por el VIH. Cryptococcus se adquiere habitualmente por vía respiratoria, por lo que hay que tener en cuenta que la criptococosis pulmonar puede ser más frecuente que la meníngea en los receptores de trasplantes de órganos sólidos o de progenitores hematopoyéticos, en los pacientes con neoplasias hematológicas y en aquellos con tratamiento prolongado con corticoides. C. gattii (serotipos B y C) es un endófito de árboles, como los eucaliptos (Eucalyptus camaldulensis y Eucalyptus tereticortis), sobre todo de zonas tropicales y subtropicales. La enfermedad causada por C. gatti se asocia a una mortalidad más baja, pero las secuelas neurológicas (granulomas cerebrales) son graves1,18,46.
En un reciente estudio poblacional realizado en España (FILPOP), Alastruey-Izquierdo et al.2 observaron una prevalencia media de 1,6 aislamientos de hongos filamentosos por millón de habitantes. Aspergillus representaba el 86,3% de los aislamientos clínicos: Aspergillus fumigatus (48,5% de los aislamientos), Aspergillus flavus (8,4%), Aspergillus terreus (8,1%), Aspergillus tubingensis (6,8%) y Aspergillus niger (6,5%). El alto número de aislamientos de Aspergillus diferentes de A. fumigatus puede plantear problemas diagnósticos y terapéuticos al ser más difíciles de identificar y presentar una menor sensibilidad a los fármacos antifúngicos de uso habitual en el tratamiento de estas micosis42. El resto de los géneros de hongos filamentosos no superaba el 5% de los aislamientos: Lomentospora / Scedosporium (4,7%), mucorales (2,5%), Penicillium (2,2%) y Fusarium (1,2%). Esta imagen del estudio FILPOP complementa lo observado por Pemán et al.39 en el estudio FUNGEMYCA, en el que Fusarium era el único género de hongos filamentosos aislado en hemocultivos.
Aspergillus se adquiere por inhalación y puede causar focos primarios en pulmón y senos paranasales en pacientes con inmunodeficiencia. También se han descrito brotes de aspergilosis nosocomial en pacientes sometidos a cirugía cardiovascular en quirófanos contaminados con conidios de Aspergillus. La exposición ambiental a las conidiosporas favorecida por los sistemas de ventilación o procedentes de obras en los hospitales puede ser causa de brotes nosocomiales. La neutropenia grave (<500células/mm3) y prolongada (más de 10 días), una función fagocitaria defectuosa y las alteraciones de la inmunidad celular son factores predisponentes para el desarrollo de una aspergilosis invasora22,43. Se ha estimado que la incidencia de la aspergilosis es mayor en pacientes con leucemia mieloide aguda y en receptores de trasplante alogénico de progenitores hematopoyéticos, corazón, pulmón e hígado (5-15%) y menor en los receptores de trasplante autógeno, riñón y páncreas (<5%). Otros factores de riesgo son la fibrosis quística, las enfermedades pulmonares crónicas, la malnutrición, el tratamiento con corticoides, la infección por el VIH, la diabetes y los tumores sólidos. En estos pacientes, la mortalidad de la aspergilosis invasora es muy elevada (40 al 50%)50,55,56.
Las infecciones invasoras causadas por hongos filamentosos diferentes de Aspergillus tienen una incidencia mucho menor y casi siempre se observan en personas con inmunodeficiencias graves4,29,41,50. Destacan las escedosporiasis y las fusariosis, pero cada vez se observa un número mayor de hialohifomicosis y feohifomicosis. La entrada habitual es a través de la piel, facilitada por los traumatismos, con infecciones subcutáneas, musculares y óseas, o por inhalación, causando infecciones en senos paranasales y pulmón, muchas veces con isquemia, hemorragia y necrosis. Entre los hongos filamentosos hialinos, sin pigmentación, destacan Acremonium, Beauveria, Fusarium, Paecilomyces, Penicillium, Pseudallescheria/Scedosporium, Purpureocillium, Sarocladium, Scopulariopsis y Trichoderma. Entre los hongos dematiáceos, de pigmentación oscura, destacan los géneros Alternaria, Aureobasidium, Bipolaris, Cladophialophora, Curvularia, Exophiala, Exserohilum, Hortaea, Lomentospora, Phialophora y Rhinocladiella. La mayoría de estas micosis plantean grandes problemas diagnósticos y son necesarios métodos moleculares para la identificación correcta de la especie implicada, pero esta es importante por las diferencias observadas en la sensibilidad a los fármacos antifúngicos6,26,42,46,47,50. Perlin et al.42 han publicado recientemente una interesante y actualizada revisión sobre el problema global que representa la resistencia a los fármacos antifúngicos, su prevalencia, mecanismos y posibles soluciones.
Las mucormicosis son poco frecuentes, pero se asocian a una elevada mortalidad (50-100%). La diabetes mellitus descompensada (cetoacidosis diabética) o mal controlada, las inmunodeficiencias, la mielosupresión, las neoplasias hematológicas y la insuficiencia renal son enfermedades que predisponen a sufrir una mucormicosis. Los pacientes que reciben tratamientos prolongados o con dosis altas de corticoides, los que reciben múltiples transfusiones de sangre o los dializados con sobrecarga de hierro, debido al empleo de deferoxamina (un quelante de hierro y aluminio), también son más propensos a desarrollar mucormicosis. La mayoría de las mucormicosis están causadas por el género Rhizopus, pero otros géneros como Lichtheimia (Absidia), Apophysomyces, Cunninghamella, Mucor, Rhizomucor y Saksenaea se describen con cierta frecuencia. Es importante resaltar que existen variaciones cualitativamente importantes en la actividad antifúngica contra los mucorales que podrían permitir diferentes aproximaciones terapéuticas y que hay fármacos antifúngicos poco activos contra los mismos, como candinas, fluconazol, itraconazol o voriconazol4,12,26,29,33,36,41.
La presión antifúngica asociada tanto al tratamiento de las micosis como a la profilaxis de las mismas en grupos de pacientes con elevado riesgo de contraer una micosis ha influido en la epidemiología de estas enfermedades6. La reciente revisión de Perlin et al.42 aborda los problemas asociados con el uso elevado de fármacos antifúngicos tanto en el tratamiento y la prevención de las micosis humanas y animales como en el de las plagas fúngicas de las cosechas. El aumento de C. parapsilosis en algunos países se ha asociado a varios factores, entre ellos la introducción en la terapia humana de las equinocandinas. Un efecto similar había sido descrito con anterioridad asociando el uso del fluconazol y el aumento de las candidiasis causadas por C. glabrata, C. tropicalis o C. krusei15,27,39. Esta presión del empleo de azoles podría estar asociada con la aparición de los brotes de candidemia por C. auris15,25. Otro hecho epidemiológico importante es la asociación de la aparición de resistencia a los azoles en cepas de A. fumigatus con el uso de fármacos antifúngicos utilizados en agricultura2,22,29,42.
El paisaje epidemiológico de las micosis invasoras está en un cambio continuo. Existen importantes variaciones etiológicas entre hospitales y países, relacionadas con múltiples variables locales, con los factores de riesgo de los pacientes o las diferentes praxis médicas y quirúrgicas. El conocimiento adecuado de la etiología y la epidemiología de estas micosis puede facilitar la creación de redes de vigilancia, obtener un diagnóstico temprano e instaurar el tratamiento más adecuado para el enfermo.
FinanciaciónGuillermo Quindós ha recibido ayudas para la investigación de la Consejería de Educación, Universidades e Investigación del Gobierno Vasco-Eusko Jaurlaritza (GIC15 78 IT-990-16), del Ministerio de Economía y Competitividad del Gobierno de España, MINECO (SAF2017-86188-P) y de la Universidad del País Vasco/Euskal Herriko Unibertsitatea, UPV/EHU (UFI 11/25).
Conflicto de interesesEn los últimos cinco años Guillermo Quindós ha recibido ayudas para la investigación de Astellas Pharma, Pfizer, Merck Sharp and Dohme y Scynexis. Ha sido consultor de Merck Sharp and Dohme y Scynexis, y ha participado en actividades científicas patrocinadas por Abbvie, Astellas Pharma, Gilead Sciences, Merck Sharp and Dohme, Pfizer y Scynexis.