En las últimas décadas se ha observado un incremento de las infecciones fúngicas invasoras ocasionadas por levaduras. Aunque Candida albicans es el principal aislamiento de muestras clínicas, ha aumentado la proporción de afecciones debidas a otras especies de Candida y levaduras pertenecientes a otros géneros. La aparición de un mayor número de aislamientos resistentes a diversos antifúngicos obliga a una identificación presuntiva rápida de estos microorganismos para poder instaurar el tratamiento antimicótico adecuado.
El empleo de diferentes medios de cultivo con sustratos cromogénicos ha demostrado su indudable valor como herramienta para el diagnóstico presuntivo de levaduras. Con el objetivo de evaluar la utilidad del medio cromogénico Brilliance Candida Agar en comparación con otro de uso habitual en nuestro país, CHROMagar Candida, se organizó un estudio multicéntrico en 16 hospitales de la Red de Micología del Gobierno de la Ciudad de Buenos Aires (Argentina). Se estudiaron 240 cepas provenientes de materiales clínicos y los resultados obtenidos con el Brilliance Candida fueron comparables a los del CHROMagar.
Fungal infections caused by yeasts have increased during the last decades and invasive forms represent a serious problem for human health. Candida albicans is the species most frequently isolated from clinical samples. However, other emerging yeast pathogens are increasingly responsible for mycotic infections, and some of them are resistant to some antifungal drugs. Consequently, it is necessary to have methods that can provide a rapid presumptive identification at species level.
Numerous chromogenic agar media have been shown to be of value as diagnostic tools. We have compared a chromogenic medium, Brilliance Candida Agar, with CHROMagar Candida, the chromogenic medium most used in our country. A multicentre study was conducted in 16 Hospitals belonging to the Mycology Net of Buenos Aires City Government. A total of 240 yeast isolates were included in this research.
The new chromogenic agar showed results very similar to those obtained with CHROMagar Candida.
Las infecciones fúngicas ocasionadas por levaduras son muy frecuentes en las últimas décadas, y Candida spp. está en el cuarto lugar entre los microorganismo aislados de hemocultivos en Estados Unidos19 y en el quinto en España como agente etiológico de sepsis21. C. albicans causa el 50–60% de las candidemias seguida de C. parapsilosis (10–20%) y C. tropicalis (6–7%). En Argentina, las fungemias causadas por levaduras fueron predominantes (33,76%) entre las infecciones sistémicas oportunistas6 y las formas invasoras presentan una elevada mortalidad constituyendo un grave problema de salud pública2,7,11. Las afecciones producidas por levaduras se han incrementado paralelamente con el aumento de patologías tales como sida, trasplantes de médula ósea o de órganos sólidos, internaciones prolongadas en unidades de cuidados intensivos, cirugías abdominales, tratamientos con antibióticos, corticoides, quimioterapia u otras drogas, etc18.
Candida albicans continúa siendo el aislamiento clínico más frecuente, pero la emergencia de otras levaduras, principalmente aquellas que demuestran mayor resistencia a algunos antifúngicos, hace imprescindible la identificación rápida a nivel de especie de estos microorganismos10,20,22.
La incorporación de medios con sustratos cromogénicos ha sido un gran adelanto en la identificación presuntiva de levaduras3–5,9 a la vez que ha permitido reconocer la presencia simultánea de 2 o más especies en una misma muestra clínica. La orientación acerca del microorganismo involucrado permite seleccionar el antifúngico más adecuado hasta que se realice la identificación definitiva3,5,10.
En nuestro país se comercializan desde hace tiempo CHROMagar Candida® (CHROMagar Company Ltd., Francia) y Candida ID2® (bioMérieux, Francia). Durante el último año se ha incorporado Brilliance® Candida Agar (Oxoid, Reino Unido).
El fundamento de estos medios es la inclusión de sustratos cromogénicos que, ante la presencia de actividad enzimática específica de las levaduras, producen un color determinado. Las enzimas que se revelan son hexosaminidasa y fosfatasa alcalina; la primera está presente en Candida tropicalis, C. albicans y Candida dubliniensis, en tanto que Candida krusei posee fosfatasa alcalina; otras especies también pueden presentar discreta actividad de esta última enzima y la variación en la tonalidad depende del sustrato cromógeno y la pigmentación natural de la levadura.
El objetivo de este trabajo fue evaluar la utilidad del medio cromogénico de Oxoid para la identificación presuntiva de levaduras en comparación con CHROMagar Candida mediante un estudio multicéntrico llevado a cabo en 16 hospitales de la Red de Micología del Gobierno de la ciudad de Buenos Aires (GCBA).
Materiales y métodosLevaduras estudiadas: se incluyeron en total 240 aislamientos: 46 C. albicans, 6 C. dubliniensis, 34 C. tropicalis, 34 Candida parapsilosis, 36 C. krusei, 35 Candida glabrata, 9 Candida guilliermondii, 1 Candida inconspicua, 2 Candida lipolytica, 16 Trichosporon spp., 7 Saccharomyces spp. y 14 Cryptococcus neoformans. Las levaduras provenían de muestras clínicas de pacientes de tres Hospitales del GCBA, F. J. Muñiz, J. Fernández y P. de Elizalde, y habían sido previamente identificadas por métodos convencionales.
Como control se incluyeron las siguientes cepas: ATCC 22019 (C. parapsilosis), ATCC 6258 (C. krusei), ATCC 90028 y ATCC 90029 (C. albicans), CECT 11473 y NCPF 3949 (C. dubliniensis).
Siembra e incubación: todas las cepas se subcultivaron en medio de agar glucosado de Sabouraud y se incubaron a 28°C durante 24–48h. Se realizaron suspensiones de las levaduras en solución fisiológica que se ajustaron al n.° 2 de la escala de Mc Farland, y se repicaron simultáneamente a placas de Brilliance Candida Agar (BCA) y CHROMagar Candida (CHM). Las placas se incubaron a 28°C durante 6 días y fueron observadas diariamente.
Los dos medios fueron preparados según las especificaciones de los fabricantes. Para evitar diferencias en la preparación del medio BCA, las placas fueron preparadas únicamente en la Unidad Micología del Hospital Muñiz y distribuidas a cada integrante de la red; el CHM fue preparado en cada hospital.
Identificación de las levaduras utilizadas: las identificaciones de las 240 levaduras fueron realizadas por medio de las pruebas comerciales de API ID32C, API 20C, VYTEC (bioMérieux, Francia) o (MicroScan®/Dade-Behring, EE. UU.) Como pruebas diferenciales se observaron macromorfología de las colonias en medio de Sabouraud glucosado, la micromorfología en agar harina de maíz con Tween 80 o agar leche-Tween 80, el crecimiento a distintas temperaturas, la producción de ureasa en medio de Christensen, y la de fenoloxidasa en medio de girasol, además de realizar y pruebas complementarias cuando fue necesario13,17,18. Se distribuyeron 15 aislamientos codificados (a ciego) y 2 cepas de referencia a cada centro.
Los datos se recopilaron en una planilla de Excel donde se consignaron las características de color y aspecto de las colonias en ambos medios cromogénicos a las 24h, 48h, 72h y 6 días.
Los colores y aspectos de las colonias definidos por los fabricantes para algunas especies del género Candida son:
BCA: C. tropicalis: colonias cremosas de bordes lisos y azul oscuro¸ C. albicans y C. dubliniensis colonias verdes, cremosas y de bordes lisos; C. krusei: colonias secas de bordes irregulares y rosadas. El color de las demás especies varía del beige al marrón.
CHM: C. tropicalis: colonias azules cremosas de bordes lisos; C. albicans y C. dubliniensis: colonias cremosas de bordes lisos y color verde; C. krusei: colonias rosas de aspecto seco con bordes irregulares. En las demás especies se observan colonias de tonalidades entre el crema y el violeta.
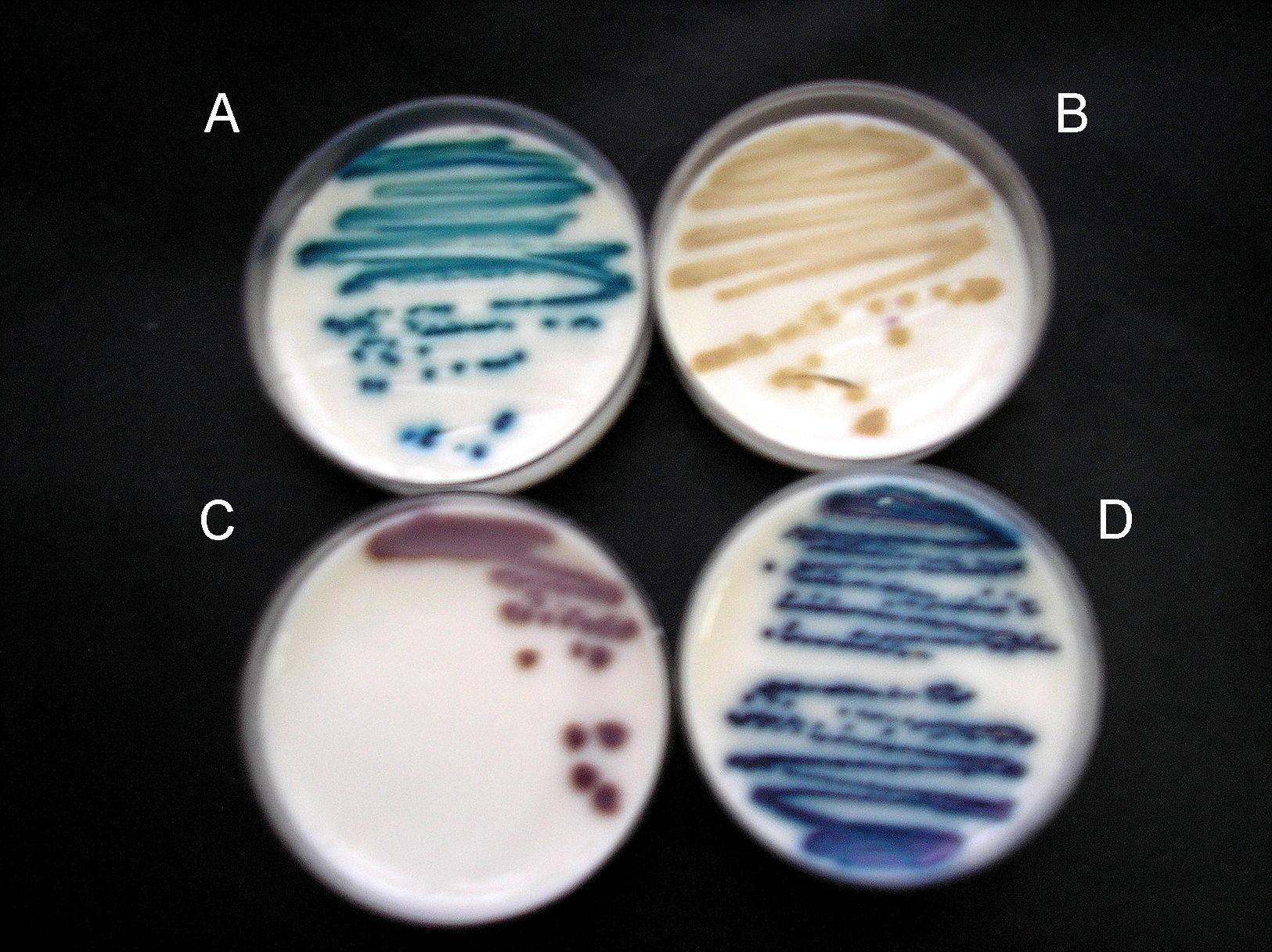
El desarrollo de algunas especies se presenta en la figura 1.
Análisis de los datos: se calculó la sensibilidad (S), especificidad (E), valor predictivo positivo (VPP) y valor predictivo negativo (VPN) para las especies que diferencian estos medios (BCA y CHM), y luego se calculó el coeficiente Kappa15,16 para ver la concordancia entre los resultados obtenidos con ambos medios.
ResultadosLos datos de identificación presuntiva de las 240 cepas de levaduras estudiadas con ambos medios cromogénicos se presentan en la tabla 1.
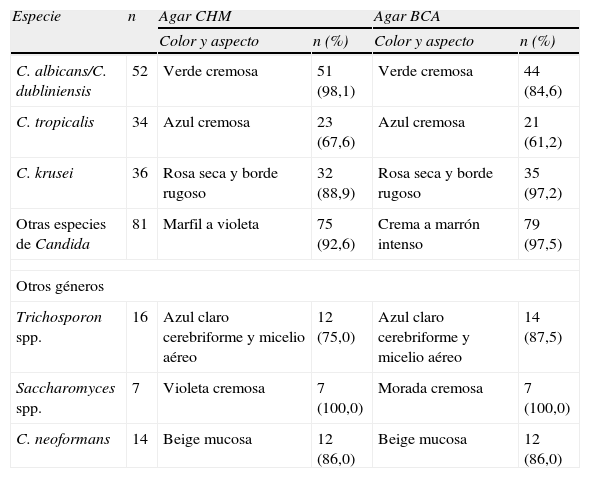
Resultados de color y aspecto obtenidos con CHROMagar Candida y Brilliance Candida Agar de los 240 aislamientos estudiados, en comparación con lo indicado por los fabricantes
| Especie | n | Agar CHM | Agar BCA | ||
| Color y aspecto | n (%) | Color y aspecto | n (%) | ||
| C. albicans/C. dubliniensis | 52 | Verde cremosa | 51 (98,1) | Verde cremosa | 44 (84,6) |
| C. tropicalis | 34 | Azul cremosa | 23 (67,6) | Azul cremosa | 21 (61,2) |
| C. krusei | 36 | Rosa seca y borde rugoso | 32 (88,9) | Rosa seca y borde rugoso | 35 (97,2) |
| Otras especies de Candida | 81 | Marfil a violeta | 75 (92,6) | Crema a marrón intenso | 79 (97,5) |
| Otros géneros | |||||
| Trichosporon spp. | 16 | Azul claro cerebriforme y micelio aéreo | 12 (75,0) | Azul claro cerebriforme y micelio aéreo | 14 (87,5) |
| Saccharomyces spp. | 7 | Violeta cremosa | 7 (100,0) | Morada cremosa | 7 (100,0) |
| C. neoformans | 14 | Beige mucosa | 12 (86,0) | Beige mucosa | 12 (86,0) |
BCA: brilliance Candida Agar; CHM: cHROMagar Candida.
En la tabla 2 se muestran los valores porcentuales de comparación de sensibilidad, especifidad, de valor predictivo positivo y valor predictivo negativo con ambos medios cromogénicos. Tanto en el agar BCA como en el CHM se observó que las cepas de Trichosporon spp. presentaron colonias cerebriformes y de aspecto aterciopelado, de color azul-verdoso que ayudaron a su identificación. Las colonias de C. neoformans fueron todas de color beige y de aspecto cremoso o mucoso, en tanto que las colonias de Saccharomyces spp. presentaron un color violeta o marrón intenso.
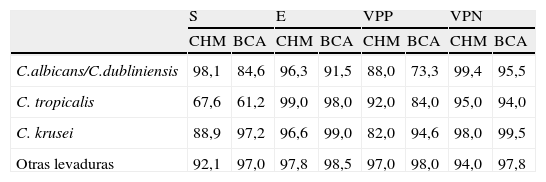
Comparación de sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo entre CHROMagar Candida y Brilliance Candida Agar
| S | E | VPP | VPN | |||||
| CHM | BCA | CHM | BCA | CHM | BCA | CHM | BCA | |
| C.albicans/C.dubliniensis | 98,1 | 84,6 | 96,3 | 91,5 | 88,0 | 73,3 | 99,4 | 95,5 |
| C. tropicalis | 67,6 | 61,2 | 99,0 | 98,0 | 92,0 | 84,0 | 95,0 | 94,0 |
| C. krusei | 88,9 | 97,2 | 96,6 | 99,0 | 82,0 | 94,6 | 98,0 | 99,5 |
| Otras levaduras | 92,1 | 97,0 | 97,8 | 98,5 | 97,0 | 98,0 | 94,0 | 97,8 |
BCA: brilliance Candida Agar; CHM: cHROMagar Candida; E: especificidad; S: comparación de sensibilidad; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
El índice de concordancia entre los resultados obtenidos con ambos medios fue de 0,67 que, según Landis y Koch16, corresponde a un grado de acuerdo sustancial (0,60–0,80).
DiscusiónEl uso de medios con sustratos cromogénicos ha sido un gran avance en el reconocimiento temprano de distintas especies de levaduras, en especial para distinguir C. albicans del resto, como así también para observar la presencia de más de una especie en una misma muestra clínica20. De esta forma se puede orientar rápidamente la terapéutica antifúngica más adecuada hasta tener la tipificación definitiva. En este estudio comparamos la capacidad de identificación presuntiva de un nuevo medio cromogénico (Brilliance Candida Agar, Oxoid) con CHROMagar Candida que se utiliza habitualmente en los laboratorios de Microbiología en nuestro país. Pudimos observar que ambos medios son útiles para la identificación presuntiva de varias especies de Candida tal como lo especifican los respectivos fabricantes.
La preparación del nuevo medio BCA es sencilla y el fondo blanco opaco permite una buena observación de los colores. Los sustratos cromógenos que utiliza para evidenciar la actividad enzimática de las levaduras son el 5-bromo-4-cloro-3-indol N-acetil βD-glucosaminidasa (X-NAG) que detecta la actividad de la enzima hexosaminidasa presente en C. tropicalis y en C. albicans/C. dubliniensis, y el 5-bromo-6 cloro-3-indol fosfatasa p-toluidina (BCIP), que detecta la actividad de la fosfatasa alcalina presente en C. krusei. Además cuenta con otros sustratos que hacen que, en lugar de azul, C. albicans/C. dubliniensis aparezcan de color verde. En este nuevo medio existen levaduras que presentan una gama que va del crema al marrón debido a la existencia de pigmento natural y algún grado de actividad fosfatasa alcalina. Por su parte, en CHM las mismas levaduras se observan en la gama de los rosados (de crema a violeta)1.
El tiempo óptimo del desarrollo del color de las colonias con ambos medios fue de 72h. Entre las 24–48h es posible confundir algunas cepas entre C. albicans/C. dubliniensis y C. tropicalis.
En ninguno de los dos medios pudo diferenciarse claramente C. albicans de C. dubliniensis, como postulan algunos autores20 ni como se podría hacer con Candida ID29. El aspecto seco y de bordes festoneados de las colonias de C. krusei fue el elemento distintivo que caracterizó a esta levadura y permitió identificarla fácilmente en ambos medios.
El uso sistemático de algún agar cromogénico facilita la identificación presuntiva, ya que un observador experimentado se orienta hacia alguna especie de levadura de acuerdo con la tonalidad o el aspecto a fin de ayudar a instaurar una terapéutica adecuada. Por otra parte también se pudo evidenciar que microorganismos como Trichosporon spp. presentan características culturales (aspecto cerebriforme y micelio aéreo corto) que los diferencian del resto, y Saccharomyes spp. mostró un color morado intenso en ambos medios, lo que permitió su sospecha. Esto coincide con los hallazgos de Ghelardi et al12, quienes también observan caracteres distintivos para Trichosporon mucoides, C. guilliermondii, Saccharomyces cerevisiae y Geotrichum capitatum.
Además, algunas investigaciones preliminares informaron que BCA permitiría a observadores experimentados diferenciar colonias de C. glabrata, Candida kefyr, C. parapsilosis o Candida lusitaniae, pero que estos hallazgos deberían ser corroborados por nuevos estudios8. En nuestro caso, C. glabrata presentó tonalidades que variaron del dorado al ocre en tanto que los aislamientos de C. parapsilosis fueron desde el crema hasta el marrón-violáceo.
En este estudio pudimos comprobar que ambos medios son similares de acuerdo al grado de concordancia obtenido con el índice Kappa (0,67). Los datos de sensibilidad, especificidad, VPP y VPN no son tan elevados como los presentados por Carrillo-Muñoz et al4, que valoraron el medio Chromalbicans, un medio cromogénico específico para C. albicans. Debe tenerse en cuenta, además, que el BCA identifica presuntivamente otras especies de levaduras y que nuestro trabajo fue realizado en distintos centros, por lo que existen variaciones debidas a la subjetividad en la observación realizada por distintas personas, con la consiguiente disminución en el índice de concordancia.
La elección de BCA o CHM dependerá del costo y de las preferencias del operador, dado que ambos son fáciles de preparar y brindan resultados confiables para la identificación presuntiva, aunque debe recalcarse la importancia de seguir las instrucciones de preparación de los fabricantes14 para evitar resultados erróneos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Dra. Adriana Bau de la Empresa Bioartis, por la provisión del medio Brilliance Chromogenic Agar para la realización de este trabajo en la Red de Micología del GCBA. A los doctores. Elena Eraso y Guillermo Quindós de la Universidad del País Vasco por facilitarnos las cepas de Candida dubliniensis.
Elsa Armentano (Hospital Rivadavia, Buenos Aires, Argentina), Susana Carabelli† (Hospital Tornú, Buenos Aires, Argentina), Silvana Cataldi (Hospital Durand, Buenos Aires, Argentina), María José Gallegos (Hospital Ferrer, Buenos Aires, Argentina), Claudia Garbasz (Hospital Pirovano, Buenos Aires, Argentina), Laura López Moral (Hospital Argerich, Buenos Aires, Argentina), Andrés Martínez Burkett (Hospital Gutiérrez, Buenos Aires, Argentina), Patricia Minervini (Hospital Santa Lucia, Buenos Aires, Argentina), María del Carmen Morales (Hospital Piñero, Buenos Aires, Argentina), Rosana Pereda (Hospital Elizalde, Buenos Aires, Argentina), Ercilia Postai (Hospital Tornú, Buenos Aires, Argentina), Mariela Schijman (Hospital Álvarez, Buenos Aires, Argentina).