Las levaduras representan la segunda causa mundial de infecciones fúngicas ungueales, donde Candida albicans y Candida parapsilosis son las dos especies más frecuentes.
ObjetivosConocer la frecuencia de especies de levaduras y su sensibilidad antifúngica in vitro, obtenidas de pacientes con manifestaciones clínicas sugestivas de onicomicosis.
MétodosEn México se realizó un estudio prospectivo en pacientes atendidos en cuatro centros de atención dermatológica de 2004 a 2007. El diagnóstico clínico fue corroborado por examen directo y cultivo. La especie de levadura fue determinada por pruebas morfológicas y bioquímicas. A cada aislamiento se le determinó la sensibilidad a ketoconazol, itraconazol y fluconazol mediante el método de microdilución en caldo (documento M27-A2).
ResultadosSe obtuvieron 166 aislamientos levaduriformes; las especies más frecuentes fueron C. parapsilosis (31,9%), C. albicans (22,4%) y Candida guilliermondii (12,7%). De todos los aislamientos, 51 mostraron resistencia a uno o varios de los azoles probados: 33 a itraconazol, 12 a ketoconazol y 6 a fluconazol. Fue notable que los 4 aislamientos de Candida glabrata fueron resistentes a los tres compuestos azólicos; C. guilliermondii y Candida famata fueron resistentes a itraconazol en el 42,9% y en el 54,5%, respectivamente.
ConclusiónLos resultados obtenidos demuestran la importancia de identificar al agente etiológico y realizar pruebas de sensibilidad para evitar fracasos terapéuticos en las onicomicosis.
Yeasts represent the second cause of nail fungal infection in the world, and Candida albicans and Candida parapsilosis are the two most common species.
ObjectivesTo determine the yeast species frequency and their in vitro antifungal susceptibility test, obtained from patients with clinical features suggestive of onychomycosis.
MethodsA prospective study was carried out in four dermatological care centers in Mexico from 2004 to 2007. Clinical diagnosis was corroborated by direct examination and culture. The yeast species was determined by morphological and biochemical tests. An antifungal susceptibility test to ketoconazole, itraconazole and fluconazole by the broth microdilution method was performed on each isolate (document M27-A2).
ResultsOne hundred sixty-six yeast isolates were obtained; the most frequently found species were C. parapsilosis (31.9%), C. albicans (22.4%) and Candida guilliermondii (12.7%). Of all isolates, 51 showed resistance to one or several of the azole compounds: 33 to itraconazole, 12 to ketoconazole and 6 to fluconazole. It was remarkable that the four Candida glabrata isolates were resistant to the three azole compounds; C. guilliermondii and Candida famata were resistant to itraconazole in 42.9% and 54.5%, respectively.
ConclusionThe results obtained show the importance of identifying the aetiological agent and antifungal susceptibility testing in order to avoid therapeutic failures in onychomycosis.
La onicomicosis es la afección más común de las uñas; se ha calculado una prevalencia mundial del 2–50%6,10,23,25. Los hombres son el grupo de la población más afectado y con predominio en la población adulta7,27,29, aunque algunos datos recientes reportan que la onicomicosis por levaduras es más común en mujeres25. La frecuencia de las onicomicosis y el número de agentes etiológicos va en aumento15,19,25. Entre los factores predisponentes se encuentran la insuficiencia venosa, la diabetes mellitus y otras enfermedades inmunosupresoras10,15,27. De los hongos filamentosos queratinofílicos, el principal agente encontrado es Trichophyton rubrum, pero en los últimos años se ha visto un incremento de infecciones causadas por levaduras, de las cuales las especies del género Candida son las más comunes1,7,11,24. También se ha observado variación en la localización corporal de estas infecciones; actualmente, del 51 al 70% de las onicomicosis por Candida se presentan en las uñas de las manos, y el 1–32% en las uñas de los pies24. Durante muchos años, Candida albicans ha sido la levadura más frecuente causante de onicomicosis en las manos de mujeres adultas; sin embargo, en las dos últimas décadas, se ha observado un cambio en las especies, destacando un incremento en Candida parapsilosis, seguida de C. albicans8,17,24. Segal et al24 describieron una frecuencia de C. parapsilosis en el 39,5% de los casos de onicomicosis de las uñas de los pies y en el 36,7% de las uñas de las manos. Otro hallazgo observado en relación a este agente es que cuando afecta a individuos sanos, existe el antecedente de traumatismos en las uñas y, habitualmente, son personas dedicadas a las labores de jardinería8,12. En México se han realizado estudios sobre la onicomicosis en algunos grupos de población1,2,15 y su importancia como causa del 24% de las consultas dermatológicas2. En el trabajo de Abad-González et al se estudiaron 5.221 casos de onicomicosis, de los cuales el 83,5% fueron causados por dermatofitos y el 11,1% por Candida spp. y Trichosporon spp. El 31,8% de estas levaduras fueron aisladas de pacientes adultos con diabetes mellitus1.
En general, para el tratamiento de la onicomicosis por levaduras están indicados los antifúngicos sistémicos azólicos. De éstos, el de mayor uso ha sido el itraconazol9, antifúngico que también ha sido empleado ampliamente como profiláctico de infecciones micóticas sistémicas en pacientes con inmunosupresión severa3.
Uno de los fenómenos de reciente observación en las infecciones ungueales por hongos levaduriformes es el incremento en los fracasos terapéuticos que, entre otras causas, puede tener su origen en la aparición de resistencia a los antifúngicos. Diversas publicaciones demuestran que Candida spp. presenta resistencia in vitro a fluconazol e itraconazol14,21,28. Recientemente, en México también se ha documentado la existencia de resistencia hasta en el 27,5% de los aislamientos de Candida obtenidos de diversas localizaciones16.
Los objetivos de este estudio fueron conocer la frecuencia de las especies de levaduras causantes de onicomicosis en cuatro centros de atención dermatológica de la ciudad de México, su correlación con la localización de la distrofia ungueal y, finalmente, conocer la sensibilidad antifúngica frente a ketoconazol, itraconazol y fluconazol, que son los antimicóticos de mayor disponibilidad y uso en México.
Materiales y métodosDe enero de 2004 a diciembre de 2007 se realizó un estudio prospectivo y descriptivo de pacientes en edad adulta con onicomicosis causadas por levaduras diagnosticados por examen directo y cultivo, en cuatro centros de atención dermatomicológica de la Ciudad de México (Hospital General Dr. Darío Fernández, ISSSTE, Hospital de Especialidades Centro Médico Nacional, IMSS, Hospital General Dr. Manuel Gea González S.A., Laboratorio de Micología Médica, Facultad de Medicina, UNAM). De todos los pacientes se obtuvieron datos de edad, sexo y localización de la distrofia ungueal. Para considerar a las levaduras como causantes de la infección ungueal, fue necesario cumplir por lo menos con dos de los siguientes criterios: 1) examen microscópico directo de las escamas con abundantes levaduras y/o pseudohifas, hifas; 2) crecimiento abundante de levaduras como único agente, en por lo menos 2 placas, o 3) desarrollo de la misma levadura en tres cultivos repetidos4.
Los aislamientos fueron cultivados en agar dextrosa Sabouraud (ADS) con y sin cloranfenicol y con cicloheximida (Bioxon, México) y en CHROMagar Candida® (CHROMagar Company Ltd., Francia), para la identificación presuntiva de algunas de las especies22. Después se estimuló la producción de clamidoconidios en agar harina de maíz con Tween 80 al 1% y la formación de tubo germinativo en suero. La asimilación de carbohidratos fue determinada por el método API ID 32C (bioMérieux). Para la diferenciación entre Candida dubliniensis y C. albicans se realizaron pruebas fenotípicas, como la producción de clamidoconidios en agar Staib, agar tabaco, agar caseína y crecimiento a 45°C13,26.
Prueba de sensibilidad antifúngica in vitroCada uno de los aislamientos fue procesado por el método de microdilución en caldo, de acuerdo con la metodología descrita en el documento M27-A2 del Clinical Laboratory Standards Institute20, para determinar la concentración mínima inhibitoria (CMI) de tres antifúngicos azólicos: ketoconazol (KTZ), itraconazol (ITZ) y fluconazol (FLZ). El medio de cultivo empleado fue RPMI 1640, al que se añadió MOPS 0,165mol/l a pH 7. Los rangos para KTZ y ITZ fueron de 0,03 a 16 μg/ml, y para FLZ de 0,125 a 64 μg/ml. Cien microlitros de las distintas concentraciones de cada uno de los azoles fueron depositados en los pozos de las microplacas de 96 pozos. Las columnas 11 y 12 de la microplaca fueron utilizadas como controles de crecimiento y ausencia de crecimiento, respectivamente. El inóculo de cada aislamiento fue preparado a partir de cultivos de 24 horas de crecimiento en ADS. Se preparó una suspensión de levaduras en solución salina al 0,85% y se diluyó en caldo RPMI 1640; 100μl de esta suspensión fueron colocados en los pozos de las microplacas respectivas para obtener una concentración final de 1–5x103 UFC/mL, que fueron incubadas a 35°C. Las lecturas se realizaron a las 24 y 48h. Los resultados de CMI fueron comparados con los criterios (sensible, sensible dosis dependiente y resistente) descritos en el documento del CLSI.
Las cepas de C. parapsilosis (ATCC 22019) y Candida krusei (ATCC 6258) fueron utilizadas como control de calidad.
Análisis estadísticoLa prueba de proporciones (α<0,05, Z>1,64 y Z<−1,64) fue utilizada para valorar la relación entre las diferentes especies de levaduras y la localización de la onicomicosis. Se obtuvieron porcentajes de los resultados de CMI.
ResultadosEl número total de casos estudiados sugestivos de onicomicosis fue de 936 (578 mujeres [61,7%] y 358 hombres [38,3%]), con una proporción mujer:hombre de 1,6:1. En 467 casos se demostró la etiología fúngica (302 mujeres [64,7%] y 165 hombres [35,3%]), con una proporción mujer:hombre de 1,8:1. De los 467 casos de onicomicosis, 278 (59,5%) correspondieron a dermatofitos, 23 (5%) a hongos filamentosos no dermatofitos y 166 (35,5%) a levaduras.
De los 166 aislamientos levaduriformes, 117 (70,5%) correspondieron a mujeres y 49 (29,5%) a hombres, con una proporción mujer:hombre de 2,3:1; esta diferencia observada entre ambos géneros fue estadísticamente significativa. El rango de edad fue de 41-72 años, con un promedio de 51.
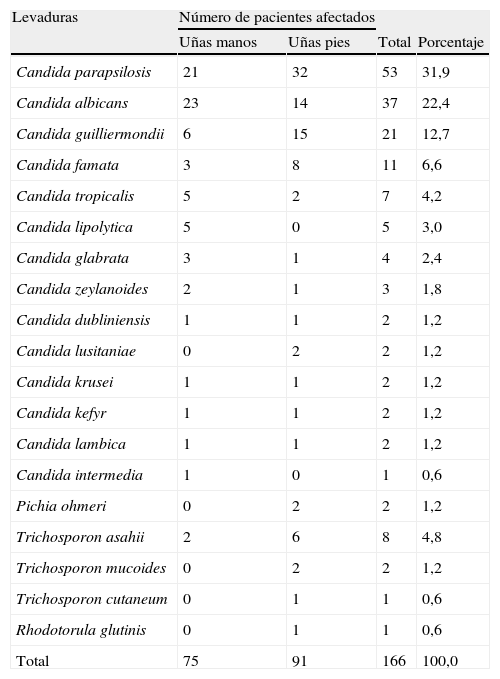
El número de aislamientos de levaduras fue mayoritariamente obtenido de las uñas de los pies. Las seis especies de levaduras que se aislaron con más frecuencia fueron, en orden descendente C. parapsilosis, C. albicans, Candida guilliermondii, Candida famata, Trichosporon asahii y Candida tropicalis (tabla 1). Al relacionar la especie de levadura con la localización de la distrofia, C. parapsilosis y C. albicans se aislaron más de las uñas de los pies y de las manos, respectivamente. La aplicación de la prueba de proporciones al número de aislamientos de ambas localizaciones arrojó un resultado no significativo. Por el contrario, esta misma prueba aplicada a los aislamientos de C. guilliermondii determinó una diferencia significativa. Candida lipolytica fue aislada solamente de las uñas de las manos.
Relación entre levaduras causantes de onicomicosis y localización de la distrofia ungueal en 166 pacientes.
| Levaduras | Número de pacientes afectados | |||
| Uñas manos | Uñas pies | Total | Porcentaje | |
| Candida parapsilosis | 21 | 32 | 53 | 31,9 |
| Candida albicans | 23 | 14 | 37 | 22,4 |
| Candida guilliermondii | 6 | 15 | 21 | 12,7 |
| Candida famata | 3 | 8 | 11 | 6,6 |
| Candida tropicalis | 5 | 2 | 7 | 4,2 |
| Candida lipolytica | 5 | 0 | 5 | 3,0 |
| Candida glabrata | 3 | 1 | 4 | 2,4 |
| Candida zeylanoides | 2 | 1 | 3 | 1,8 |
| Candida dubliniensis | 1 | 1 | 2 | 1,2 |
| Candida lusitaniae | 0 | 2 | 2 | 1,2 |
| Candida krusei | 1 | 1 | 2 | 1,2 |
| Candida kefyr | 1 | 1 | 2 | 1,2 |
| Candida lambica | 1 | 1 | 2 | 1,2 |
| Candida intermedia | 1 | 0 | 1 | 0,6 |
| Pichia ohmeri | 0 | 2 | 2 | 1,2 |
| Trichosporon asahii | 2 | 6 | 8 | 4,8 |
| Trichosporon mucoides | 0 | 2 | 2 | 1,2 |
| Trichosporon cutaneum | 0 | 1 | 1 | 0,6 |
| Rhodotorula glutinis | 0 | 1 | 1 | 0,6 |
| Total | 75 | 91 | 166 | 100,0 |
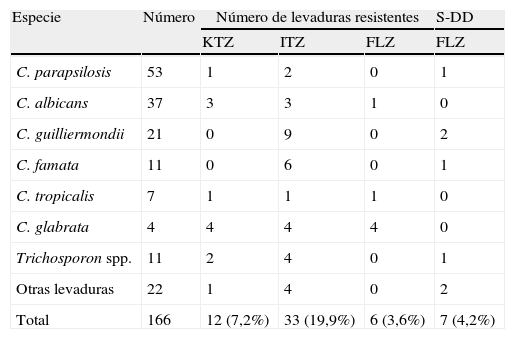
En la tabla 2 se muestra el número de aislamientos resistentes frente a los diferentes azoles probados, comparando los valores de CMI con los de referencia, CMI ≥ 1μg/ml para ITZ y KTZ y CMI ≥ 64μg/ml para FLZ. El fenómeno de resistencia fue mayoritariamente expresado frente a ITZ (19,9%); 9 de los 21 aislamientos de C. guilliermondii (42,9%) y 6 de los 11 aislamientos de C. famata (54,5%) mostraron resistencia a este compuesto azólico. De los 166 aislamientos, seis (Candida glabrata, C. albicans y C. tropicalis) presentaron resistencia a FLZ. Los 4 aislamientos de C. glabrata mostraron resistencia a los tres antifúngicos.
Total de levaduras resistentes a los diferentes antifúngicos probados y cepas sensibles dosis dependientes a fluconazol.
| Especie | Número | Número de levaduras resistentes | S-DD | ||
| KTZ | ITZ | FLZ | FLZ | ||
| C. parapsilosis | 53 | 1 | 2 | 0 | 1 |
| C. albicans | 37 | 3 | 3 | 1 | 0 |
| C. guilliermondii | 21 | 0 | 9 | 0 | 2 |
| C. famata | 11 | 0 | 6 | 0 | 1 |
| C. tropicalis | 7 | 1 | 1 | 1 | 0 |
| C. glabrata | 4 | 4 | 4 | 4 | 0 |
| Trichosporon spp. | 11 | 2 | 4 | 0 | 1 |
| Otras levaduras | 22 | 1 | 4 | 0 | 2 |
| Total | 166 | 12 (7,2%) | 33 (19,9%) | 6 (3,6%) | 7 (4,2%) |
FLZ: fluconazol; ITZ: itraconazol; KTZ: ketoconazol; S-DD: sensible dosis dependiente.
Otro criterio considerado en los valores de CMI para FLZ, mostrado en el documento M-27 A2, es la sensibilidad dosis dependiente (16–32μg/ml); esta se observó en 7 aislamientos (tabla 2). El resto de aislamientos mostró una alta sensibilidad frente a los tres antimicóticos probados.
DiscusiónLa población general considera las onicomicosis como un problema únicamente de tipo cosmético, por lo cual no se les ha dado la importancia real que tienen, ni se identifica al agente causal. En consecuencia, frecuentemente no se administra el tratamiento antifúngico adecuado por el tiempo necesario, y mucho menos se realizan pruebas de sensibilidad antifúngica, aun frente a casos de fracaso terapéutico.
Algunos autores han reportado que la onicomicosis es un padecimiento que predomina en pacientes adultos entre los 50 y 70 años de edad2,7,27. A diferencia de los reportes de algunos de estos autores7,27, en el presente estudio la onicomicosis predominó en mujeres (64,7%). Considerando la onicomicosis por levaduras en el presente estudio, esta patología predominó en las mujeres (70,5%). La localización de la mayoría de los casos de onicomicosis por levaduras fue en las uñas de los pies, hallazgo diferente a otros estudios, donde la onicomicosis por Candida tuvo tendencia a predominar en las uñas de las manos1,24.
En el estudio de Darko et al5, las 5 especies más frecuentes fueron C. albicans (60,9%), C. parapsilosis (19,6%), C. tropicalis (9,8%), C. krusei (4,9%) y C. guilliermondii. En el presente estudio se observó que las 5 especies principales fueron C. parapsilosis (31,9%), C. albicans (22,4%), C. guilliermondii (12,7%), C. famata (6,6%) y C. tropicalis (4,2%). Además, aunque en bajo porcentaje, se aislaron levaduras del género Trichosporon con 11 casos y la especie más frecuente fue T. asahii (4,8%), agente etiológico de onicomicosis descrito en otro estudio de pacientes mexicanos de áreas rurales18 y en el de Souza et al25.
Desde hace aproximadamente 20 años se ha observado un cambio en la etiologia de las infecciones ungueales causadas por levaduras, donde C. parapsilosis ha ido incrementando paulatinamente su frecuencia8,14,17,24,29. Un ejemplo descrito en la revisión de Gautret et al8 es el cambio que presentó C. parapsilosis del 23 al 51% en las diferentes casuísticas. Los factores de riesgo asociados fueron traumatismos en las uñas, labores de jardín, enfermedades inmunosupresoras como diabetes mellitus y el uso de corticosteroides.
Otro hallazgo interesante del presente trabajo fue la detección de C. parapsilosis, C. guilliermondii y C. famata como especies predominantes causantes de distrofia ungueal en las uñas de los pies. En cambio, C. albicans, C. tropicalis y C. lipolytica fueron predominantemente aisladas de las uñas de las manos. Desde el punto de vista estadístico solamente hubo diferencia significativa en la localización de C. guilliermondii, que predominó en las uñas de los pies.
El 80,2% de los aislamientos fueron sensibles a FLZ, mientras que la mayor resistencia fue a ITZ. C. glabrata es la levadura que presentó mayor resistencia a los compuestos azólicos.
La respuesta observada al tratamiento de onicomicosis causadas por levaduras es variable y entre otros factores a considerar, además del estado inmunológico del paciente (diabetes, desnutrición, tratamiento con esteroides, etc.), está la localización de la distrofia ungueal. Además, aún no se han realizado estudios suficientes para evaluar si el fracaso del tratamiento en muchos casos es intrínseca, como la que se observa en C. glabrata, o bien es una resistencia adquirida por la presión selectiva a la que están sujetas las levaduras que forman parte de la biota normal, en los pacientes que reciben tratamiento antifúngico profiláctico.
Este estudio demuestra que C. parapsilosis presenta un predominio sobre C. albicans; quizá esto refleje una capacidad desarrollada por C. parapsilosis para utilizar los nutrientes a nivel ungueal que favorecen la instalación y propician la infección. También fue evidente que los aislamientos de C. glabrata son resistentes a los azoles, por lo que estos antifúngicos no deben ser utilizados para su tratamiento. Finalmente, es notable un incremento en la frecuencia de Trichosporon spp. como agente etiológico de onicomicosis (7,2%), que en la mayoría de estudios no aparece reportado.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.