Malassezia pachydermatis forma parte de la microbiota cutánea de perros y gatos. M. pachydermatis se ha asociado frecuentemente a otitis externa y dermatitis seborreicas, sobre todo en el perro, y con menor frecuencia en el gato. M. pachydermatis podría actuar como patógeno cuando existen alteraciones en los mecanismos físicos, químicos o inmunológicos de la piel. Se han identificado diversos factores de virulencia como la capacidad de producir estearasas, lipasas, lipooxigenasas, proteinasas, condroitinsulfatasas e hialuronidasas.
ObjetivosSe ha estudiado la actividad fosfolipasa medida a pH 6,3 y la actividad proteinasa medida a pH 6,3 y pH 6,8 (pH de oídos de perros con otitis) de cepas de M. pachydermatis aisladas de perros con otitis y sin otitis.
MétodosSe ha estudiado la actividad fosfolipasa mediante un método semicuantitativo con yema de huevo y la actividad proteinasa mediante un método semicuantitativo con agar albúmina sérica bovina. Se ha realizado el estudio en 96 aislamientos de M. pachydermatis, 43 de ellos aislados de perros sin sintomatología clínica de otitis y 52 aislados de perros con otitis.
ResultadosSe observó que el 75,8% de los aislamientos presentaron actividad fosfolipasa a pH 6,3 y el 81% presentaron actividad proteinasa medida a pH 6,3, y el 97,9% a pH 6,8. Se detectó una mayor actividad fosfolipasa en cepas aisladas de perros con otitis. Con respecto a la actividad proteinasa, esta fue mayor a pH 6,8.
ConclusionesEstos hallazgos sugieren que la actividad fosfolipasa podría jugar un papel importante en la invasión de los tejidos del hospedador, por lo menos en la otitis crónica canina. Con respecto a la actividad proteinasa, estos hallazgos podrían ayudar a mejorar la terapéutica de la otitis cuando está implicada M. pachydermatis en el proceso, ajustando a pH bajos los tratamientos aplicados.
Malassezia pachydermatis is part of the skin microbiota of dogs and cats. M. pachydermatis has been associated with external otitis and seborrhoeic dermatitis, reported more often in dogs than in cats. When the physical, chemical or immunological mechanisms of the skin are altered, M. pachydermatis could act as a pathogen. Thus, several virulence factors, such as the ability to produce esterase, lipase, lipoxygenase, protease, chondroitin sulphatase, and hyaluronidase, have been studied.
AimsIn the present study, we aim to identify the phospholipase activity measured at pH 6.3, and the proteinase activity measured at pH 6.3 and pH 6.8 (pH from ears of dogs with external otitis) of M. pachydermatis strains isolated from dogs with and without external otitis.
MethodsThe phospholipase activity was measured using a semi-quantitative method with egg yolk, and the proteinase activity with a semi-quantitative method using bovine serum albumin agar. The study was performed on 96 isolates of M. pachydermatis, 43 isolated from dogs without clinical symptoms of otitis, and 52 isolated from dogs with otitis.
ResultsIn our study, 75.8% of the isolates showed phospholipase activity at pH 6.3, and 81 and 97.9% of them showed proteinase activity measured at pH 6.3 and 6.8, respectively. A higher phospholipase activity was detected in strains isolated from dogs with otitis. The proteinase activity was increased at a pH of 6.8 (97.9%) in comparison to a pH of 6.3 (81%).
ConclusionsOur results suggest that the phospholipase activity may play an important role in the invasion of host tissues in chronic canine otitis cases. The proteinase activity results obtained in this study suggest that a reduction in the pH of the treatment may improve its efficacy in the resolution of M. pachydermatis otitis.
Malassezia pachydermatis forma parte de la microbiota cutánea de perros y gatos16. En el perro se aísla frecuentemente del ano, cavidad oral, área interdigital, labio inferior y conducto auditivo externo, y es menos frecuente su aislamiento del área nasal, prepucio, vulva, axila e ingle y dorso3,7,18,21. Esta levadura, que forma parte de la microbiota cutánea, puede comportarse como patógeno oportunista como consecuencia de cualquier alteración de la superficie de la piel o de las defensas del hospedador12,16,23,24.
M. pachydermatis se asocia frecuentemente a otitis externa y dermatitis seborreicas, sobre todo en el perro y con menos frecuencia en el gato. M. pachydermatis podría actuar como patógeno cuando existen alteraciones en los mecanismos físicos, químicos o inmunológicos de la piel1,12,16,24,25,30. Estos mecanismos fisiopatológicos podrían estar regulados por la producción de factores de virulencia y antígenos5,16,22. Se han identificado distintos factores de virulencia, como la capacidad de producir estearasas, lipasas, lipooxigenasas, proteinasas, condroitinsulfatasas e hialuronidasas13. La actividad fosfolipasa para este género es la que más se ha estudiado en los últimos años9,10,13,19, mientras que la actividad proteinasa ha recibido menos atención13.
El objetivo de este trabajo ha sido estudiar la actividad fosfolipasa medida a pH 6,3 y proteinasa medida a pH 6,3 y 6,8 en cepas de M. pachydermatis aisladas del conducto auditivo externo de perros sanos y perros con otitis.
Materiales y métodosSe estudiaron un total de 95 aislamientos de M. pachydermatis, 43 de ellos (45,3%) aislados del oído de perros sin sintomatología clínica de otitis, y 52 cepas (54,7%) aisladas de perros con otitis. Las muestras de perros sin otitis procedían de diferentes centros veterinarios y albergues de la Comunidad de Madrid. Las muestras de perros con otitis procedían del Hospital Clínico Veterinario Complutense (Facultad de Veterinaria de la Universidad Complutense de Madrid). También se estudiaron las cepas de referencia del centro Voor Schimmelcultures (Utrecht, Holanda) M. pachydermatis (CBS1892) y M. pachydermatis (CBS1885). Los aislamientos fueron congelados en glicerol a -80°C para su conservación14. Antes del ensayo, se resembraron 2 veces consecutivas en Agar Dixon, a partir de la segunda resiembra y tras 7 días de incubación a 32°C en aerobiosis. Para preparar el inóculo se recogieron 2 o 3UFC con un hisopo de algodón, no tóxico, estéril, que se añadieron a 5ml de solución salina fisiológica hasta obtener una concentración de células equivalente al grado 0,5 de la escala McFarland (aproximadamente 1-5×106UFC/ml).
La actividad fosfolipasa se estudió según el método descrito por Price et al. para levaduras del género Candida27. A partir de la suspensión de M. pachydermatis se inocularon 5μl en 3 puntos equidistantes, en una placa de 90mm que contenía medio Sabouraud Egg Agar (agar glucosado de Sabouraud 65g; NaCl 58,45g; CaCl2 0,0554g; yema de huevo 80ml; agua destilada 1.000ml). Se ajustó el pH a 6,3. Todos los ensayos se realizaron por triplicado en días diferentes. Las placas se incubaron a 32°C en aerobiosis y en cámara húmeda. La lectura de los resultados se realizó a los 15 días según lo indicado por Coutinho et al.13, mediante la medición del halo formado alrededor de la colonia que se consideró como indicativo de la producción de la enzima fosfolipasa. Los resultados de actividad enzimática se expresaron como ratio (Pz) de diámetro de la colonia y zona de actividad enzimática, tal como fue descrito para Candida albicans por Price et al.27. Se consideraron resultados negativos aquellos en los que el valor de Pz fue igual a 1; resultados positivos con actividad débil aquellos en los que Pz<1 y≥0,64, y resultados positivos con actividad fuerte aquellos en que Pz<0,64, según lo descrito por Coutinho et al.13.
Para la valoración de la actividad proteinasa, a partir de la suspensión de M. pachydermatis se inocularon 5μl en 3 puntos equidistantes, en una placa de 90mm que contenía medio agar albúmina sérica bovina (K2PO4 0,5g; MgSO4 7H2O; 0,04g; extracto de levadura 0,2g; glucosa D [+] 4g; agar bacteriológico europeo 4g; agua destilada 180ml)29. Se prepararon placas de Petri con este medio de cultivo ajustado a pH 6,3 y 6,8. Se utilizó un pH de 6,3, que correspondió al pH medio del conducto vertical del oído externo de perros sanos sin otitis, y un pH de 6,8, equivalente al pH del conducto vertical de animales con otitis17. Las placas se incubaron a 32°C en aerobiosis. Los estudios se hicieron por triplicado en días diferentes. La lectura de los resultados se realizó a las 96h, según lo indicado por Coutinho et al.13.
La formación de un halo alrededor de la colonia se consideró como indicativa de la producción de la enzima proteinasa. Los resultados de actividad enzimática se expresaron como ratio (Prz) de diámetro de la colonia y zona de precipitación, tal como fue descrito para C. albicans por Price et al.27. Se consideraron resultados negativos aquellos en los que Prz fue igual a 1; resultados positivos con actividad débil aquellos en los que el valor Prz<1 y≥0,64, y resultados positivos con actividad fuerte aquellos con Prz<0,64, según lo descrito por Coutinho et al.13.
El valor de los resultados se obtuvo a partir de la media aritmética de los valores obtenidos en los distintos ensayos para cada aislamiento. Para comparar la actividad fosfolipasa y la actividad proteinasa a diferentes pH entre perros con otitis y sin otitis, se utilizó el test de Mann-Whitney. Para comparar la actividad proteinasa medida a diferentes pH se utilizó el test de signos pareados de Wilcoxon. Se consideraron resultados estadísticamente significativos aquellos en los que p<0,05.
El análisis estadístico de los datos se realizó con el programa PASW Statistics (PASW) para Windows 18.0.
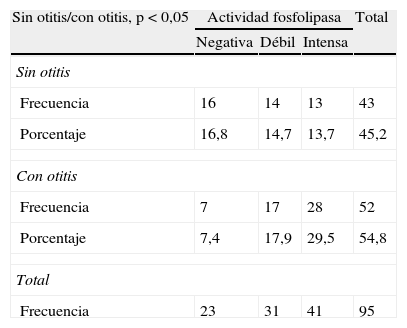
ResultadosActividad fosfolipasaEl 43,2% (41/95) de las cepas mostró actividad fosfolipasa intensa, el 32,6% (31/95) mostró una actividad fosfolipasa débil y el 24,2% (23/95) de las cepas no tuvieron actividad fosfolipasa. El halo máximo de actividad fosfolipasa fue de 35mm. Al comparar la actividad fosfolipasa entre las cepas procedentes de perros con otitis y sin otitis, se obtuvieron diferencias estadísticamente significativas, de manera que las cepas procedentes de perros con otitis presentaron mayor actividad fosfolipasa y actividad más intensa que los perros sin otitis (tabla 1 y fig. 1).
Distribución de la actividad fosfolipasa en cepas de Malassezia pachydermatis procedentes de perros con y sin otitis
| Sin otitis/con otitis, p<0,05 | Actividad fosfolipasa | Total | ||
| Negativa | Débil | Intensa | ||
| Sin otitis | ||||
| Frecuencia | 16 | 14 | 13 | 43 |
| Porcentaje | 16,8 | 14,7 | 13,7 | 45,2 |
| Con otitis | ||||
| Frecuencia | 7 | 17 | 28 | 52 |
| Porcentaje | 7,4 | 17,9 | 29,5 | 54,8 |
| Total | ||||
| Frecuencia | 23 | 31 | 41 | 95 |
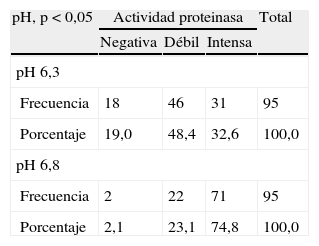
A pH 6,8, el 2,1% (2/95) de las cepas no presentaron actividad proteinasa, el 23,1% (22/95) de las cepas presentaron actividad proteinasa débil y el 74,8% (71/95) presentaron actividad proteinasa intensa (tabla 2 y fig. 2). A pH 6,3, el 19,0% (18/95) de las cepas no presentaron actividad proteinasa, el 48,4% (46/95) de las cepas presentaron actividad proteinasa débil y el 32,6% (31/05) presentaron actividad proteinasa intensa (tabla 2 y fig. 2). El halo máximo de actividad proteinasa a pH 6,8 fue de 25mm, y a pH 6,3, de 28mm.
Se encontraron diferencias estadísticamente significativas aplicando el test de signos pareados de Wilcoxon, entre la actividad proteinasa media a pH 6,3 y pH 6,8. Los aislamientos presentaron mayor actividad proteinasa a pH 6,8. No se encontraron diferencias significativas aplicando el test de Mann-Whitney de la actividad proteinasa medida a pH 6,3 o 6,8 entre las cepas de M. pachydermatis aisladas de animales sanos y enfermos.
La cepa de referencia M. pachydermatis CBS1892 presentó actividad fosfolipasa y proteinasa medida a pH 6,3 débil y actividad proteinasa medida a pH 6,8 intensa. La cepa de referencia M. pachydermatis CBS1885 presentó actividad fosfolipasa intensa y actividad proteinasa a pH 6,3 y pH 6,8 débil.
DiscusiónCon respecto a la actividad fosfolipasa hemos encontrado que la mayoría de las cepas la presentaron. Este hecho coincide con lo publicado por otros autores que también detectan la actividad fosfolipasa en cepas de M. pachydermatis4,8,10,13,20. En nuestro estudio también es importante destacar que hemos encontrado más actividad fosfolipasa en las cepas que provienen de muestras de animales con otitis. Este hallazgo es coincidente con el observado por Cafarchia et al. y Machado et al., que encontraron más actividad fosfolipasa en cepas aisladas a partir de lesiones en la piel, que de las procedentes de muestras de piel sana6,19. Estos autores demostraron una mayor actividad fosfolipasa en cepas aisladas de perros con leishmaniasis que en perros sin esta8. Esta mayor actividad fosfolipasa también ha sido descrita para otras especies de Malassezia en cepas aisladas de pacientes con dermatitis seborreica en comparación con las de pacientes sin problemas dermatológicos de pitiriasis versicolor26. Esta mayor actividad fosfolipasa puede estar involucrada en el mecanismo por el cual estas levaduras pueden generar un proceso inflamatorio, ya que la fosfolipasa causa la liberación de ácido araquidónico, cuyos metabolitos están implicados en lesiones inflamatorias cutáneas2,4,13,15,20,28. Además, estos hallazgos demuestran que la actividad fosfolipasa podría jugar un papel importante en la invasión de los tejidos del hospedador, por lo menos en la otitis crónica canina.
Con respecto a la actividad proteinasa, hemos encontrado que la mayoría de las cepas presentan esta actividad tanto a pH 6,3 como a pH 6,8. Este hallazgo coincide con lo publicado por otros autores4,11,13,20. En nuestro estudio hemos obtenido diferencias significativas en la actividad proteinasa medida a diferentes pH, y también significativamente mayor a pH 6,8. El pH 6,8 es el que presentan con más frecuencia los oídos con otitis17, lo que nos demuestra que si presenta mayor actividad proteinasa in vitro a este pH, probablemente también la tenga in vivo. Este hallazgo podría ayudar a mejorar la terapéutica de la otitis, cuando está implicada Malassezia en el proceso, con la aplicación de tratamientos con valores de pH relativamente bajos. De hecho, Swinney et al., en un estudio en el que prueban in vitro diferentes productos óticos, obtienen mejores resultados de inhibición de crecimiento de Malassezia con los productos que tienen pH más bajo, formulados con ácido bórico31. Sin embargo, son necesarios estudios posteriores que puedan confirmar esta correlación in vitro-in vivo.
A la Dra. Cutuli de Simón por su colaboración en el aislamiento e identificación de las muestras.