La distancia entre los genitales y el ano (distancia anogenital [AGD]) es un reflejo de la concentración de andrógenos durante el desarrollo prenatal en mamíferos. En la actualidad solo existe un estudio que indique la relación entre AGD y riesgo de presentar cáncer de próstata (CaP). El objetivo de este estudio fue evaluar la utilidad clínica de la AGD, como biomarcador del ambiente androgénico prenatal y el riesgo de presentar CaP en una amplia población.
Material y métodoSe realizó un estudio de casos y controles sobre 260 pacientes, atendidos en la consulta externa de Urología, a los que se sometió a examen físico y andrológico, y cumplimentaron cuestionarios. En los pacientes con CaP (n=125) hubo confirmación histológica de la enfermedad y se dividió a los pacientes según la puntuación de Gleason acorde con los grupos de riesgo de d’Amico. Los controles (n=135) fueron hombres sin signos, ni síntomas de CaP que fueron atendidos en la consulta externa de Urología para un examen rutinario. Se midieron 2variantes de AGD (del ano a la base posterior del escroto [AGDAS] y del ano a la inserción cefálica del pene [AGDAP]). Se utilizaron pruebas paramétricas y no paramétricas y curvas ROC para determinar la relación entre la AGD y la presencia de CaP.
ResultadosLa mayor área bajo la curva se obtuvo para el subgrupo de Gleason=7 con las mediciones AGDAS y AGDAP (0,69; IC del 95%: 0,60-0,78 y 0,69; IC del 95%: 0,61-0,77, respectivamente), con una sensibilidad y especificidad del 83 y el55%, y el 91 y el 41%, un valor predictivo positivo del 39 y el 35%, y predictivo negativo del 90 y el 93%, respectivamente.
ConclusiónNuestros resultados sugieren que la AGD podría ser una herramienta clínica útil para el diagnóstico del CaP.
The distance from the genitals to the anus (anogenital distance [AGD]) reflects androgen concentration during prenatal development in mammals. At the present time, there is only one study suggesting the relationship between AGD and risk of prostate cancer (CaP). The goal of this study was to assess the performance and clinical utility of AGD, as a biomarker of prenatal androgenic milieu, and risk of CaP in a larger population, in CaP diagnosis.
Material and methodsA case-control study was conducted on 260 men seen in a hospital outpatient clinic where underwent a physical and andrological examination and completed a brief questionnaire. CaP patients were confirmed by biopsy of the tumor. Controls were men without CaP seen in the urology outpatient clinic for routine examinations. Two variants of AGD (from the anus to the posterior base of the scrotum [AGDAS] and to the cephalad insertion of the penis [AGDAP]) were measured. Parametric and non-parametric tests and receiver operating characteristic (COR) analyses were used to determine relationships between AGD and presence of CaP.
ResultsThe highest area under the curve (0.69; 95% CI 0.60 to 0.78 and 0.69; 95% CI 0.61 to 0.77) was obtained for the Gleason=7 subgroup with the AGDAS and AGDAP measurement, with a sensitivity and specificity of 83% and 55%, and 91% and 41%, the predictive positive value of 39% and 35% and negative value of 90% and 93% respectively.
ConclusionAGD may be a useful clinical tool for the CaP diagnosis.
El cáncer de próstata (CaP) es el cáncer más común en varones añosos (> 70 años) en Europa. Es un grave problema de salud, especialmente en los países desarrollado, en los cuales la proporción de hombres añosos en la población general es mayor. La incidencia en Europa septentrional y occidental es más alta (> 200 casos por 100.000 habitantes), mientras que las tasas en Europa oriental y meridional han mostrado un incremento progresivo y continuo1. El CaP es una de las principales causas de muerte por cáncer en el varón, con una tasa de mortalidad ajustada de la UE de 17,1 casos por cada 100.000 habitantes. En 1941, Huggins y Hodges demostraron que el CaP era una enfermedad andrógeno-dependiente2.
La distancia anogenital (AGD), distancia desde el ano a los genitales, es un dimorfismo sexual propio de mamíferos placentarios3,4 y un biomarcador de la exposición a andrógenos del feto masculino durante el período crítico de crecimiento genital, conocido como ventana de programación de masculinización (MPW)5. La AGD se determina prenatalmente y persiste durante la edad adulta6. Existe un estudio previo que ha mostrado una relación entre la AGD y el CaP7.
La forma más frecuente de diagnosticar un CaP es el examen rectal digital (DRE) o el aumento de los niveles de antígeno prostático específico (PSA) en sangre, pero no existen datos que apoyen un método de cribado como superior a otro8. El diagnóstico definitivo del CaP es histopatológico. El método ideal es la biopsia de próstata, aunque también puede aparecer en muestras de cirugía para el tratamiento de la hipertrofia prostática. El objetivo de nuestro estudio fue analizar si la AGD, como biomarcador del ambiente androgénico prenatal, es un predictor fiable de la presencia del CaP y pudiera utilizarse de la misma manera que el PSA y el DRE.
Material y métodoDiseño del estudio y poblaciónSe trata de un estudio de casos y controles, realizado entre mayo de 2013 y julio del 2015 en el Servicio de Urología del Hospital Universitario Reina Sofía de Murcia. Los casos (n=125) fueron hombres atendidos en el Servicio de Urología del Hospital Universitario y se incluyeron tanto casos prevalentes como incidentes. Todos los casos se sometieron a prostatectomía radical y fueron diagnosticados mediante examen histológico tras biopsia prostática. Los casos fueron divididos según la puntuación de Gleason obtenida en la biopsia siguiendo los criterios de los grupos de riesgo de d’Amico, es decir, Gleason ≤ 6, Gleason=7 y Gleason ≥ 8, dada la diferente degresividad, evolución y pronóstico de los pacientes9. Los controles (n=135) fueron hombres, seleccionados al azar de la lista de pacientes ambulatorios del mismo departamento hospitalario, que no mostraban signos o síntomas de enfermedad prostática (p. ej., síntomas del tracto urinario inferior, etc.). No se ofreció ninguna compensación económica. Todos los participantes proporcionaron su consentimiento informado por escrito para participar y el protocolo del estudio fue aprobado por el Comité Ético y de Investigación Clínica del Hospital Universitario y la Universidad de Murcia (Ref. No. 776/2013).
Examen físico y medidas de AGDSe midieron el peso corporal y la estatura, y se calculó el índice de masa corporal (IMC) como el peso en kiligramos dividido por la altura al cuadrado en metros. Se evaluó la presencia de varicocele, hidrocele, quiste epididimario u otras anomalías escrotales. Se excluyó a los pacientes que presentaban alguna limitación para el examen físico, incluyendo flexibilidad limitada, cirugía perineal o hemorroides externas.
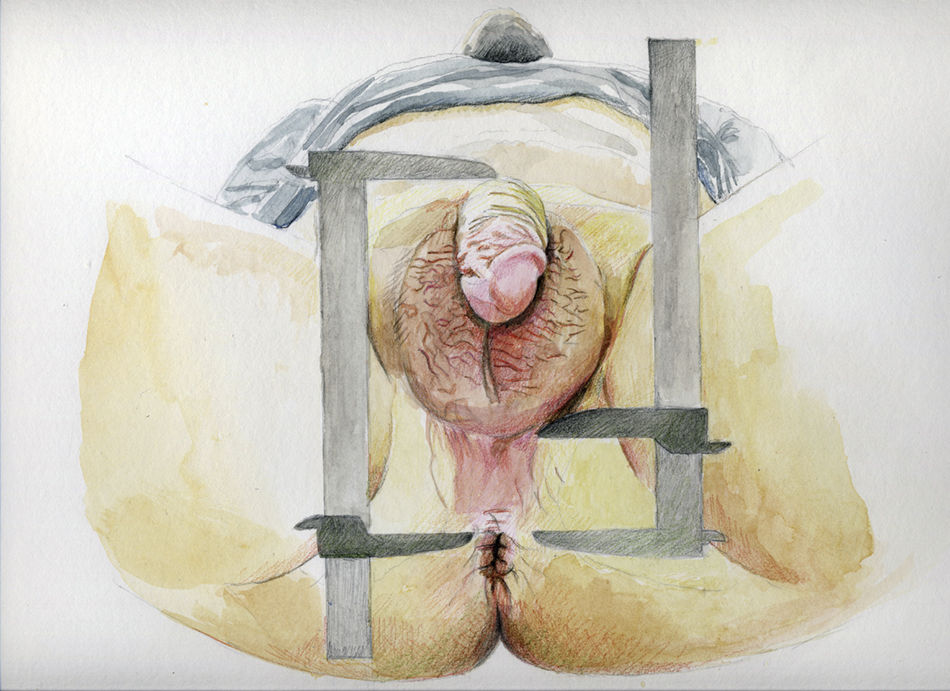
Se midieron 2distancias en cada sujeto. La primera se midió desde la base anterior del pene hasta el borde superior del ano (AGDAP); la segunda se midió desde el aspecto posterior (primer pliegue) del escroto hasta el borde superior del ano (AGDAS) (fig. 1). Ambas AGD se midieron usando un calibre digital (Stainless Steel Digital Caliper, VWR® International, LLC, West Chester, PA, EE. UU.). Los sujetos se colocaron en posición de litotomía, tumbado de espaldas, con los muslos flexionados en un ángulo de 45° con respecto a la mesa de examen, apoyando cada pie sobre estribos situados por encima o al mismo nivel que las caderas y el perineo situado en el borde de la mesa de examen. En todos los sujetos se midió cada distancia 3veces y el promedio de estos valores se utilizó para el análisis10. Además, los examinadores no conocían el estatus de caso o control de los sujetos a estudio.
Análisis estadísticoEl análisis descriptivo de las variables continuas se presentó como media, desviación estándar, medianas y percentiles. Las variables categóricas se presentaron como porcentajes. Se utilizaron pruebas t de Student y U de Mann-Whitney para la comparación de variables continuas entre casos y controles. Para las variables categóricas se utilizó la prueba de la ji al cuadrado.
Se utilizaron curvas características del receptor (ROC) para evaluar la precisión diagnóstica de AGD para detectar CaP. Las curvas ROC se generaron usando la estimación de máxima verosimilitud para ajustar una curva ROC binomial a datos distribuidos continuamente. Las curvas ROC fueron creadas comparando las mediciones AGD (AGDAP y AGDAS) y la presencia de CaP y subgrupos (CaP global, Gleason ≤ 6, Gleason=7 y Gleason ≥ 8) versus los controles.
Se calculó el valor de Youden (J)11 para determinar los puntos de corte óptimos para dicotomizar las medidas AGD y calcular la sensibilidad (S), la especificidad (E), los valores predictivos positivos (VPP) y negativos (VPN) y las relaciones de verosimilitud positiva (LR+) y negativa (LR–). Todos los resultados de la curva ROC se presentaron con un IC del 95%.
Todas las pruebas fueron de 2colas en el nivel de significación de 0,05. Los análisis se realizaron utilizando IBM SPSS 20.0 (IBM Corporation, Armonk, Nueva York, EE. UU.) y el software de estadística R utilizando el paquete OptimalCutpoints12 y el paquete pROC13.
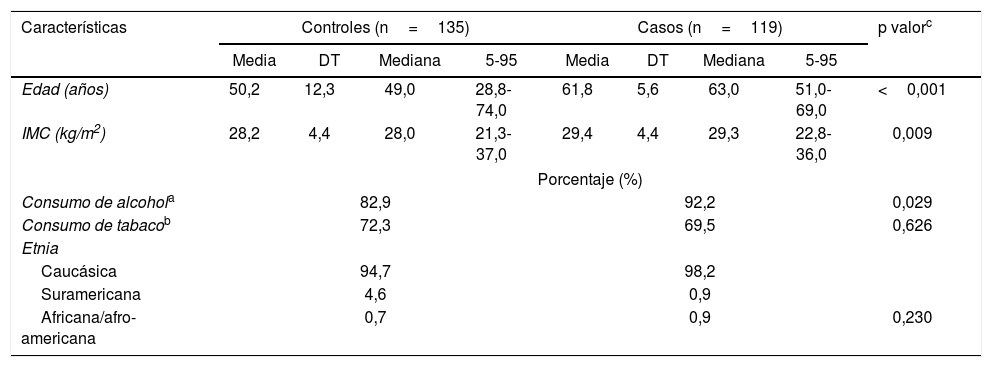
ResultadosPara toda la muestra, los casos eran más añosos y presentaban un IMC menor que los controles, pero eran similares en otras características demográficas y de estilo de vida (tabla 1). Con respecto a las mediciones de calidad de la AGD, los coeficientes de variación intra e interexaminadores fueron inferiores a 5 y 10% para AGDAP y AGDAS, respectivamente. Los coeficientes de correlación intraclase fueron superiores 0,80 para ambas medidas AGD. Los casos mostraron AGDAP y AGDAS significativamente más cortas que los controles, excepto para AGDAS en el subtipo Gleason ≥ 8.
Comparación de las características generales de casos y controles
| Características | Controles (n=135) | Casos (n=119) | p valorc | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Media | DT | Mediana | 5-95 | Media | DT | Mediana | 5-95 | ||
| Edad (años) | 50,2 | 12,3 | 49,0 | 28,8-74,0 | 61,8 | 5,6 | 63,0 | 51,0-69,0 | <0,001 |
| IMC (kg/m2) | 28,2 | 4,4 | 28,0 | 21,3-37,0 | 29,4 | 4,4 | 29,3 | 22,8-36,0 | 0,009 |
| Porcentaje (%) | |||||||||
| Consumo de alcohola | 82,9 | 92,2 | 0,029 | ||||||
| Consumo de tabacob | 72,3 | 69,5 | 0,626 | ||||||
| Etnia | |||||||||
| Caucásica | 94,7 | 98,2 | |||||||
| Suramericana | 4,6 | 0,9 | |||||||
| Africana/afro-americana | 0,7 | 0,9 | 0,230 | ||||||
DT: desviación típica; IMC: índice de masa corporal; 5-95=percentil 5-95.
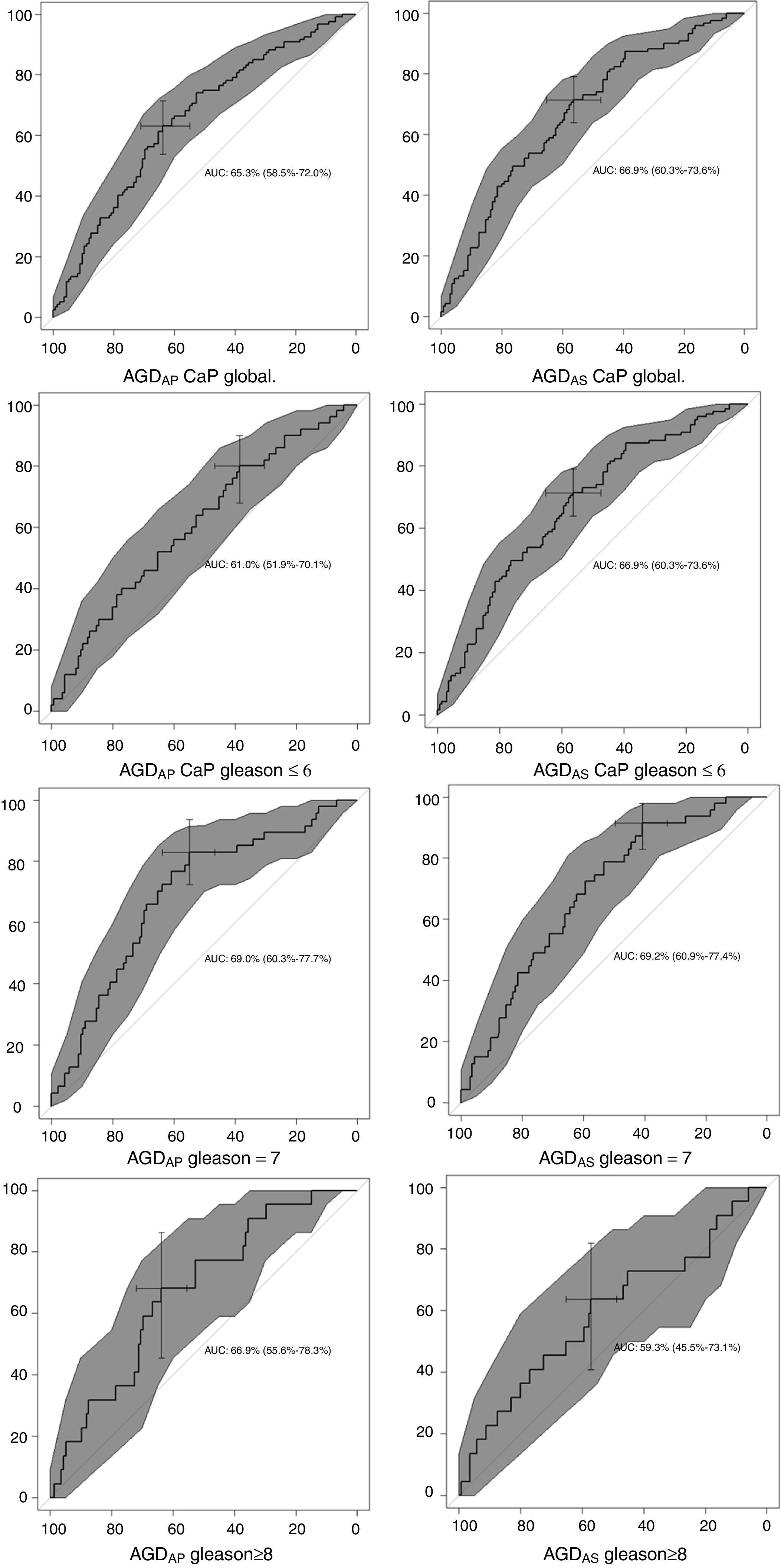
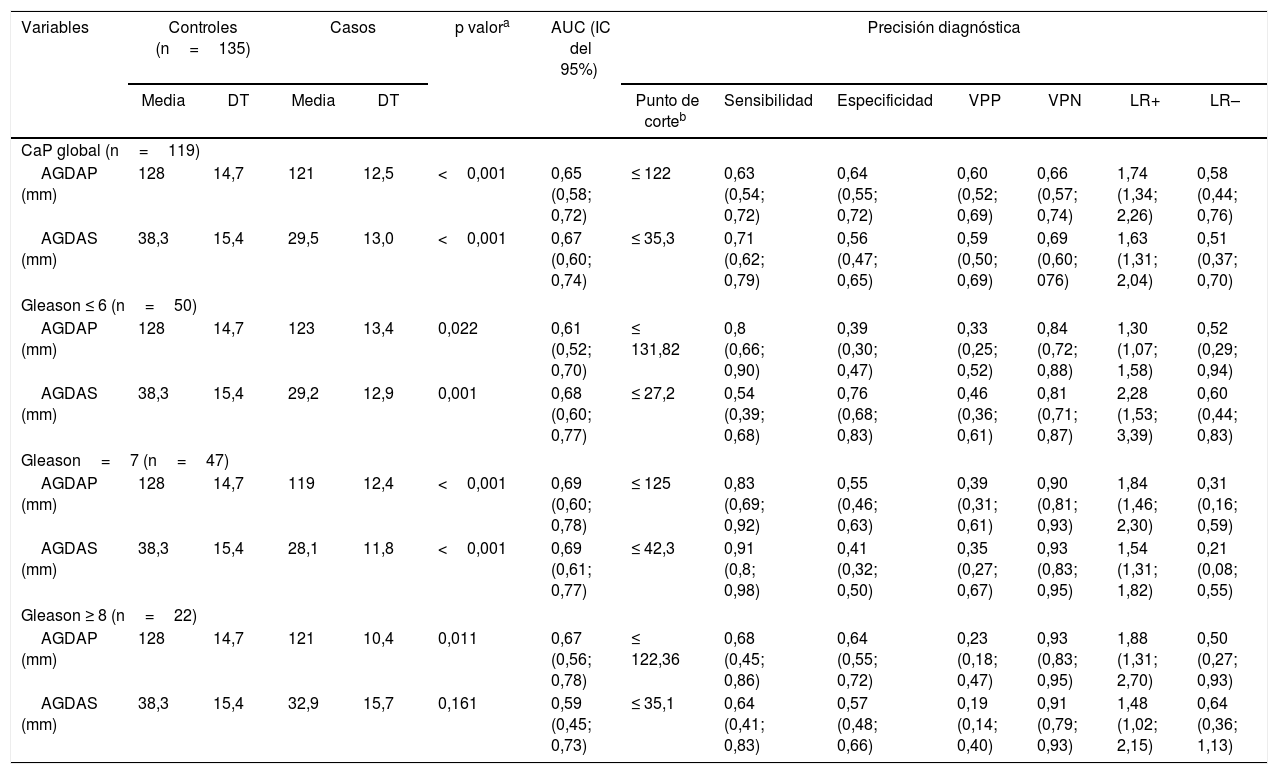
En la tabla 2 se muestra la precisión diagnóstica de las mediciones de AGD en los grupos CaP global y subtipos Gleason ≤ 6, Gleason=7 y Gleason ≥ 8. En el grupo CaP global y en el subtipo Gleason ≤ 6, el área bajo la curva (AUC) fue mayor para AGDAS comparado con AGDAP. En el subtipo Gleason=7, el AUC era el mismo para AGDAS que para AGDAP.
Precisión diagnóstica de AGD en los grupos Cáncer de próstata global y los subtipos según puntuación de Gleason
| Variables | Controles (n=135) | Casos | p valora | AUC (IC del 95%) | Precisión diagnóstica | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Media | DT | Media | DT | Punto de corteb | Sensibilidad | Especificidad | VPP | VPN | LR+ | LR– | |||
| CaP global (n=119) | |||||||||||||
| AGDAP (mm) | 128 | 14,7 | 121 | 12,5 | <0,001 | 0,65 (0,58; 0,72) | ≤ 122 | 0,63 (0,54; 0,72) | 0,64 (0,55; 0,72) | 0,60 (0,52; 0,69) | 0,66 (0,57; 0,74) | 1,74 (1,34; 2,26) | 0,58 (0,44; 0,76) |
| AGDAS (mm) | 38,3 | 15,4 | 29,5 | 13,0 | <0,001 | 0,67 (0,60; 0,74) | ≤ 35,3 | 0,71 (0,62; 0,79) | 0,56 (0,47; 0,65) | 0,59 (0,50; 0,69) | 0,69 (0,60; 076) | 1,63 (1,31; 2,04) | 0,51 (0,37; 0,70) |
| Gleason ≤ 6 (n=50) | |||||||||||||
| AGDAP (mm) | 128 | 14,7 | 123 | 13,4 | 0,022 | 0,61 (0,52; 0,70) | ≤ 131,82 | 0,8 (0,66; 0,90) | 0,39 (0,30; 0,47) | 0,33 (0,25; 0,52) | 0,84 (0,72; 0,88) | 1,30 (1,07; 1,58) | 0,52 (0,29; 0,94) |
| AGDAS (mm) | 38,3 | 15,4 | 29,2 | 12,9 | 0,001 | 0,68 (0,60; 0,77) | ≤ 27,2 | 0,54 (0,39; 0,68) | 0,76 (0,68; 0,83) | 0,46 (0,36; 0,61) | 0,81 (0,71; 0,87) | 2,28 (1,53; 3,39) | 0,60 (0,44; 0,83) |
| Gleason=7 (n=47) | |||||||||||||
| AGDAP (mm) | 128 | 14,7 | 119 | 12,4 | <0,001 | 0,69 (0,60; 0,78) | ≤ 125 | 0,83 (0,69; 0,92) | 0,55 (0,46; 0,63) | 0,39 (0,31; 0,61) | 0,90 (0,81; 0,93) | 1,84 (1,46; 2,30) | 0,31 (0,16; 0,59) |
| AGDAS (mm) | 38,3 | 15,4 | 28,1 | 11,8 | <0,001 | 0,69 (0,61; 0,77) | ≤ 42,3 | 0,91 (0,8; 0,98) | 0,41 (0,32; 0,50) | 0,35 (0,27; 0,67) | 0,93 (0,83; 0,95) | 1,54 (1,31; 1,82) | 0,21 (0,08; 0,55) |
| Gleason ≥ 8 (n=22) | |||||||||||||
| AGDAP (mm) | 128 | 14,7 | 121 | 10,4 | 0,011 | 0,67 (0,56; 0,78) | ≤ 122,36 | 0,68 (0,45; 0,86) | 0,64 (0,55; 0,72) | 0,23 (0,18; 0,47) | 0,93 (0,83; 0,95) | 1,88 (1,31; 2,70) | 0,50 (0,27; 0,93) |
| AGDAS (mm) | 38,3 | 15,4 | 32,9 | 15,7 | 0,161 | 0,59 (0,45; 0,73) | ≤ 35,1 | 0,64 (0,41; 0,83) | 0,57 (0,48; 0,66) | 0,19 (0,14; 0,40) | 0,91 (0,79; 0,93) | 1,48 (1,02; 2,15) | 0,64 (0,36; 1,13) |
AGDAP: distancia anogenital desde la base anterior del pene hasta el margen superior del ano; AGDAS: distancia anogenital desde el aspecto posterior del escroto (primer pliegue) hasta el margen superior del ano; AUC: área bajo la curva; DT: desviación típica; LR: likelihood ratio; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Dicotomizado basado en el índice de Youden (J) (máxima eficacia para sensibilidad y especificidad). Tomado de Ruopp et al.11.
Para el grupo CaP global (n=119) versus controles (n=135), el AUC de AGDAP y AGDAS fue de 0,65 (IC del 95%: 0,58-0,72) y 0,67 (IC del 95%: 0,60-0,74), respectivamente. En el caso del subtipo Gleason ≤ 6 (n=50), Gleason=7 (n=47) y Gleason ≥ 8 (n=22) frente a los controles (n=135) el AUC de AGDAP y AGDAS fueron de 0,61 (IC del 95%: 0,52-0,70) y 0,68 (0,60-0,74); 0,69 (IC del 95%: 0,60-0,78) y 0,69 (IC del 95%: 0,61-0,77); y 0,67 (IC del 95%: 0,56-0,78) y 0,59 (IC del 95%: 0,45-0,73), respectivamente (fig. 2). Se obtuvo el AUC más alto (0,69; IC del 95%: 0,60-0,78 y 0,69; IC del 95%: 0,61-0,77) para el subtipo Gleason=7 con ambas medidas AGD con un corte óptimo de 125mm y 42,3mm para AGDAP y AGDAS, respectivamente.
La sensibilidad para AGDAP y AGDAS en todos los grupos, CaP global y los subtipos Gleason ≤ 6, Gleason=7 y Gleason ≥ 8 fueron 0,63 (IC del 95%: 0,54-0,72) y 0,71 (IC del 95%: 0,62-0,79); 0,8 (IC del 95%: 0,66-0,90) y 0,54 (IC del 95%: 0,39-0,68); 0,83 (IC del 95%: 0,69-0,92) y 0,91 (IC del 95%: 0,8-0,98); 0,68 (IC del 95%: 0,45-0,86) y 0,64 (IC del 95%: 0,41-0,83), respectivamente. La especificidad para AGDAP y AGDAS en todos los grupos, CaP global y los subtipos Gleason ≤ 6, Gleason=7 y Gleason ≥ 8 fueron 0,64 (IC del 95%: 0,55-0,72) y 0,56 (IC del 95%: 0,47 a 0,65); 0,39 (IC del 95%: 0,30-0,47) y 0,76 (IC del 95%: 0,68-0,83); 0,55 (IC del 95%: 0,46-0,63) y 0,41 (IC del 95%: 0,32-0,50); 0,64 (IC del 95%: 0,55-0,72) y 0,57 (IC del 95%: 0,48-0,66), respectivamente.
El VPP para AGDAP y AGDAS en todos los grupos, CaP global y los subtipos Gleason ≤ 6, Gleason=7 y Gleason ≥ 8 fueron 0,60 (IC del 95%: 0,52-0,69) y 0,59 (IC del 95%: 0,50-0,69); 0,33 (IC del 95% 0,25-0,52) y 0,46 (IC del 95%: 0,36-0,61); 0,39 (IC del 95%: 0,31-0,61) y 0,35 (IC del 95%: 0,27-0,67); 0,23 (IC del 95%: 0,18-0,47) y 0,19 (IC del 95% 0,14-0,40), respectivamente. El VPN para AGDAP y AGDAS en todos los grupos, CaP global y los subtipos Gleason ≤ 6, Gleason=7 y Gleason ≥ 8 fueron 0,66 (IC del 95%: 0,57-0,74) y 0,69 (IC del 95%: 0,60-0,76); 0,84 (IC del 95%: 0,72-0,87) y 0,81 (IC del 95%: 0,71-0,87); 0,90 (IC del 95%: 0,81-0,93) y 0,93 (IC del 95%: 0,83-0,95); 0,93 (IC del 95%: 0,83-0,95) y 0,91 (IC del 95%: 0,79-0,93), respectivamente.
DiscusiónHasta donde conocemos, este es el primer estudio que evalúa el rendimiento y la utilidad clínica de la AGD en el diagnóstico de CaP. Nuestros hallazgos indican que la AGD, un biomarcador del medio hormonal intrauterino, podría ser útil para identificar a los pacientes con CaP.
Una mayor exposición a los estrógenos durante la ventana de programación de la MPW podría inducir una AGD más corta. Una menor AGD también podría resultar de una menor exposición a la testosterona durante el período de MPW, como se ha demostrado en modelos animales14 y estudios observacionales en humanos15,16. Distancias de AGD alargadas y anomalías del tracto genitourinario, como hipospadias o criptorquidia17,18, se han asociado con exposiciones prenatales a disruptores endocrinos, como los ftalatos (antiandrógenos), tanto en niños como en neonatos15,16.
Un entorno prenatal hiperandrogénico o hiperestrogénico podría por tanto también ejercer una influencia sobre el desarrollo del tracto reproductivo femenino, incluida la AGD19. Varios estudios han mostrado que una AGD alargada se correlaciona con un mayor número de folículos ováricos20 y mayores niveles de testosterona en mujeres adultas21. Recientemente, una AGD acortada se ha asociado con la presencia y la gravedad de la endometriosis (una enfermedad crónica dependiente de estrógenos) en mujeres adultas22, lo que sugiere una posible conexión entre las exposiciones prenatales a estrógenos (reflejadas por una AGD más corta) y esta patología. El mismo grupo de investigadores observaron que la AGD era una herramienta útil para predecir la presencia de endometriosis, especialmente la endometriosis infiltrante profunda23.
Boberg et al.24 mostraron una relación entre la disminución de los niveles de testosterona perinatal y la aparición de lesiones proliferativas en próstata de rata, lo que indica que la una exposición perinatal a toxinas ambientales (p. ej., productos químicos antiandrogénicos), podrían aumentar el riesgo de presentar CaP a lo largo de la vida adulta. Aunque los mecanismos no se conocen por completo en la actualidad, existe una creciente evidencia de que los estrógenos pueden desempeñar un papel clave en el desarrollo de la próstata25. La exposición a estrógenos durante el desarrollo embrionario podría inducir cambios celulares en la próstata, siendo un factor predisponente para las enfermedades prostáticas en la edad adulta. De acuerdo con esa hipótesis, una mayor exposición de la población a estrógenos durante el período fetal podría resultar en una mayor incidencia de CaP26.
En la época pre-PSA, la única herramienta para la detección temprana de CaP era el tacto rectal (DRE). El tacto rectal es una exploración subjetiva y dependiente del examinador. Smith y Catalona (1995) sugirieron que la reproducibilidad del DRE para la detección del CaP era adecuada únicamente entre los urólogos y que la variabilidad interexaminador era mayor tanto para otros facultativos como para residentes27. Muchos pacientes con CaP, inclusive algunos en estadio avanzado, nunca desarrollan una anormalidad palpable28. La sensibilidad y la especificidad del DRE es del 46,1 y el 84,7%, respectivamente, cuando se utiliza aisladamente29. El VPP del DRE aislado varía del 17,7 a 53,5% en algunos trabajos publicados en la literatura29-31. La precisión del DRE se ve, además, muy influida por el volumen prostático y la presencia de biopsias prostáticas previas32.
Por otro lado, una de las actividades más comunes para la detección precoz del CaP es la medición de los niveles séricos de PSA. La detección del CaP mediante la medición de los niveles PSA sérico es un tema controvertido, ya que ningún estudio ha mostrado que esta estrategia reduzca la mortalidad derivada de esta patología33. La sensibilidad y especificidad del PSA varían dependiendo de dónde se establezca el punto de corte. Un límite de PSA de 4,0g/l produce una sensibilidad y especificidad del 20,5 y el 94%, respectivamente, para la detección de CaP con una ligera mejoría si se realiza estratificación por edad34. El VPP para un valor de corte de PSA de 4,0g/l es del 27,7 al 28,3%29,31.
La inexactitud del PSA se debe, en parte, a la influencia de una serie de factores genéticos, clínicos y biológicos que modifican los niveles de PSA sérico35. Por el contrario, la AGD posee una reproducibilidad adecuada intra e interobservador, no existiendo diferencias entre urólogos y residentes, como se demostró en un estudio anterior10. Nuestros resultados muestran una sensibilidad y especificidad del 63 y el 64% para AGDAP y el 71 y el 56% para AGDAS. Estos resultados mejoran sustancialmente cuando establecemos grupos según la puntuación de Gleason. El VPP para AGDAS y AGDAP en el grupo CaP global fue del 60 y el 59%, respectivamente. El único factor que parece influir las mediciones de AGD en el varón adulto sería la presencia de cirugía perineal previa, por lo que podríamos decir que es una medida estable y confiable. La precisión del PSA y del DRE aumenta cuando se utilizan conjuntamente29-31. La adición de medidas de AGD para el cribado inicial de CaP podría mejorar los porcentajes de diagnóstico, pero en el momento actual no hay estudios publicados para apoyar esta teoría.
Nuestro estudio presenta algunas limitaciones. Podría caber la posibilidad de un sesgo de selección y medida. Los controles fueron pacientes que acudieron al hospital público (controles hospitalarios) en el mismo periodo de tiempo, pero sin embargo procedían de la misma población de la que surgieron los casos. Se reclutaron casos prevalentes e incidentes puesto que, hasta donde conocemos, la AGD se mantiene estable a través de la vida adulta, con lo cual no afectaría al objetivo de nuestro estudio. Además, los casos fueron solo pacientes tratados mediante prostatectomía radical, con lo cual se podrían obtener riesgos más bajos en comparación con casos tratados mediante radioterapia u otras técnicas. En general, hallamos áreas bajo la curva entre 0,55 y 0,69, que serían aceptables para el propósito de este primer estudio, pero se sabe que un valor diagnóstico apropiado se impone a partir de una AUC mayor de 0,80. También podría existir una mala clasificación de la enfermedad, no obstante, hubiera contribuido a una atenuación de las asociaciones observadas. En conclusión, proponemos las medidas de AGD, en adición al PSA y DRE, como una herramienta para intentar mejorar la precisión en el diagnóstico inicial de CaP. Además, una AGD que refleje un desarrollo sexual intrauterino normal podría asociarse a un menor riesgo de presentar CaP. No obstante, son necesarios más trabajos para corroborar nuestros resultados y determinar la utilidad de este biomarcador en la práctica clínica habitual. Además, cabe señalar que en futuros estudios sería muy importante recopilar datos sobre PSA y TR en casos y controles, con el fin de comparar la precisión diagnóstica de la AGD con respecto a dichas variables por separado y conjuntamente en la misma población de estudio.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.
Agradecemos a la Prof. Dr. Elena Vicente-Herranz por sus ilustraciones médicas. Este trabajo cuenta con el respaldo del Ministerio de Educación, Economía y Competitividad, ISCIII (AES), PI13/01237; y la Fundación Séneca de la Región de Murcia, Agencia Regional de Ciencia y Tecnología, 19443/PI/14.