La asociación de la disfunción eréctil (DE) y la enfermedad cardiovascular (ECV) es bien conocida, siendo un factor temprano de riesgo independiente que puede aparecer hasta cinco años antes del inicio de los síntomas cardiovasculares. En su fisiopatología podría estar implicada la enzima óxido nítrico sintasa endotelial (eNOS) como vasodilatador endógeno. Nuestro objetivo fue analizar la influencia de variantes del gen eNOS en la respuesta al tratamiento de la DE, en pacientes con ECV.
MetodologíaEstudio observacional, prospectivo, en pacientes con DE del Programa de Rehabilitación Cardíaca. Se recogieron variables demográficas (Indice Internacional de Función Eréctil [IIEF]), calidad de vida sexual (mSLQQ), ansiedad y depresión (HAD), junto con los factores de riesgo cardiovascular (FRCV). El análisis genético de los polimorfismos T-786C, G894T del gen eNOS se realizó mediante RT-PCR con sonda TaqMan. Los datos fueron analizados mediante SPSS 25.
ResultadosLos pacientes (n = 35, 60,8 ± 8,44 años) mostraron una mediana de una ECV (RIC 1-3) con una DE grave (IIEF-EF de 9,4 ± 6,73 puntos) y una baja percepción de su calidad de vida sexual (–19,4 ± 8,37 puntos). En la visita final (n = 15), hubo un 71% de respondedores al tratamiento con inhibidores de la fosfodiesterasa 5 (iPDE5), con una mejoría significativa de su DE (IIEF = 49,4 ± 17,29; IIEF-FE = 18,5 ± 9,60 puntos), calidad de vida sexual y ansiedad, con un mayor porcentaje de respondedores entre los genotipos homocigoto nativos -786-TT y el 864-TT.
ConclusiónLas variantes del gen NOS3 podrían influir en la respuesta a iPDE5. Se requerirá el análisis completo de la muestra del paciente para confirmar estos resultados preliminares.
The association between erectile dysfunction (ED) and cardiovascular disease (CVD) is well known, the latter being an early independent risk factor that can appear up to 5 years before the onset of cardiovascular symptoms. The enzyme endothelial nitric oxide synthase (eNOS) could be implicated in its pathophysiology as an endogenous vasodilator. Our objective was to analyse the influence of variants of the eNOS gene, in the response to treatment of ED, in patients with CVD.
MethodologyObservational, prospective study in patients with ED of the Cardiac Rehabilitation Programme. Demographic variables were collected (International Index of Erectile Function (IIEF), quality of sexual life (mSLQQ), anxiety and depression (HAD), along with cardiovascular risk factors (CVRF). Genetic analysis of polymorphisms T-786C, G894T of the eNOS gene was performed by RT-PCR with TaqMan probe, and the data were analysed using SPSS 25.
ResultsPatients (n = 35, 60.8 ± 8.44 years) showed a median CVD (IQR 1-3) with severe ED (IIEF-EF of 9.4 ± 6.73 points) and a low perception of their quality of sexual life (–19.4 ± 8.37 points). At the final visit (n = 15), there were 71% responders to treatment with iPDE5, with a significant improvement in their ED (IIEF = 49.4 ± 17.29, IIEF-FE = 18.5 ± 9.60 scores) and of their quality of sexual life (7 ± 12 scores), with a higher percentage of responders among the native homozygous genotypes -786-TT and 864-TT.
ConclusionVariants of the NOS3 gene could influence the response to iPDE5. Full analysis of the patient sample will be required to confirm these preliminary results.
La disfunción eréctil (DE) es un trastorno definido como la imposibilidad de conseguir o mantener una erección que permita unas relaciones sexuales satisfactorias1. Esta disfunción llega a afectar a cerca de dos millones de españoles puesto que, en el estudio nacional EDEM2, entre el 12 y el 19%, según el IIEF, de los varones entre 25 y 70 años, presentan algún grado de DE (16% mínima, 2% moderada y 1% severa). Dicha prevalencia aumenta con la edad (8,6% en varones de 25 a 39 años, 13,7% de 40-49 años, 24,5% entre 50 y 59 años y 49% en sujetos de 60 a 70 años). Sin embargo, sigue siendo un trastorno infradiagnosticado e infratratado, lo cual es relevante ya que se considera a la DE un signo centinela de enfermedad cardiovascular (ECV) que puede llegar a precederla hasta en unos cinco años, considerándose una manifestación temprana de ateroesclerosis y disfunción endotelial3.
Tanto la DE como la ECV comparten factores de riesgo (hipertensión arterial [HTA], diabetes mellitus [DM], dislipemia [DL] y tabaquismo)4. Por lo tanto, es importante una detección temprana junto a un adecuado tratamiento para mejorar tanto su calidad de vida sexual, como la prevención de eventos cardiovasculares.
Fisiología de la erección e implicación del gen eNOSEl óxido nítrico (NO) se considera un nitrovasodilatador endógeno, puesto que estimula la guanilil ciclasa para producir monofosfato de guanosina cíclico (GMPc), causando vasodilatación del músculo liso vascular y de los cuerpos cavernosos. Este fenómeno aumenta el flujo sanguíneo, que queda atrapado en los sinusoides venosos, al quedar los plexos venosos comprimidos contra la túnica albugínea, impidiendo el retorno venoso disminuido5. Diversas publicaciones muestran que el NO puede actuar, a nivel del sistema nervioso central, en el comportamiento sexual y erección peneana. La producción de NO aumenta durante las erecciones. Además, la inyección en el núcleo paraventricular de inhibidores de la NO sintasa (L-NAME) inhibe la erección producida por dopamina, oxitocina o NMDA. Esta inhibición no se observa si se inyecta además L-arginina, el sustrato para la producción de NO6. Múltiples modelos animales de DE con diabetes 1 y 2 tienen disminuida la vasodilatación del tejido cavernoso dependiente del endotelio a consecuencia de una menor producción de ON7. Por tanto, una menor síntesis de la enzima óxido nítrico endotelial sintasa (eNOS) o una menor actividad de esta, se ha relacionado con la DE y otras patologías asociadas con la disfunción endotelial (hipertensión arterial [HTA], nefropatía y retinopatía diabética, obesidad, migraña, preeclampsia)8,9.
El gen que codifica para esta enzima, el NOS3, se encuentra en el cromosoma 7q36. De todos, hay dos loci polimórficos que se han asociado con una menor actividad con consecuencias clínicas: (i) G894T en el exón 7: condiciona un cambio de glutamato en la posición 298 a aspartato y posee una menor actividad biológica por un defecto en el transporte y una mayor afinidad a la caveolina 1, que posee una función inhibidora sobre la eNOS10; (ii) T-786C en la región promotora: produce un sitio de unión para la proteína A1 que bloquea la expresión de la enzima eNOS en un 50% 10. También se ha relacionado el genotipo de la NOS3 con diferencias en la respuesta al tratamiento de la DE con sildenafilo, un inhibidor de la fosfodiesterasa 5 (iPDE5)11, la respuesta al tratamiento antihipertensivo con enalapril12 y un aumento de nitritos en sangre inducido por el tratamiento con atorvastatina13. Por este motivo, sería de interés analizar si la respuesta al tratamiento de la DE con inhibidores de la fosfodiesterasa 5 (iPDE5) podría variar según el genotipo de los pacientes.
El objetivo del estudio fue el de analizar el genotipo de los pacientes, tanto como marcador de riesgo de ECV como de diferente respuesta al tratamiento con iPDE5, así como implementar una vía de derivación clínica entre las unidades de Cardiología y Andrología para favorecer el tratamiento de la DE y conseguir una mayor calidad de vida sexual en estos pacientes.
MétodosDiseño y población de estudioSe diseñó un estudio observacional, prospectivo y unicéntrico, en el que se incluían todos los pacientes en el Programa de Rehabilitación Cardiaca del Hospital General Universitario de Alicante (HGUA), con ECV (angina inestable [AI] o infarto agudo de miocardio [IAM]), que presentaban DE y por tanto, iban a ser derivados a la consulta de Andrología por rutina clínica para recibir tratamiento con iPDE5. Los criterios de inclusión fueron: pacientes varones de más de 30 años, con antecedente de enfermedad cardiovascular y pareja estable. Los criterios de exclusión fueron: contraindicaciones para el tratamiento con iPDE5 (tratamiento con nitratos, IAM hace menos de seis meses), hipoactividad sexual y abuso de drogas. El proyecto fue aprobado por el Comité Ético de Investigación Clínica con medicamentos (CEIm) del Departamento de Salud de Alicante-Hospital General (DSA-HG).
Variables analizadasSe realizó una anamnesis e historia clínica detallada. Se preguntó sobre la calidad de las erecciones, las posibilidades de penetración, la capacidad de mantener la erección y su presencia en otras situaciones. Los pacientes cumplimentaron el cuestionario Índice Internacional de Función Eréctil (IIEF), que consta de preguntas que abarcan: función eréctil (IIEF-FE), función orgásmica, deseo sexual, satisfacción con la relación sexual y satisfacción general. El grado de DE (subdominio IIEF-FE) va de 1 a 30 puntos y clasifica la DE en: severa 1-10 puntos, moderada 11-16 puntos, leve 17-25 puntos y sin DE 26-30 puntos14,15.
Se cumplimentó un cuestionario sobre calidad de vida sexual (Sexual Life Quality Questionnaire, mSLQQ), una herramienta multidimensional en la que se pide a los pacientes y sus parejas que comparen sus experiencias antes de la aparición de la DE en 10 subescalas de evaluación: frecuencia del sexo, la duración de las relaciones sexuales, la facilidad de penetración, la facilidad de alcanzar el orgasmo; la facilidad de iniciar las relaciones sexuales, el placer de la anticipación, sentimientos sin preocupaciones durante las relaciones sexuales, placer del orgasmo, placer total y placer a su pareja. Una puntuación de 0 indica que no hay cambios, < 0 y > 0 puntos indican un empeoramiento o mejoría, respectivamente. Por otra parte, se realizó el test de Escala Hospitalaria de Ansiedad (HAD-A) y Depresión (HAD-D), clasificándose según la puntuación en «no caso» (< 7), «posible caso» (8-10) y caso (> 11).
Se realizaron analíticas sanguíneas o se recuperaron los datos de analíticas recientes de los últimos seis meses que incluyeran glucosa plasmática, triglicéridos y colesterol en sangre. También se registraron otros valores analíticos según la disponibilidad (creatinina, velocidad de filtración glomerular, urea, transaminasas, bilirrubina, hemoglobina glicosilada, testosterona, hormona foliculoestimulante [FSH] y hormona luteinizante [LH]). Se definió como hipertrigliceridemia un valor de triglicéridos en sangre superior a 150 mg/dL o un diagnóstico previo de hipertrigliceridemia y como hipercolesterolemia un colesterol total en sangre superior a 200 mg/dL o un diagnóstico previo de hipercolesterolemia. Se consideraron como dislipémicos a los pacientes con hipertrigliceridemia o hipercolesterolemia. Aquellos que estaban en tratamiento antihipertensivo o tenían un diagnóstico previo de hipertensión arterial se catalogaron como hipertensos. Aquellos que presentaron una glucosa plasmática en ayunas superior a 126 mg/dL en dos ocasiones o tenían un diagnóstico y/o tratamiento previo hipoglucemiante se catalogaron como diabéticos. Se consideraron como obesos los pacientes con un índice de masa corporal (IMC) superior a 30 kg/m2. Se registraron además todos los fármacos que pudieran estar implicados en la DE.
Se recogieron 2 mL de saliva en tubos con 6 mL de solución salina. Tras la extracción del ADN de las muestras de saliva, se procedió a la determinación de las variantes genéticas T-786C (rs2070744) y G894T (rs1799983) del gen eNOS mediante RT-PCR (Real Time-Polymerase Chain Reaction) con sonda TaqMan.
Procedimiento clínicoSe realizaron dos visitas más, a los tres y seis meses, repitiendo los cuestionarios en la tercera visita y reajustando el tratamiento en caso de que no hubiera respuesta. En las visitas se compararon las diferencias en las puntuaciones en las escalas, entre la visita final y basal. Además, se dividieron a los pacientes en respondedores y no respondedores, según el cambio en la puntuación en la escala IIEF fuera superior o inferior a la mediana, respectivamente, y se analizaron las prevalencias de los distintos genotipos en cada grupo. Para valorar el riesgo cardiovascular se comparó la edad de aparición del primer episodio cardiovascular según el genotipo.
Análisis estadísticoLos datos se expresan como media ± desviación estándar o como mediana y rango intercuartílico para parámetros que no se ajusten a una distribución normal. Se empleó la prueba de U de Mann-Whitney y la prueba de Kruskal-Wallis para la comparación de variables continuas y el test exacto de Fisher para la comparación de variables categóricas. El análisis estadístico se realizó mediante el programa SPSS versión 25 para Windows®. Se estableció el nivel de significación estadística cuando p ≤ 0,05.
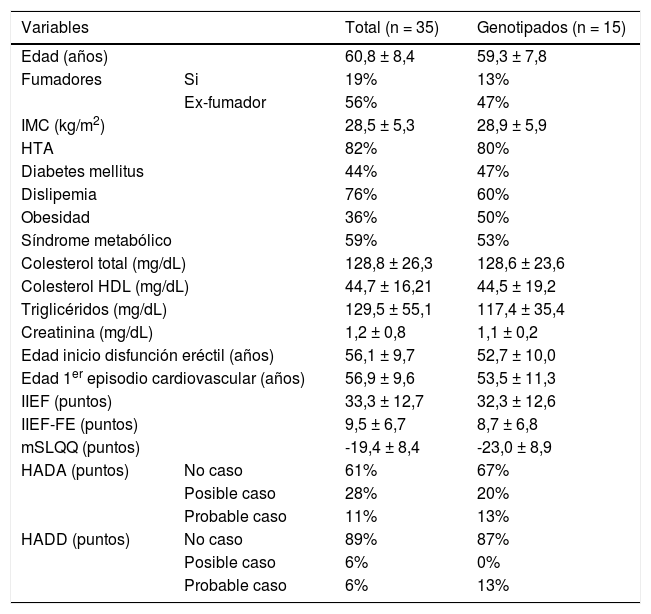
ResultadosDatos demográficos y clínicosSe han derivado a la consulta de andrología 36 pacientes, de los cuales, 35 han sido incluidos para el estudio. Se ha realizado el estudio genético en 27 de esos pacientes, estando el resto pendiente. Han completado el estudio hasta la visita final 15 pacientes. Los datos clínicos y analíticos de la muestra están resumidos en la tabla 1.
Características clínicas y analíticas. Datos en porcentaje y media ± desviación estándar
| Variables | Total (n = 35) | Genotipados (n = 15) | |
|---|---|---|---|
| Edad (años) | 60,8 ± 8,4 | 59,3 ± 7,8 | |
| Fumadores | Si | 19% | 13% |
| Ex-fumador | 56% | 47% | |
| IMC (kg/m2) | 28,5 ± 5,3 | 28,9 ± 5,9 | |
| HTA | 82% | 80% | |
| Diabetes mellitus | 44% | 47% | |
| Dislipemia | 76% | 60% | |
| Obesidad | 36% | 50% | |
| Síndrome metabólico | 59% | 53% | |
| Colesterol total (mg/dL) | 128,8 ± 26,3 | 128,6 ± 23,6 | |
| Colesterol HDL (mg/dL) | 44,7 ± 16,21 | 44,5 ± 19,2 | |
| Triglicéridos (mg/dL) | 129,5 ± 55,1 | 117,4 ± 35,4 | |
| Creatinina (mg/dL) | 1,2 ± 0,8 | 1,1 ± 0,2 | |
| Edad inicio disfunción eréctil (años) | 56,1 ± 9,7 | 52,7 ± 10,0 | |
| Edad 1er episodio cardiovascular (años) | 56,9 ± 9,6 | 53,5 ± 11,3 | |
| IIEF (puntos) | 33,3 ± 12,7 | 32,3 ± 12,6 | |
| IIEF-FE (puntos) | 9,5 ± 6,7 | 8,7 ± 6,8 | |
| mSLQQ (puntos) | -19,4 ± 8,4 | -23,0 ± 8,9 | |
| HADA (puntos) | No caso | 61% | 67% |
| Posible caso | 28% | 20% | |
| Probable caso | 11% | 13% | |
| HADD (puntos) | No caso | 89% | 87% |
| Posible caso | 6% | 0% | |
| Probable caso | 6% | 13% | |
IIEF = International Index of Erectile Function. IIEF-FE = International Index of Erectile Function, Función Eréctil. mSLQQ = Sexual Life Quality Questionnaire HADA = Hospital Anxiety and Depression, Anxiety. HADD = Hospital Anxiety and Depression, Depression.
Los pacientes (60,8 ± 8,44 años, 56% exfumador, 82% hipertensos, 76% dislipemia, 56% con síndrome metabólico) presentaron una mala calidad de vida sexual, con una puntuación negativa en el test mSLQQ. El 70% (19/27) mostraban una DE severa, con una puntuación IIEF-FE menor o igual a 10. En la mayor parte no existía una comorbilidad de ansiedad ni de depresión. El primer ECV lo había tenido una media de cinco años antes.
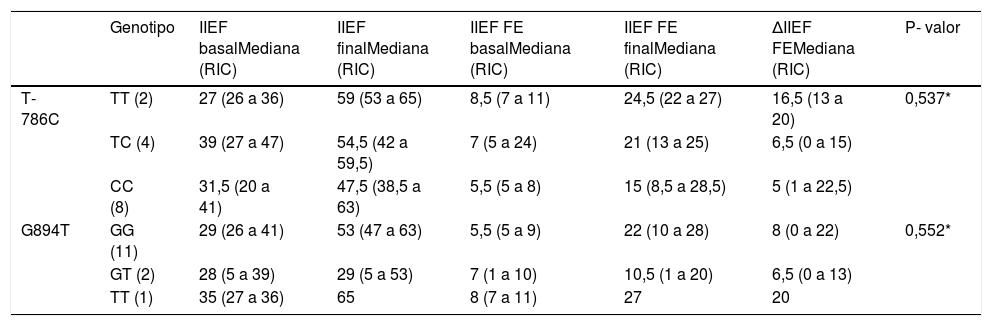
Respuesta al tratamiento e influencia del genotipoTras la derivación a la Unidad de Andrología y el tratamiento con iPDE5 (100%), la mediana de cambio en la puntuación IIEF-FE fue de 10,5 (RIC 0,0 a 20,5) puntos. En la tabla 2, se muestra que el 71% de los pacientes mostraron mejoría en la función eréctil, mientras que el 29% no mostró ningún cambio. Sin embargo, la diferencia en la puntuación de la escala IIEF y IIEF-FE entre la visita final y basal no fue significativa (p = 0,088 y 0,228).
Puntuaciones basales y respuesta al tratamiento según el genotipo
| Genotipo | IIEF basalMediana (RIC) | IIEF finalMediana (RIC) | IIEF FE basalMediana (RIC) | IIEF FE finalMediana (RIC) | ΔIIEF FEMediana (RIC) | P- valor | |
|---|---|---|---|---|---|---|---|
| T-786C | TT (2) | 27 (26 a 36) | 59 (53 a 65) | 8,5 (7 a 11) | 24,5 (22 a 27) | 16,5 (13 a 20) | 0,537* |
| TC (4) | 39 (27 a 47) | 54,5 (42 a 59,5) | 7 (5 a 24) | 21 (13 a 25) | 6,5 (0 a 15) | ||
| CC (8) | 31,5 (20 a 41) | 47,5 (38,5 a 63) | 5,5 (5 a 8) | 15 (8,5 a 28,5) | 5 (1 a 22,5) | ||
| G894T | GG (11) | 29 (26 a 41) | 53 (47 a 63) | 5,5 (5 a 9) | 22 (10 a 28) | 8 (0 a 22) | 0,552* |
| GT (2) | 28 (5 a 39) | 29 (5 a 53) | 7 (1 a 10) | 10,5 (1 a 20) | 6,5 (0 a 13) | ||
| TT (1) | 35 (27 a 36) | 65 | 8 (7 a 11) | 27 | 20 |
IIEF = International Index of Erectile Function. IIEF-FE = International Index of Erectile Function, Función Eréctil.
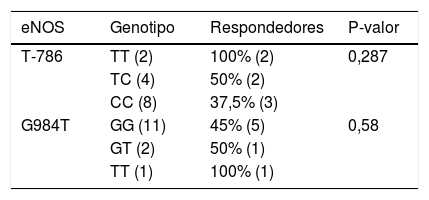
Las distribuciones de los alelos no difieren del equilibrio de Hardy Weinberg (p-valor 0,83 y 0,14 para T-786C y G894T, respectivamente). Se encontró una tendencia a la mejor respuesta clínica entre los genotipos homocigoto nativos 786-TT (100% respondedores) y el 864-TT (100% respondedores), sin ser significativas entre los distintos genotipos (p = 0,537 para el polimorfismo T-786C y p = 0,552 para el polimorfismo G894T) tal vez por el escaso tamaño muestral (tabla 3).
Pacientes respondedores al tratamiento con inhibidores de la fosfodiesteresa 5 según genotipo eNOS analizado
| eNOS | Genotipo | Respondedores | P-valor |
|---|---|---|---|
| T-786 | TT (2) | 100% (2) | 0,287 |
| TC (4) | 50% (2) | ||
| CC (8) | 37,5% (3) | ||
| G984T | GG (11) | 45% (5) | 0,58 |
| GT (2) | 50% (1) | ||
| TT (1) | 100% (1) |
Test de Kruskal-Wallis comparando la tasa de respondedores entre los diferentes genotipos.
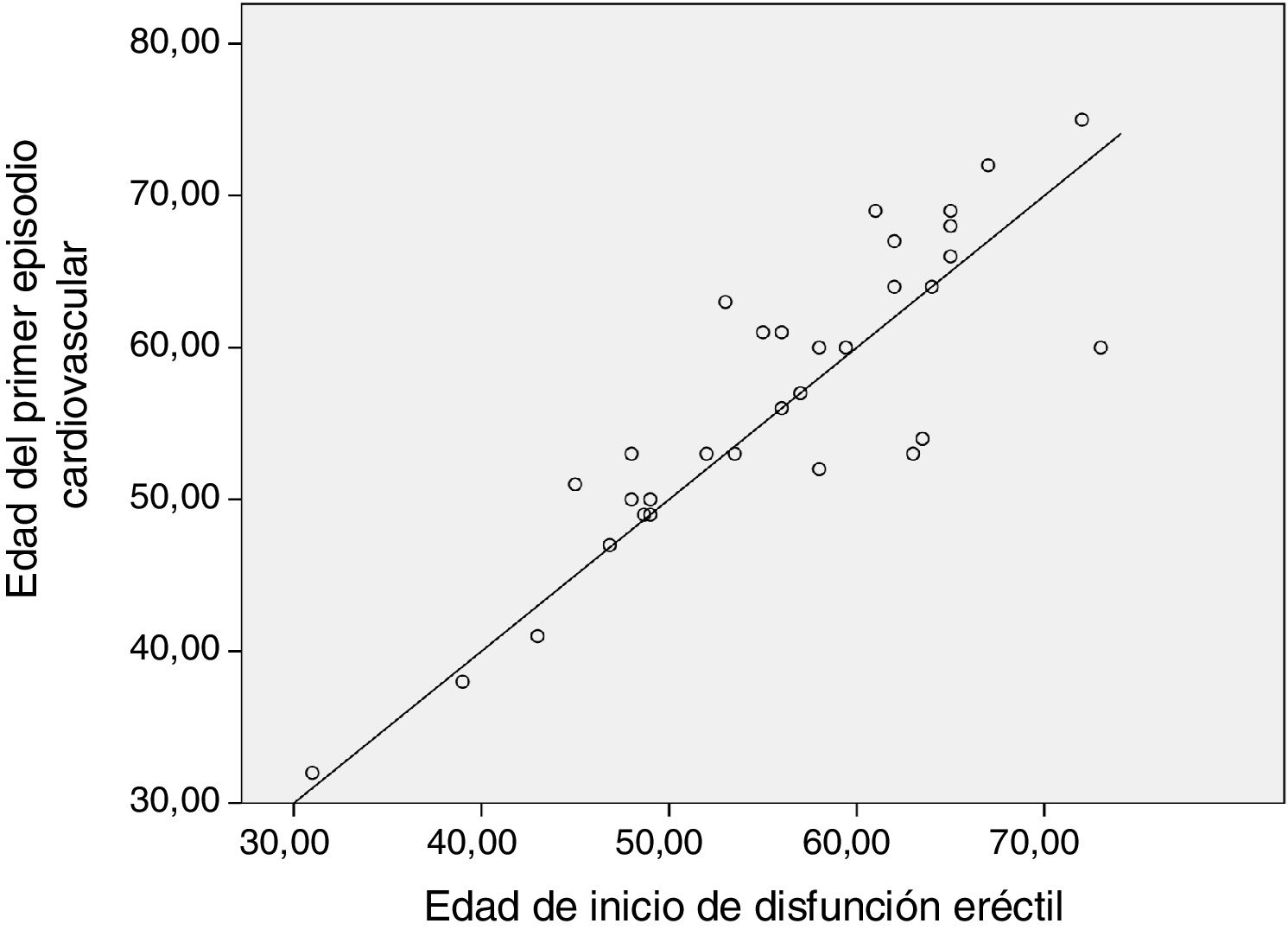
En la figura 1 se muestra la edad de inicio de DE frente a la edad de aparición del primer ECV, siendo los pacientes que están a la izquierda de la línea diagonal los que han presentado DE como síntoma centinela de ECV. No se encontró una diferencia estadísticamente significativa entre los grupos según el genotipo. Se espera realizar un seguimiento de los pacientes a cinco años y valorar la aparición de nuevos ECV y mortalidad.
DiscusiónLos resultados de la muestra actual tienen una tendencia a una mejor respuesta al tratamiento con iPDE5 según el genotipo de los pacientes con DE y ECV. Este resultado debería confirmarse para poder incluir a estas variantes del gen eNOS como marcadores farmacogenéticos.
Existen múltiples estudios farmacogenéticos valorando la respuesta a sildenafilo en individuos con DE. Actualmente, los genes más prometedores, con implicaciones farmacogenéticas, están relacionados con el óxido nítrico y la vía GMPc, aunque es probable que otros genes afecten la capacidad de respuesta al tratamiento de la DE. El cambio de glutamato por aspartato en la posición 298 (g.894G > T) se relacionó con una peor respuesta a sildenafilo en pacientes hipertensos, pero esa peor respuesta no se mantuvo cuando se incluyeron pacientes normotensos16. En estos dos casos, una menor actividad de la eNOS se relacionó con una menor respuesta a sildenafilo. Sin embargo, los pacientes con el genotipo del 786T > C mutado (786C), con una expresión y una actividad menor de la eNOS, tienen una mejor respuesta a sildenafilo, En dicho trabajo de Eisenhardt et al., los pacientes con el genotipo del 786T >C mutado (786C), con una expresión y una actividad menor de la eNOS, tienen una mejor respuesta a sildenafilo, lo cual parece contradecir los resultados anteriores y la hipótesis inicial de que una mayor actividad de la eNOS y por lo tanto una mayor biodisponibilidad de NO implicaría una mayor respuesta al tratamiento con iPDE5. También existen otras variantes como el genotipo 4 b del VNTR, del intrón 4, que se ha relacionado con una peor respuesta en pacientes prostatectomizados en población brasileña, pero no así en pacientes con DE orgánica11. En un estudio en población turca el genotipo 4 b era más prevalente en pacientes con mala respuesta, sin embargo, esta respuesta se definió únicamente como la puntuación después del tratamiento con sildenafilo, sin tener en cuenta la situación inicial11.
Hay otros aspectos para tener en cuenta a la hora de valorar estos resultados porque todavía no se conocen adecuadamente las relaciones entre los distintos polimorfismos y el análisis de haplotipos valorando en su conjunto todas las variantes analizadas17. Además, la acción del sildenafilo requiere una mínima cantidad de NO para ejercer su función y esta debería ser evaluada en los trabajos. Los datos indican que con niveles menores de NO plasmático la respuesta a sildenafilo es mayor, aunque se requiere una mínima cantidad de NO para que haya una respuesta clínica. También hay otros genotipos candidatos, por ejemplo, existe también un polimorfismo de la eNOS más reciente y menos estudiado, 665C >T, que se ha relacionado con la presencia de hipertensión arterial18 y otros, como son la nNOS, VEFG, ECA, GNB3 y el CYP3A5*3 implicado en el metabolismo del sildenafilo, vardenafilo y udenafilo19. Debido a esto podemos estar sobreestimando la asociación de diversos genotipos con factores de riesgo o patologías20. En el caso de que si que se diera la asociación de ciertos polimorfismos con FRCV el papel del gen NOS3 como marcador de riesgo independiente estaría bien. Nos planteamos que estos datos podrían ser útiles para valorar el efecto de dichos polimorfismos pueden tener un efecto acumulativo sobre el RCV independiente de otros FRCV o si el aumento de la morbi-mortalidad se debe exclusivamente al efecto de las FRCV tradicionales.
Además, el estudio cuenta con una serie de limitaciones. En primer lugar, el tamaño muestral es pequeño y eso conlleva el número reducido de sujetos en algunos grupos de genotipos; además la población de estudio, con enfermedad cardiovascular establecida (muchos con un infarto reciente), tiene unas características especiales que podrían no ser aplicables a la población general: 1) ya son considerados pacientes con un alto riesgo cardiovascular y enfermedad vascular establecida, 2) están en tratamiento con múltiples fármacos, algunos de los cuales tienen efecto sobre la función eréctil (betabloqueantes), contraindican el tratamiento con iPDE5 y no pueden ser incluidos (nitratos) o afectan a los valores analíticos (estatinas) no permitiendo valorar la dislipemia como factor de riesgo de DE o incluirla en el análisis multivariante, 3) han sufrido un evento estresante y el factor psicológico afecta a su calidad de vida sexual y a su función sexual. La mayor parte de los pacientes tuvieron DE a raíz del evento cardiovascular en lugar de presentarse como un síntoma centinela de arteriosclerosis. En segundo lugar, para valorar el genotipo como FRCV es necesario realizar un seguimiento a largo plazo y medir la incidencia de nuevos eventos cardiovasculares y su potencial morbimortalidad.
ConclusionesSe ha conseguido una vía de derivación clínica entre las unidades de Cardiología y Andrología consiguiendo una tasa de respuesta al tratamiento de la DE del 71%. Los datos actuales permiten observar una tendencia en la respuesta al tratamiento con iPDE5 según el genotipo eNOS, requiriéndose para esto el análisis de la muestra completa. Los datos recogidos permitirán realizar un análisis multivariante de riesgo cardiovascular según el genotipo de los pacientes para ver si puede ser un factor de riesgo independiente.
En cuanto a la aplicabilidad de la genética en la clínica, en relación con el gen NOS3, no hay datos suficientes para utilizarlo como marcador de riesgo cardiovascular y su posible efecto parece estar sobreestimado en los estudios debido a un sesgo de publicación. Además, su influencia sobre el tratamiento no parece ser clínicamente significativa ya que los pacientes pueden responder al tratamiento con iPDE5 independientemente de su genotipo, siendo más importante su estado vascular.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.