Introducción
La detección de parámetros seminales con valor predictivo en el resultado de las técnicas de reproducción representa uno de los principales objetivos para los profesionales de un laboratorio de andrología. Si estos parámetros están alterados, hay que intentar disponer de los recursos necesarios para poder dar solución o intentar disminuir el efecto negativo.
Entre los parámetros básicos de valoración del espermiograma, cabe destacar la importancia que ha adquirido la morfología espermática en el diagnóstico de la infertilidad masculina. A pesar de la controversia existente acerca de su función en la fecundación y el desarrollo embrionario1, numerosos estudios han demostrado que la selección del mejor espermatozoide antes de una inyección intracitoplasmática de espermatozoides (ICSI) mejora el resultado del tratamiento2-4.
La aparición de nuevas herramientas, como el microscopio de alta magnificación, ha permitido a los investigadores profundizar en el estudio de la morfología espermática y detectar defectos en el núcleo del espermatozoide, como la presencia de vacuolas nucleares que no pueden ser detectadas mediante una ICSI convencional a ×400. Se ha demostrado que estas vacuolas tienen un efecto directo en el desarrollo embrionario y el aborto temprano5,6. Varios autores han demostrado una correlación negativa entre la presencia de grandes vacuolas en el núcleo del espermatozoide y la estabilidad de la cromatina espermática4,7,8. Asimismo, se ha observado también que el aumento de la fragmentación del ácido desoxirribonucleico (ADN) espermático está asociado a la presencia de anomalías en la morfología espermática9.
Los mecanismos exactos que dan lugar a estas alteraciones espermáticas son todavía objeto de estudio. Se han barajado diferentes teorías que implican la interrelación de diferentes mecanismos: empaquetamiento de la cromatina espermática, apoptosis, estrés oxidativo, anomalías genéticas y estrés crónico10. Un ambiente testicular alterado (con presencia de leucocitos, células germinales inmaduras, etc.) puede causar disfunción en la espermatogénesis. Así pues, el daño en el ADN y el potencial de fertilidad espermático se han relacionado con la toxicidad provocada por el oxígeno y la acción de las especies reactivas de oxígeno (ROS, del inglés Reactive Oxygen Species)11. Una elevada producción de ROS que sobrepase los mecanismos de defensa de la célula puede dañar significativamente la función de la membrana espermática debido a la peroxidación lipídica12, con lo que así se reduce la capacidad del espermatozoide para llevar a cabo la reacción acrosómica13.
Debido a la escasa efectividad de los mecanismos endógenos de defensa en humanos, parece efectiva la administración de un tratamiento con antioxidantes11,14 para la mejora de la calidad espermática en pacientes que se someten a tratamiento de fertilización in vitro/ICSI.
El objetivo de este estudio piloto fue investigar el efecto de la L-carnitina, la coenzima Q10 y las vitaminas C, E y B12 en la vacuolización en la cabeza del espermatozoide y la fragmentación del ADN espermático.
Material y método
Para este estudio prospectivo se seleccionó a un total de 65 pacientes que acudieron a nuestro centro entre mayo y noviembre de 2009, de los cuales 33 finalizaron el estudio dentro de este período. La edad media ± desviación estándar fue de 37,2 ± 5,4 años. El presente estudio fue aprobado por el Comité Ético del centro y todos los pacientes firmaron el consentimiento informado.
Cada paciente entregó dos muestras de semen en un intervalo aproximado de 30 días. Las muestras se obtuvieron por masturbación después de mantener entre 3 y 5 días de abstinencia sexual. Las muestras se dejaron licuar a temperatura ambiente y tras 20 minutos se realizó un análisis de los parámetros seminales básicos siguiendo los criterios de la Organización Mundial de la Salud. Se consideraron las variables siguientes: volumen (ml), concentración espermática (n × 106/ml), movilidad espermática (porcentaje de espermatozoides a y b) y morfología espermática (porcentaje de formas normales).
Una vez entregada la primera muestra, los pacientes empezaron un tratamiento con Androferti® (Laboratorios Q Pharma SL, Alicante [España]), cuya composición por dosis es de 750 mg de L-carnitina fumarato, 250 mg de acetil-L-carnitina, 10 mg de coenzima Q10, 5 mg de cinc, 100 μg de ácido fólico, 25 μg de selenio, 0,50 μg de vitamina B12, 30 mg de vitamina C y 5 mg de vitamina E.
La dosis administrada fue de un sobre cada 12 horas durante un mínimo de 30 días. Se decidió realizar el estudio con este intervalo de tiempo con la intención de valorar el efecto de este tratamiento en espermatozoides del mismo ciclo espermatogénico.
Tras este período, cada paciente entregó una segunda muestra de semen que fue nuevamente analizada.
A cada una de las muestras se practicaron, además, los análisis siguientes: a) índice de vacuolización en el núcleo del espermatozoide, y b) fragmentación del ADN espermático.
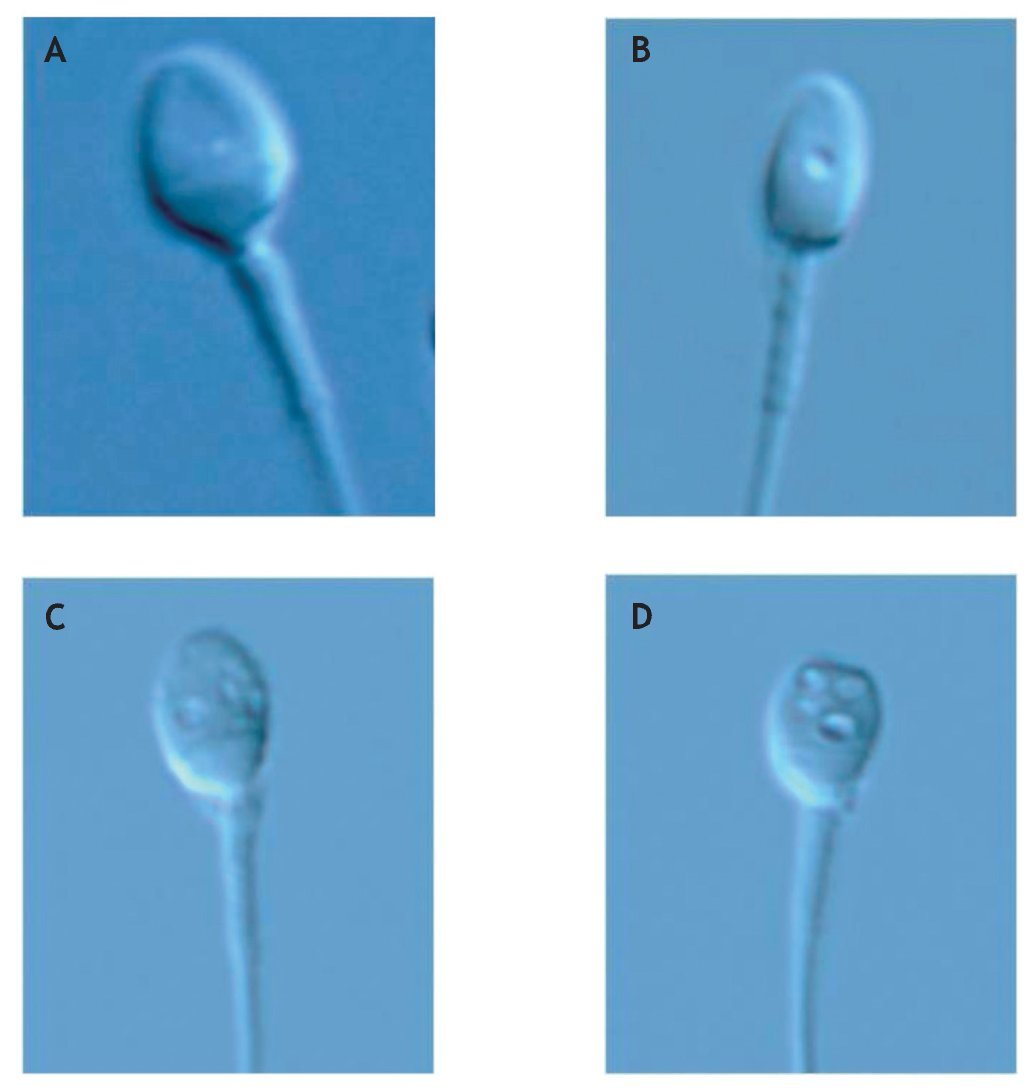
El análisis del índice de vacuolización se llevó a cabo mediante un microscopio invertido equipado con lentes Nomarski, que permite un grado de magnificación de ×8000. En cada una de las muestras se analizaron 100 espermatozoides, que se clasificaron en cuatro categorías, teniendo en cuenta el número y el tamaño de las vacuolas que contenía su núcleo4 (fig. 1).
Figura 1 Criterio de clasificación de espermatozoides en función de la presencia vacuolar4. A) Forma normal sin vacuolas (grado I). B) Forma normal y un máximo de 2 vacuolas pequeñas (grado II). C) Forma normal y al menos una vacuola grande (grado III). D) Forma anormal u otras anormalidades (grado IV). (×8000).
La fragmentación del ADN espermático se evaluó mediante el kit Halosperm (Halotech DNA SL, Madrid [España])15 siguiendo las instrucciones del fabricante. Se determinó el porcentaje de fragmentación mediante la evaluación de 500 espermatozoides de cada muestra, con microscopía óptica a ×1000. Se considera que el resultado del test de Halosperm tiene un valor predictivo negativo en el resultado de embarazo cuando más del 30% de los espermatozoides en la muestra en fresco presentan fragmentación del ADN15.
Como principales indicadores de éxito del tratamiento antioxidante, se consideraron la mejora en el índice de vacuolización y en la fragmentación del ADN espermático.
Las comparaciones entre las muestras de semen pretratamiento y postratamiento se llevaron a cabo mediante el test Wilcoxon para datos pareados, considerándose estadísticamente significativo un valor de p < 0,05. Los datos se analizaron mediante software R v 2.9.0.
Resultados
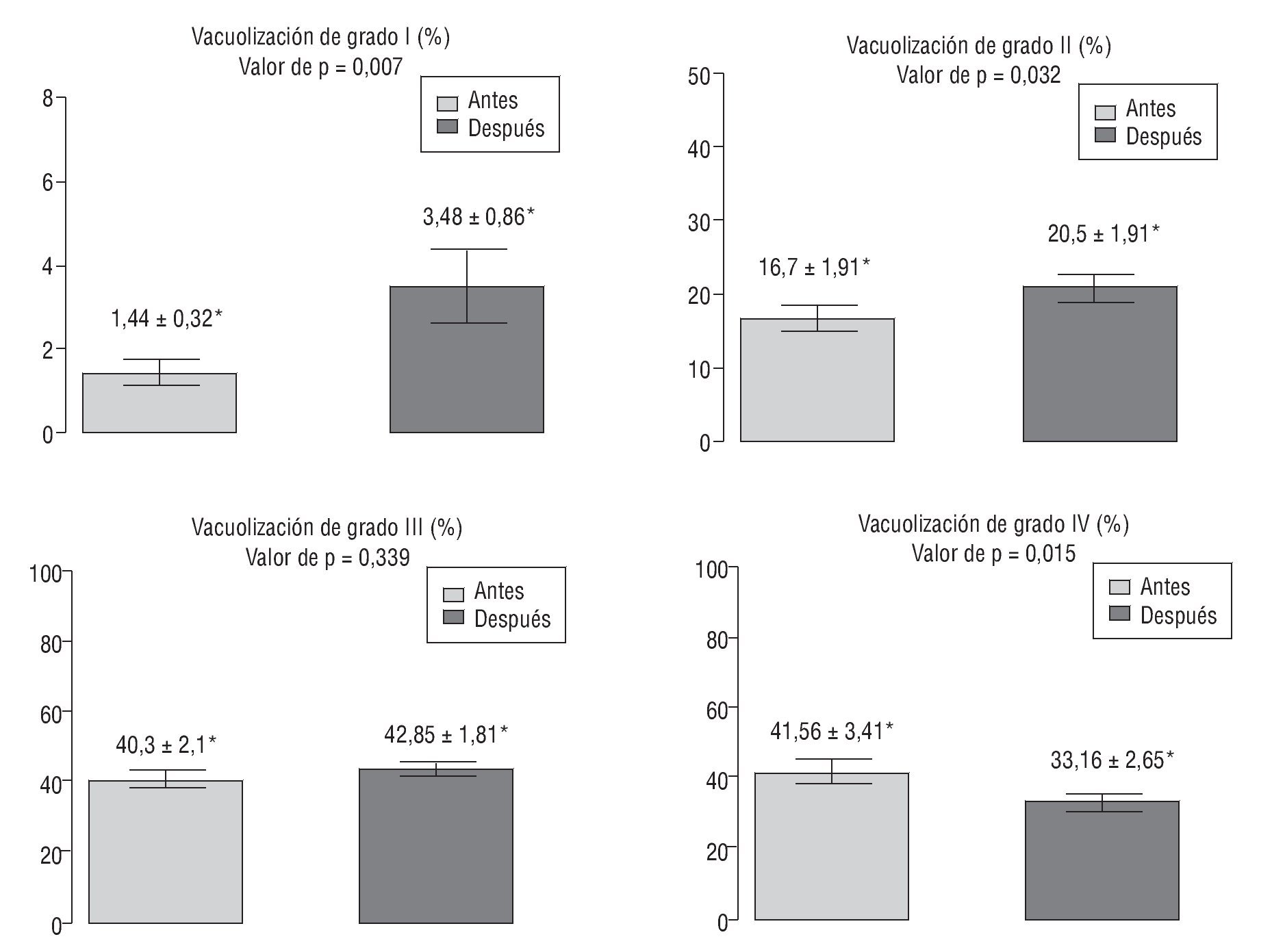
Se observa un aumento estadísticamente significativo de espermatozoides con grados de vacuolización I y II después de un mes de tratamiento (5,85 ± 2,14; p = 0,01). El grado de fragmentación del ADN espermático también se ve significativamente reducido después del tratamiento (-4,91 ± 2,5; p = 0,03). En la tabla 1 se muestran las variaciones estadísticamente significativas expresadas como el incremento resultante de comparar las variables estudiadas antes y después de un mes de tratamiento antioxidante.
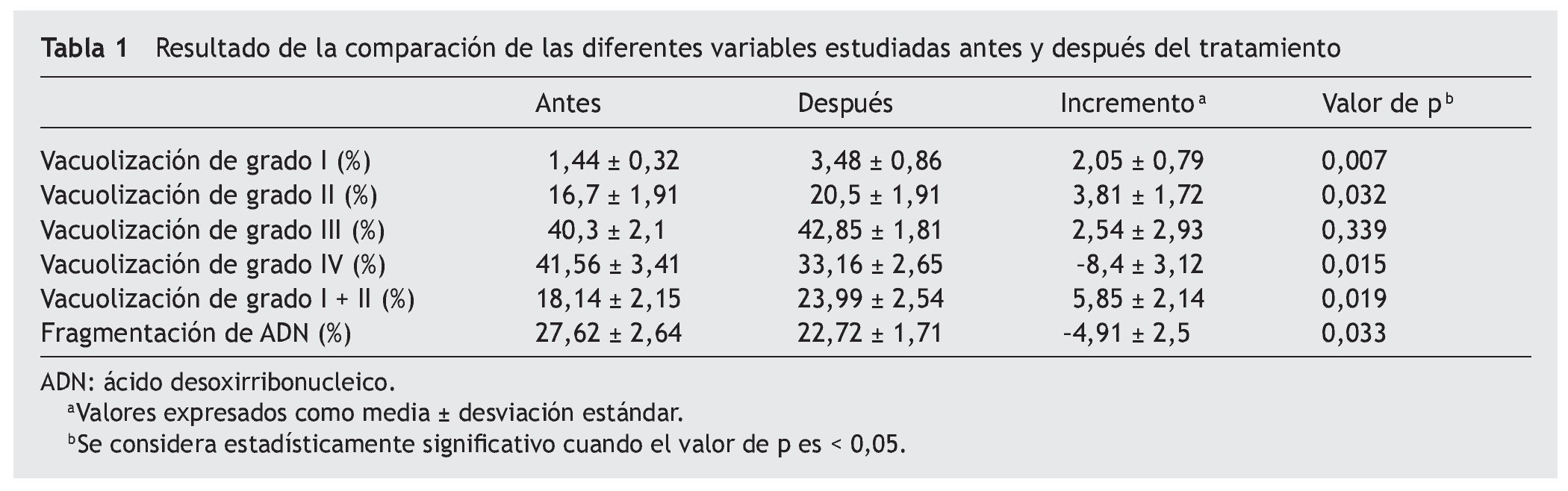
En la figura 2 se ilustran los valores de cada uno de los grados de vacuolización (grados I-IV) expresados como media ± desviación estándar de la media.
Figura 2 Comparación de los grados de vacuolización espermática (grado I, grado II, grado III y grado IV) evaluados mediante alta magnificación, antes y después del tratamiento con antioxidantes. *Valores expresados como media ± desviación estándar.
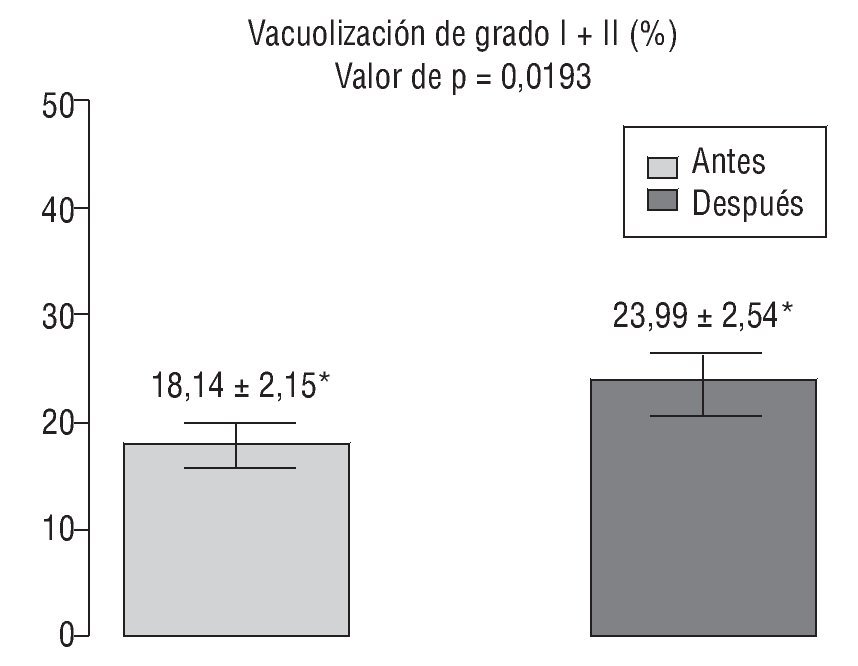
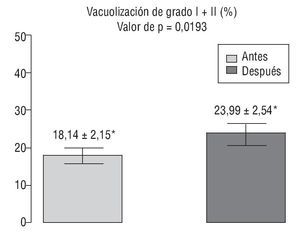
En la figura 3 se ilustra la variación del porcentaje de espermatozoides de los grados I y II (considerados los más adecuados para IMSI [del inglés, intra-cytoplasmic morphologically-selected sperm injection, microinyección intracitoplásmica de esperma seleccionado morfológicamente])16 antes y después del tratamiento con antioxidantes.
Figura 3 Comparación de la suma de los grados I y II de vacuolización espermática, considerados aptos para IMSI (del inglés intra-cytoplasmic morphologically-selected sperm injection, microinyección intracitoplásmica de esperma seleccionado morfológicamente), antes y después del tratamiento. *Valores expresados como media ± desviación estándar.
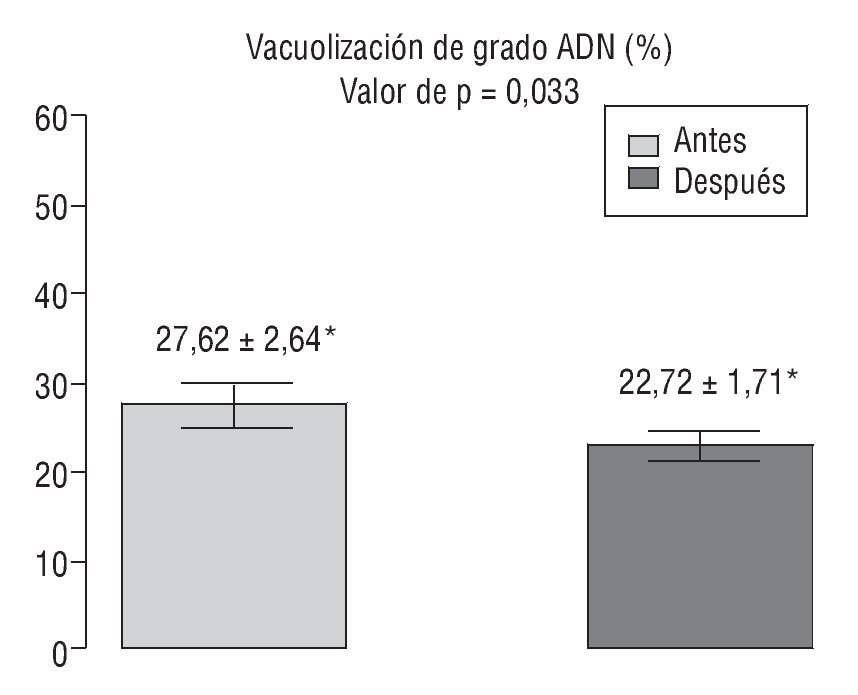
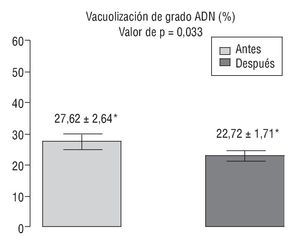
En la figura 4 se representan los valores del índice de fragmentación del ADN espermático obtenidos antes y después del tratamiento.
Figura 4 Comparación del índice de fragmentación del ácido desoxirribonucleico (ADN) espermático antes y después del tratamiento con antioxidantes. *Valores expresados como media ± desviación estándar.
Discusión
Hay varias hipótesis acerca del momento en el que se produce el daño oxidativo sobre los espermatozoides. Tesarik et al17 indicaron que había un mecanismo postesticular de daño del ADN espermático, pero no excluyeron la posibilidad de una acción directa en el testículo durante el período de desarrollo de las células germinales.
Sabemos que el período de tratamiento escogido para el estudio no es suficiente para afectar un ciclo de espermatogénesis completo, pero cabía esperar una mejora en la homeostasis y el microambiente del epidídimo14 que afectara directamente a los espermatozoides extratesticulares en período de maduración.
El tratamiento ofrecido a los pacientes contiene diferentes componentes que han sido comúnmente utilizados como tratamiento en varones con baja calidad espermática o infértiles. Se ha demostrado que la carnitina tiene una acción en el metabolismo energético del espermatozoide y como protector del daño oxidativo, y que evita el deterioro de la membrana espermática inducido por los radicales libres de oxígeno14. Se ha establecido también la función de la coenzima Q10 como un componente de la cadena respiratoria mitocondrial, la cual desempeña un papel crucial en el metabolismo energético y como antioxidante liposoluble para membranas celulares y lipoproteínas. También se encuentran altos niveles de su forma reducida (ubiquinol) en los espermatozoides, hecho que indica un papel defensivo como antioxidante18.
Además, estudios previos han demostrado que el tratamiento con antioxidantes orales, como las vitaminas E y C, dan lugar a una disminución en la fragmentación del ADN espermático19.
Las variaciones de estos componentes en el plasma seminal o dentro de la célula se han correlacionado de forma positiva con una mejora en la integridad del ADN espermático. La contribución de estos componentes a la capacidad antioxidante del semen podría explicar el aumento de espermatozoides menos vacuolados en las muestras postratamiento.
Dado que el resultado de las técnicas de reproducción asistida está influido negativamente por la presencia de malformaciones en el núcleo espermático y por la fragmentación del ADN espermático9 —y coincidiendo con el trabajo publicado por Balmori et al20 en esta misma revista—, parece concluyente que el uso de un tratamiento antioxidante puede aumentar el éxito de un ciclo de reproducción asistida.
A pesar de que se trata de un estudio clínico no aleatorizado, los datos obtenidos muestran claramente que el índice de vacuolización y la fragmentación del ADN espermático se reducen notablemente gracias al tratamiento combinado de antioxidantes orales, como la L-carnitina, la coenzima Q10 y las vitaminas C, E y B12.
No obstante, consideramos la necesidad de llevar a cabo estudios prospectivos aleatorizados para concluir si el tratamiento con estos antioxidantes tiene también un efecto positivo en los parámetros seminales básicos y en la consecución de embarazo tras la aplicación de un tratamiento de reproducción asistida.
Agradecimientos
Los autores agradecen al Dr. Antoni Miñarro (Departament d'Estadística de la Universitat de Barcelona) su colaboración en el análisis estadístico de los datos, así como al equipo de técnicos de laboratorio de andrología.
Conflicto de intereses
Los autores declaran que no tienen ningún conflicto de intereses.
* Autor para correspondencia
Correo electrónico:glopez@cirh.es (G. López Granollers).
Recibido el 12 de septiembre de 2011;
aceptado el 13 de octubre de 2011