Introducción
En 1935 Adolf Butenandt y Leopold Ruzicka sintetizaron por primera vez la testosterona, y fueron galardonados por este avance con el Premio Nobel de Química en 19391. A principios de la década de 1940, algunos investigadores observaron que en los varones a los que se administraba testosterona aumentaba la masa muscular y su resistencia al trabajo1.
Sin embargo, sus especiales características farmacocinéticas la hacían poco útil desde un punto de vista terapéutico, por lo que los laboratorios se afanaron en realizar modificaciones en su molécula para conseguir mayor actividad anabólica, dando lugar a una amplia gama de esteroides androgénicos anabolizantes (EAA). Su utilización no clínica se inició a mediados de la década de 1950, siendo los levantadores de pesas los primeros en utilizarlos para mejorar el rendimiento muscular. En los Juegos Olímpicos de Tokio de 1964, su consumo estaba tan extendido que se convirtieron en un serio problema. Numerosos atletas y entrenadores establecieron sus propios regímenes posológicos, al margen de cualquier fundamento o control clínico. Finalmente, en 1968, el Comité Olímpico Internacional acuerda una definición de dopping y en los Juegos Olímpicos de Montreal en 1976 se prohíbe su utilización2.
En la actualidad, el abuso de EAA ha dejado de estar restringido al ámbito del deporte de élite, extendiéndose a deportes recreativos como el culturismo o incluso ganando adeptos entre no practicantes de deportes de competición y, lo que es peor, entre adolescentes cuyo principal objetivo es simplemente mejorar su apariencia física. La observación de un incremento de las consultas por problemas andrológicos derivados del consumo de EAA nos motivó e indujo a elaborar este artículo de revisión sobre sus implicaciones andrológicas, centrado fundamentalmente en las repercusiones en las funciones sexual y reproductiva, y en la aparición de ginecomastia.
Epidemiología
Básicamente pueden identificarse tres perfiles de consumidores de EAA:
— Deportistas implicados en competiciones para mejorar su rendimiento o deportistas recreativos, como en el caso de los culturistas.
— Usuarios de gimnasios, por razones cosméticas, para mejorar su aspecto físico.
— Profesionales, de los cuerpos de seguridad pública y privada, personal de prisiones o miembros de fuerzas armadas.
Durante la última década, la prevalencia del abuso de EAA con fines no terapéuticos se ha evaluado en varios estudios3-6. En Estados Unidos se ha estimado entre 1 y 3 millones de consumidores de EAA, oscilando ampliamente entre el 1 y el 12% en adolescentes, el 3 y el 31% en usuarios de gimnasio y entre el 16 y el 50% en culturistas6-8.
En la Unión Europea (UE), en un estudio sobre el dopaje en los gimnasios realizado en 2002 en cuatro de sus estados miembros (Bélgica, Alemania, Italia y Portugal), se observó que el 5,7% de los usuarios de gimnasio consumía regularmente EAA. Considerando unos 16 millones de inscritos en los 23.000 gimnasios comerciales existentes en la UE, la cifra de consumidores habituales sería de casi 1 millón9.
Aunque a nivel estatal no hay cifras oficiales en España, la extrapolación de estos resultados equivaldría a unos 20.000 consumidores habituales de EAA. Según datos de un estudio realizado por la Conselleria de Sanitat de la Generalitat Valenciana en 2006 sobre el abuso de EAA con fines estéticos, la prevalencia en varones es del 3,1% a los 14 años, porcentaje que se incrementa con la edad hasta alcanzar el 7,9% a los 18 años. En una segunda fase del estudio, se mostró una prevalencia del 12% a los 27 años de edad, en varones que de forma habitual entrenaban en musculación10.
Algunos estudios muestran una asociación entre abuso de EAA y otras drogas, o con otras conductas de riesgo (peleas, carreras de motocicletas, llevar armas, conducir en estado de embriaguez), lo que avalaría la hipótesis de que el abuso de EAA es parte de un "síndrome de conducta de riesgo" más que una conducta aislada11,12.
Fisiofarmacología de los ándrógenos y esteroides androgénicos anabolizantes
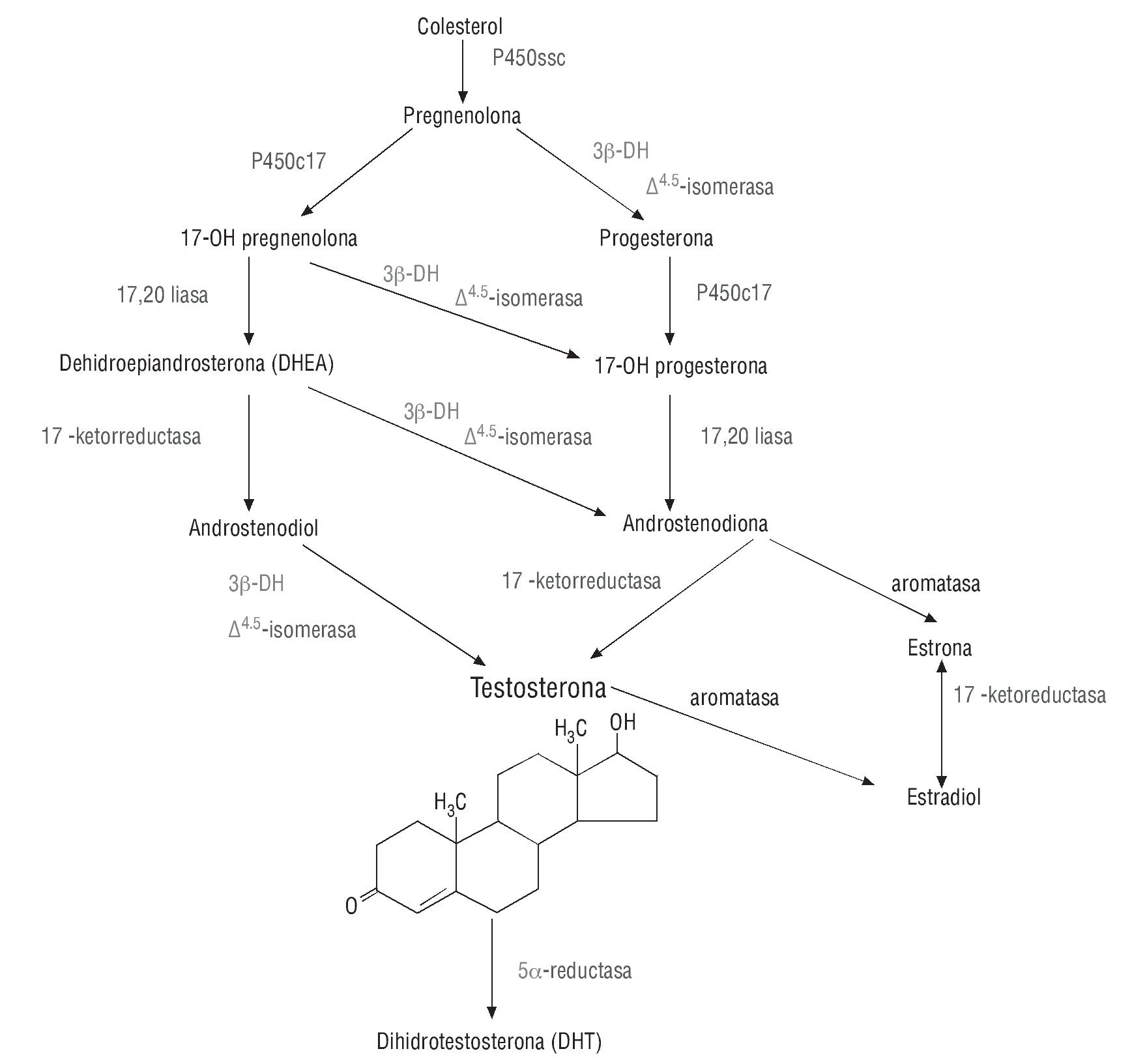
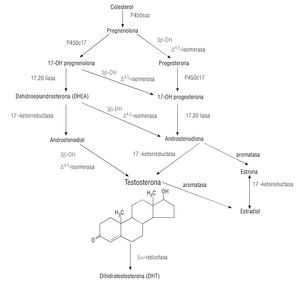
Los andrógenos desempeñan un papel crucial en la virilización del tracto urogenital, y en consecuencia en el desarrollo del fenotipo masculino, que se inicia entre las 7 y las 12 semanas de desarrollo embrionario. Por la expresión del factor determinante testicular o gen SRY(sex determining region Y), localizado en el brazo corto del cromosoma Y(Yp), las gónadas indiferenciadas evolucionan a testículos fetales, que producirán dos hormonas: a) la anti-Mülleriana (AMH), encargada de la regresión de los conductos de Müller, y b) la testosterona, necesaria para la formación, a partir de los conductos de Wolf, del epidídimo, vasos deferentes y vesículas seminales, así como para el desarrollo de la próstata, pene y escroto. Los andrógenos tienen efectos androgénicos, relacionados con el desarrollo de los órganos sexuales y de los caracteres sexuales secundarios y anabólicos, en relación a los cambios que se producen en órganos y tejidos no reproductivos (tabla 1). En el varón adulto, la producción media de testosterona es de unos 7 mg/día13, el 95% se secreta en las células de Leydig del testículo, bajo el estímulo de la hormona luteinizante (LH) de la adenohipófisis, y el 5% en la corteza suprarrenal. Como el resto de esteroides, su estructura deriva de la molécula del ciclopentanoperhidrofenantreno, hidrocarburo policíclico de 17 átomos de carbono, constituido por cuatro anillos: un ciclopentano y tres anillos resultado de la saturación del fenantreno. De esta estructura se deriva la molécula de colesterol, que es captado por las células de Leydig a través de receptores de lipoproteínas de baja densidad o lipoproteínas de alta densidad, o generado ex novo mediante vías de síntesis o a partir de ésteres de colesterol. En el retículo endoplásmico liso, el colesterol es transformado sucesivamente por enzimas mitocondriales en pregnenolona, 17-hidroxi-pregnenolona, dihidroepiandrosterona, androstenodiol y androstenodiona, y finalmente en testosterona, cuya molécula está formada por 19 átomos de carbono, con una doble ligadura entre C4 y C5, un átomo de oxígeno en C3 y un radical hidroxilo (OH) en C17 (fig. 1). Sólo el 2-3% de la testosterona se encuentra disuelta en la sangre de forma libre (TL). En el plasma, la testosterona circula fundamentalmente unida a dos proteínas: la globulina ligadora de hormonas sexuales (SHBG, del inglés sex hormone binding globulin) y la albúmina. Entre el 35 y el 60% de la testosterona total (TT) se fija a la SHBG, glucoproteína hepática expresada también en otros tejidos diana de los andrógenos y los estrógenos, como los epitelios prostático y mamario14, y en los espermatozoides, en los que se concentra en el acrosoma15. La SHBG es similar a la ABP (androgen binding protein), producida en la célula de Sertoli y que fija la testosterona intratubular, diferenciándose tan solo en el número de oligosacáridos que contienen16. Ambas están codificadas por el mismo gen, localizado en el brazo corto del cromosoma 17 (p12-p13)17.
Figura 1 Biosíntesis de los andrógenos.
La albúmina llega a transportar hasta el 50% o más de la TT, esta puede disociarse rápidamente de aquella a su paso por los capilares quedando libre, por lo que la testosterona ligada a la albúmina más la TL constituyen la testosterona biodisponible (Tbio). Merced a su elevada solubilidad, la testosterona atraviesa fácilmente la membrana de las células diana; ya en su interior, es reducida por la acción de la 5α-reductasa a dihidrotestosterona (DHT) para poder ejercer su acción. Los andrógenos se unen en el interior de la célula al receptor de andrógenos (RA), cuyo gen se localiza en el cromosoma X (Xq 11-12). A pesar de la existencia de diferentes formas de andrógenos, solo se ha identificado y clonado un RA18. El complejo receptor-esteroide se activa y tiene la capacidad de traslocarse hacia el núcleo y unirse a él en un sitio aceptor del ácido desoxirribonucleico (ADN), lo que produce la activación de la transcripción, con el incremento de la actividad del ácido ribonucleico (ARN) polimerasa y la formación de ARN mensajero, lo cual estimula la síntesis de proteínas celulares, responsables finales de las acciones fisiológicas o farmacológicas.
Sin embargo, desde un punto de vista terapéutico, la testosterona resultó poco útil debido a sus especiales características farmacocinéticas (vida media muy corta, de aproximadamente 10 minutos, e intenso efecto de primer paso en el hígado, donde es rápidamente metabolizada por isoenzimas de la familia del citocromo P450), por lo que su administración oral prácticamente no incrementa sus niveles plasmáticos. Para poder utilizarla como recurso terapéutico, ha sido necesario modificar su molécula o sintetizar análogos activos con una absorción mantenida o retardada y con un metabolismo hepático disminuido. Los distintos tipos de EAA son análogos sintéticos de la testosterona y proceden básicamente de tres tipos de modificaciones realizadas en su molécula:
— 17 β-ésteres. La esterificación del grupo 17 β-OH con ácidos carboxílicos disminuye la polaridad de la molécula y aumenta su solubilidad en vehículos lipídicos utilizados para la administración parenteral, lo que resulta en un incremento de las propiedades androgénicas y una liberación más lenta a la circulación cuando se administra por vía parenteral.
— 17 α-alquilados. La alquilación a nivel de la posición 17 α determina la eficacia de los andrógenos por vía oral, ya que el hígado metaboliza más lentamente los derivados alquílicos.
— Modificación de los anillos A, B o C. Con sustituciones en los carbonos 1, 2, 9 y 11.
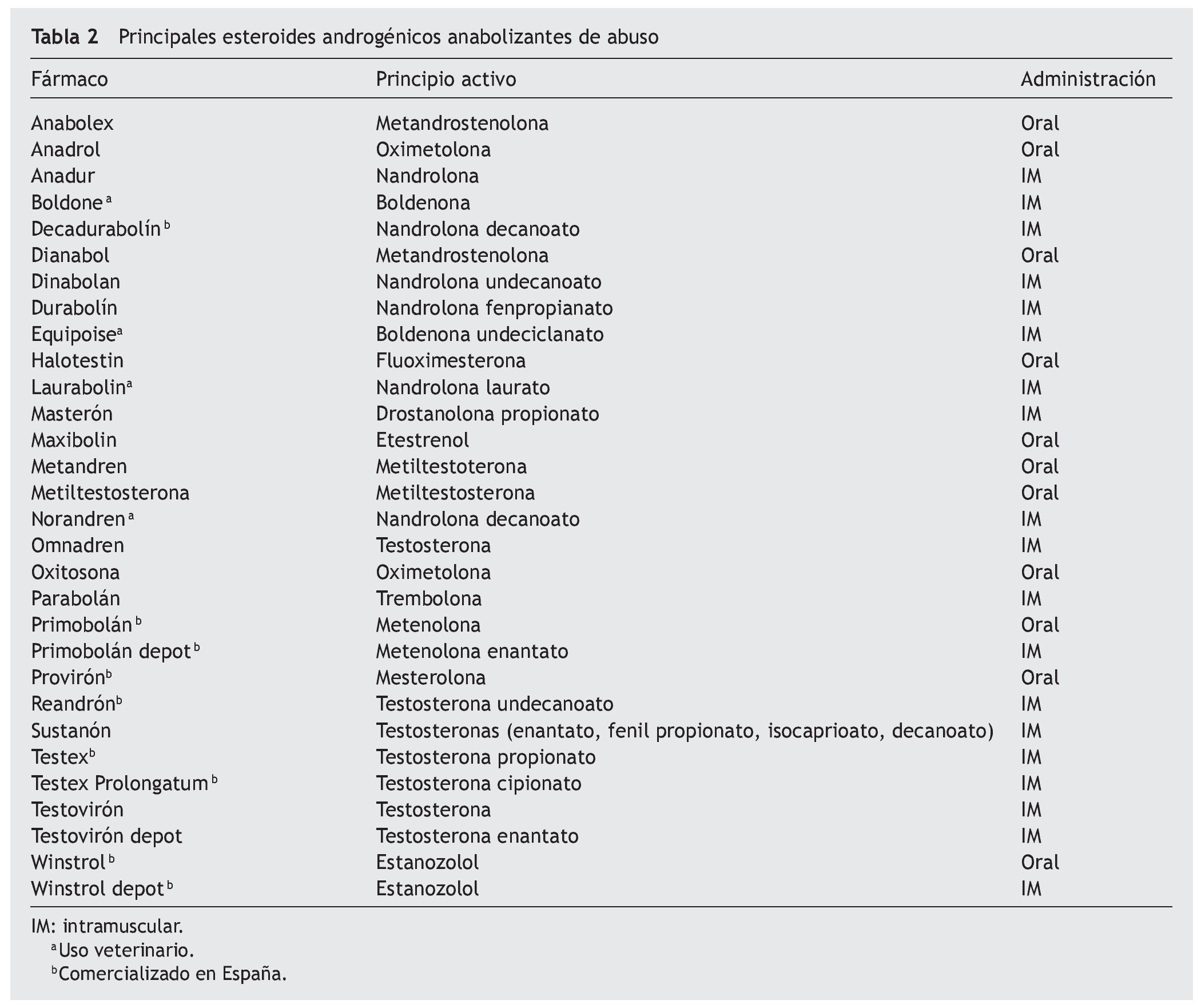
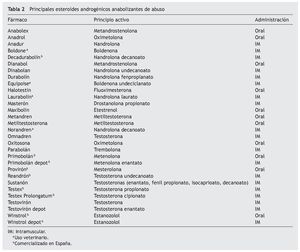
La oferta actual del mercado español es limitada con respecto al total de sustancias que se consumen de manera ilícita fuera y dentro de España (tabla 2).
Como la testosterona, los EAA tienen efectos androgénicos y anabólicos, por lo que en muchas circunstancias, terapéuticas o no, su utilización se ve frenada por la aparición de efectos virilizantes indeseados. Todos los esfuerzos realizados por sintetizar EAA con mayor acción anabólica y menor androgénica han tropezado con una dificultad no superada: la existencia de un único tipo de RA. Por lo que la respuesta parece estar más condicionada por el órgano efector que por las características del fármaco, sin posibilidad de disociar las acciones androgénicas de las anabólicas19.
Implicaciones andrológicas del abuso de esteroides androgénicos anabolizantes
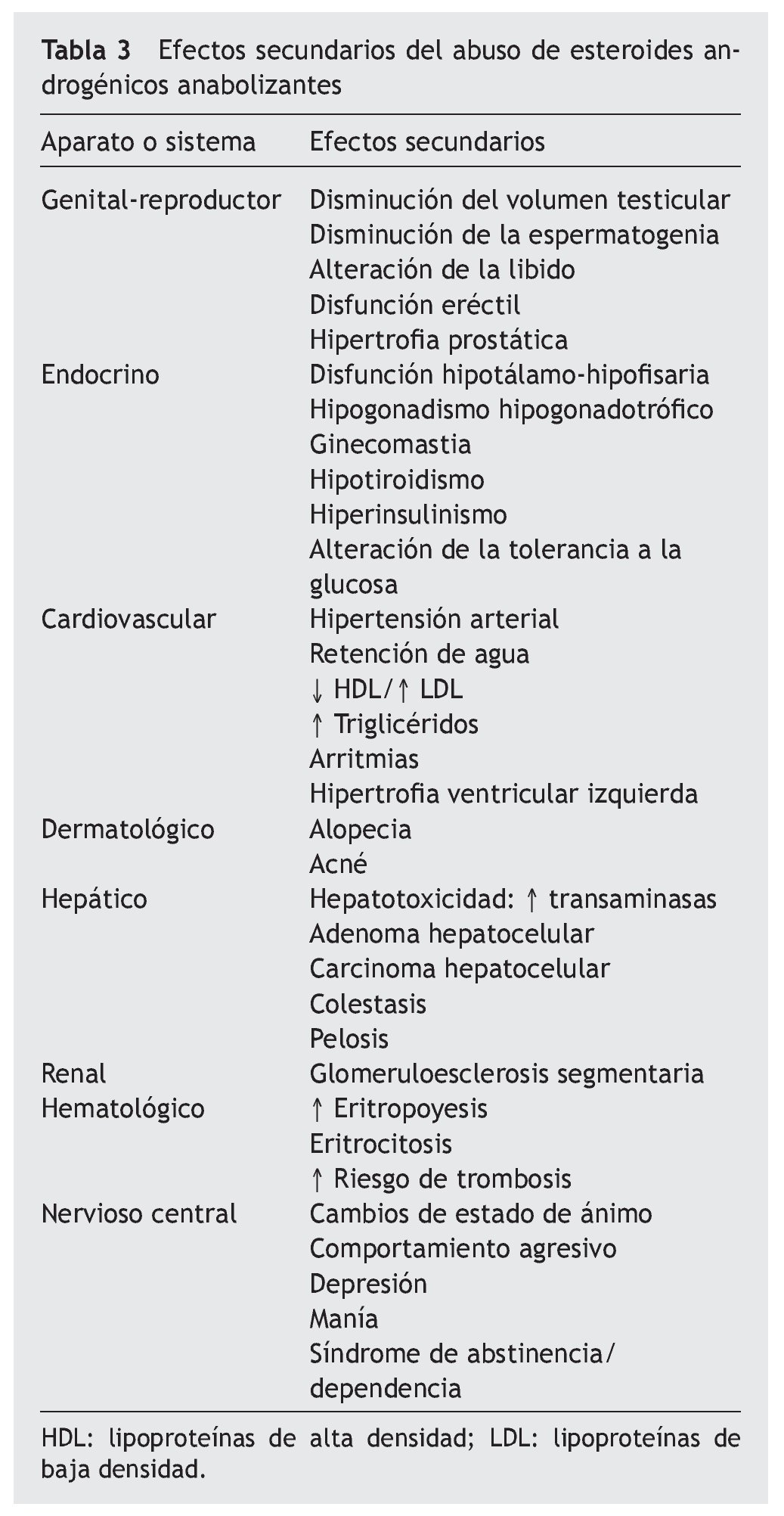
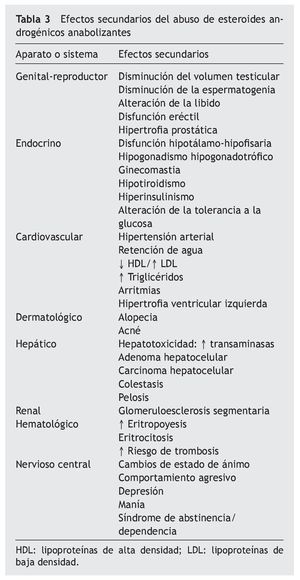
El abuso de EAA se caracteriza por la asociación simultánea de varios anabolizantes a dosis suprafisiológicas, que pueden llegar a ser entre 40 y 100 veces superiores a las terapéuticas, combinando tanto preparados inyectables, como orales en el mismo tratamiento. Sus consecuencias se reflejan prácticamente en todos los aparatos o sistemas del organismo (tabla 3), y algunas de ellas, como el carcinoma hepático o la glomeruloesclerosis segmentaria y focal, pueden ser severos. Sin embargo, hay pocos trabajos que demuestren los efectos secundarios del abuso de EAA a largo plazo, por lo que nuestro conocimiento de ellos es limitado y fruto de comunicaciones aisladas. En la consulta andrológica es cada vez más frecuente observar consumidores habituales de estas sustancias que acuden por presentar esterilidad, disfunción eréctil, disminución de la libido o ginecomastia.
Esterilidad
Durante la vida fetal, la hormona foliculoestimulante (FSH) es necesaria para la proliferación de las células de Sertoli, en las que se encuentra exclusivamente el receptor FSH. Bajo la influencia de la testosterona intratesticular secretada en las células de Leydig, el número de gonocitos por túbulo aumentará hasta triplicarse en los primeros meses de embarazo. Hacia la 2.ª semana de vida posnatal, la secreción de testosterona vuelve a aumentar y se mantiene a concentraciones de adulto durante aproximadamente 6 meses; luego cae y permanece en valores bajos hasta el inicio de la pubertad, con lo que se previene la virilización masculina. En la pubertad, la secreción hipotalámica de hormona liberadora de gonadotropinas (GnRH) estimula la producción hipofisaria de LH y FSH, lo que da lugar al incremento de la síntesis de testosterona, encargada del desarrollo de los caracteres sexuales secundarios y del inicio de la espermatogénesis. Parece obligada la acción dual de FSH y testosterona "intratesticular" para una espermatogénesis cuantitativa y cualitativamente completa20. La testosterona es necesaria para el mantenimiento de la espermatogénesis y para la inhibición del proceso de apoptosis celular21. La falta de 5α-reductasa en el testículo, podría explicar por qué los inhibidores de esta enzima no tienen un marcado efecto en la espermatogénesis22; por consiguiente, la testosterona no es reducida a DHT. Esta es más potente ligada al RA que aquella, por lo que en el compartimiento tubular, en ausencia de DHT y para mantener la expresión del RA, será necesario mantener niveles altos de testosterona que se encontrará principalmente ligada a la ABP producida por las células de Sertoli23. Los túbulos seminíferos están expuestos a concentraciones de testosterona de 25 a 100 veces mayor que los niveles circulantes. La testosterona no parece actuar directamente en las células germinales, sino funcionando a través de las células de Sertoli por expresión del RA e influyendo en el microambiente tubular. Puede metabolizarse a estradiol por acción de la estrógeno sintetasa o aromatasa, presente en el testículo. En el varón también hay actividad aromatasa en la próstata, cerebro, adipocitos, fibroblastos de la piel, hueso y en las células del estroma del pecho24, siendo normal una producción diaria de 50 μg. Aunque el papel del estrógeno en el compartimiento tubular no es bien conocido, se ha indicado un efecto estrogénico en la secreción de inhibina B por las células de Sertoli. También es probable que la acción estrogénica sea importante para el desarrollo celular y función de las células de Leydig, de Sertoli y germinales25.
La función epididimaria también es dependiente de andrógeno, a través del sistema tubular cantidades sustanciales de testosterona alcanzan el epidídimo a través del sistema tubular26. Aunque la testosterona es esencial para el desarrollo del epidídimo, para su función en la edad adulta se requiere la DHT. La síntesis de la mayoría de proteínas del epidídimo está regulada al alza por los andrógenos.
La inhibina B es la causa de la retroalimentación negativa para la FSH, mientras que la testosterona plasmática, junto con su metabolito el estradiol, tiene una retroalimentación negativa en el hipotálamo y la hipófisis, inhibiendo respectivamente la producción de GnRH y de FSH y LH.
En consecuencia, la administración de dosis suprafisiológicas de EAA genera un cuadro de hipogonadismo hipogonadotrópico. La supresión de gonadotropinas induce hipoespermatogénesis, y la inhibición completa de la testosterona intratesticular dará lugar a un bloqueo completo de la espermatogénesis a nivel de espermátide27. Además, durante la deprivación androgénica, el epidídimo pierde gradualmente su capacidad de mantener el proceso de maduración espermática28. Clínicamente, los pacientes pueden presentar un patrón seminológico de oligo-oligoastenozoospermia severa, o más frecuentemente azoospermia, con un volumen seminal normalmente inalterado. A la exploración física, se encuentra una disminución del volumen testicular, que puede ser de hasta el 20%. Estas alteraciones son reversibles con el cese del tratamiento. Sin embargo, tras largos períodos de abuso, puede persistir un hipogonadismo relativo durante bastante tiempo después, a pesar del cese del consumo, que podría deberse a un estado hipogonadotrópico relativo y/o a una refractariedad testicular a las gonadotropinas. Queda poco claro si el deterioro testicular puede explicarse por la elevación del estradiol plasmático. La primera medida terapéutica deberá ser suspender la administración de EAA. Posteriormente, y dependiendo de las expectativas genésicas de la pareja, se puede adoptar una actitud expectante hasta 6 meses, ya que en más de la mitad de los casos se producirá la regresión espontánea del hipogonadismo y, por consiguiente, el restablecimiento de la espermatogénesis. De no ser así, o si la pareja no desease esperar este período, y siempre que los niveles plasmáticos de FSH y LH se mantengan por debajo del rango inferior de normalidad, se puede pautar tratamiento con 500-1.000 UI de hormona gonadotropina coriónica (HCG) y 75 UI de FSH, a días alternos durante 3 meses. En la actualidad en España no hay ninguna HCG que tenga como indicación terapéutica el hipogonadismo hipogonadotrópico masculino, ya que la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) suspendió la comercialización de la última existente (HCG-Lepori®) en marzo de 2010, a solicitud del titular de la autorización de su comercialización en España. Si bien se comercializa una HCG recombinante (Ovitrelle®), entre sus indicaciones no contempla el tratamiento del hipogonadismo hipogonadotrópico masculino, por lo que su utilización debería hacerse off label, con la dificultad añadida de establecer una pauta con las dosis correctas, ya que se presenta en jeringa precargada con 250 μg de coriogonadotropina alfa en 0,5 ml, equivalente a unas 6.500 UI.
Disfunción sexual
Los andrógenos desempeñan un papel fundamental en la función sexual del varón, tanto en el mantenimiento de la libido, como en la función eréctil. La erección es un fenómeno neurovascular bajo control hormonal, en el que intervienen neurotransmisores, factores endocrinos, así como agentes vasoactivos, y precisa de la integridad de las propiedades fibroelásticas del tejido cavernoso. Sigue siendo debatido el papel de los andrógenos en la función eréctil (las evidencias existentes sobre la influencia de la testosterona en la función eréctil son sobre todo a nivel experimental). Los andrógenos intervendrían en la regulación bioquímica del proceso fisiológico de la erección, su déficit parece provocar cambios estructurales en el tejido cavernoso que afectan especialmente a la activación y al mantenimiento del mecanismo venooclusivo. Así, en estudios experimentales en ratas, se ha demostrado que la privación de andrógenos por castración altera la ultraestructura de los nervios cavernosos, del nervio dorsal del pene y puede producir fuga venosa29,30, alteraciones reversibles tras el tratamiento con testosterona31. El factor de crecimiento endotelial vascular (VEGF, del inglés vascular endothelial growth factor) es regulado por los andrógenos32 y, al tratar a animales castrados con VEGF, se restaura la función nerviosa y la enfermedad venooclusiva30, por lo que es posible que la síntesis de VEGF en el cuerpo cavernoso esté mediada por los andrógenos. También se ha comprobado que la erección producida por estimulación del área medial preóptica en ratas es dependiente de la testosterona33. Por tanto, los andrógenos parecen regular en el animal de experimentación los mecanismos neurológicos de la erección, tanto a nivel central como periférico. Otros estudios experimentales en ratas han demostrado que la testosterona regula la expresión y la actividad de las distintas isoformas (neuronal y endotelial) de la sintasa de óxido nítrico (NOS) en el cuerpo cavernoso34,35. El óxido nítrico es el mediador de la relajación del músculo liso trabecular y arterial intracavernoso. En animales castrados, la administración de testosterona o DHT restableció la función eréctil y la expresión de NOS en el cuerpo cavernoso34,35. También se ha demostrado que la testosterona regula la actividad de la fosfodiesterasa 5 (PDE5). La castración en conejos y ratas reduce la expresión y actividad de la PDE5, y provoca la ausencia de respuesta a la administración in vivo de inhibidores de la PDE536,37; tras la administración de testosterona se restauraría la actividad de la PDE5, por lo que la testosterona regularía tanto el inicio de la erección, mediante la activación de NOS, como su finalización, mediante la activación de la PDE5.
En estudios experimentales realizados en conejos, se ha observado que el déficit de andrógenos provoca alteraciones estructurales del tejido cavernoso, consistentes en una reducción del tejido muscular liso y un incremento del tejido conectivo, con acumulación de adipocitos en el espacio subtunical, que contribuyen al fallo del mecanismo venooclusivo38,39. En estudios llevados a cabo en ratas, se ha demostrado que la castración induce apoptosis en células del tejido espongiocavernoso, que puede ser bloqueada mediante la administración de testosterona40.
En el ser humano, no se han podido establecer evidencias tan firmes sobre la influencia de la testosterona en la función eréctil como a nivel experimental. No obstante, estudios realizados en varones con hipogonadismo grave indican que el deseo sexual, la frecuencia de la actividad sexual y las erecciones espontáneas nocturnas son dependientes de la testosterona, mientras que las erecciones psicógenas, la eyaculación y el orgasmo serían solo parcialmente dependientes41.
En los varones con hipogonadismo severo, el tratamiento sustitutivo con andrógenos mejora los resultados del registro de la tumescencia peneana nocturna, así como las erecciones evocadas por los estímulos eróticos42. Asimismo, la administración de testosterona a un varón hipogonádico con una respuesta subóptima a los inhibidores de la PDE5 produce una mejora de esta.
Parece haber un umbral crítico del nivel de testosterona sérica, con variación individual, pero consistente para un mismo individuo, por debajo del cual se afectaría la función sexual, y que podría ser específico para cada parámetro de la función sexual43.
La administración de dosis suprafisiológicas de EAA, además del hipogonadismo hipogonadotrópico secundario, puede generar un desequilibrio en el balance andrógenos/ estrógenos. El incremento, a causa de la aromatización, de la transformación periférica de los andrógenos en estrógenos induce un aumento de la síntesis de SHBG, marcador de hiperestrogenismo en el varón, con el consiguiente incremento de la ligazón de andrógenos a esta globulina. En consecuencia, aumenta la fracción de TT ligada a la SHBG y disminuye la TL. La primera medida terapéutica será el cese de la administración de EAA. Si hay un marcado hiperestrogenismo, se puede administrar un antiestrógeno como el tamoxifeno, a dosis de 10-20 mg/día. Si no se produce la regresión espontánea del hipogonadismo hipogonadotrópico, se deberá reactivar el eje hipófiso-testicular mediante la administración de gonadotropinas, con los inconvenientes mencionados previamente al referirnos al tratamiento de la esterilidad. En ocasiones, a pesar de la normalización de los parámetros bioquímicos y hormonales sanguíneos, persiste la disfunción sexual, por lo que se deberá considerar la etiología psicógena.
Ginecomastia
La ginecomastia o aumento de tamaño de la glándula mamaria en el varón es un signo clínico consistente en la proliferación del componente glandular de la mama masculina. En la glándula mamaria, los andrógenos inhiben la proliferación del tejido fibroglandular, mientras que los estrógenos la estimulan. Tanto en los adipocitos como en las células del estroma, hay actividad aromatasa, por lo que la administración de dosis suprafisiológicas de EAA puede generar un desequilibrio en el balance andrógenos/estrógenos, debido a la aromatización de la testosterona a estradiol, lo que dará lugar a la proliferación de tejido fibroglandular, tejido graso y, en consecuencia, al desarrollo de ginecomastia. Además, el hiperestrogenismo estimula la síntesis de SHBG, con el consiguiente incremento de la ligazón de andrógenos a esta globulina.
Debe distinguirse de la seudoginecomastia, en la que la acumulación de grasa causa la impresión del aumento del pecho en el varón, así como de la ginecomastia fisiológica que se produce en tres períodos etarios concretos: perinatal, puberal y senil. Por lo que, antes de establecer un tratamiento, es necesario establecer el diagnóstico diferencial entre ginecomastia fisiológica y patológica. La etiología de esta última es múltiple, y entre las más significativas destacan: a) tumores (productores de estrógenos o precursores, como son los tumores testiculares de células de Leydig, suprarrenales o productores de HCG como el coriocarcinoma); b) ginecomastia familiar; c) hipogonadismo hipergonadotrópico (síndrome de Klinefelter, defectos enzimáticos de la síntesis de testosterona, hermafroditismos y alteraciones testiculares adquiridas por radiación, traumatismo o infecciones); d) hipogonadismo hipogonadotrópico; e) ginecomastia idiopática; f) enfermedades sistémicas (insuficiencia renal, insuficiencia hepática); g) endocrinopatías (hipotiroidismo/hipertiroidismo); h) drogas, y i) fármacos.
La identificación de un fármaco causante de la ginecomastia es importante, ya que evitará costosos estudios diagnósticos; al suspender el fármaco, la ginecomastia es con mucha frecuencia reversible y, además, revierten otros efectos secundarios que también pueden estar presentes, como el hipogonadismo hipogonadotrópico. La revisión sistémica debe incluir la detección de signos o síntomas de: fallos renales, hepáticos o tiroideos (hipo/hiper); ganancias de peso; alcoholismo, o procesos neoplásicos. Se debe realizar un examen físico completo, incluidos los testículos, valoración de las funciones renal, hepática y tiroidea, así como determinación de la FSH, LH, β-HCG, TT, TL, estradiol y SHBG. Las mamas pueden parecerse a glándulas mamarias femeninas o presentar un pequeño botón subareolar de consistencia blanda y no adherido a los tejidos adyacentes. La induración, el dolor y la sensibilidad anormal son indicadores del aumento reciente de las mamas, pero en la mayoría de los casos se manifiesta de forma asintomática. El criterio diagnóstico es variable, pero la mayoría de los autores consideran que se puede hablar de ginecomastia cuando se palpa un botón mamario subareolar mayor de 2 cm de grosor44.
La palpación de la mama nos puede indicar si la causa de la ginecomastia es mayoritariamente la grasa (consistencia blanda) o bien la proliferación glandular (consistencia firme). La mamografía y la ecografía son de utilidad diagnóstica para valorar si la proporción principal es del componente graso o de la proliferación parenquimatosa. El tratamiento de la ginecomastia patológica es el de su causa subyacente, en el caso que nos ocupa: la supresión de los EAA. El tiempo de evolución de la ginecomastia es uno de los principales factores para decidir el tratamiento de elección. Está justificado un tratamiento médico si el diámetro de la mama es inferior a 6 cm y el tiempo de evolución inferior a 2 años. Pasados los 2 años de evolución, se han producido cambios fibróticos que harán improbable que cualquier tratamiento médico obtenga resultados. Se han utilizado antiestrógenos e inhibidores de la aromatasa. De forma off label, se ha utilizado el tamoxifeno, que es el que ha acreditado mejores resultados a dosis de 10-20 mg/día. En adultos, ha demostrado su utilidad para evitar los efectos estrogénicos derivados del tratamiento hormonal del cáncer de próstata, demostrando su efectividad (80%) y la escasa incidencia de efectos secundarios45. Como norma general, en pacientes con ginecomastia dolorosa o de reciente comienzo, es recomendable un ciclo de tratamiento con tamoxifeno durante 3-6 meses. También puede usarse en pacientes con ginecomastia de larga duración, aunque en pocos casos se conseguirá una remisión completa debido a la fibrosis. Para la ginecomastia mayor de 6 cm de diámetro y/o tiempo de evolución superior a 2 años, el tratamiento de elección es la intervención quirúrgica, y la mamoplastia periareolar o transareolar es la que ofrece los mejores resultados46.
Conclusiones
El abuso de EAA ha dejado de estar restringido al ámbito del deporte de élite, y se ha extendido a deportes recreativos, como el culturismo, o incluso ha ganado adeptos entre no practicantes de deporte de competición y, lo que es más preocupante, entre adolescentes cuyo principal objetivo es simplemente mejorar su apariencia física.
Ante la imposibilidad teórica de obtener en la farmacia EAA sin prescripción médica, los usuarios llegan a recurrir incluso a preparados de uso veterinario47 (más fáciles de conseguir por su menor control) y a la obtención de estas hormonas en terceros países que tengan una legislación más permisiva. Pueden obtenerse fácilmente a través de internet o en los gimnasios, y hay un auténtico mercado negro alrededor de la venta de estos fármacos, en el que en ocasiones aparecen involucrados médicos o farmacéuticos.
Las altas dosis administradas, varias veces superiores a las terapéuticas; la combinación de más de un esteroide y la asociación a otras sustancias farmacológicamente activas; la utilización de esteroides de aplicación veterinaria, de efectos no bien conocidos en la especie humana; la falta de control sobre sus efectos adversos; su influencia en el ámbito psíquico; el riesgo de dependencia, así como su extenso consumo de forma "ilegal", confiere a este grupo de fármacos relevancia sanitaria y toxicológica. El consumo de anabolizantes no se limita a los esteroides; la hormona de crecimiento (GH), combinaciones de factores de crecimiento (factor de crecimiento fibroblástico, factor de crecimiento nervioso, factor de crecimiento epidérmico, factor de crecimiento insulínico, factor de crecimiento de tejido conectivo) o aminoácidos estimulantes de la secreción de GH como arginina, lisina, ornitina y triptófano, forman parte de una interminable lista de sustancias utilizadas como anabólicos. Recientemente, se han popularizado "anabolizantes naturales", como el Tribulusterrestris, planta fanerógama a la que se le atribuye la capacidad de incrementar la síntesis de GnRH, o la maca andina (Lepidium meyenii).
En España, el tráfico de anabolizantes constituye un delito contra la salud pública, tal como recoge el artículo 361 bis de la Ley Orgánica 7/2006, de 21 de noviembre, de Protección de la Salud y de Lucha contra el Dopaje en el Deporte, conocida también como "ley antidoping", que puede ser castigado con penas de prisión de 6 meses a 2 años, multa de 6 a 18 meses e inhabilitación especial para empleo o cargo público, profesión u oficio, de 2 a 5 años47.
En resumen, el consumo de anabolizantes, lejos de ser un problema baladí, en muchos países supone un problema de salud pública. Como profesionales de la salud, es nuestra obligación estar alerta ante el uso de estas sustancias e informar a los pacientes y divulgar a la sociedad, en general, los riesgos que entrañan para la salud.
Conficto de intereses
El autor declara que no tiene ningún conflicto de intereses.
Correo electrónico:ferran.garcia@institutomarques.com
Recibido el 7 de octubre de 2011;
aceptado el 13 de octubre de 2011