INTRODUCCIÓN
La congelación de semen es una alternativa para almacenar espermatozoides (viables y con capacidad de fertilizar un ovocito) en los pacientes que serán sometidos a uno de los siguientes procesos: orquitectomía (uni o bilateral), quimioterapia, radioterapia y vasectomía1-3. Con excepción de los casos de vasectomía, es frecuente que el semen de este tipo de pacientes muestre una baja calidad seminal, medida a través de la movilidad y/o concentración de espermatozoides. La situación anterior, requiere considerar, por una parte, el efecto deletéreo per se de la congelación sobre los espermatozoides4-7 y, por otra, la reducción en viabilidad, motilidad y capacidad fertilizante que muestran los espermatozoides durante el proceso de descongelación4,5,8.
El proceso de congelación de semen ha sido ampliamente estudiado y en su conjunto la metodología está bien protocolizada9,10. Sin embargo, en el caso de la descongelación, es necesario aclarar la participación de diversos factores como temperatura de descongelación (constante 37 °C o con cambios graduales 4, 20 y 37 °C), velocidad de descongelación (lenta frente a rápida) y velocidad con la que se congeló (lenta, rápida) sobre la motilidad, vitalidad y morfología de los espermatozoides.
En varones normozoospérmicos la motilidad de los espermatozoides posdescongelación se reduce hasta en un 51% con respecto a la motilidad mostrada previamente a la congelación4. En el caso de pacientes astenozoospérmicos, la magnitud en la reducción de la motilidad después de someter a los espermatozoides al proceso congelación-descongelación resulta mayor con respecto a lo detectado en pacientes normozoospérmicos7. De ahí, la importancia de contar con protocolos de descongelación que minimicen los efectos deletéreos propios del proceso congelación-descongelación-lavado.
La vitalidad de los espermatozoides expuestos al proceso de congelación-descongelación se reduce hasta en un 14% en varones normozoospérmicos4, esta perdida en vitalidad puede ser mayor en muestras seminales que previamente a su congelación muestran una reducida vitalidad (p. ej., < 70%) y motilidad activa (p. ej., < 50%).
Se ha reportado11 que durante el proceso de descongelación de semen se incrementa la proporción de espermatozoides con colas con aspecto enrollado; una cola alterada en su morfología (p. ej., enrollamiento) dificulta el movimiento del espermatozoide e influye en el tipo de motilidad que muestran los espermatozoides, de ahí que resulte importante que el método de descongelación utilizado produzca el mínimo de alteraciones en la morfología de la cola de los espermatozoides.
Considerando lo señalado previamente, el objetivo de este estudio fue, partiendo de muestras seminales de mala calidad, establecer la influencia de los diferentes pasos efectuados durante la descongelación sobre la muestra seminal, para seleccionar la metodología que menos afecte a los espermatozoides en su vitalidad, motilidad y morfología de la cola.
MATERIAL Y MÉTODOS
Muestras de semen
Se utilizaron muestras seminales provenientes de 13 eyaculados obtenidos por masturbación y de diferentes pacientes con astenozoospermia. El promedio de edad de los varones fue 33 ± 1,4 años (media ± error estándar). Los eyaculados se evaluaron en forma previa a su congelación, y en promedio presentaron las siguientes características seminales: a) volumen 5,1 ± 0,6 ml; b) pH 8,1 ± 0,07 (tira reactiva de papel; Merck®); c) una concentración de 52 ± 14 × 106 espermatozoides ml-1 (cámara de Makler); d) una concentración de 246 ± 68 × 106 espermatozoides eyaculado-1; e) índice de vitalidad 57 ± 4% (naranja de acridina12); f) motilidad total y activa de 40 ± 3 y 29 ± 3%, respectivamente; g) índice de madurez nuclear de los espermatozoides: maduros 77 ± 1%, intermedios 7,0 ± 0,4% e inmaduros 16 ± 1% (test de condensación de la cromatina espermática: tinción azul de anilina13, h) y espermatozoides con morfología normal 12 ± 1% (tinción panóptico rápido modificada11,14).
Manejo del semen previo a la congelación
Una vez determinada la concentración de espermatozoides, se colocó en un tubo cónico (15 ml, Falcon®) una muestra de semen en estado de licuefacción con un mínimo de 20 × 106 de espermatozoides para su congelación.
Congelación de semen
El semen se congeló en píldoras10. Con anterioridad a su congelación, se permitió que el semen estuviera en estado de licuefacción, posteriormente se homogenizó; cada muestra seminal se diluyó 1:1 (volumen/volumen) con un crioprotector (SpermFreeze®; Beernem, Bélgica), la concentración final del crioprotector fue del 7,5%. La muestra por congelar (semen más crioprotector) se mezcló manualmente en forma suave y se mantuvo a temperatura ambiente durante 10 min; posteriormente, el tubo con la muestra se introdujo en un recipiente con agua a temperatura ambiente durante 15 min (estabilización).
El descenso de temperatura fue lento; para ello se colocó el tubo con la muestra por congelar (dentro del recipiente con agua) a una temperatura entre 4 y 5 °C durante 60 min. El siguiente descenso de temperatura se logró al colocar 150 μl de muestra por congelar en la superficie de bloques de CO2; una vez congeladas y formadas las píldoras, éstas fueron retiradas del bloque de CO2 y se introdujeron en un criotubo (6 píldoras por criotubo); de forma inmediata, cada criotubo se sumergió en nitrógeno líquido. Las muestras seminales se mantuvieron en congelación hasta el momento de su estudio por un mínimo de 48 h.
Tratamientos
De un total de 6 píldoras por paciente, se asignaron 2 píldoras por tratamiento: a) descongelación en 1 paso: este tratamiento se consideró como control y consistió en colocar las píldoras en un tubo cónico (15 ml) para su descongelado a temperatura ambiente (20 °C) durante 25 min. El tubo se frotó manualmente 2 veces (en forma breve y con la palma de ambas manos) a los minutos 15 y 25 de iniciado el proceso de descongelación con el propósito de favorecer un descongelado homogéneo; b) descongelación en 2 pasos. Consistió en descongelar las píldoras a temperatura ambiente durante 15 min y, posteriormente, a 37 °C durante 10 min. El tubo se frotó manualmente (tal como se detalló en el tratamiento "a", a los minutos 5 y 15 de iniciado el proceso de descongelación, y
c) descongelación en 3 pasos. Consistió en descongelar las píldoras a 4 °C durante 5 min seguido de temperatura ambiente durante 10 min y 37 °C durante 10 min. El tubo se frotó manualmente a los minutos 5 y 15. En este protocolo, descongelar a 4 °C implicó colocar el tubo (con las píldoras dentro de éste) en un vaso de precipitado con agua a 4 °C; el nivel empleado de agua (50 ml) permitió cubrir las píldoras por descongelar.
Medio de lavado. Una hora previa a la descongelación, se colocó en la estufa (37 °C, 5% CO2) un tubo cónico (15 ml, Falcón®) con medio de lavado Gamete® (Vitrolife, Guthenburg, Suecia), aproximadamente 1,5 ml por cada par de píldoras, con el fin de equilibrar y mantener estable el pH del medio de lavado.
Lavado de la muestra seminal. Una vez efectuada la descongelación de la muestra seminal (minuto 25), se tomaron 3 alícuotas (2 de 15 μl y una de 40 μl) para llevar a cabo la primera evaluación de la muestra seminal (antes del lavado). Al resto de la muestra se le agrego 1 ml de medio de lavado y se centrífugo a 360 g durante 10 min. Se retiró el sobrenadante y se resuspendió en 100 μl de medio de lavado para su evaluación poslavado.
Diseño experimental
Se utilizó un diseño de 2 factores con medidas repetidas sobre ambos15. El primer factor de estudio correspondió al protocolo de descongelación de las píldoras de semen: a) 25 min a temperatura ambiente; b) 15 min a temperatura ambiente seguido de 10 min a 37 °C, y c) 5 min a 4 °C seguido de 10 min a temperatura ambiente y 10 min a 37 °C. El segundo factor fue el momento de evaluación de la muestra seminal dentro del proceso de lavado: a) antes del lavado, y b) después del lavado.
Unidad experimental
Correspondió a 2 píldoras (150 μl píldora-1) de semen congelado.
Variables evaluadas
Las variables se evaluaron en 2 momentos: una vez que se habían descongelado las píldoras y después del lavado de la muestra descongelada (centrifugación y lavado).
Motilidad activa
Se evaluó de forma subjetiva a través de la observación directa de 200 espermatozoides a 40× utilizando un microscopio de contraste de fases (Labophot, Nikon®). Se utilizaron 2 patrones de motilidad, G3 y G216.
Índice de vitalidad
En 200 espermatozoides, se cuantificó la proporción de espermatozoides vivos y muertos por el uso de un microscopio de fluorescencia (Tansformer, UN, con filtro primario de 495 nm y filtro secundario de 500 nm, Nikon®). Se utilizó la tinción naranja de acridina12 para diferenciar los espermatozoides vivos de los muertos; los vivos muestran fluorescencia verde y los muertos fluorescencia naranja.
Alteraciones en la morfología de la cola
La morfología de la cola fue evaluada a 1.000× en 100 espermatozoides teñidos con la tinción panóptico rápido modificada11; todas las morfologías de cola fueron clasificadas por un solo observador. La morfología de la cola se clasificó en 4 categorías: a) cola normal; b) cola corta; c) cola enrollada parcialmente, y d) cola enrollada totalmente. Una cola normal se definió como la que no presentó enrollamiento parcial o total a lo largo de su extensión; la cola corta, es la que muestra un mayor grosor y una menor longitud con respecto al detectado en la cola normal; la cola enrollada parcialmente, se refiere a la que muestra un enrollamiento parcial en su extremo distal (sin llegar a ser total); la cola enrollada totalmente, es el tipo de cola que está enrollada alrededor de la cabeza del espermatozoide.
Análisis estadístico
Los datos se presentan como media ± error estándar y previamente se les aplicó la prueba de Shapiro-Wilk's para probar que se distribuyen en forma normal; las variables que no se distribuyeron en forma normal fueron transformados a la raíz cuadrada (motilidad activa) y logaritmo en base 10 (porcentaje de colas enrolladas parcialmente y totalmente). Los datos se analizaron utilizando un análisis de varianza a través de los modelos lineales generales para el diseño descrito17.
RESULTADOS
Efecto del protocolo de descongelación
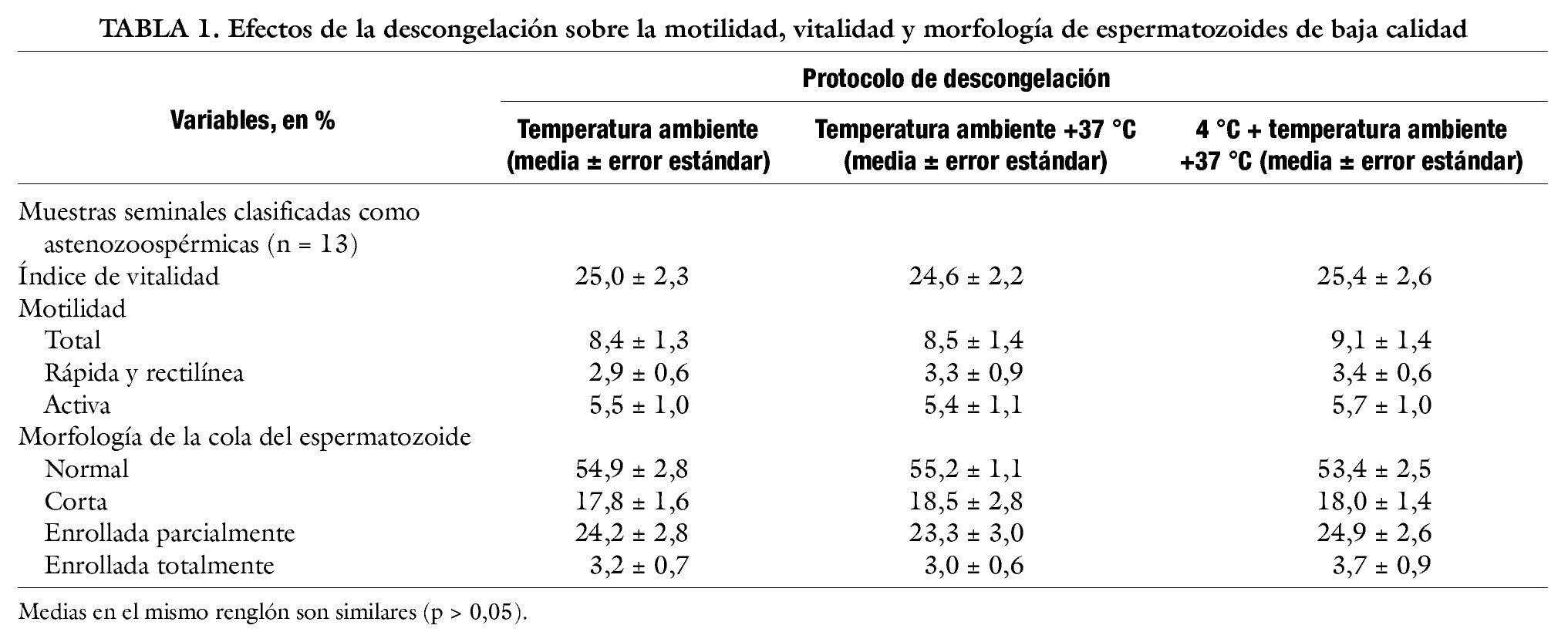
El protocolo de descongelación no influyo (p > 0,05) sobre las siguientes variables: índice de vitalidad, motilidad total, motilidad activa, espermatozoides con cola normal, espermatozoides con cola corta, espermatozoides con cola enrollada parcialmente y espermatozoides con cola enrollada totalmente (tabla 1).
Efecto del lavado
Todas las variables estudiadas fueron influidas por el proceso de lavado. Después del lavado de la muestra seminal, las variables índice de vitalidad, motilidad total, motilidad activa, espermatozoides con cola normal y espermatozoides con cola normal y corta se redujeron (p < 0,001) con respecto a los valores presentes antes del lavado. En el caso de los espermatozoides con cola enrollada parcialmente (p < 0,001) y totalmente (p < 0,01) se registró un aumento (tabla 2).
Efecto del protocolo de descongelación y lavado de la muestra seminal
La interacción protocolo de descongelación con lavado no resulto significativa (p > 0,05).
DISCUSIÓN
El proceso de congelación-descongelación reduce el porcentaje de espermatozoides vivos, tanto en muestras seminales de buena calidad, normozoospérmicas, como en las de mala calidad, astenozoospérmicas, oligozoospérmicas y teratozoospérmicas18-20. Sin embargo, al presentarse desde un inicio en las muestras seminales de baja calidad, una vitalidad baja, cualquier reducción adicional en este parámetro compromete sus posibilidades de uso con alguna de las tecnologías de reproducción asistida disponibles.
En el presente estudio, los protocolos propuestos para descongelar semen de mala calidad no mostraron un efecto (p > 0,05) sobre el índice de vitalidad de los espermatozoides. Se detectó que el proceso congelación-descongelación reduce el índice de vitalidad de los espermatozoides en un 56% con respecto al valor registrado previo al proceso de congelación. Los valores de vitalidad posdescongelación en las muestras seminales estudiadas resultaron similares a lo detectado en otros estudios18,20, en donde se estudió el efecto del proceso de congelación-descongelación sobre la vitalidad de muestras seminales de baja calidad.
El proceso de descongelación de muestras seminales debe reducir el desequilibrio osmótico y la recristalización de microcristales de agua intracelular que pueden dañar las estructuras celulares10. Los resultados de este estudio indican que los protocolos de descongelación evaluados afectan de manera similar la vitalidad de los espermatozoides, lo que siguiere que el cambio gradual de la temperatura de almacenaje (-196 °C) a la temperatura de evaluación (teniendo constante el tiempo de descongelación) no reduce el porcentaje de espermatozoides muertos. A diferencia de lo indicado en este estudio, otros autores21 muestran que cuando una muestra seminal normozoospérmica se enfría a una tasa baja (1 °C min-1), la función mitocondrial de los espermatozoides (variable asociada con la vitalidad de los espermatozoides) resulta mayor si la tasa de calentamiento de la muestra seminal también es baja (1 °C min-1) en lugar de alta (400 °C min-1). Mientras que si la tasa de enfriamiento es alta (entre 175 y 800 °C min-1) y la de calentamiento alta (400 °C min-1), se obtiene un mayor porcentaje de espermatozoides con función mitocondrial con respecto a una tasa de calentamiento baja (1 °C min-1).
Convencionalmente, las muestras de semen que se someten al proceso de congelación contienen plasma seminal, un medio de nutrientes (como citrato-yema de huevo o albúmina sérica humana) y glicerol. Las muestras seminales congeladas que se requieran utilizar para alguna de las técnicas de reproducción asistida (fecundación in vitro o inyección intracitoplasmática del espermatozoide) deberán ser descongeladas y lavadas, este último proceso se realiza con el fin de retirar el plasma seminal, el crioprotector y contaminantes, ya que éstos interfieren con el proceso de fecundación20.
En este estudio, la etapa del proceso de lavado influyó sobre el índice de vitalidad de los espermatozoides. Durante el proceso de lavado de la muestra descongelada se disminuyó el índice de vitalidad en un 26%. Por lo que el proceso de congelación-descongelación tiene un mayor efecto deletéreo sobre los espermatozoides que el proceso de lavado posdescongelación.
Con respecto a la motilidad, los resultados de este estudio indican que los protocolos de descongelación estudiados redujeron la motilidad de los espermatozoides en al menos un 77% con respecto a la motilidad de los espermatozoides previa a su congelación. Una reducción en la motilidad (muestra seminal fresca frente a descongelada) ligeramente inferior a la indicada en este estudio ha sido reportada previamente7 en muestras seminales de varones catalogados como infértiles.
En el presente estudio no se evaluó la tasa de calentamiento (°C min-1) de una muestra congelada. Sin embargo, al mantenerse constante el tiempo de descongelación de la muestra seminal (25 min) y diferir la temperatura de calentamiento entre los protocolos de descongelación propuestos, se asume que la tasa de calentamiento difiere entre tratamientos. No obstante, los diversos protocolos de descongelación estudiados afectaron de manera similar la motilidad de los espermatozoides (total, G3 y activa). Estos resultados no concuerdan con hallazgos previos21, donde se contrastaron 2 temperaturas de calentamiento de la muestra seminal congelada (1 frente a 400 °C min-1) y se indica una interacción significativa entre la temperatura de enfriamiento y la temperatura de calentamiento, es decir, la motilidad de los espermatozoides posdescongelación resulta mayor cuando se utilizan una tasa de enfriamiento baja con una tasa baja de calentamiento. Al parecer, se requiere contrastar diferencias marcadas en las tasas de calentamiento para detectar cambios en la motilidad de los espermatozoides.
De manera similar a los hallazgos en el índice de vitalidad, la etapa del proceso de lavado afectó la motilidad de los espermatozoides, sin que este efecto fuera de mayor magnitud al ejercido por el proceso de descongelación. El proceso de lavado implica someter a los espermatozoides a la dilución en medios de cultivo, seguido de la centrifugación y resuspensión en medios de cultivo. La dilución se realiza con un gran volumen de medio de cultivo y la centrifugación tiene como fin concentrar una población de espermatozoides previamente diluida. Una consecuencia del lavado de la muestra seminal es el daño en la integridad de la membrana plasmática y en la función mitocondrial, lo que trae consigo una reducción de la motilidad de los espermatozoides21,22.
El proceso de congelación de los espermatozoides produce cambios en la morfología espermática, incluyendo daño en las mitocondrias, el acrosoma y la cola del espermatozoide23,24. Los cambios morfológicos en la cabeza y en la pieza intermedia de los espermatozoides provenientes de pacientes infértiles se han descrito previamente21,23,24, y hay limitada información acerca de los cambios que ocurren en la morfología de la cola del espermatozoide11,23.
La criopreservación causa rotura de la membrana plasmática en la cabeza y regiones de la cola del espermatozoide. El daño ocasionado por la congelación en la membrana plasmática de la cabeza y la cola puede ocurrir de manera independiente; la presencia de una membrana intacta en la cola no necesariamente indica que la membrana de la cabeza también está intacta23.
Los diferentes protocolos de descongelación evaluados en este trabajo no ejercieron efecto sobre la morfología de la cola del espermatozoide. Del total de las colas evaluadas, solo el 54% se clasificó como normal, destacando la cola enrollada parcialmente (24%) como una de las alteraciones que se registran tras el proceso de congelación-descongelación. Los resultados del presente trabajo apoyan resultados previos de estudios11 en donde se indica que el proceso de descongelación de semen incrementa la proporción de espermatozoides con colas con aspecto enrollado.
El proceso de lavado redujo en un 26% la presencia de espermatozoides con una morfología de la cola normal. Destacando el incremento (255%) en el porcentaje de colas enrolladas parcialmente posterior al lavado. Lo que sugiere que los efectos negativos del lavado de una muestra seminal descongelada no solo son evidentes en la pérdida de la integridad de la membrana plasmática21-23 sino en la alteración de la morfología de la cola, la cual resulta determinante para la calidad del movimiento del espermatozoide.
Se concluye que las diferencias en los protocolos de descongelación evaluados no influyeron en las variables estudiadas. Sin embargo, es de resaltar la reducción que se observó en la motilidad, vitalidad e incremento en las alteraciones en la morfología de la cola producida por el lavado de la muestra una vez descongelada.
Correspondencia: Dr. J. Oliva-Hernández.
Instituto Nacional de Investigaciones, Forestales, Agrícolas y Pecuarias.
Km 1 carretera Huimanguillo-Cárdenas. Huimanguillo, 86400 Tabasco. México.
Correo electrónico: olivajh20@yahoo.com.mx