El objetivo de este estudio es describir y analizar los niveles basales y la dinámica de fragmentación del ADN espermático tras la eyaculación en varones jóvenes.
Material y métodoSe trata de un estudio transversal realizado en jóvenes universitarios sanos (n=114) de la Región de Murcia entre 2010 y 2011. La fragmentación del ADN espermático (SDF) se definió como el porcentaje de espermatozoides con el ADN fragmentado con respecto al total de los espermatozoides analizados. Se calcularon las tasas de incremento de fragmentación (rSDF) por tramos de incubación utilizando el test de dispersión de la cromatina espermática. Se estudiaron los valores basales de la SDF, así como los valores tras la incubación de las muestras a 37°C durante 2,5, 17 y 24h. Los análisis estadísticos se realizaron mediante pruebas paramétricas y no paramétricas.
ResultadosEl SDF basal medio obtenido fue de 27,2% (DE 14,4), y la rSDF fue significativamente mayor durante el primer intervalo de incubación comparada con los valores obtenidos en los siguientes intervalos. La tasa de degradación durante las primeras 2,5h (5,5%/h) resultó significativamente mayor en aquellas muestras con un nivel de fragmentación basal superior al 30%.
ConclusionesObservamos unos valores medios de SDF basal relativamente altos comparados con los de otros estudios publicados y corroboramos que la rSDF es mayor durante las primeras horas tras la eyaculación. Por otra parte, las muestras con SDF basal superior al 30% presentan mayor rSDF durante las primeras horas de incubación comparadas con muestras con niveles basales inferiores al 15%.
To describe and analyze sperm DNA fragmentation and its dynamics after ejaculation in young men.
Material and methodThis is a cross-sectional study conducted between 2010 and 2011 in young university students (n=114) from the Murcia Region (Spain). Sperm DNA fragmentation index (SDF) was defined as the percentage of sperm with fragmented DNA divided by the total amount of assessed sperm. The rate of sperm DNA fragmentation (rSDF) was determined by periods of incubation according to the sperm chromatin dispersion test. SDF and its dynamics were evaluated after incubation for 2.5, 17 and 24h at 37°C. Parametric and non-parametric tests were used for statistical analyses.
ResultsMean basal SDF was 27.2% (SD 14.4) and rSDF was significantly higher in the first period of incubation compared to the following periods of incubations. The rate of sperm DNA degradation during the first 2.5h (5,5%/h) was significantly higher in those samples with a basal SDF above 30%.
ConclusionsThese results indicate that our mean values of SDF are relatively higher compared to other published studies and corroborate that rSDF is significantly higher during the first hours after ejaculation. Moreover, samples with basal SDF above 30% showed higher rSDF during the first hours of incubation compared to the samples with basal SDF below 15%.
Se estima que un 15% de las parejas en edad reproductiva presentan problemas de fertilidad1, y alrededor de un 50% de los casos se debe a un factor masculino2. La infertilidad de origen masculino se ha diagnosticado tradicionalmente mediante el estudio de la concentración, la movilidad y la morfología espermática, y estos parámetros son esenciales para evaluar la calidad seminal humana2.
Se ha propuesto que el estudio de la fragmentación del ADN espermático (SDF) podría ser una herramienta útil complementaria a los parámetros seminales clásicos para valorar el potencial fértil de los varones3. La integridad del ADN espermático es un factor crítico para la correcta transmisión de la información genética paterna al embrión4, de tal forma que la molécula de ADN en el espermatozoide podría comprometer el éxito reproductivo5,6. El daño en el ADN espermático tiene consecuencias negativas para la fertilidad, tanto a la hora de conseguir la implantación embrionaria como para el desarrollo fetal posterior7,8. El elevado daño en el ADN de los espermatozoides se ha asociado a bajas tasas de fecundación e implantación, y a un aumento en la tasa de abortos y la incidencia de enfermedades en los niños nacidos6,7,9.
La mayoría de los estudios que analizan la SDF valoran este daño como el porcentaje de espermatozoides que tienen la molécula de ADN dañada en un momento determinado8,9. Sin embargo, trabajos recientes indican que la SDF es un fenómeno dinámico, ya que tras la eyaculación la fragmentación tiende a aumentar con el tiempo10 y es un fenómeno que afecta a todas las especies de mamíferos y que parece correlacionarse, entre otros factores, con el tipo y la calidad de la protaminación11–13. De hecho, diversos trabajos han explorado o evaluado la dinámica de la fragmentación espermática como herramienta coadyuvante en el estudio de la infertilidad masculina10,11,14,15. La mayoría de estos trabajos se llevaron a cabo con pacientes infértiles que acudían a clínicas de fertilidad y con donantes de semen con fertilidad contrastada10,11,14–17.
No obstante, hasta donde conocemos, ningún estudio previo ha explorado este fenómeno en varones jóvenes sanos o población no seleccionada sin conocimiento de su calidad seminal o fertilidad. Por tanto, nuestro objetivo es describir y analizar los niveles basales y la dinámica de la SDF tras la eyaculación en varones jóvenes.
Material y métodoEste trabajo se engloba dentro del Estudio de hombres jóvenes de Murcia (Murcia Young Men's Study). La metodología se ha descrito y publicado previamente18. Brevemente, se distribuyeron anuncios por todos los campus universitarios invitando a los estudiantes a participar en este proyecto con el mensaje: «Se buscan hombres jóvenes sanos universitarios para proyecto de investigación». Para ser incluidos en el Murcia Young Men's Study los sujetos tenían que ser estudiantes universitarios, nacidos en España después del 31 de diciembre de 1987, y poder contactar con sus madres para que estas cumplimentaran un cuestionario. El estudio se llevó a cabo analizando muestras seminales procedentes de jóvenes universitarios voluntarios y sanos (entre 18-23 años) de la Región de Murcia entre 2010 y 2011. El presente trabajo comprende un total de 114 sujetos para los que se disponía de todos los datos y variables necesarias para este estudio –calidad seminal, SDF y características demográficas–. Los participantes fueron recompensados por su participación con una tarjeta regalo de 50€. Se obtuvo el consentimiento informado de todos los sujetos participantes, y la Comisión de Ética de Investigación de la Universidad de Murcia aprobó este estudio.
Análisis seminalLa obtención de la muestra se realizó mediante masturbación en el propio centro. El tiempo de abstinencia se registró como el número de horas desde la obtención de la muestra hasta la eyaculación anterior. Los análisis de parámetros seminales (volumen, concentración, recuento total, movilidad y morfología espermática) se realizaron siguiendo las recomendaciones de la OMS (2010)2. Brevemente, el volumen eyaculado fue estimado a partir del peso de la muestra, asumiendo una densidad del semen de 1,0g/mL. La concentración espermática fue evaluada utilizando un hemocitómetro (Improved Neubauer; Hausser Scientific Inc., Horsham, PA, EE. UU.). Los espermatozoides fueron clasificados según si eran móviles o inmóviles para establecer el porcentaje de los primeros (con movimiento progresivo y no progresivo)2. El recuento espermático total se calculó como el producto entre el volumen y la concentración espermática. La morfología se evaluó usando la tinción de Papanicolaou y el criterio estricto de Kruger19. La misma embrióloga especializada llevó a cabo todos los análisis espermáticos.
Examen físicoEl índice de masa corporal se calculó como el peso en kilogramos dividido por el cuadrado de la altura en metros. Se evaluó el tamaño testicular usando un orquidómetro de Prader (Andrology Australia, Clayton, Victoria, Australia) y la presencia o no de varicocele u otras anormalidades escrotales.
Análisis de fragmentación del ácido desoxirribonucleico espermáticoPara el estudio de la dinámica, una vez licuada la muestra, se separaron distintas alícuotas que fueron incubadas a 37°C durante distintos periodos de tiempo antes de ser congeladas. Los periodos de tiempo fueron los siguientes: a tiempo 0h (valor basal de fragmentación), a 2,5, a 17 y a 24h. Una vez transcurrido el tiempo de incubación las alícuotas fueron congeladas directamente sin crioprotector a −20°C, y posteriormente a −80°C. El análisis de la SDF se realizó mediante el test de dispersión de la cromatina espermática (SCD), utilizando el Dyn-Halosperm® (Halotech S. L., Madrid, España)20. Las muestras se descongelaron mediante inmersión 30s en agua a 37°C, y se diluyeron hasta obtener una concentración aproximada de 15millones/mL. Las muestras fueron procesadas inmediatamente tras su descongelación. Las muestras procesadas se analizaron utilizando microscopia de fluorescencia (SYBR® Green II RNA Gel Stain, Invitrogen™, Life Technologies Corporation, Paisley, Reino Unido) y se contabilizaron por el mismo observador. El índice de fragmentación (SDF) se definió como el porcentaje de espermatozoides con el ADN fragmentado con respecto al total de los espermatozoides analizados. Para cada alícuota se estudiaron 300 espermatozoides. La tasa de fragmentación del ADN espermático (rSDF, del inglés rateSDF) se definió como el incremento de la SDF por unidad de tiempo evaluado en horas.
Análisis estadísticoSe realizaron análisis descriptivos sobre las características demográficas, el examen físico, la calidad seminal, el SDF y la rSDF. Tras comprobar la normalidad de las variables mediante el test de Kolmogorov-Smirnov, se usaron indistintamente pruebas paramétricas (t de Student) y no paramétricas (Mann-Whitney) para la comparación de medias entre 2 grupos. Del mismo modo, para la comparación de medias entre varios grupos se utilizó ANOVA (Kruskal-Wallis en variables no normales) y la prueba post-hoc de Games-Howell (Mann-Whitney). Todas las pruebas fueron de 2 colas, y el nivel de significación estadística se fijó en 0,05. Para la realización de los análisis estadísticos se empleó el paquete SPSS® 20.0 (IBM Corporation, Armonk, Nueva York, EE. UU.).
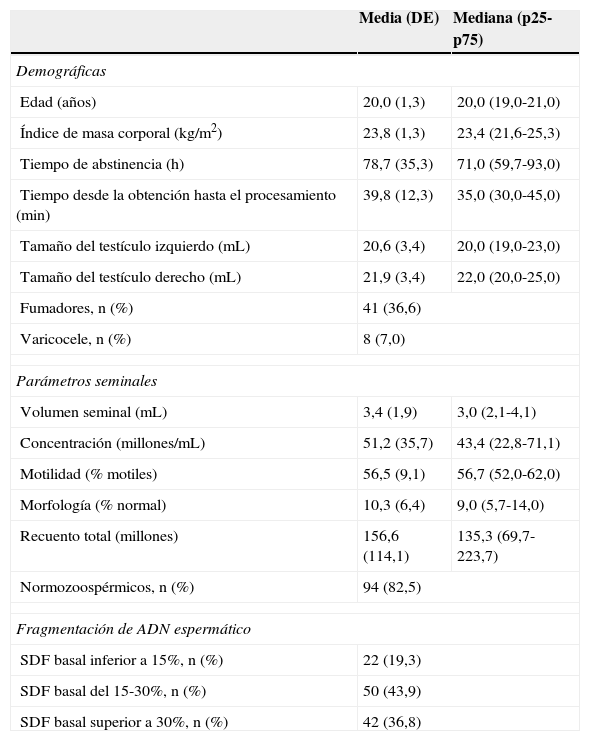
ResultadosEn la tabla 1 se muestran las principales características de los sujetos participantes en este trabajo (n=114). El 36,6% eran fumadores habituales y un 7% presentaron varicocele. La mayoría presentaba un buen estado de salud general. El tiempo medio de abstinencia fue de 78,7h (desviación estándar [DE] 35,3), y el tiempo transcurrido desde la obtención hasta el análisis de la muestra fue de 39,8min (DE 12,3). La concentración espermática media fue de 51,2millones/mL (DE 35,7), y el porcentaje de espermatozoides móviles totales fue de 56,5% (DE 9,1). El porcentaje de espermatozoides morfológicamente normales fue de 10,3% (DE 6,4). El 82,5% de las muestras analizadas presentó todos los parámetros dentro de la normalidad según la OMS2. En la tabla 1 también podemos observar la distribución de los individuos en 3 grupos en función de los valores basales de SDF observados.
Características principales de los sujetos participantes en este trabajo
| Media (DE) | Mediana (p25-p75) | |
|---|---|---|
| Demográficas | ||
| Edad (años) | 20,0 (1,3) | 20,0 (19,0-21,0) |
| Índice de masa corporal (kg/m2) | 23,8 (1,3) | 23,4 (21,6-25,3) |
| Tiempo de abstinencia (h) | 78,7 (35,3) | 71,0 (59,7-93,0) |
| Tiempo desde la obtención hasta el procesamiento (min) | 39,8 (12,3) | 35,0 (30,0-45,0) |
| Tamaño del testículo izquierdo (mL) | 20,6 (3,4) | 20,0 (19,0-23,0) |
| Tamaño del testículo derecho (mL) | 21,9 (3,4) | 22,0 (20,0-25,0) |
| Fumadores, n (%) | 41 (36,6) | |
| Varicocele, n (%) | 8 (7,0) | |
| Parámetros seminales | ||
| Volumen seminal (mL) | 3,4 (1,9) | 3,0 (2,1-4,1) |
| Concentración (millones/mL) | 51,2 (35,7) | 43,4 (22,8-71,1) |
| Motilidad (% motiles) | 56,5 (9,1) | 56,7 (52,0-62,0) |
| Morfología (% normal) | 10,3 (6,4) | 9,0 (5,7-14,0) |
| Recuento total (millones) | 156,6 (114,1) | 135,3 (69,7-223,7) |
| Normozoospérmicos, n (%) | 94 (82,5) | |
| Fragmentación de ADN espermático | ||
| SDF basal inferior a 15%, n (%) | 22 (19,3) | |
| SDF basal del 15-30%, n (%) | 50 (43,9) | |
| SDF basal superior a 30%, n (%) | 42 (36,8) | |
ADN: ácido desoxirribonucleico; DE: desviación estándar; p25: percentil 25; p75: percentil 75; SDF: fragmentación del ADN espermático.
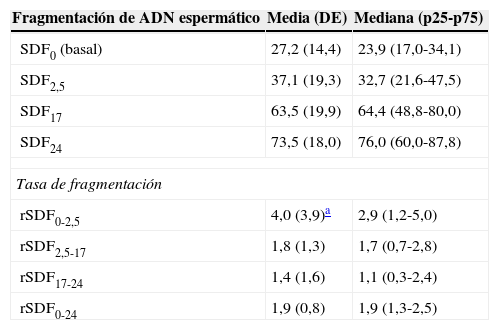
El porcentaje de fragmentación en cada periodo de tiempo y las tasas de degradación se muestran en la tabla 2. El SDF basal medio fue de 27,2% (DE 14,4). Los resultados en el análisis dinámico de la SDF (rSDF) muestran que durante la incubación de las muestras se produce un incremento en la SDF. La tasa de fragmentación (4,0%/h) fue significativamente mayor durante el primer intervalo de incubación comparada con los valores obtenidos en el segundo y tercer intervalo (1,8 y 1,4%/h, respectivamente).
Características principales de los análisis de fragmentación del ácido desoxirribonucleico espermático y sus tasas de degradación en los sujetos participantes en este trabajo
| Fragmentación de ADN espermático | Media (DE) | Mediana (p25-p75) |
|---|---|---|
| SDF0 (basal) | 27,2 (14,4) | 23,9 (17,0-34,1) |
| SDF2,5 | 37,1 (19,3) | 32,7 (21,6-47,5) |
| SDF17 | 63,5 (19,9) | 64,4 (48,8-80,0) |
| SDF24 | 73,5 (18,0) | 76,0 (60,0-87,8) |
| Tasa de fragmentación | ||
| rSDF0-2,5 | 4,0 (3,9)a | 2,9 (1,2-5,0) |
| rSDF2,5-17 | 1,8 (1,3) | 1,7 (0,7-2,8) |
| rSDF17-24 | 1,4 (1,6) | 1,1 (0,3-2,4) |
| rSDF0-24 | 1,9 (0,8) | 1,9 (1,3-2,5) |
ADN: ácido desoxirribonucleico; DE: desviación estándar; p25: percentil 25; p75: percentil 75; rSDF0-2,5: tasa de fragmentación entre las 0 y las 2,5h; rSDF2,5-17: tasa de fragmentación entre las 2,5 y las 17h; rSDF17-24: tasa de fragmentación entre las 17 y las 24h; rSDF0-24: tasa de fragmentación entre las 0 y las 24h; SDFt: índice de fragmentación del ADN espermático a las «t» horas.
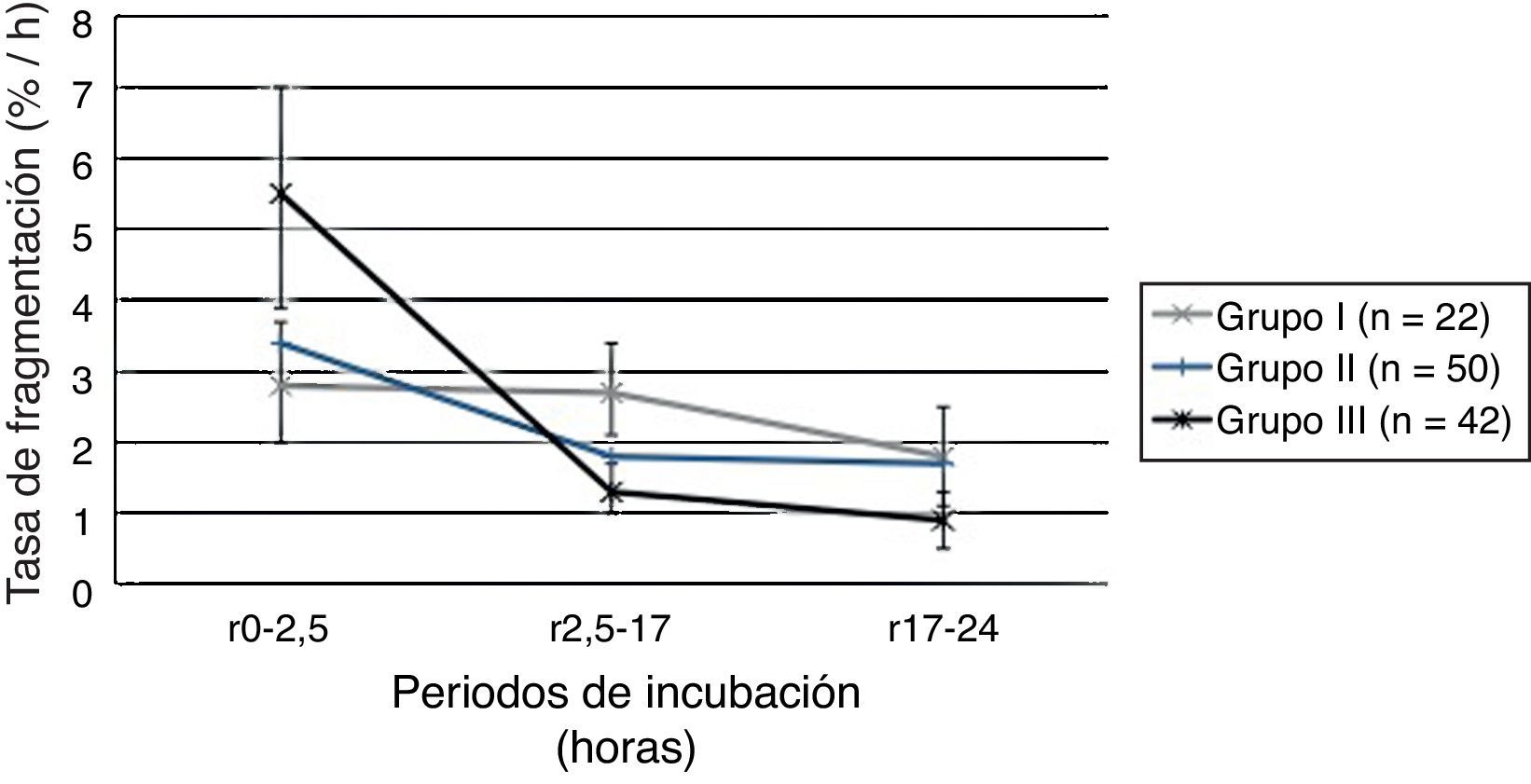
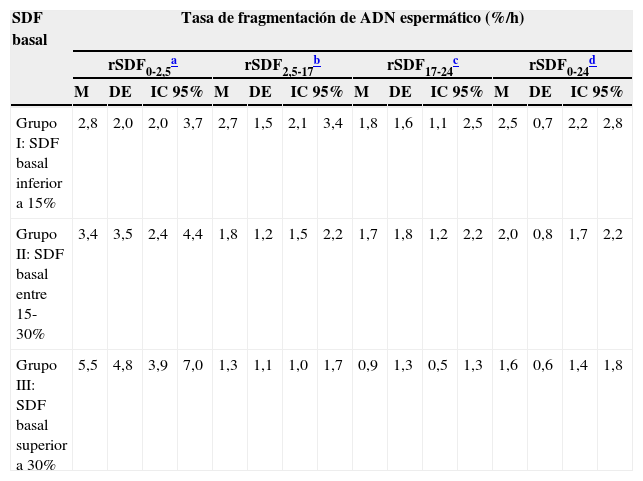
En la tabla 3 se muestran los valores de la rSDF en función de la SDF basal. Como se puede observar, existen diferencias significativas entre los distintos grupos. La tasa de degradación durante el primer intervalo resulta significativamente mayor en aquellas muestras con un nivel de fragmentación basal superior al 30% (tasa 5,5%/h) comparada con las muestras con un nivel basal de fragmentación menor (tasa 2,8%/h). A mayor fragmentación basal, mayor velocidad de fragmentación durante las primeras horas de incubación. En la figura 1 se representa la rSDF en los distintos periodos de incubación en función de la SDF basal.
Relación entre la fragmentación basal y la dinámica de fragmentación del ácido desoxirribonucleico espermático
| SDF basal | Tasa de fragmentación de ADN espermático (%/h) | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| rSDF0-2,5a | rSDF2,5-17b | rSDF17-24c | rSDF0-24d | |||||||||||||
| M | DE | IC 95% | M | DE | IC 95% | M | DE | IC 95% | M | DE | IC 95% | |||||
| Grupo I: SDF basal inferior a 15% | 2,8 | 2,0 | 2,0 | 3,7 | 2,7 | 1,5 | 2,1 | 3,4 | 1,8 | 1,6 | 1,1 | 2,5 | 2,5 | 0,7 | 2,2 | 2,8 |
| Grupo II: SDF basal entre 15-30% | 3,4 | 3,5 | 2,4 | 4,4 | 1,8 | 1,2 | 1,5 | 2,2 | 1,7 | 1,8 | 1,2 | 2,2 | 2,0 | 0,8 | 1,7 | 2,2 |
| Grupo III: SDF basal superior a 30% | 5,5 | 4,8 | 3,9 | 7,0 | 1,3 | 1,1 | 1,0 | 1,7 | 0,9 | 1,3 | 0,5 | 1,3 | 1,6 | 0,6 | 1,4 | 1,8 |
ADN: ácido desoxirribonucleico; DE: desviación estándar; IC 95%: intervalo de confianza del 95%; M: media; rSDF0-2,5: tasa de fragmentación entre las 0 y las 2,5h; rSDF2,5-17: tasa de fragmentación entre las 2,5 y las 17h; rSDF17-24: tasa de fragmentación entre las 17 y las 24h; rSDF0-24: tasa de fragmentación entre las 0 y las 24hSDF: fragmentación del ADN espermático.
Se aplicó ANOVA (con prueba post-hoc de Games-Howell) para la comparación de rSDF2,5-17, rSDF17-24 y rSDF0-24 en cada uno de los grupos definidos según fragmentación basal del individuo.
Para rSDF0-2,5 se usó la prueba de Kruskal-Wallis.
En general, los estudios que hacen referencia a los niveles de fragmentación en el ADN del espermatozoide utilizan muestras procedentes de clínicas con fallos de reproducción asociados a los pacientes o bien son donantes seleccionados basándose en una serie de criterios de calidad espermática, genética y morfológica. Hasta donde conocemos, este es el primer estudio que describe y analiza los niveles tanto del daño basal como del dinámico en el ADN de los espermatozoides en una muestra amplia de jóvenes varones sanos.
Según nuestros resultados, la SDF basal media observada en nuestra población de estudio es relativamente alta comparada con los resultados publicados sobre donantes jóvenes. Los SDF observados en jóvenes varones, normozoospérmicos y con fertilidad probada suelen oscilar entre el 10-15%10,14, mientras que en nuestro trabajo el SDF medio es del 27,3%. Debemos tener en cuenta que aunque los individuos de nuestro estudio son jóvenes sanos y, la mayoría, normozoospérmicos (82,5%), a diferencia de los donantes de semen utilizados en la mayor parte de los trabajos, no presentan fertilidad probada. No obstante, nuestros resultados en cuanto a fragmentación basal son similares a los publicados en un estudio realizado en pacientes normozoospérmicos que acudían a clínicas de fertilidad21, aunque otros trabajos con pacientes similares obtienen índices de fragmentación inferiores22. Evidentemente, los estudios de prevalencia del daño registrado en el ADN del espermatozoide en población humana requieren de la inclusión de un tamaño poblacional mayor para considerarlos como indicativos de la situación real. No obstante, en la mejor situación que podríamos considerar bajo la que asumir unos niveles de daño en el ADN bajos, que sería una población de donantes, los niveles detectados utilizando la misma técnica de evaluación están en torno al 10%10,14. Las diferencias con la población aquí analizada son altamente significativas. Quizás esta situación sea mucho más real de lo que imaginamos, dado que si bien no existen datos bien contrastados sobre este particular, se estima que tan solo sobre un 10-15% de los individuos que acuden para ser seleccionados como posibles donantes de semen son seleccionados como tales. De hecho, si tomamos como referencia los valores de corte establecidos por Gosálvez et al.14 para los donantes en nuestra población, tan solo un 3,5% cumplirían esta condición.
En nuestro trabajo utilizamos el test de SCD, el cual ha sido estudiado y analizado con respecto a otras técnicas disponibles, concluyendo que los resultados obtenidos con él son comparables a los obtenidos con el terminal deoxynucleotidyl transferase dUTP nick-end labeling o el sperm chromatin structure assay23. Por otra parte, otros trabajos han analizado los puntos de corte, la sensibilidad y la especificidad obtenidos con el test SCD, y muestran que el test presenta una buena capacidad para determinar o diagnosticar la infertilidad masculina8,20,23. Otro punto importante en la metodología de nuestro trabajo es la congelación de las muestras seminales. Algunos autores no encontraron diferencias en la fragmentación entre muestras de semen congeladas y no congeladas14, aunque un trabajo reciente indica un incremento del 10% en roturas de cadena simple en muestras previamente criopreservadas24. Sin embargo, en la literatura encontramos resultados dispares, por ejemplo, algunos trabajos muestran un incremento en el daño del ADN espermático debido a la criopreservación25, mientras que otros estudios sostienen que la congelación no produce ningún efecto26. El principal problema es que muchos de estos estudios están realizados con diferentes técnicas analíticas moleculares, lo cual limita la comparabilidad de los resultados.
Nuestros resultados sobre la dinámica de la fragmentación del ADN espermático (rSDF) concuerdan con lo publicado hasta la fecha, ya que la fragmentación aumenta tras la eyaculación cuando incubamos las muestras de semen a 37°C, y este incremento en la fragmentación es característico de cada individuo10,11,14,15,17,27. Estudios realizados en humanos y otros mamíferos señalan que la rSDF es característica de cada especie11. No obstante, entre individuos de una misma especie también se observan diferentes patrones de rSDF. Este incremento diferencial del daño asociado al individuo puede presentar modelos de crecimiento tanto de tipo exponencial como logarítmico10.
Nuestros resultados coinciden con otros estudios realizados en donantes fértiles, que nos muestran que la rSDF es mayor durante las primeras horas de incubación10. En general, se observa que a medida que aumenta el tiempo de incubación, aumenta la fragmentación de las muestras y la tasa de degradación se atenúa. La rSDF media durante las primeras horas de incubación obtenida en nuestro trabajo es inferior a la publicada en los primeros estudios sobre dinámica10, aunque es similar a la presentada en trabajos posteriores, con valores que oscilan entre el 2-4%/h14,16,28. Un reciente trabajo que estudia la rSDF en varones normozoospérmicos y en donantes obtiene resultados parecidos a los nuestros, con una rSDF media±DE en el intervalo de 0 a 2h de 3,6±2,77 en varones normozoospérmicos, y de 1,6±1,8 en donantes14. Este tipo de discrepancias es asumible si tenemos en cuenta las condiciones de manejo de los espermatozoides en distintos laboratorios. Es decir, la utilización o no de crioprotectores, los crioprotectores utilizados, diferencias en las rampas de temperatura aplicadas para la criopreservación, los cambios en la composición de los diluyentes seminales29 y un largo etcétera de situaciones pueden provocar que la longevidad del ADN presente diferencias incluso dentro del mismo eyaculado. Pero, en general, las tendencias en las que el daño se presenta tras la incubación suelen ser asimilables a nivel de especie11, ligeramente variables para cada individuo dentro de una especie11, y siempre dependientes de las condiciones de manejo de las muestras seminales30.
Cuando comparamos la rSDF en función de la SDF basal de las muestras encontramos diferencias significativas entre los distintos grupos. Durante las 2,5 primeras horas de incubación la rSDF fue mayor en aquellas muestras con SDF superiores al 30% (Grupo III) comparadas con las muestras que presentaron valores basales inferiores al 15% (Grupo I). Podríamos decir que las muestras con mayor SDF basal presentan, además, una menor longevidad de su ADN. En otras palabras, si bien se desconocen las razones últimas de esta realidad, el ADN de individuos que presentan mayores niveles de daño basal es más vulnerable al daño iatrogénico. Nuestros resultados en este sentido concuerdan con trabajos previos donde se compara la rSDF durante las primeras horas de incubación entre pacientes y donantes de semen11,14. Una posible explicación para este efecto reside en el incremento de determinadas enzimas en el medio, a medida que los espermatozoides están más afectados. La enzimas contenidas en el acrosoma tienen características tanto lipolíticas como proteolíticas31, y adicionalmente determinadas ADNasas pueden también canalizar efectos de degradación del ADN espermático32.
A medida que aumenta el tiempo de incubación todos los individuos tienden a homogeneizar los valores de fragmentación. La rSDF media obtenida en nuestro estudio en el intervalo de 0 a 24h es de 1,9±0,8%/h. Este valor es superior al publicado en otros trabajos, que muestran rSDF de 0,55 ±0,25%/h14. Hay que tener en cuenta que en nuestro análisis las muestras fueron incubadas junto con el plasma seminal, lo que puede afectar a la fragmentación final obtenida tras 24h de incubación. Cuando comparamos la tasa de fragmentación en periodos largos de incubación entre los distintos grupos observamos diferencias significativas. En la tasa de fragmentación, en el intervalo de 0 a 24h, el Grupo I (SDF<15%) presenta una tasa de fragmentación significativamente mayor que los Grupos II (SDF entre 15-30%) y III (SDF>30%) (tabla 3). Desde el punto de vista clínico, este fenómeno es interesante, puesto que 2,5h es un tiempo que suele transcurrir desde la obtención de la muestra y su utilización. Parece aconsejable para cualquier clínica que las muestras seminales se utilicen lo más rápido posible tras su obtención, con especial atención a aquellas con alteraciones en la SDF basal. La degradación del ADN se inicia rápidamente tras la eyaculación, por lo tanto, cualquier ligero retraso podría ejercer una influencia negativa sobre el potencial fértil de la muestra. Dado que se considera que individuos que presentan un SDF basal>30% podrían tener mayores dificultades para conseguir un embarazo33, es evidente que las muestras de semen que se utilizan en tratamientos de reproducción asistida, transcurridos una serie de minutos, pueden haber superado estos valores. Según nuestros resultados, un 32% (24/75) de las muestras que presentaban valores de SDF basales inferiores al 30%, transcurridas 2,5h presentaban valores de SDF por encima del 30%. Además, desde un punto de vista clínico, y considerando la importancia de la dinámica de fragmentación, sería muy interesante realizar trabajos similares al presente pero con la muestra capacitada, como ha sido publicado por Caballero Peregrín et al.34, que además se ajustaría mejor a lo que ocurre en realidad en el laboratorio de andrología.
En conclusión, observamos una fragmentación basal media relativamente alta comparada con la facilitada por otros estudios publicados, y corroboramos que la velocidad de fragmentación del ADN espermático es mayor durante las primeras horas tras la eyaculación. Por otra parte, las muestras con fragmentación basal superior a 30% presentan mayor tasa de fragmentación durante las primeras horas de incubación comparadas con muestras con niveles basales inferiores al 15%.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste estudio ha sido financiado por las siguientes entidades: Ministerio de Ciencia e Innovación, Instituto de Salud Carlos III (PI10/00985), Fundación Séneca de la Región de Murcia (08808/PI/08) y proyecto BFU-2013-44290-R.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.