INTRODUCCIÓN
La eclosión asistida (EA) es una técnica que se utiliza en los laboratorios de reproducción asistida con el ánimo de mejorar los resultados en los procesos de fecundación in vitro. La EA consiste en crear, de manera artificial, un orificio en la zona pelúcida del embrión, para facilitar el proceso natural de eclosión. Cohen et al1,2 fueron los primeros en desarrollar esta técnica al observar que los embriones a los que habían realizado la disección parcial de la zona pelúcida, antes de ser transferidos al útero materno, tenían unas tasas de implantación más altas que aquellos a los que no se les había realizado. Desde entonces se han ido definiendo una serie de indicaciones que a continuación se enumeran y detallan.
INDICACIONES
Edad
La tasa de implantación desciende progresivamente a partir de los 37 años haciéndose más evidente más allá de los 40 años. El proceso de envejecimiento ovárico favorece el aumento de alteraciones cromosómicas en el ovocito3,4 que pueden llegar a afectar la habilidad del embrión para eclosionar in vivo e implantar5. Diversos autores recomiendan la EA como técnica para mejorar la tasa de implantación en pacientes ≥ 35 años6. Sin embargo, otros investigadores no encontraron una tasa de implantación mayor cuando se aplicó la técnica en mujeres ≥ 37 años con menos de 3 fallos de implantación7.
Aumento de la hormona folículo estimulante basal sérica
A pesar de las mejoras constantes en los protocolos de estimulación, sigue habiendo bajas tasas de implantación en pacientes que tienen elevada la hormona folículo estimulante (FSH) en el día 3 del ciclo. Esta situación puede afectar tanto al ambiente endocrino, paracrino y autocrino del folículo como a la zona pelúcida del ovocito, comprometiendo posteriormente su desarrollo8. Las pacientes que presentan valores séricos basales elevados de FSH parecen tener una mayor tasa de gestación tras la EA9.
Fallos de implantación
Cuando una paciente ha tenido 2 fracasos de implantación, cualquiera que sea su edad, algunos autores consideran la EA como técnica de ayuda para intentos posteriores, pues favorece la implantación más temprana del embrión en desarrollo al permitir una sincronía más adecuada entre el embrión y el endometrio10.
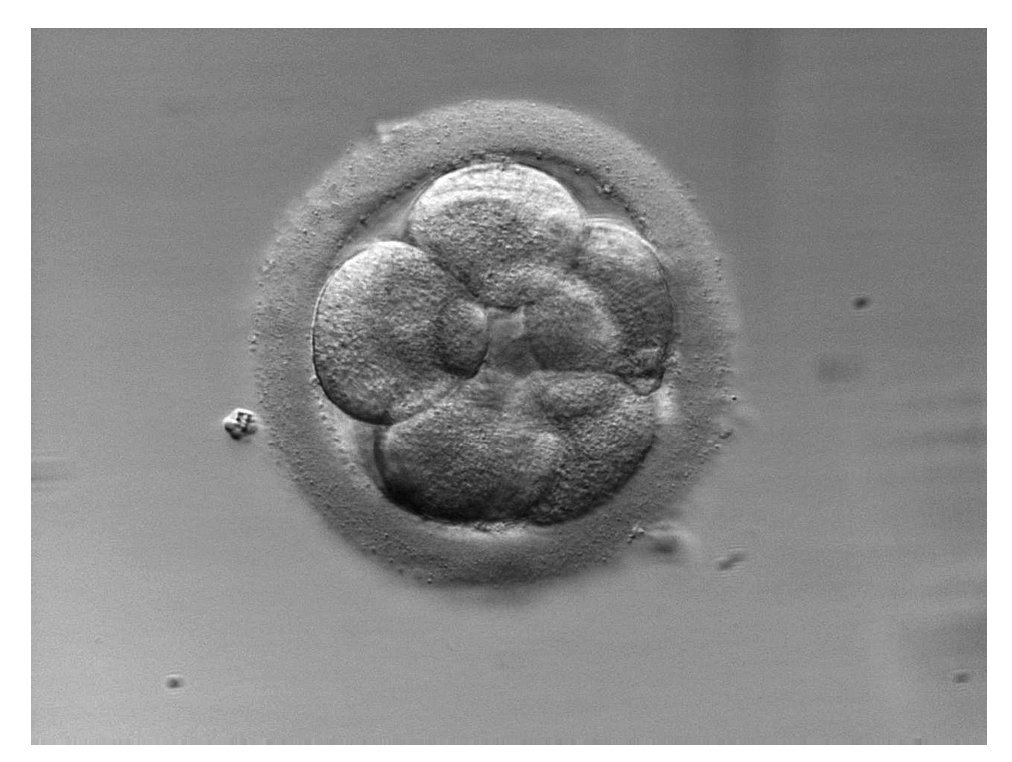
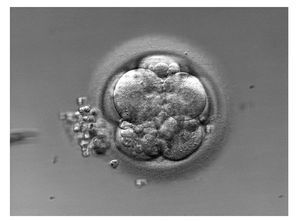
Zona pelúcida engrosada (fig. 1)
El grosor de la zona pelúcida varía durante el desarrollo embrionario, y a partir de las primeras divisiones celulares se adelgaza hasta hacerse una fina capa durante el estadio de blastocisto. El fallo en el proceso de adelgazamiento puede impedir la implantación del embrión11. Se ha propuesto el uso sistemático de la EA cuando el grosor de la zona pelúcida es > 15 µm para facilitar el proceso natural de eclosión al disminuir las necesidades metabólicas del embrión para realizar dicho proceso12. Otros autores sugieren que la técnica mejora de manera importante las tasas de implantación en mujeres añosas con zonas pelúcidas engrosadas, pero no así en mujeres jóvenes13. También se ha observado un efecto perjudicial en la tasa de embarazo cuando se aplica la técnica en embriones con zonas pelúcidas < 13 µm12.
Figura 1. Embrión en día 3 de desarrollo en el cual se observa la zona pelúcida con un grosor > 15 µm.
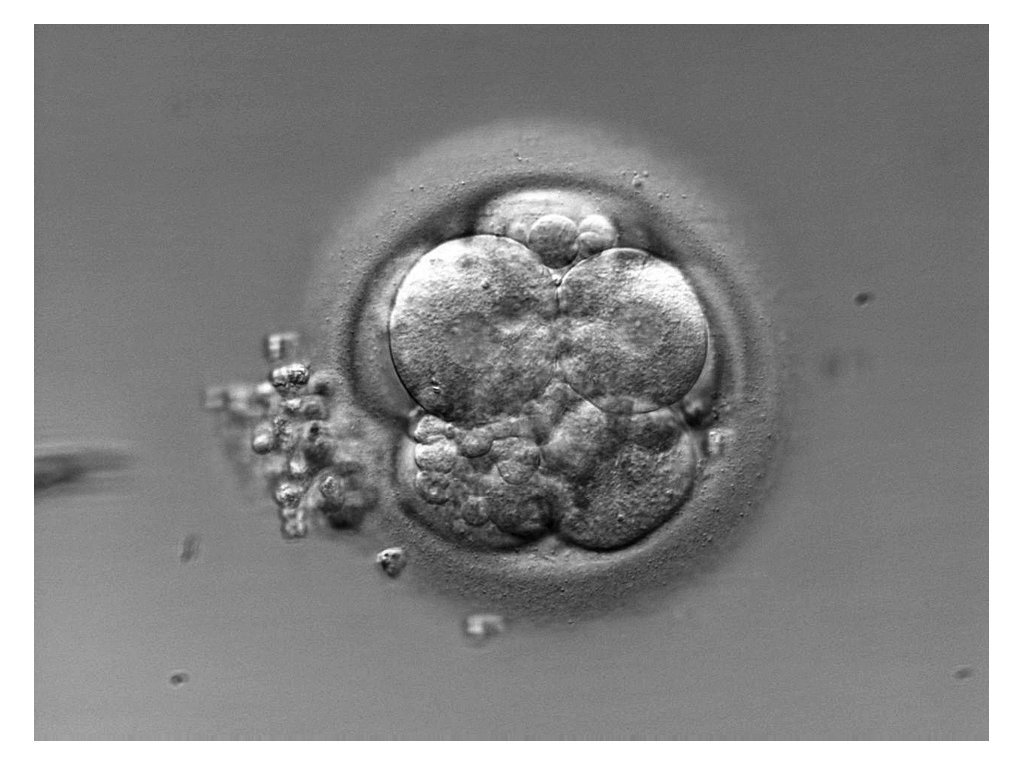
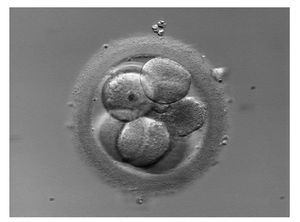
Fragmentación excesiva (fig. 2)
Los fragmentos celulares son porciones de citoplasma carentes de núcleo14 y rodeados de membrana. La mayoría de los fragmentos se forman durante la mitosis, durante las 2 primeras divisiones celulares, y su presencia parece ser común en los embriones humanos15, aunque se desconoce la señal extrínseca o intrínseca que los genera. Aun así, se piensa que cuanto mayor es el grado de fragmentación menor es la capacidad del embrión para realizar una adecuada división celular16. Por tanto, los embriones que muestran menos cantidad de fragmentos se consideran más competentes desde el punto de vista del desarrollo y se les da prioridad para la transferencia17,18.
Figura 2. Presencia de fragmentos de diferente tamaño distribuidos en todo el embrión.
El potencial de implantación de los embriones fragmentados no sólo se determina por el grado de fragmentación sino también por su tamaño y distribución dentro del embrión. Se sugiere la EA, con eliminación de los fragmentos, como medio para restablecer la capacidad de desarrollo en embriones con más del 25% de fragmentos, independientemente de su tamaño y distribución. Con su uso, se restablece la relación espacial de los blastómeros, el contacto entre las células y los planos normales de división del embrión,
dando lugar a la formación de blastocistos de mejor pronóstico19 a la luz de los conocimientos actuales acerca de diferentes tipos de uniones celulares en las células centrales y en la periferia. Sin embargo, otros piensan que cualquier embrión fragmentado no logrará restablecer su capacidad de desarrollo aunque se aspiren dichos fragmentos, ya que ciertos patrones de fragmentación pueden estar relacionados con la pérdida parcial o total de proteínas reguladoras necesarias para el desarrollo del embrión20.
Criotransferencia
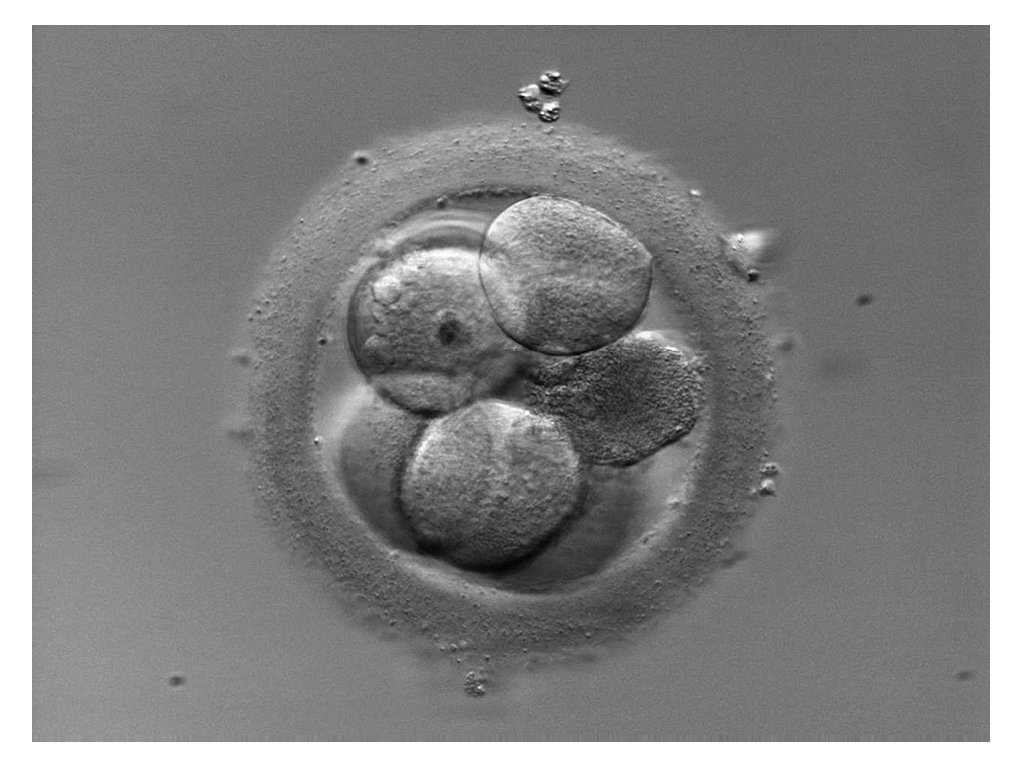
Las tasas de embarazo e implantación en transferencias de embriones criocongelados son habitualmente bajas comparadas con las de embriones en fresco. El endurecimiento de la zona pelúcida21 junto con la presencia de blastómeras lisadas tras el proceso de congelación y descongelación llega a comprometer la viabilidad embrionaria (fig. 3). Mediante la EA se consigue restablecer la capacidad de desarrollo e implantación en estos embriones una vez descongelados22-25.
Figura 3. Lisis celular en un embrión descongelado. La célula dañada presenta un aspecto picnótico.
En un estudio prospectivo realizado por nuestro equipo26 se evaluó la eficacia de esta técnica en embriones en día 3 de desarrollo descongelados, eliminando el material degenerado y transfiriendo únicamente 2 embriones para evitar el embarazo múltiple. En todos los embriones transferidos se consiguió eliminar la mayor parte de los fragmentos dejando como máximo un 10% en su interior. Los resultados dieron unas tasas de embarazo e implantación por transferencia del 42,8 y del 21,4%, respectivamente, siendo éstas muy superiores a los resultados obtenidos en el último Registro Nacional de Centros efectuado por la Sociedad Española de Fertilidad, que reflejan una tasa de embarazo global por transferencia del 25,3%27.
Sin embargo, hay autores que no encuentran ningún beneficio con el uso sistemático de la técnica al no encontrar diferencias significativas en las tasas de embarazo, embarazo múltiple e implantación al comparar los resultados con un grupo control28. Estos resultados podrían deberse a que no eliminan el material lisado de los embriones descongelados, pudiendo afectar posteriormente a la degeneración secundaria de células sanas adyacentes.
ASPECTOS TÉCNICOS
En la bibliografía hay descritos varios métodos para la realización de la EA (mecánicos, químicos, con láser) e incluso para el adelgazamiento de la zona pelúcida29. Los laboratorios que utilizan estas técnicas, usan uno u otro método dependiendo de la experiencia del embriólogo que lo realiza y la disponibilidad técnica. En cualquier caso, el proceso requiere mucho cuidado en su ejecución para que no se produzca la lisis de alguna de las células del embrión y reste posibilidades de éxito. Además, se ha valorado si la EA provocaba algún efecto perjudicial en los embriones y se ha demostrado que la técnica no sólo aumenta la tasa de implantación sino que además no afecta en la tasa de anomalías cromosómicas en los nacidos vivos6.
En un estudio prospectivo y aleatorizado30 que comparaba los métodos mecánicos y el láser dio como resultado una tasa de implantación significativamente más alta en el grupo del láser, además de una tasa de embarazo a término mayor, aunque no significativa. Puede que el método mecánico, aunque fácil de ejecutar, no de muy buenos resultados debido a que el pequeño orificio que se crea por la aguja de disección produzca la posterior estrangulación del blastocisto cuando intenta eclosionar1. Otro método mecánico, con resultados prometedores es el piezomicromanipulador, que consiste en un sistema de vibración de alta frecuencia que adelgaza o rompe la zona pelúcida. Sin embargo, su inconveniente principal es que al igual que el láser es un método costoso31.
En otro estudio también prospectivo y aleatorizado32 donde se evaluó el método químico con ácido de Tyrode y el láser en el desarrollo del blastocisto, ambos métodos dieron un resultado similar al no encontrar diferencias significativas en la proporción de blastocistos obtenidos. El método químico, aunque requiere entrenamiento previo, tiene la ventaja de estar al alcance de cualquier laboratorio33, pero hay que tener cuidado con el ácido pues se corre el riesgo de que un volumen excesivo dañe alguna célula de los embriones. Por otro lado, el láser endurece el área de la zona pelúcida expuesta34 pudiendo dificultar la posterior aspiración de los fragmentos. Sin embargo, las ventajas de utilizar el láser frente al ácido de Tyrode son la velocidad y la precisión en su ejecución, no es tóxico y puede que se constituya como método de elección al reducir la experiencia técnica necesaria para llevarla a cabo. En otras palabras, puede estandarizar una técnica que actualmente no está normalizada.
En la bibliografía tampoco hay datos que nos sugiera el día adecuado para realizar la EA. De hecho, la mayoría de los centros la realiza instantes antes de efectuar la transferencia, es decir, en día 3 de desarrollo embrionario. A nuestro juicio, al realizar la técnica en el día 2 de cultivo, se corre el riesgo de que pueda salir alguna célula, al no estar todavía establecida en este estadio la adhesión celular. Y por otro lado, si se efectúa en el día 5 o 6 de cultivo, se puede dañar alguna célula cercana a la zona pelúcida del blastocisto, comprometiendo su desarrollo.
Varios estudios relacionan el tamaño del orificio en la zona pelúcida con el incremento de la frecuencia de gemelos monocigóticos35,36, por lo que se aconseja no realizar aberturas muy pequeñas que puedan causar la herniación del blastocisto. Tampoco son recomendables las aberturas muy grandes ya que se corre el riesgo de la salida de algún blastómero que comprometa la capacidad de desarrollo del embrión.
Aún no está claro si la eliminación de fragmentos y células lisadas permite restablecer la capacidad de desarrollo de los embriones de peor pronóstico. Posiblemente, la experiencia del embriólogo que la lleva a cabo es esencial ya que no ejecutarla con extremo cuidado puede dañar alguna de las células sanas del embrión.
VALORACIÓN ACTUAL
En un estudio multicéntrico, prospectivo y aleatorizado37, donde se valoró la eficacia de la técnica, no se encontró ningún beneficio en ninguna de las indicaciones anteriormente descritas, pero se llegó a la conclusión de que sería necesario fortalecer los criterios de selección de los pacientes para evaluar la eficacia de la técnica.
Por otro lado, en un metaanálisis38 donde se examinó si la EA mejoraba las tasas de embarazo y niño nacido sano, y si favorecía el embarazo múltiple y el aborto, se llegó a la conclusión de que aunque la técnica mejoraba significativamente las probabilidades de embarazo clínico y la tasa de niño nacido sano, no hay suficientes evidencias para recomendar la EA como técnica de rutina. También se observó que la técnica no incrementa la tasa de embarazo múltiple.
Actualmente, debido a los diferentes métodos utilizados, los distintos criterios de selección de pacientes y embriones, el reducido número de casos incluidos en los estudios, y el escaso número de embriólogos entrenados en este procedimiento, resulta muy difícil valorar los resultados entre los distintos grupos. Sería necesario estandarizar la metodología y los criterios de inclusión para establecer el beneficio verdadero de esta técnica.
Correspondencia:
Dr. J.M. Moreno García.
Unidad de Reproducción. Clínica Vistahermosa.
Avda. de Denia, 103. 03015 Alicante. España.
Correo electrónico: lab@urvistahermosa.com