COMPONENTES DE LA RESPUESTA SEXUAL
El término respuesta sexual (RS) fue introducido en la obra pionera, homónima, de Masters y Johnson1. Con éste se designa el conjunto de cambios psicofisiológicos asociados con la realización de actos sexuales. Comprende un conjunto de cambios físicos que afectan a la totalidad del organismo (por lo que la RS se considera un paradigma de "respuesta integrada" fisiológica2), así como mentales, que incluyen alteraciones del estado de conciencia y percepciones sensoriales generalmente muy placenteras, lo que suele reforzar poderosamente la motivación para repetir la experiencia.
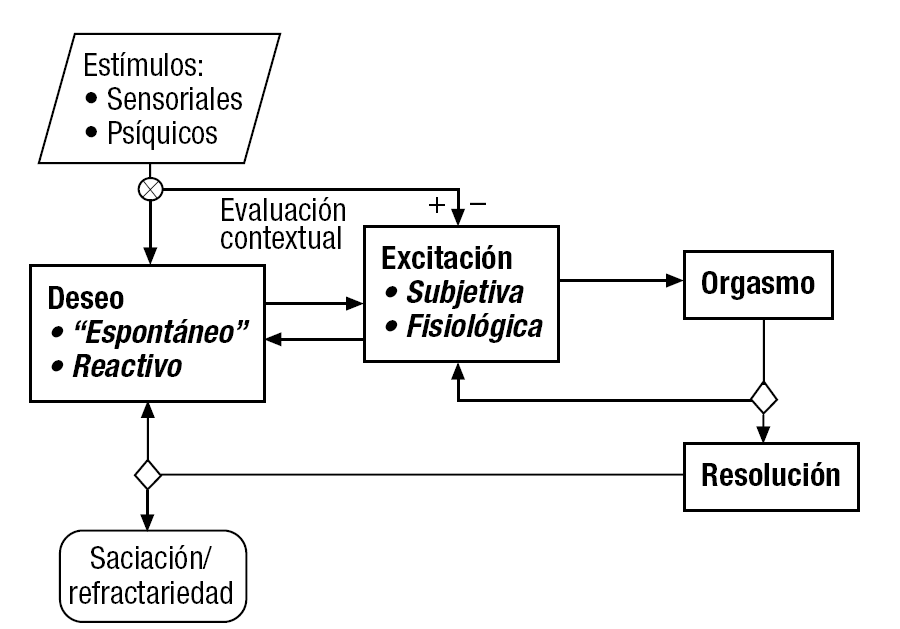
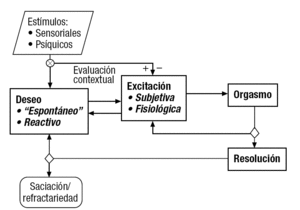
La RS suele describirse, en la actualidad, tras abandonar los primitivos modelos lineares, como una secuencia cíclica de etapas o fases características: deseo; excitación, y orgasmo (y la fase de resolución que le sigue), cuyos mecanismos interactúan, reforzándose o inhibiéndose recíprocamente (fig. 1)3. Esta distinción tiene utilidad clínica, pues muchos trastornos de la RS y/o sus tratamientos psicológicos, farmacológicos o quirúrgicos, afectan primariamente y de modo relativamente selectivo a alguno de estos componentes.
Figura 1. Esquema operativo del ciclo de la respuesta sexual femenina. Frente a los modelos clásicos (como los de Masters y Johnson o Kaplan), que describen sus fases como etapas que se suceden en una secuencia lineal, en la actualidad se prefiere el tipo de interpretación "circular" del estilo de la que se resume en el presente diagrama de flujo3. Se pretende resaltar la influencia recíproca entre las distintas fases del ciclo de la respuesta sexual. Así, la reacción de excitación, especialmente en su modalidad subjetiva, que puede ser consecuencia o no (ya que puede precederlo) del estado de deseo, suele reforzar a éste a modo de feedback positivo. También se señala el hecho de que la presentación de una determinada fase no requiere necesariamente la precedente. Por ejemplo, una estimulación sensorial intensa puede producir excitación y hasta orgasmo sin que haya deseo, o incluso cuando exista aversión, lo que puede tener implicaciones psicológicas y legales importantes. Los rombos de decisión tras el orgasmo simbolizan el que éste puede seguirse de la fase de resolución o del retorno a la de excitación que conduzca a una o varias experiencias orgásmicas adicionales antes de entrar en la fase de resolución.
Se llama deseo, libido o apetito sexual al estado mental de atención a estímulos eróticos y motivación, para responder a ellos para gratificarse, que precede la realización de actos sexuales y/o la acompaña. Tiene componentes cognitivos y afectivos, además de un sustrato neurohormonal2,4. Puede presentarse de modo "espontáneo" o bien "reactivo"5; se llama así cuando se produce en respuesta a diversos estímulos sensoriales y otras incitaciones por parte de la pareja, incluida la propia excitación fisiológica inducida de modo reflejo, en un contexto de afecto positivo. Dicho fenómeno es más frecuente y relevante en la mujer, particularmente en el contexto de una relación prolongada y de buena calidad afectiva que en el varón5,6. A su vez, en la excitación sexual se distinguen ahora 2 componentes: los cambios fisiológicos, que se describen posteriormente, y la excitación subjetiva que motiva tratar de intensificar la estimulación sexual y desarrollar completamente el ciclo de la RS.
La RS fisiológica propiamente dicha conlleva una serie de cambios neurofisiológicos, hemodinámicos y hormonales; los más pronunciados y específicos tienen lugar en los órganos genitales, por lo que se comentan con más detalle.
SINOPSIS DE LA ESTRUCTURA Y FUNCIÓN BASAL DE LOS ÓRGANOS GENITALES FEMENINOS IMPLICADOS EN LA RESPUESTA SEXUAL
Vagina
Es un conducto aplanado en forma de sigmoide alargada, cerrado en su extremo superior por el fondo vaginal posterior a 8-10 cm del orificio vulvar; en la pared anterior, más corta (1-2 cm menos) se inserta el cuello del útero. Su sección transversal, de unos 2-3 cm de ancho, tiene forma de "H" o "W", de modo que sus superficies luminares anterior y posterior se tocan, por lo que, en su estado quiescente, su luz constituye una cavidad virtual. Las paredes vaginales son muy distensibles, lo que hace válido el viejo aserto de que "la capacidad de la vagina se mide por las dimensiones del cuerpo extraño que se inserte en ella"7. En su porción inferior, la cara posterior y los bordes laterales están rodeados por los potentes músculos del suelo pélvico, y es especialmente importante la rama pubovaginal del componente pubococcígeo del músculo elevador del ano. Su cara anterior se encuentra en contacto, en la porción más profunda, con la vejiga urinaria; entre ambos órganos se interpone la fascia de Halban; en la mitad más externa, se relaciona íntimamente con la uretra que, de hecho, discurre prácticamente en todo su trayecto embebida en la pared vaginal anterior.
Las paredes vaginales están formadas, en su mayor parte, por una túnica de fibras musculares lisas y elásticas, que le confieren su gran distensibilidad; está recubierta por una serosa que contacta con los órganos y las cavidades que la circundan. La superficie interna de la pared vaginal está tapizada por un epitelio estratificado escamoso no queratinizado, de 10 a 20 células de espesor en continua descamación y cuya renovación desde la capa basal es estimulada potentemente por los estrógenos. Entre el epitelio y la capa muscular se encuentra una capa de tejido conjuntivo (lámina propia), ricamente vascularizada y con abundantes capilares. La lámina propia posee, además, terminaciones nerviosas, fundamentalmente de tipo vasomotor, con relativa abundancia de neurotransmisores, como el péptido intestinal vasoactivo (VIP), el péptido histidina metionina (PHM), el neuropéptido Y (NPY), el óxido nítrico (NO), etc.8. Además, en su segmento inferior, y especialmente en la pared anterior, posee una importante inervación sensorial que, junto con la de la uretra y la fascia de Halban, confiere a esta zona una mayor sensibilidad erótica, por lo que recibe la denominación de "complejo erótico de la pared anterior"9, expresión que parece más apropiada que la tan popular, como inexacta, "punto G". Cabe señalar, sin embargo, que un estudio reciente no ha detectado diferencias en la densidad de la inervación de distintas zonas de la vagina humana10. El epitelio y la lámina propia forman una serie de pliegues transversales (rugae), más prominentes en el segmento inferior, que se atenúan considerablemente tras la menopausia, por el cese del estímulo estrogénico.
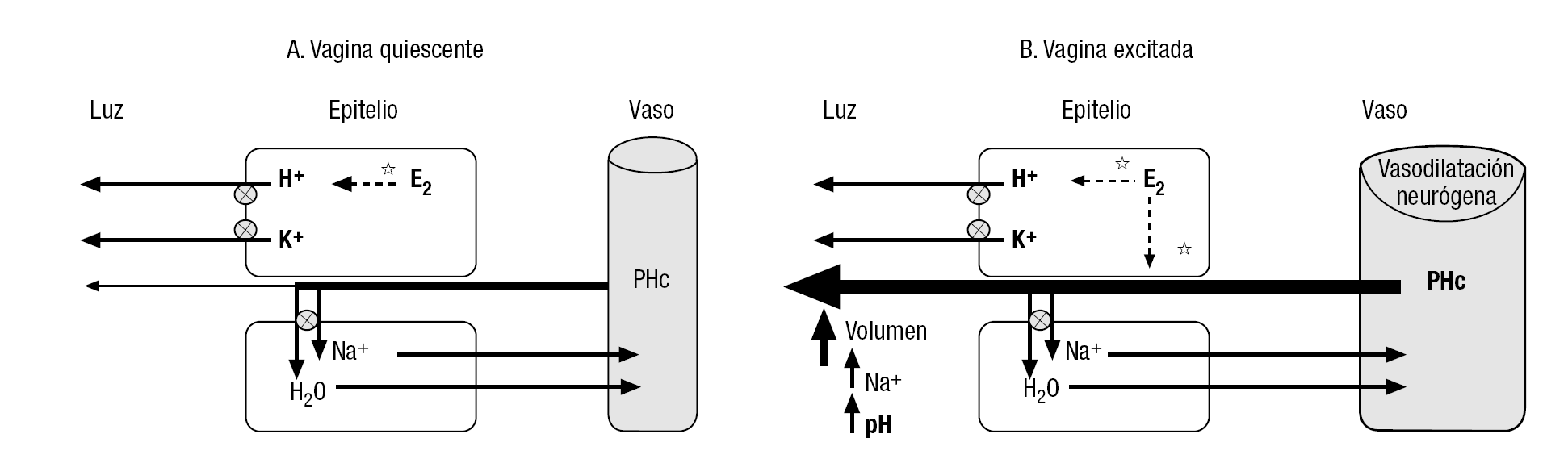
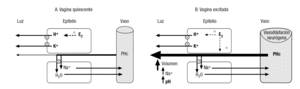
Aunque tanto la vagina como el cuello uterino carecen por completo de formaciones glandulares, la superficie vaginal está humedecida por una película de líquido formada, en su mayor parte, por un trasudado del plasma sanguíneo procedente de los lechos capilares de la lámina propia (fig. 2A). La composición iónica de este líquido se modifica al atravesar el epitelio vaginal: se reabsorbe parte del Na+ (lo que limita la salida de agua hacia la luz) y se añade K+. De este modo, las concentraciones de estos iones en el líquido vaginal, en ausencia de excitación sexual, corresponden, respectivamente, a la mitad y a unas 5-6 veces la del plasma9. La capacidad de transferencia de líquido a través del epitelio vaginal es facilitada por los estrógenos; disminuye tras la menopausia y parece ser mediada por el NO, cuyas enzimas productoras abundan en el epitelio vaginal. El líquido de humidificación vaginal, en ausencia de excitación, tiene también una elevada concentración de H+ (pH de 3,5 a 4,5) durante todo el ciclo, en las mujeres premenopáusicas, excepto durante la regla, en que se asemeja al plasmático por la presencia de sangre y otros productos de la descamación endometrial9. Este ambiente ácido de la vagina joven le confiere protección frente a bacterias coliformes y levaduras. Tradicionalmente, se ha atribuido a la actividad de lactobacilos anaerobios (p. ej., Döderlein) presentes en la luz vaginal, que fermentarían el glucógeno contenido en las células descamadas. Sin embargo, estudios recientes han documentado una importante actividad de bombeo de protones (por una H+-ATPasa) en la membrana apical (luminar) de las células de los epitelios vaginal y cervical, estimulada por los estrógenos11 y que disminuye tras la menopausia, y por ello se acompaña de aumento del pH vaginal (considerado clínicamente como signo de atrofia). Está por dilucidar cuál de los 2 mecanismos es más importante para mantener la acidez fisiológica de la vagina. Al líquido de humectación vaginal de reposo se añaden también las secreciones mucosas producidas por el epitelio columnar del cuello vaginal, lo que le confiere un tacto sedoso.
Figura 2. Mecanismos de transferencia de líquido a través de la pared vaginal. La presión hidrostática en los capilares (PHc) de la lámina propia determina que una parte del plasma, desprovisto de proteínas, salga fuera de ellos y atraviese el epitelio vaginal adyacente. A) En ausencia de excitación, las células epiteliales modifican significativamente la composición de este ultrafiltrado plasmático: reabsorben parte del Na+ (acompañado por agua, lo que reduce el volumen de líquido extravasado a la vagina) y le añaden K+ y H+ (acidificando la vagina). B) Durante la excitación sexual, la intensa vasodilatación inducida por los nervios vasomotores produce un gran aumento de la PHc, lo que fuerza una mayor salida de líquido fuera de los capilares, con lo que se excede la capacidad de reabsorción del epitelio (que permanece constante). El abundante líquido de lubricación vaginal tiene ahora una composición más parecida a la del plasma. Los estrógenos (E2) contribuyen a estos procesos de diversas formas (líneas de puntos): estimulan el bombeo de H+ hacia la luz vaginal y aumentan la capacidad de transferencia de líquidos del epitelio.
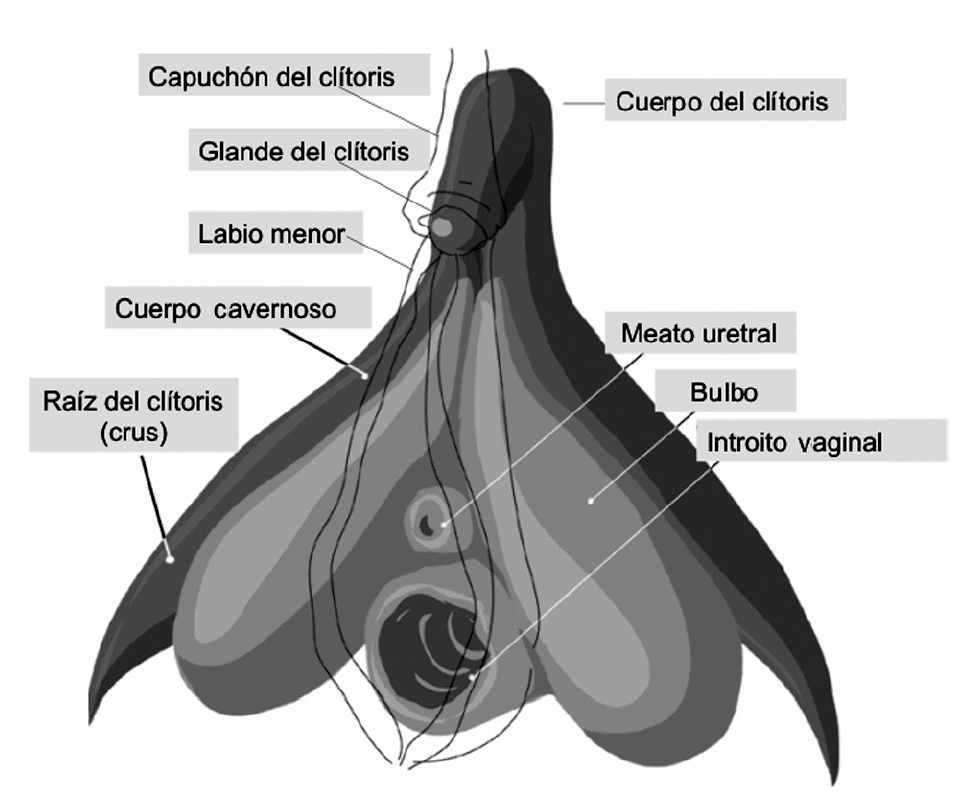
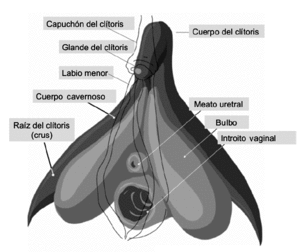
La pirámide erótica vulvar
Se puede llamar así al conjunto de forma aproximada de poliedro piramidal, cuyo vértice más alargado se sitúa bajo la sínfisis pubiana, constituido por el clítoris, los bulbos vestibulares (o bulbos del clítoris), los labios menores y las porciones distales de la vagina y la uretra (fig. 3). Estas estructuras tienen en común 2 importantes características: a) una rica vascularización, con densas redes capilares y, en algunos de ellos, espacios sinusoidales, que le permiten acomodar una importante cantidad de sangre, base de su aumento de volumen durante la RS, y b) una importante inervación sensorial, con receptores al tacto y la vibración que les hace especialmente sensibles a la estimulación erótica. Hay, sin embargo, diferencias entre ellos en cuanto a la estructura exacta del referido tejido vascular y la densidad de inervación sensorial, como se comentan posteriormente.
Figura 3. Componentes de la "pirámide erótica vulvar".
El clítoris consta de un cuerpo de 2-4 cm de longitud, con sección longitudinal a modo de "V" invertida; esta forma se debe a la fijación de su mitad posterior a la sínfisis pubiana y la línea blanca abdominal por medio del ligamento suspensorio que lo rodea7,12. Está formado fundamentalmente por 2 cuerpos cavernosos adosados, cada uno envuelto en una túnica albugínea fibrosa que se fusiona en la línea media formando un septo (tabique pectiniforme), que separa ambos cuerpos, aunque tiene interrupciones en algunos puntos que permiten la comunicación entre ellos. En el tejido subcutáneo, por encima de la cara dorsal de los cuerpos cavernosos, discurren los gruesos nervios dorsales del clítoris (sensitivos), las ramas terminales del nervio pudendo interno; aunque dan algunas ramificaciones finas a la dermis que cubre la superficie de los corpora, donde terminan en corpúsculos de Pacini, la mayor parte de sus fibras terminan en el interior del glande. En su extremo posterior, bajo la sínfisis púbica, los cuerpos cavernosos se separan lateralmente y continúan en las 2 raíces o crura, de unos 5-9 cm de longitud, fijados al borde inferior de las ramas isquiopubianas y cubiertos por los músculos isquiocavernosos. Cada cuerpo cavernoso está formado por un tejido trabecular (eréctil) envuelto en una túnica albugínea fibroelástica relativamente gruesa, aunque bastante menos que la de los corpora penianos, lo que, sumado a la ausencia (también a diferencia de éstos) de un plexo venoso subalbugíneo, hace que, a diferencia del pene, en el clítoris no se llegue a producir rigidez13. Por lo demás, el tejido eréctil del clítoris es similar al del pene, y está formado por un entramado de espacios vasculares intercomunicados (sinusoides o lagunas), donde desembocan las arteriolas derivadas de las arterias cavernosas, que son drenados hacia la superficie por vénulas comunicantes. Las paredes o trabéculas de los sinusoides están formadas por músculo liso, fibras colágenas y elásticas, y un revestimiento endotelial. En las trabéculas se encuentran terminaciones nerviosas de los nervios cavernosos (procedentes del plexo vaginal), que utilizan neurotransmisores vasoactivos, como NO (más abundante), VIP, etc.14,15.
El glande del clítoris envuelve al extremo anterior, cerrado, de los corpora. Es la porción anterior y más visible de esta estructura, aunque, en ausencia de excitación, suele estar cubierto por la fusión del extremo anterior de los labios menores (capuchón o prepucio del clítoris). Las dimensiones del glande son, en las nulíparas, de unos 2-4 mm de ancho y de 3-5 mm de diámetro anteroposterior, aunque aumentan de tamaño en el embarazo16. El glande contiene también tejido de tipo eréctil, aunque en menor proporción que en el cuerpo y los crura. En el glande hay más proporción de músculo liso entre los espacios lacunares, por lo que son de menor volumen que en los corpora clitorídeos. Otra diferencia con las trabéculas cavernosas es que en las del glande parece predominar la forma endotelial de la sintasa del NO (eNOS), mientras que en los corpora abundaría más la forma neuronal (nNOS)15 (una relación similar se da entre las estructuras homólogas del pene). Entre este tejido eréctil y el epitelio del glande se encuentra una gruesa capa dérmica, que ocupa buena parte del volumen del órgano, que es especialmente prominente en las regiones dorsal, lateral y en la punta, formando una especie de gruesa cúpula que envuelve el núcleo de tejido eréctil. Esta capa dérmica está repleta de elementos neurales17; de hecho, contiene la mayor densidad de receptores de presión, tacto y vibración (corpúsculos de Pacini, Meissner, Dogiel-Krause, terminaciones libres, etc.)18 de todo el tracto genital, tanto femenino como masculino, lo que está en la base de la exquisita sensibilidad erótica de esta zona. El desarrollo del cuerpo y el glande del clítoris, al igual que el del pene (ambas estructuras se derivan del tubérculo genital), es estimulado por los andrógenos. Por ello, los estados hiperandrogénicos, congénitos o adquiridos, pueden llevar a un crecimiento exagerado del clítoris (clitoromegalia).
Los bulbos vestibulares o, como se ha propuesto llamarles más apropiadamente, bulbos del clítoris, son 2 estructuras globulares ligeramente aplanadas, situadas entre los crura y el meato uretral, en la profundidad de los labios menores y cubiertos por los músculos bulboesponjosos (o constrictores vulvares). Sus dimensiones suelen ser de 3-7 cm de longitud, 1-2 cm de altura y 1 cm de diámetro transversal, aproximadamente. Por delante, convergen llegando a unirse (comisura bulborum) entre el meato uretral y el cuerpo del clítoris, al que suelen fijarse por medio de una red vascular. Todavía se debate acerca de si los bulbos (cuerpos esponjosos) se continúan o no con el glande del clítoris (como ocurre en el pene), o bien ambas estructuras están totalmente separadas, y los escasos datos reales (sustanciados con imágenes anatómicas e histológicas) publicados son bastante contradictorios: unos demuestran19 y otros niegan17 su existencia. Probablemente, reflejen variaciones anatómicas entre sujetos, a las que pueden haber contribuido diferentes grados de exposición previa a los andrógenos. La extensión posterior de los bulbos es muy variable; en algunos casos, se prolongan por los lados de casi todo el introito vaginal y, en otros, terminan al comienzo del extremo anterosuperior de éste. Por debajo y por dentro del extremo posterior de los bulbos, y en estrecho contacto con ellos, se encuentran las glándulas vestibulares de Bartholin (equivalentes a las glándulas de Cowper masculínas). Los bulbos están recubiertos de una capa de tejido conjuntivo mucho más delgada aún que la túnica albugínea de los corpora del clítoris, lo que permite su mayor expansión durante la excitación sexual. Están formados por tejido trabecular (eréctil), con espacios lacunares, como en el clítoris, aunque los de los bulbos suelen ser mayores y sus trabéculas, más delgadas. Por todas estas similitudes estructurales e íntimas relaciones anatómicas, actualmente se tiende a considerar que los bulbos forman parte integrante del clítoris; de ahí el término señalado anteriormente de bulbos del clítoris17,20.
Los labios menores, la porción más externa de la vagina, y la uretra tienen ricos plexos vasculares. Por ello, aunque no llegan a formar verdadero tejido eréctil (formaciones de tipo sinusoide)17, la dilatación de los referidos vasos permite su considerable congestión y aumento de volumen durante la RS.
En la superficie interna de la uretra, y drenando hacia su luz (glándulas uretrales), así como por fuera de ella (glándulas parauretrales de Skene, con orificios de salida laterales al meato urinario), se encuentran formaciones glandulares homólogas a la próstata masculina; en ambas se encuentra el mismo tipo de marcadores específicos de dicho órgano (antígeno prostático específico [PSA], fosfatasa ácida, etc.)14,21. Su desarrollo es muy variable; indetectable en unas mujeres, en otras puede ser bastante notable, y llegar a producir durante la RS una descarga perceptible de su contenido.
CAMBIOS FISIOLÓGICOS ASOCIADOS A LA RESPUESTA SEXUAL
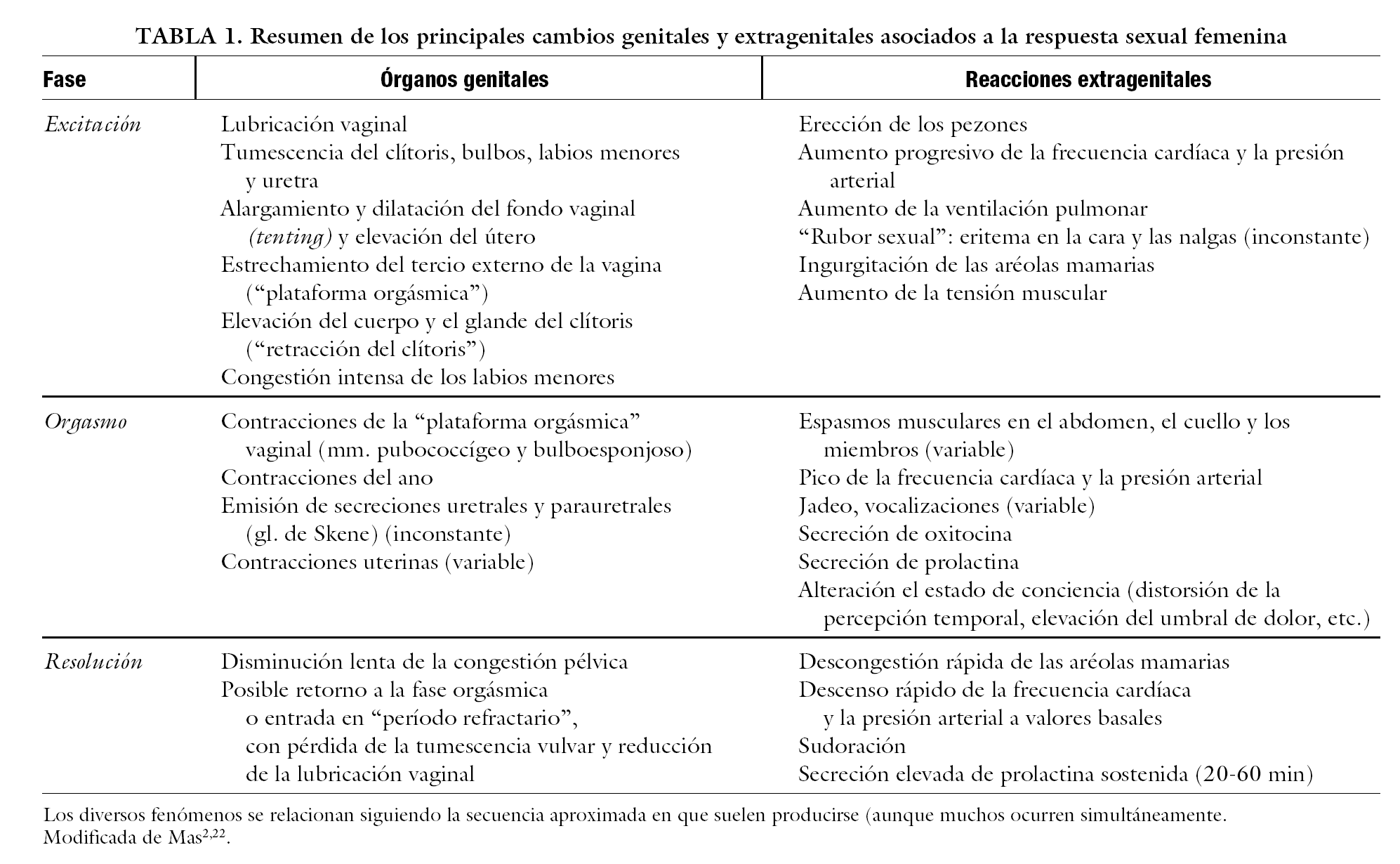
Los más destacables en la mujer se resumen en la tabla 1. Para una discusión más amplia y referencias adicionales, así como su comparación con los fenómenos propios del varón véanse los trabajos de Mas4,22.
Cambios fisiológicos en los genitales
Excitación
La fase de excitación se caracteriza por un considerable aumento del aporte sanguíneo a los órganos genitales, debido a su vasodilatación. Ello se traduce en la erección del clítoris, que llega a duplicar su volumen, y la vasocongestión de la vagina y el conjunto de la pirámide vulvar descrita anteriormente23. Ello determina el aumento de tamaño y dilatación de la vulva, así como la lubricación vaginal (fenómenos todos ellos equivalentes a la erección del pene en el varón). Estos cambios se han objetivado mediante registros fisiológicos diversos, que incluyen la medición de la temperatura de los labios menores, la disipación de calor (por el flujo sanguíneo) en electrodos de O2 precalentados aplicados a la superficie de la vagina y los labios, la fotopletismografía vaginal (medida de la fracción de luz reflejada por la pared vaginal tras su emisión por una sonda colocada en su interior), así como visualizado, cuantificándose, mediante técnicas de ultrasonografía-Doppler color y de resonacia magnética dinámica9,24.
La respuesta de lubricación vaginal (fig. 2B), manifestación característica de la excitación sexual, ocurre rápidamente desde su inicio (en pocos segundos en mujeres jóvenes y en 2-4 min en maduras). El líquido de lubricación vaginal se forma por la trasudación a través de las paredes de la vagina de plasma sanguíneo procedente del plexo vascular subepitelial intensamente dilatado. El aumento de volumen del trasudado lleva a que pronto se sature la limitada capacidad de reabsorción de Na+ por el epitelio vaginal, de modo que mayores cantidades de este ión escapan hacia la luz, lo que arrastra un volumen mayor de agua, con lo que aumenta la lubricación. El líquido vaginal producido durante la excitación sexual se asemeja, así, más al plasma en cuanto a su concentración de electrolitos y pH. La utilidad fisiológica de este fenómeno es facilitar la penetración y los movimientos del pene dentro de la vagina, así como neutralizar el pH vaginal (cuyo valor basal se mantiene normalmente ácido, como se ha mencionado anteriormente), lo que facilitaría la supervivencia de los espermatozoides que allí se depositasen. Aunque la producción de este fenómeno no es imprescindible para la viabilidad espermática, como lo prueba que muchas mujeres quedan embarazadas en coitos en los que no ha habido reacción de excitación sexual (ya que el semen contiene sus propios sistemas amortiguadores), en sujetos con una capacidad amortiguadora reducida en el plasma seminal, el mecanismo de neutralización del pH por la lubricación vaginal puede ser relevante, y su ausencia, contribuir a la subfertilidad en algunas parejas. Cuando cesa la excitación, la reducción de la vasodilatación permite que el bombeo de Na+ por el epitelio pueda retirar lentamente este ión y el agua acompañante de la luz vaginal, con lo que se restaura la composición de reposo5,9. La función de transferencia de líquidos a través del epitelio vaginal es estimulada por los estrógenos24, lo que contribuye a explicar la disminución de la capacidad de lubricación tras la menopausia.
Las glándulas exocrinas del tracto urogenital también aumentan su secreción durante la excitación sexual de modo relevante (aunque no contribuyen significativamente al líquido de lubricación vaginal). Al igual que en el varón la próstata y las vesículas seminales aumentan su actividad secretora y contribuyen a formar la mayor parte del volumen del ulterior eyaculado, en la mujer, las glándulas uretrales y parauretrales, equivalentes a la próstata, aumentan también su secreción durante la excitación lo que, en aquellas que las tengan más desarrolladas y/o estimuladas, puede llevar a que su expulsión sea perceptible durante el orgasmo. Se trataría de la célebre, y debatida aunque bien documentada en algunos casos, "eyaculación femenina"25. Las glándulas de Bartholin aumentan también su secreción (de pequeño volumen), lo que contribuye a la lubricación del introito vulvar (aunque no de la vagina).
Cuando la fase de excitación se encuentra muy avanzada, la congestión del plexo vascular de la pared vaginal lleva al engrosamiento conspicuo del tercio externo de ésta, formando lo que Masters y Johnson1 llamaron "plataforma orgásmica", por cuanto se explica posteriormente. Otro fenómeno de la fase de excitación avanzada, también descrita por dichos autores mediante visualización endoscópica1 y posteriormente confirmado por registros con resonancia magnética26, es el de la elevación del útero y el estiramiento hacia arriba de la pared posterior de la vagina (tenting), que se observa tanto si hay penetración como si la excitación se produce por estimulación del clítoris. Se suele atribuir a la contracción de la musculatura lisa presente en los ligamentos cardinales y sacrouterinos, que por su disposición anatómica tiran del cuello uterino y la porción superior de la vagina hacia arriba y los lados5. Combinado con la mencionada ingurgitación de la porción más externa de las paredes de la vagina, confiere a ésta una forma de botella invertida, lo que podría facilitar la retención del semen que se depositara en ella.
Orgasmo
El orgasmo se caracteriza por contracciones intermitentes tanto de la musculatura lisa de los órganos genitales como de la esquelética. En la mujer, la contracción rítmica (8-12 veces) de los músculos estriados del suelo de la pelvis (que en el varón da lugar a la expulsión eyaculatoria), particularmente la pubovaginal, hace estrecharse intermitentemente las paredes de la porción más externa de la vagina (son las contracciones de la "plataforma orgásmica" que describieran Masters y Johnson1); el ano se contrae también sincrónicamente. La pérdida de tono de los músculos del suelo pélvico, además de predisponer a problemas como incontinencia urinaria y prolapsos, afecta también a la intensidad y placer de la RS. Por el contrario, se han descrito efectos beneficiosos en la función sexual del fortalecimiento mediante ejercicios de Kegel27, aunque otros estudios no lo han confirmado. En algunos de los orgasmos estudiados en el laboratorio se han registrado también contracciones uterinas; cuando ocurren, suelen asociarse a una sensación más placentera. Es importante subrayar que los referidos cambios fisiológicos característicos de la respuesta orgásmica femenina parecen ser esencialmente similares cualquiera que sea el modo de lograrla (estimulación del clítoris, penetración vaginal, etc.).
Resolución
La fase de resolución consiste en el retorno a los valores funcionales iniciales, con reducción de la vasocongestión pélvica y relajación muscular. Se acompaña de un "período refractario", durante el que es difícil inducir una nueva RS1. Dura varios minutos y se alarga progresivamente con la edad. Este fenómeno es más característico en el varón. En la mujer, se pueden producir estados similares de refractariedad, especialmente tras orgasmos muy intensos. Sin embargo, tras el orgasmo femenino, con frecuencia se regresa a un nivel todavía alto de excitación sobre el que se pueden superponer sucesivos orgasmos si persiste la estimulación ("respuesta multiorgásmica").
Cambios extragenitales
La actividad sexual se acompaña también de cambios somáticos generales y psíquicos a veces muy intensos. Muchos de ellos son bastante inespecíficos y se combinan los propios del ejercicio con los de activación neurovegetativa asociados a la respuesta de estrés. Así, durante la excitación se produce un aumento progresivo de la presión arterial, la frecuencia cardíaca y la ventilación pulmonar, hasta alcanzar su máximo en el orgasmo, y decae rápidamente después de éste28. También suele producirse una reacción de sudoración de intensidad variable. La utilidad fisiológica de la mayoría de estos cambios parece clara; permiten, por ejemplo, aumentar el aporte de sangre y oxígeno a los órganos genitales o disipar calor.
Se han descrito también variaciones en los valores plasmáticos de diversas hormonas asociadas a la RS femenina. Los más documentados son los aumentos de oxitocina durante el orgasmo29 y de prolactina, durante y después de éste28, observados en ambos sexos.
Hay importantes cambios psíquicos y sensaciones usualmente muy placenteras, de gran variabilidad entre los distintos individuos y según las situaciones. Estas sensaciones, aunque focalizadas especialmente en los genitales, pueden extenderse a otras partes del cuerpo. Se producen alteraciones de la percepción sensorial, y es característica la elevación de los umbrales de percepción dolorosa en diversas partes del cuerpo que ocurre durante la excitación sexual intensa y, especialmente, en el orgasmo30. Durante éste se altera también la percepción temporal: los sujetos suelen describir su percepción subjetiva de la duración de éste como bastante inferior (a veces, la mitad) a la registrada simultáneamente en el laboratorio31. La experiencia orgásmica conlleva, pues, una alteración característica del estado de conciencia, descrita como una desconexión temporal con la realidad externa inmediata que puede llegar, en casos extremos, hasta la pérdida de conciencia.
MECANISMOS VASCULARES DE LA RESPUESTA SEXUAL
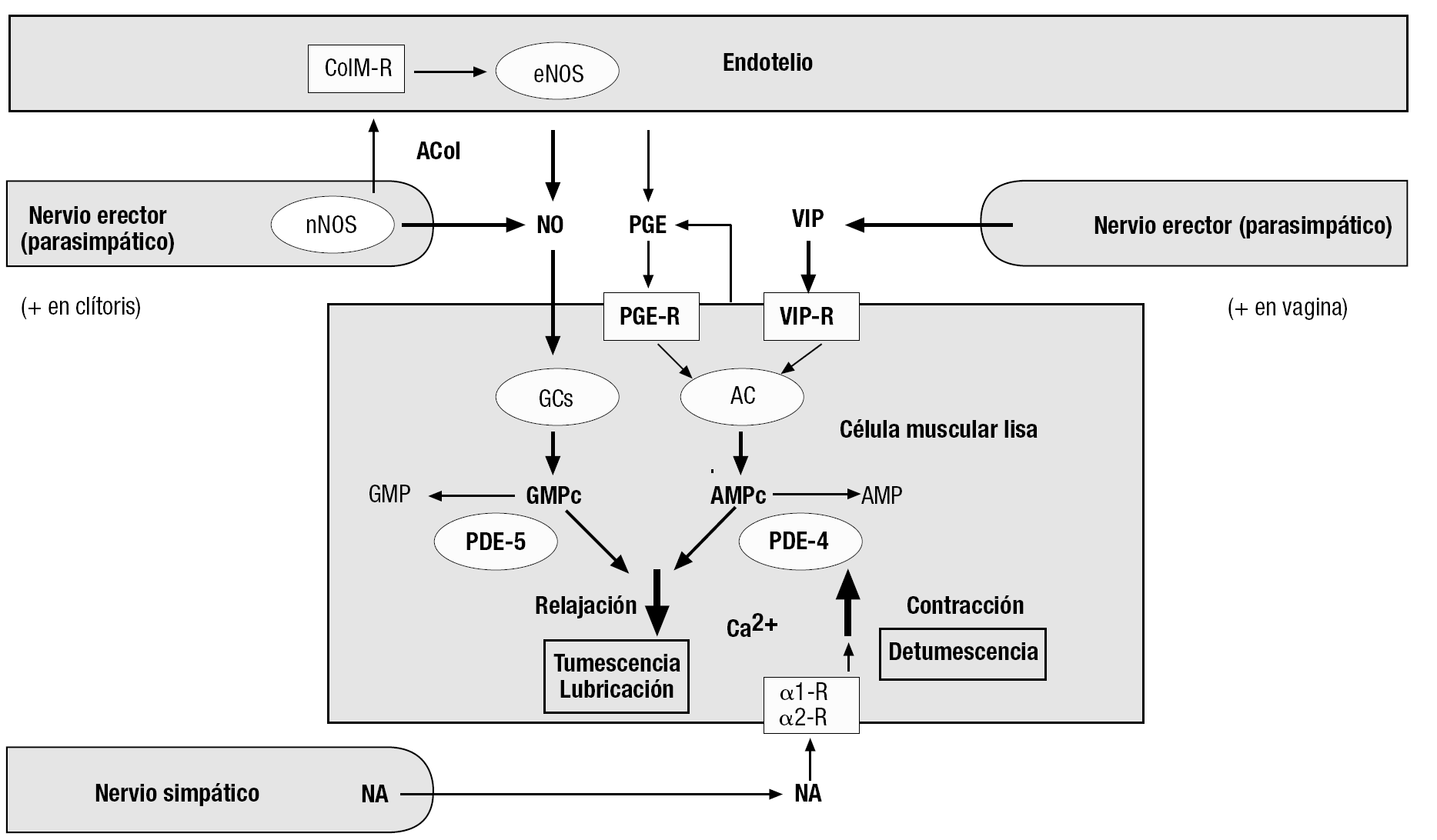
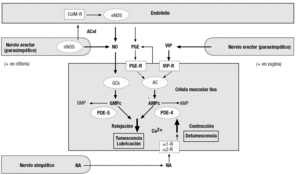
El aumento de aporte sanguíneo a los sinusoides de los órganos eréctiles (clítoris y bulbos), y al plexo vascular de las paredes vaginal y uretral, y al interior de los labios menores, característico de la fase de excitación, es consecuencia de la relajación de las células musculares lisas de las trabéculas y/o las arteriolas que los irrigan. La regulación de su actividad contráctil se hace mediante fibras nerviosas posganglionares parasimpáticas y simpáticas, presentes en las trabéculas y las paredes de las arteriolas, que actúan coordinadamente con las células endoteliales adyacentes (fig. 4). Así, las células musculares lisas de los tejidos eréctiles y los vasos sanguíneos que los irrigan están sometidos a la influencia de numerosos mediadores químicos de origen neural, paracrino y autocrino. Su balance determina el de mensajeros intracelulares del que, a su vez, depende el nivel de Ca2+ en el citosol de las células musculares que, a su vez, determina y el estado de contracción o de relajación. En la figura 4 se ofrece un resumen de las más documentadas hasta ahora en los tejidos eréctiles femeninos. La concentración intracitosólica de Ca2+ aumenta en respuesta a la estimulación de receptores como los a-adrenérgicos (por la noradrenalina secretada por los nervios simpáticos); la contracción resultante se traduce en detumescencia. Por el contrario, la concentración de Ca2+ en el citosol disminuye cuando aumentan los valores intracelulares de nucleótidos cíclicos, como los de guanosina (GMPc) y adenosina (AMPc). Esto conlleva la relajación del músculo liso y la consiguiente entrada de sangre (tumescencia). El NO liberado por los nervios erectores y el endotelio en el clítoris15 y la vagina32,33 activa una guanilato ciclasa soluble presente en el citosol de sus células musculares lisas, estimulando la producción de GMPc. La producción de AMPc aumenta tras la activación de diversos receptores de membrana acoplados a la adenilato ciclasa, como los del péptido intestinal vasoactivo (VIP), secretado también por los nervios erectores, particularmente en la vagina, donde parece ser el principal neuromediador de la reacción de lubricación, y de las prostaglandinas E (PGE), de producción paracrina y/o autocrina en el propio tejido eréctil. Así, la aplicación tópica de PGE1 sobre la superficie del clítoris tiene un eficaz efecto erectogénico en éste34, lo que es congruente con la alta efectividad mostrada por dicha sustancia en producir la erección del pene cuando se administra mediante inyección intracavernosa o por vía intrauretral. Igualmente la aplicación de PGE1 en forma de crema vaginal a mujeres con disfunción sexual se ha mostrado eficaz en mejorar su respuesta de lubricación35.
Figura 4. Esquema de las principales señales inter e intracelulares, cuya intervención en el control de la actividad contráctil del músculo liso de los tejidos eréctiles de la mujer está mejor documentada hasta el momento. En el clítoris, parece predominar la transmisión nitrérgica, mientras que en la vagina abundan más las terminaciones nerviosas VIPérgicas, a las que se atribuye un papel principal en la vasodilatación (y consecuente lubricación) de este órgano. Neurotransmisores: ACol: acetilcolina; NA: noradrenalina; NO: óxido nítrico, VIP: péptido intestinal vasoactivo. Las prostaglandinas E parecen ser liberadas por el endotelio y/o las propias células musculares lisas. Los receptores se representan como rectángulos. α1-R, α2-R: receptores adrenérgicos; ColM-R: receptor colinérgico muscarínico; PGE-R: receptor de prostaglandinas E; VIP-R: receptor de VIP. Las enzimas se representan como elipses. AC: adenilato ciclasa; eNOS: NO sintasa endotelial; GCs: guanilato ciclasa soluble; nNOS: NO sintasa neuronal; PDE-4: fosfodiesterasa tipo 4; PDE-5: fosfodiesterasa tipo 5.
Los mencionados nucleótidos cíclicos vasodilatadores son inactivados por diversas fosfodiesterasas (PDE). Las PDE4 y PDE5, relativamente abundantes en la vagina36, hidrolizan respectivamente AMPc y GMPc. La inhibición farmacológica de estas enzimas mantiene elevados los valores intracelulares de dichos nucleótidos cíclicos, y facilita y prolonga las respuestas eréctiles y de lubricación vaginal. La disfunción eréctil del varón se suele tratar eficazmente mediante la inhibición selectiva de la PDE5, con fármacos efectivos por vía oral, como el sildenafilo, el tadalafilo y el vardenafilo. La acción proeréctil de estos fármacos se debe a que prolongan la vida del GMPc que se haya producido fisiológicamente por la vía NO-guanilato ciclasa, al inhibir su degradación. Su espectacular éxito en los varones llevó a que pronto se intentasen utilizar estos fármacos en la disfunción sexual femenina. Los estudios controlados, indispensables, dado el considerable efecto placebo observado con estos tratamientos, muestran que, aunque este tipo de fármacos aumenta efectivamente el flujo sanguíneo vaginal o clitorídeo en mujeres expuestas a estímulos eróticos, en la mayoría de las usuarias ello no se suele acompañar de una mayor satisfacción sexual36,37, lo que ilustra la complejidad de la RS femenina.
MECANISMOS NEURALES DE LA RESPUESTA SEXUAL
La RS es el resultado de una sucesión de reflejos neurovegetativos y somáticos, modulados a su vez por multitud de factores que incluyen desde los valores sanguíneos de diversas hormonas hasta procesos cognitivos y estados emocionales. Todo ello es regulado por el sistema nervioso38,39.
Los órganos genitales femeninos están inervados por las 2 grandes divisiones del sistema nervioso autónomo. Las fibras simpáticas proceden del plexo hipogástrico y tienen su origen en la columna intermedia lateral de la médula espinal toracolumbar (T11-L2); su actividad produce vasoconstricción de los órganos eréctiles y la vagina. Las fibras parasimpáticas, originadas en los niveles medulares sacros S2-S4, forman los nervios pélvicos o erectores, cuya actividad produce, mediante la liberación de NO y VIP (fig. 4), vasodilatación de los órganos eréctiles y lubricación vaginal.
El nervio pudendo (raíces S2-S4) proporciona la principal inervación somatomotora a los músculos estriados que participan en la respuesta orgásmica (pubovaginal, bulboesponjoso, isquiocavernoso, esfínter anal, etc.). Este nervio lleva también las principales fibras sensitivas de la región genital, que adquieren su mayor densidad en el glande del clítoris, lo que lleva a que su grado de sensibilidad a la estimulación vibrotactil sea similar al del dorso de la mano y muy superior al del dorso del pie40. Por otra parte, como se apuntó anteriormente, la inervación sensorial de la vagina no es uniforme, y es más densa en el tercio externo y, especialmente, en la pared anterior41 que, junto a los también ricamente inervados tejidos periuretrales y fascia de Halban, se traduce en la mayor sensibilidad erótica de esta región vaginal a su estimulación táctil o de presión42.
Hay también pruebas convincentes, obtenidas en estudios neurofisiológicos y de neuroimagen funcional, de la transmisión por el nervio vago de señales procedentes del cuello del útero, cuya estimulación por presión produce sensaciones genitales e incluso orgasmo en mujeres con lesiones medulares completas por encima del nivel torácico43.
Se dispone ya de datos en humanos obtenidos con técnicas funcionales de formación de imágenes (la llamada "neuroimagen funcional"), en cambios de actividad en áreas cerebrales discretas en relación con la RS. Así, se han descrito cambios en el flujo sanguíneo regional de diversas regiones cerebrales, como indicador de su actividad metabólica, en sujetos expuestos a estímulos audiovisuales eróticos y durante el orgasmo39,44. Para ello, se han utilizado técnicas de tomografía de emisión de positrones (PET) y de resonancia magnética funcional (RMf) (en mujeres sólo se ha empleado esta última). Se ha mostrado que durante la estimulación erótica se producen aumentos de actividad en zonas límbicas, como la región anterior de la circunvolución del cíngulo (involucrada en la expresión emocional y el control neurovegetativo), la ínsula-claustro (percepción e integración de sensaciones viscerales), los ganglios basales (núcleos caudado y accumbens) (procesos apetitivo-motivacionales) y diversas áreas corticales (procesamiento cognitivo). Las mujeres mostraron una menor activación que los varones en áreas como el hipotálamo45 y la amígdala46, aun cuando su grado de excitación sexual subjetiva inducida llegase a ser similar47, lo que sugiere un procesamiento diferente por ambos sexos de los estímulos eróticos.
Por el momento, hay pocos registros de neuroimagen funcional obtenidos durante el orgasmo en mujeres. Los mejor documentados son los realizados en mujeres parapléjicas, con lesiones medulares relativamente altas, que se autoestimulaban mecánicamente el cuello uterino43. Su estudio con RMf muestra que, a medida que progresa la estimulación sexual, se va produciendo la activación progresiva de la corteza cingular, la amígdala, los ganglios basales y la ínsula. Al alcanzar el orgasmo se añade la activación del hipotálamo, el hipocampo y el cerebelo. Además, la aplicación de presión sobre el cuello uterino produjo la activación del núcleo bulbar del tracto solitario, relevo sensorial del nervio vago, lo que prueba la implicación de este nervio como vía de transmisión de sensibilidad vaginocervical43. Es previsible que en un futuro próximo aumente considerablemente la información acerca de los correlatos cerebrales de la función sexual femenina.
INFLUENCIAS HORMONALES
A la función sexual humana se le reconoce un importante soporte hormonal; especialmente por parte de los esteroides gonadales2,4. Así, desde hace tiempo se conoce el papel fundamental de los estrógenos en el manteniendo del estado trófico de la vagina y su capacidad de respuesta a estímulos sexuales, con una eficiente vasodilatación y un aumento de lubricación5,9, y se ha comentado en las secciones precedentes.
El papel de los andrógenos en la función sexual femenina es más controvertido. En el varón, está bien establecido que los andrógenos testiculares (fundamentalmente, testosterona) contribuyen de modo importante a promover el deseo sexual y al mantenimiento del estado funcional de los tejidos eréctiles. En la mujer, hay muchos datos que indican un papel similar de los andrógenos, tanto en estimular el apetito sexual como en el desarrollo y mantenimiento de parte de los órganos sexuales más relevantes para la RS, como el clítoris. Por otra parte, hay algunos estudios que cuestionan la acción facilitadora del deseo sexual femenino atribuida a los andrógenos. Las discrepancias pueden deberse a las dificultades que supone su estudio, por diferencias de diseño y variadas características de las mujeres evaluadas (jóvenes normales, premenopáusicas disfuncionales, menopausia inducida, menopausia natural, etc.), a las limitaciones técnicas, para medir fiablemente unos valores sanguíneos de testosterona considerablemente inferiores (de 10 a 20 veces) a los de los varones, al desacuerdo en cuáles son los indicadores bioquímicos de actividad androgénica más idóneos, etc.37,38. Por esto, el debate permanece abierto y se están desarrollando diversas investigaciones que serán objeto de una discusión más amplia en el artículo siguiente49.
Entre otros tipos de hormonas que pueden contribuir a modular la función sexual cabe destacar la prolactina. A su elevación postorgásmica, comentada anteriormente, se le ha atribuido el fenómeno del "período refractario" durante la fase de resolución28,50. Por otra parte, la hiperprolactinemia con frecuencia se acompaña de disminuciones del apetito sexual, en varones y mujeres, aunque es difícil discernir si el efecto se debe al propio aumento de prolactina o al hipogonadismo secundario frecuente en esta enfermedad.
Correspondencia:
Dr. M. Mas.
Facultad de Medicina. Campus de Ciencias de la Salud.
38071 La Laguna. Tenerife. España.
Correo electrónico: mmas@ull.es