Los carcinomas de la corteza suprarrenal son tumores poco frecuentes y agresivos, con mal pronóstico. Las neoplasias oncocíticas son una variante excepcional de carcinomas de la corteza suprarrenal y raramente se encuentran en la glándula suprarrenal. Por lo general, son benignas y no funcionantes. Presentamos el caso de un carcinoma adrenocortical oncocítico, secretor de testosterona, en una mujer de 37 años de edad que presenta acné, hirsutismo y ciclos menstruales irregulares. Las investigaciones clínicas revelaron una testosterona y DHEA-S elevadas, así como una masa de 11×8cm dependiente de la glándula suprarrenal izquierda. Se decide adrenalectomía izquierda. La histología mostró la presencia de una tumoración compuesta de células oncocíticas con citoplasma granular y eosinófilo, características compatibles con un carcinoma oncocítico. Durante el seguimiento se lleva a cabo una nueva TAC, a los 2 meses de la intervención, que revela la presencia de metástasis pulmonares. En estos casos la cirugía está asociada con un aumento de la supervivencia, incluso en la enfermedad metastásica. Por ello, debe ser considerada, en pacientes adecuadamente seleccionados, como parte de un tratamiento multimodal. La quimioterapia citotóxica y el uso de mitotane se han utilizado con un grado de beneficio variable, con escasas respuestas a largo plazo. Posteriormente, llevamos a cabo una revisión de la literatura, con la intención de resaltar y resumir los aspectos más significativos de su epidemiología, clínica, diagnóstico, pronóstico y tratamiento.
Adrenocortical carcinoma is a rare and aggressive cancer and its prognosis is frequently unsatisfactory. Oncocytic neoplasms are an exceptional variant of adrenocortical carcinoma and most rarely found in the adrenal gland. They are usually benign and non-functioning. We present a case of a testosterone-secreting oncocytic adrenocortical carcinoma in a 37-year-old female who presented with acne, hirsutism and irregular menses. Clinical investigations revealed an elevated testosterone and DHEA-S and a 11×8cm left adrenal mass. The tumour was successfully excised. Histopathological result of adrenal mass showed the tumour to be comprised of oncocytic cells with granular, eosinophilic cytoplasm, features consistent with an oncocytic carcinoma. However, follow-up computed tomography at 2 months after the left adrenalectomy revealed lung metastasis. Surgery is associated with improved survival, even in metastatic disease. Therefore, surgery should be considered for select patients as part of multimodality treatment. Cytotoxic chemotherapy and mitotane have been utilized with a variable degree of benefit and few long-term responses. Then we deal with a literature review to highlight and summarize most significant aspects of epidemiology, clinical, diagnosis, prognosis and therapy.
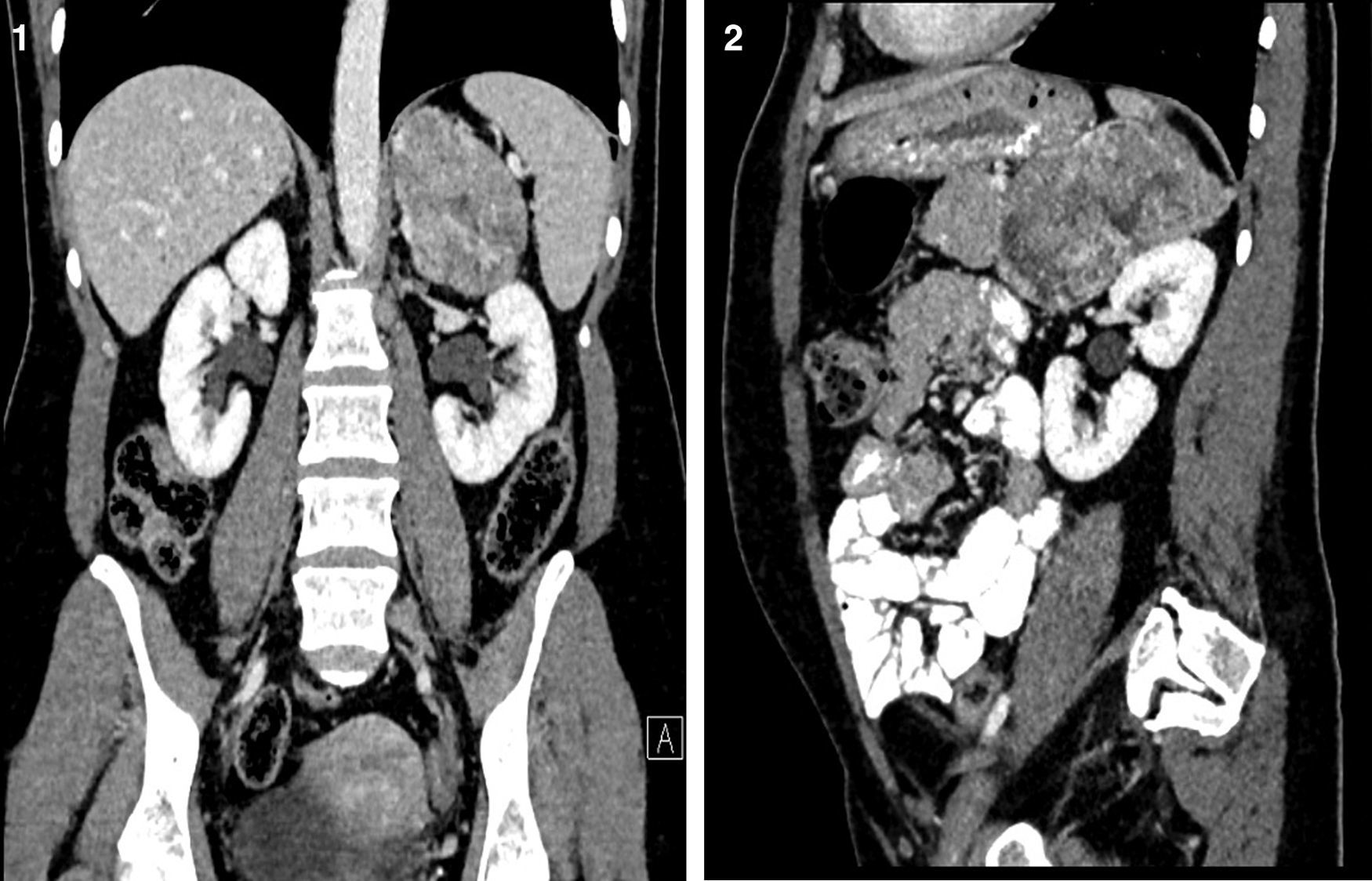
Mujer de 37 años de edad, remitida a nuestro servicio de urología desde medicina interna y cirugía general para la valoración de una lesión suprarrenal izquierda descubierta de manera incidental, en un estudio de imagen abdominal, a raíz de amenorrea e hipertricosis de más de un año de evolución. La paciente refiere, a su vez, la presencia de hormigueos faciales y en el cuello y, de manera ocasional, cefaleas y visión borrosa, así como pérdida de peso durante este período de tiempo. A la exploración se aprecian edemas generalizados, más marcados en los miembros inferiores, así como distribución marcada de vello en el abdomen, el tórax, los brazos y las piernas, con lesiones eritematosas en el tórax, los antebrazos y el abdomen. La inspección abdominal puso de relieve una gran masa en el hipocondrio izquierdo, firme y de consistencia dura, dolorosa a la palpación profunda. La ecografía abdominal muestra una gran masa sólida en el polo superior del riñón izquierdo, redondeada hipoecoica. La TAC reveló esta gran masa dependiente de la glándula suprarrenal izquierda, con unos diámetros anteroposterior-transverso-craneocaudal de 93×61×68mm. La lesión era heterogénea con áreas hipodensas en su interior, en relación con necrosis y márgenes irregulares (figs. 1 y 2). En su margen anterior perdía plano graso de separación con la cola del páncreas; en su margen superior con el bazo, y en su margen inferior con el polo superior del riñón, por lo que no se pudo descartar la infiltración de estas estructuras. Además, se apreciaban nódulos pulmonares milimétricos bilaterales de aspecto inespecífico que, dados los hallazgos visualizados, no pudieron descartarse como metastásicos.
Mediante punción aspiración con aguja fina de 22G, guiada por ecografía, se obtiene material que se extiende en cristales y es analizado por el anatomopatólogo. El resultado histológico es de una muestra citológica con elementos tumorales compatibles, con origen en glándula suprarrenal. El aspecto global de la celularidad analizada es compatible con neoplasia de origen suprarrenal. Se valora la inmunoexpresión de Melan-A, inhibina y calretinina.
Es valorada por el servicio de endocrinología, que solicita valoración hormonal. Los resultados analíticos confirman unos valores de testosterona de 572,50ng/dl y DHEAS-S de 545,2ug/dl.
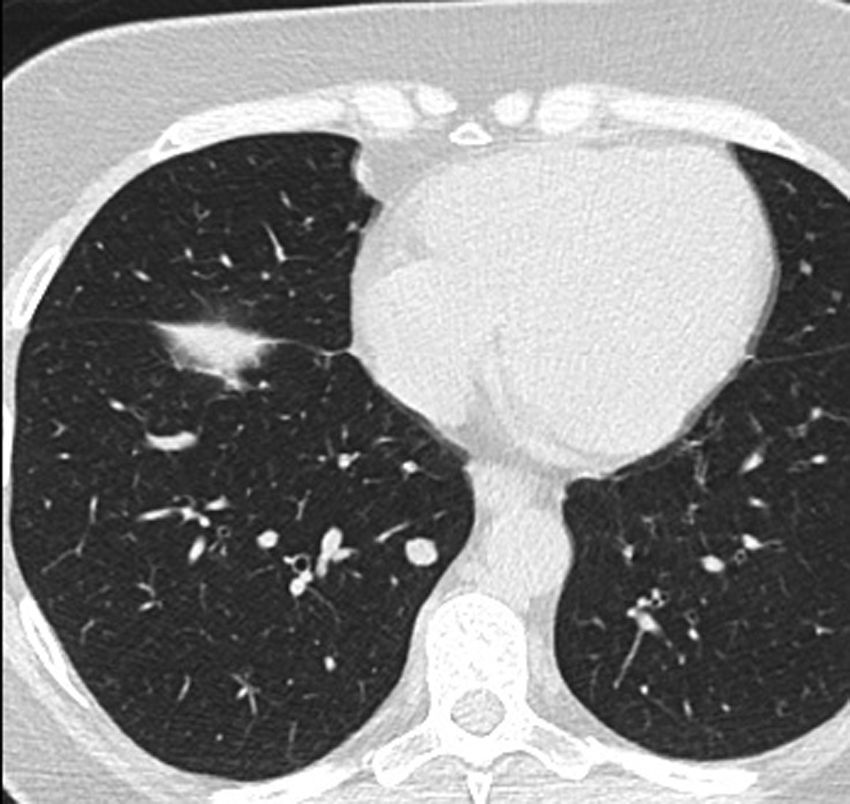
Tras ello, se decide, en el comité de tumores multidisciplinar, adrenalectomía izquierda vía abdominal, descartando la vía laparoscópica por las dimensiones de la lesión. El resultado histopatológico confirmó carcinoma adrenocortical oncocítico que infiltra el tejido adiposo adyacente, de 11,5cm de diámetro máximo. Se utiliza la European Network for the Study of Adrenal Tumors staging system para la estadificación de la lesión (tabla 1), quedando encuadrada en un estadio iii. La nueva analítica, al mes de la intervención, ofrece unos niveles de testosterona de 68,07ng/dl y DHEA-S de 165,9ug/dl. Al segundo mes de la intervención se solicita una nueva TAC donde se confirma el aumento de los nódulos pulmonares y la aparición de uno nuevo (fig. 3), así como adenopatías retroperitoneales patológicas, no visibles en la TAC previa, e implantes tumorales peritoneales de nueva aparición. Por este motivo, vemos preciso solicitar PET-TAC, hallándose lesiones hipermetabólicas en la fosa suprarrenal izquierda (posibles restos tumorales) con afectación linfática retroperitoneal, pequeño implante y afectación metastásica pulmonar bilateral.
Con todos estos datos, nuevamente, se decide en el comité de tumores multidisciplinar, el inicio de tratamiento con mitotane 500mg (de inicio 2g diarios aumentando progresivamente)+doxorrubicina 40mg/m2 el día 1, etopósido 100mg/m2 días 2, 3 y 4 y cisplatino 40mg/m2, los días 3 y 4, cada 30 días. Estrecho control en consulta de oncología para manejo de posibles efectos secundarios con aceptable tolerancia, por lo que se mantiene actitud terapéutica prevista. Las cefaleas remiten con paracetamol, así como las náuseas vespertinas que no ceden con Primperan®. Se aprecia una caída progresiva de vello corporal y continúa amenorreica.
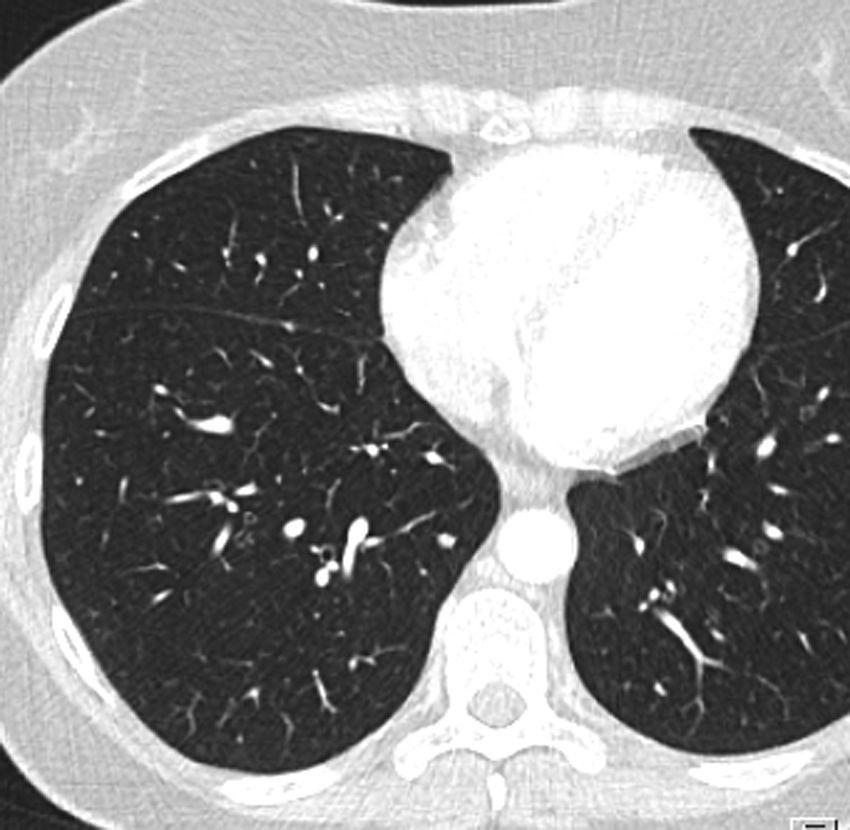
Al quinto mes de la intervención continúa con el tratamiento pautado, advirtiendo marcada disminución de vello en la cara, los brazos y las piernas. Aparece rash dérmico localizado en la zona del cuello. El estudio hormonal revela testosterona en 208ng/dl y DHEA-S de 65,38ug/dl. En la TAC se parecia respuesta parcial, no visualizándose adenopatías mediastínicas ni hiliares de tamaño significativo. Hay una disminución del tamaño de los nódulos pulmonares, así como de las adenopatías retroperitoneales y de las lesiones nodulares en la fosa suprarrenal izquierda (fig. 4). En estos momentos, y debido al beneficio obtenido, se acuerda mantener mitotane y suspender la quimioterapia.
TC de tórax (con ventana para estudio del parénquima pulmonar) 5 meses tras la cirugía, tras 3 meses de tratamiento sistémico. Se pone de manifiesto respuesta parcial al tratamiento según RECIST 1.1. En la imagen se muestra disminución del tamaño del nódulo pulmonar basal derecho representado en la figura 3.
En estos momentos continúa con mitotane 500mg (dosis 5-4-4), con valores hormonales estables, leves molestias abdominales y náuseas sin vómitos, persistiendo la ausencia de menstruación.
Revisión de la literaturaLa prevalencia de incidentalomas suprarrenales oscila entre el 3-5%, con una frecuencia cada vez mayor en la edad avanzada1. Por el contrario, el carcinoma de corteza suprarrenal (ACC) es una neoplasia muy poco frecuente, con una incidencia de 0,5-2/1 millón de habitantes/año2. En ausencia de enfermedad metastásica o invasión local, la sospecha de ACC se basa en el tamaño y la apariencia radiológica del tumor, recomendando las directrices actuales la extirpación quirúrgica de aquellos incidentalomas suprarrenales de más de 4cm. Se ha demostrado una alta incidencia de ACC en las tumoraciones corticales mayores de 8cm (sensibilidad y especificidad del 77% y 95% respectivamente)3. Por otra parte, una gran serie revela que el diámetro medio de ACC es de 12cm, lo que sugiere que la gran mayoría de los pacientes presentan tumores grandes. Por tanto, podemos afirmar que el factor pronóstico más importante es el estadio tumoral en el momento del diagnóstico. Para su clasificación usamos el sistema de estadificación de los tumores adrenales de la European Network4.
Debido a la ausencia de síntomas en estadios iniciales de la enfermedad, alrededor del 70% de los pacientes son diagnosticados en estadio iii o iv. En una serie europea5 las tasas de supervivencia a 5 años fueron del 60% para el estadio i, del 58% para el estadio ii, del 24% para el estadio iii y del 0% para el estadio iv. Es importante destacar que la mediana de supervivencia para la enfermedad metastásica (estadio iv) en el momento del diagnóstico fue de menos de un año.
Cirugía y radioterapiaSe prefiere un abordaje laparoscópico en tumores pequeños (menores de 6cm); para aquellos de 8cm o más se subraya la necesidad de extracción quirúrgica a través de cirugía abierta radical, con el objetivo de evitar la recidiva local. Más allá de la cirugía el impacto de otras terapias, como veremos posteriormente, no está completamente caracterizado, y la eficacia del tratamiento adyuvante con mitotane aún no se ha demostrado. Esto pone de relieve la importancia de la consulta y el tratamiento de estos tumores en centros con un equipo multidisciplinario endocrino especializado, en un intento de mejorar los resultados para esta enfermedad con tan mal pronóstico. El volumen relativamente bajo, incluso en centros de tercer nivel, es otra prueba de que el progreso futuro solo se puede lograr a través de colaboraciones multicéntricas, como proyectos coordinados.
En el año 2004 Saunders et al. revisaron 14 estudios con 28 pacientes con ACC tratados mediante cirugía laparoscópica (tamaño medio tumoral 5,3±1,3cm). En 9 pacientes (32%) ocurrió recurrencia de la enfermedad locorregional, con una supervivencia global libre de enfermedad de 19 meses6. Kebebew et al. reportaron 6 casos de ACC sometidos a cirugía laparoscópica, con un tamaño medio tumoral de 6,6cm y con una recurrencia del 50%7. Parece que hay una gran variabilidad entre los distintos grupos, en relación con las tasas de recurrencia después de la cirugía laparoscópica. Es difícil determinar si esto se debe, únicamente, al abordaje laparoscópico motivado por la rareza de la enfermedad y la dificultad de llevar a cabo estudios prospectivos8. Suzuki et al.9 llegaron a la conclusión de que los tumores suprarrenales mayores de 8cm deben ser operados a través de cirugía abierta, debido, en parte, a la dificultad operativa y al potencial maligno. Los autores también mencionan otros criterios que pueden ser de ayuda en la predicción de ACC, en ausencia de pruebas radiológicas. Esto incluye el rápido inicio de la virilización, feminización, además de múltiples determinaciones hormonales elevadas. Este grupo sugiere que un 60-80% de los tumores funcionantes tenían alteraciones hormonales en la analítica, mientras que otro estudio, sobre 58 pacientes, reportaba este aumento en el 47% de sus pacientes estudiados. Por tanto, el estado hormonal debería investigarse cuidadosamente en todos los casos sospechosos de ACC, ya que de estos estudios se concluye que el patrón de secreción hormonal puede ser un indicio de malignidad de una lesión suprarrenal10. Además, se necesitan más datos para aclarar el índice de crecimiento de los ACC y el significado clínico y pronóstico de la producción de hormonas de la corteza suprarrenal que afectaran tanto a la supervivencia como a la calidad de vida de estos pacientes.
El tratamiento con radioterapia (RT) ha sido etiquetado como ineficaz para el tratamiento primario o adyuvante en ACC. Sin embargo, hay evidencia de que el ACC no es resistente a la RT, y que la RT paliativa se ha usado con éxito para tratar pacientes con lesiones metastásicas sintomáticas11. Existen varias publicaciones que informan del uso de la RT paliativa en pacientes con enfermedad avanzada a dosis que van desde los 10 a 60Gy12. En algunos casos se obtuvo alivio del dolor hasta en el 72% de los mismos13. Además, la RT es eficaz para mejorar los síntomas neurológicos en pacientes con metástasis cerebrales14. Sigue siendo aún una decisión del clínico si un paciente, con metástasis generalizadas y una esperanza de vida limitada, debe recibir o no RT. Parece existir un consenso que recomienda su uso en pacientes con metástasis cerebral, obstrucción de vena cava y metástasis óseas con compresión de la médula espinal. Curiosamente, los modelos preclínicos sugieren que el mitotane puede funcionar como un radiosensibilizador15. No obstante, esto último requiere mayor investigación.
Como ya se comentó previamente, y debido a esta baja incidencia, contamos con escasos datos prospectivos aleatorizados. De hecho, solo se han llevado a cabo 2 estudios aleatorizados fase 3, ambos en pacientes con enfermedad avanzada. El primero se centró en el uso óptimo de la quimioterapia sistémica, así como las decisiones a tener en cuenta para su utilización. Por el contrario, el segundo exploró el efecto del agente receptor antiinsulina como factor de crecimiento 116. Para la enfermedad localizada, la cirugía sigue siendo el único enfoque curativo17, aunque las tasas de supervivencia y recurrencia después de la resección siguen siendo pobres18. De hecho, hasta un tercio de los pacientes que han sido sometidos a una resección quirúrgica completa con márgenes negativos aún pueden experimentar una recurrencia local de la enfermedad, a pesar del uso de mitotane adyuvante o quimioterapia19,20. Realmente, las recidivas locales son comunes, presentes en 2/3 en una serie quirúrgica reciente21. Aunque esto pone de relieve la necesidad de lograr un mejor control local, sigue habiendo una escasez de datos convincentes con respecto a los tratamientos adyuvantes. Como resultado, existe controversia en cuanto al uso de la RT adyuvante después de la resección quirúrgica22,23.
En un reciente estudio retrospectivo de la Universidad de Michigan24, 20 pacientes con enfermedad localizada estadio i-iii fueron aleatorizados a recibir RT adyuvante tras la cirugía. Al analizar estos resultados y compararlos con el grupo control 20 pacientes de similares características, pero que no recibieron este tratamiento adyuvante, no mostraron diferencias estadísticamente significativas en función del estadio, presencia de márgenes quirúrgicos positivos, grado tumoral o empleo de tratamiento con mitotane. Con una mediana de seguimiento de 34 meses la recidiva local se produjo en un paciente de los tratados con RT, por las 12 recurrencias en aquellos que no habían recibido dicho tratamiento. Este grupo demuestra que el tratamiento con RT adyuvante reduce significativamente el riesgo de recurrencia local en aquellos pacientes con ACC en los que se llevó a cabo la resección completa de la lesión. Las directrices actuales de consenso sugieren que la RT adyuvante podría ser especialmente útil en pacientes con mayor riesgo de recidiva local, es decir, en aquellos que presenten márgenes quirúrgicos positivos tras la cirugía, en tumores de gran tamaño o alto grado y/o en aquellos casos en los que se haya producido la rotura de la cápsula tumoral durante la intervención. Hasta que no se disponga de los datos que aportarán varios ensayos prospectivos solo podemos limitarnos a recomendar la RT adyuvante en este grupo de pacientes de alto riesgo.
Otras terapias intervencionistasAlgunas terapias locales, como la quimioembolización o ablación por radiofrecuencia, han demostrado un papel paliativo en la enfermedad metastásica. La ablación por radiofrecuencia percutánea puede proporcionar un control local a corto plazo en los tumores primarios no resecables, sobre todo en aquellos que tienen menos de 5cm de diámetro25. Además, la quimioembolización arterial puede ser considerada como parte del arsenal terapéutico, para el tratamiento de las metástasis hepáticas de ACC26, especialmente en los casos en que el diámetro de la metástasis es de 3 o menos cm. Se requiere una decisión individualizada para cada paciente, en función de la enfermedad y las características específicas de este.
Tratamiento sistémicoEl mitotane ha sido la columna vertebral del tratamiento sistémico para los ACC avanzados, ya que una terapia de combinación de este con etopósido, doxorrubicina y cisplatino mostró una aceptable tasa de respuesta. Fue desarrollado en 1960 como un insecticida, el DDT, que afecta la corteza suprarrenal, causando necrosis. Ejerce un efecto citotóxico sobre las células adrenocorticales, produciendo degeneración focal de la zona fascicular y, en particular, de la reticular. La actividad antitumoral se produce a una concentración plasmática de 14mg/l o mayor, pero los efectos secundarios tóxicos resultan en el nivel superior a 22mg/l. Con frecuencia hay efectos adversos (reversibles) en el sistema gastrointestinal o en el sistema nervioso central.
En un estudio retrospectivo europeo27 el tratamiento con mitotane se ha utilizado en el 65% de los pacientes con ACC, cifra idéntica a la reportada en un estudio realizado en 30 pacientes con ACC en 3 centros del Reino Unido28. Cuando se tomó en cuenta los resultados cosechados con este tratamiento, la diferencia en supervivencia entre los estadios ii y ii/iv fue menos significativa, destacando su posible papel paliativo en ACC avanzado. Además, los pacientes que recidivaron en un estadio ii y que recibieron mitotane tenían una mejor supervivencia global, en comparación con los pacientes que no la recibieron. Estos datos confirman el papel establecido de mitotane en la enfermedad recurrente/avanzada/metastásica29. Su papel, sin embargo, en el estadio ii, después de una resección adecuada, sin evidencia de enfermedad residual o recurrente, es un tema de debate. La mayor parte de esta controversia se refiere a la intolerancia de los pacientes a la medicación, por sus efectos secundarios. Debido al pobre cumplimiento del paciente, la rareza de esta enfermedad y la falta de ensayos aleatorios, es difícil establecer su beneficio en los tumores menos agresivos. Estas limitaciones y preguntas se están abordando en un ensayo aleatorizado en curso (ADIUVIO)30.
Primera línea de tratamientoLa quimioterapia (QT) con agentes individuales ha producido resultados decepcionantes con bajas tasas de respuesta31. La QT basada en cisplatino puede lograr respuestas comprendidas entre el 11% y el 48%, y los mejores resultados se pueden explicar cuando se lleva a cabo la selección de pacientes. Un pequeño estudio fase ii, llevado a cabo en 47 pacientes con enfermedad avanzada, evalúa el tratamiento de primera línea con cisplatino y etopósido seguido de mitotane en la progresión de la enfermedad, observando una respuesta objetiva en el 11% de los pacientes.
Los mejores resultados en el ACC avanzado se observaron en el esquema de tratamiento que combinaba etopósido, doxorrubicina y cisplatino (EDP) o estreptozotocina con mitotane. La primera combinación se estudió en un ensayo fase ii con 28 pacientes, en los que se informó de respuesta completa en 2 pacientes y de respuesta parcial en 13 de ellos, con una tasa de respuesta global del 53,5%32. El segundo régimen se evaluó sobre 22 pacientes, evidenciándose una respuesta completa o respuesta parcial en el 36,4% de los pacientes tratados con estreptozotocina combinado con mitotane16.
El primer ensayo aleatorizado, llevado a cabo a nivel internacional en el tratamiento de ACC localmente avanzado y metastásico (Firme-ACT), comparó los 2 regímenes de tratamiento que en primera línea habían mostrado beneficio con la intención de establecer un estándar de actuación. Los 304 pacientes fueron aleatorizados para recibir mitotane más una combinación de etopósido, doxorrubicina y cisplatino (M/EDP) o estreptozocina más mitotane (SM). La supervivencia libre de progresión (SLP) fue significativamente mayor en el esquema M/EDP que en los del grupo SM (5,0 vs 2,1 meses). La tasa de respuesta fue también mayor en el grupo M/EDP (23,2% frente a 9,2%) con un perfil de toxicidad similar. No hubo diferencias significativas en la supervivencia global (SG) (14,8 vs 12,0 meses). Este estudio proporciona la evidencia más sólida para el tratamiento sistémico de ACC avanzado.
Segunda línea de tratamientoLos estudios que evalúan el impacto de la QT en segunda línea son limitados y los resultados decepcionantes. Un objetivo secundario del ensayo Firme-ACT fue evaluar la eficacia de ambos regímenes en segunda línea. La combinación M/EDP muestra mayor eficacia antitumoral, tanto en primera como en segunda línea, con una SLP de 5,6 meses33.
Un ensayo fase ii abordó el papel de gemcitabina más dosis bajas de 5-fluorouracilo o capecitabina en pacientes con ACC avanzado que ya habían sido tratados previamente. Uno de los 28 pacientes (3,5%) presentó respuesta completa, mientras que 11 pacientes (39,3%) lograron estabilizar la enfermedad. Por lo tanto, este esquema de tratamiento podría retrasar potencialmente la progresión de la enfermedad en el AAC avanzado previamente tratado34. La terapia metronómica podría explicar estos resultados, ya que consiste en la administración de fármacos citotóxicos a dosis bajas de forma constante, pudiendo de esta forma tener tanto efectos antiangiogénicos como inmunomoduladores, estabilizando la enfermedad en aquellos tumores que se habían convertido en resistentes a los tratamientos convencionales35. Esta hipótesis debe ser abordada en futuros estudios para definir el papel de la QT metronómica en el ACC avanzado.
Perspectivas futurasLa agresividad del ACC, las opciones terapéuticas limitadas y los pobres resultados que se han obtenido objetivamente hasta la fecha han obligado a la comunidad científica a investigar la biología molecular del ACC, para permitir una mejor comprensión de la carcinogénesis de esta enfermedad. A medida que nuestro conocimiento y comprensión de las diferentes vías moleculares aumenten, también lo hará la cantidad de posibles dianas terapéuticas, que hará posible más ensayos clínicos y, potencialmente, un enfoque personalizado en función de la biología de cada tumor. Además, existe una urgente necesidad de comprender el papel de la terapia adyuvante en ACC localizados. Los resultados del ensayo Adiuvo ya comentado proporcionarán una más que probable orientación sobre este tema. Tenemos esperanza en que la mejor comprensión de la patogénesis de los ACC dará lugar al desarrollo de nuevos tratamientos terapéuticos eficaces; en particular, la terapia dirigida a la aparición de mejores marcadores diagnósticos y pronósticos, y todo ello conducirá a una mejora general de los resultados de nuestros pacientes.
DiscusiónEl ACC es un tumor poco frecuente, con muy mal pronóstico y con limitadas opciones de tratamiento curativo. La gestión de esta enfermedad requiere, a menudo, un enfoque multidisciplinar que implica a un oncólogo médico, a un cirujano endocrino o urológico, a un endocrinólogo y otras disciplinas. El factor pronóstico más importante es el estadio tumoral en el momento del diagnóstico, siendo hasta la fecha la resección quirúrgica la piedra angular del tratamiento, representando la única opción curativa en etapas tempranas. Sin embargo, alrededor del 80% de estos pacientes presentará recurrencia, tanto local como a distancia, tras una resección completa36. Con respecto a la enfermedad recurrente o avanzada, el ACC es tímidamente sensible a las quimioterapias citotóxicas comunes, demostrando un claro beneficio paliativo varias combinaciones. La radiación y las técnicas ablativas se han utilizado con beneficios variables en función del escenario clínico. Todo ello pone de relieve el hecho de que los tratamientos sistémicos disponibles son insuficientes para la enfermedad avanzada. El desarrollo de tecnologías destinadas a la producción de datos genéticos y la caracterización molecular de varios tumores sólidos, que han sido descritos por The Cancer Genome Atlas, servirán de vía de desarrollo para las terapias futuras, centrándose en el potencial de las diferentes vías de señalización y en las terapias personalizadas, para dar esperanza a una nueva era de tratamiento de ACC.
En una revisión del año 2010 se habían identificado 42 casos de neoplasias oncocíticas suprarrenales en la literatura: 18 casos de oncocitoma adrenocortical, 17 casos de carcinoma adrenocortical oncocítico y 7 casos de oncocitoma adrenocortical de potencial maligno desconocido36. De los 14 casos que incluían información sobre el seguimiento 7 no tenían evidencia de recurrencia, 6 habían recurrido con un promedio de 26 meses tras la cirugía y uno había fallecido a los 58 meses de seguimiento. Hemos identificado 5 casos de carcinomas adrenocorticales oncocíticos funcionantes en la literatura. Nuestro caso, junto con el publicado por este grupo neozelandés, es el único en el que se evidencian cifras de testosterona sérica y DHEA-S elevadas en un carcinoma adrenocortical oncocítico, evidenciando respuesta parcial al finalizar nuestro trabajo de revisión. No obstante, sigue siendo preciso un seguimiento estrecho de esta paciente, debido a las altas tasas de recurrencia documentadas en estos casos. tabla 1.
European network for the study of adrenal tumors staging system
| Estadio | TNM |
|---|---|
| I II III IV | T1, N0, M0 T2, N0, M0 T1-2, N0, M0 T3-4, N0-1, M0 Cualquier M1 |
T1 indica tumores ≤5cm en su dimensión mayor, T2 indica tumores>5cm, T3 indica la infiltración de los tejidos circundantes y T4 se reserva para tumores que invaden los órganos adyacentes o con la presencia de un trombo tumoral en la vena cava o en la vena renal. N0 denota las ausencias de los ganglios linfáticos afectados, mientras que N1 indica su positividad. M0 indica que no hay metástasis a distancia, mientras que M1 permite indicar su presencia.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.