Conocer la localización y la distribución del receptor arilsulfatasaA (ARSA) en espermatozoides humanos antes y después de incubarlos en medio de capacitación durante 1 y 4h.
Material y métodosLas muestras seminales se obtuvieron de 5donantes normozoospérmicos. La capacitación se llevó a cabo mediante la técnica de swim-up usando medio de capacitación durante 1 y 4h. La localización del receptor ARSA se evaluó mediante inmunofluorescencia indirecta usando microscopia confocal. En cada condición fisiológica se observó un mínimo de 200células.
ResultadosAntes de la incubación no se observó ningún patrón representativo entre las células positivas para este biomarcador (8,61%). Dicho porcentaje aumentó significativamente tras la incubación en medio de capacitación 1 y 4h (61,86 y 63,38%, respectivamente). Entre las células capacitadas se observó un patrón mayoritario, con marcaje intenso en la región acrosomal (27,11 y 28,20% tras 1 y 4h, respectivamente). Destacar que previamente a la incubación en los espermatozoides no se observó el patrón correspondiente a la fluorescencia a nivel de la región periacrosomal: solo tras incubar en medio de capacitación durante 1 y 4h se detectaron un 9,13 y un 12,78% de células con dicha distribución.
ConclusionesLa capacitación in vitro, independientemente del tiempo, favorece la inmunolocalización de ARSA en la región cefálica de los espermatozoides. La subpoblación más representativa tras dicho proceso fue aquella en la que ARSA se distribuyó de forma intensa y homogénea en la región acrosomal, implicada en el reconocimiento primario entre gametos.
To determine the localization and distribution of the ArylsulfataseA receptor (ARSA) in human spermatozoa before and after their incubation in capacitation medium for 1 and 4hours.
Material and methodsSemen samples were obtained from five normozoospermic donors. Capacitation was by swim-up technique using capacitation medium for 1 and 4hours. Localization of the ARSA receptor was assessed by indirect immunofluorescence using confocal microscopy. A minimum of 200cells were observed in each physiological condition.
ResultsBefore incubation, no representative pattern was observed among the cells positive for this biomarker (8.61%). This percentage increased significantly after incubation in the capacitation medium for 1 and 4hours (61.86% and 63.38% respectively). A majority pattern was observed among the capacitated cells, with intense labelling in the acrosomal region (27.11% and 28.20% after 1 and 4hours respectively). It should be noted that the pattern corresponding to fluorescence at the level of the periacrosomal region was not observed in the spermatozoa prior to incubation. Only after incubation in capacitation medium for 1 and 4hours, 9.13% and 12.78% of cells with such distribution were detected.
ConclusionsIn vitro capacitation, regardless of time, favours the immunolocalization of ARSA in the cephalic region of the spermatozoa. The most representative subpopulation after this process was the one in which ARSA was intensely and homogeneously distributed in the acrosome region, involved in primary gamete recognition.
La espermatogénesis y la espermiogénesis son las responsables de la génesis del espermatozoide, pero dichos procesos no son capaces de generar per se gametos con capacidad fecundante1,2. Dicha capacidad se adquiere durante el trayecto de los espermatozoides eyaculados por el tracto genital femenino, cuyas propiedades biológicas, físicas y químicas inducen la capacitación3-6. Este proceso implica una serie de cambios fisiológicos en el gameto masculino que van desde la pérdida de colesterol6 hasta la reorganización de glicoconjugados7, pasando por la fosforilación de proteínas8 y la hiperactivación9-11, entre otros.
Debido a la importancia fisiológica de la fosforilación de tirosinas, así como de la capacidad del espermatozoide de liberar su contenido acrosomal durante la fecundación11-13, varios estudios han señalado estos procesos moleculares como potenciales biomarcadores del éxito de la fecundación9,14-20.
A pesar de la posibilidad de llevar a cabo la capacitación de manera in vitro6,21, existe controversia en cuanto al tiempo necesario para que las células espermáticas completen los cambios fisiológicos asociados a este proceso6,22. Los estudios relativos a este tema han referido que los mayores porcentajes de espermatozoides capaces de reconocer y unirse a la zona pelúcida (ZP) del ovocito, es decir, que han completado los cambios asociados a la capacitación, son recuperados tras 4h de incubación en medio capacitante23. El hecho de que el problema más frecuente durante la fecundación sea la incapacidad del espermatozoide para reconocer y unirse a la ZP24-27 hace que se cuestione el tiempo de incubación en medio de capacitación durante una hora utilizado actualmente en reproducción asistida28. Por lo tanto, surge la necesidad de conocer la influencia del tiempo de incubación sobre la localización y redistribución de determinados biomarcadores implicados en la fecundación.
Los últimos avances en la identificación de receptores espermáticos implicados en el reconocimiento de la ZP han señalado a la arilsulfatasaA (ARSA) como una proteína clave durante este proceso. Esta proteína forma parte de un complejo junto con la proteína de choque térmicoA2 (HSPA2) y la molécula de adhesión espermática (SPAM1)27,29. Los estudios referentes a este complejo han destacado que la deficiencia en la expresión de ARSA ocasiona un fallo en la adhesión de los espermatozoides a la ZP30, haciendo evidente la importancia de esta proteína para el reconocimiento primario entre gametos.
Dada la relevancia de ARSA durante el proceso de fecundación, en la bibliografía podemos encontrar datos sobre la expresión superficial de esta proteína en espermatozoides humanos antes y tras la incubación en medio de capacitación durante 180min27,29. Estos estudios evidencian la expresión de ARSA en la superficie espermática y su colocalización con HSPA2 y SPAM1 en la región periacrosomal de la cabeza de espermatozoides tras este tiempo de incubación, pero sin tener en cuenta los cambios individuales de estas proteínas durante la capacitación ni el tiempo de 4h recomendado previamente para completar este proceso23.
Por ello, en este trabajo evaluamos por primera vez la influencia del tiempo de capacitación en la distribución espacial del receptor ARSA, antes y tras la incubación en medio de capacitación durante 1 y 4h.
Material y métodosAnálisis de muestras espermáticasLas muestras espermáticas se obtuvieron de 5 donantes mediante masturbación tras una abstinencia sexual de entre 3 y 4días. Estos donantes fueron voluntarios de fertilidad no probada pertenecientes al colectivo de estudiantes de la Universidad de Alicante durante el curso 2018/2019, cuyas edades comprendieron entre los 18 y los 23años. Antes del transcurso de una hora se realizó un seminograma básico y solo se incluyeron en el estudio las muestras clasificadas como normozoospérmicas según los criterios de la OMS28. Posteriormente se dividieron las muestras en alícuotas, de manera que se pudieron testar tres biomarcadores (fosforilación de tirosinas, reacción acrosómica espontánea y ARSA) tanto antes (fresco) como después de 1 y 4h de incubación en medio de capacitación. Este estudio fue aprobado por el Comité de Bioética de la Universidad de Alicante (España) de acuerdo con los principios de la Declaración de Helsinki y todos los donantes firmaron un consentimiento informado.
Capacitación in vitroTras eliminar el plasma seminal centrifugando la muestra a 250g durante 10min se realizó un lavado con medio de fluido tubárico humano (HTF, Origio) durante 5min a 250g. Se realizó la capacitación mediante la técnica de swim-up en medio de capacitación durante 1 y 4h usando 1ml de medio HTF suplementado con 5mg/ml de albúmina de suero bovino (BSA, Sigma-Aldrich), que se repartió en 4tubos y se incubaron a 37°C y 5% de CO2. Tras la capacitación se recuperaron 250μl de la fracción superior y se lavó con tampón fosfato (PBS, Life Technologies, Thermo Fisher Scientific Inc.).
Determinación de la reacción acrosómica espontáneaTras la incubación en medio de capacitación se verificó la integridad acrosomal de las células recuperadas fijando 5μl de muestra en un cubreobjetos con metanol durante 30min. Tras tres lavados con PBS, las células fijadas se incubaron en oscuridad durante media hora con la lectina Pisum sativum agglutinin conjugada con isocianato de fluoresceína (PSA-FITC, Sigma Aldrich) a una concentración final de 50μg/ml31. Por último, se lavaron las muestras tres veces con PBS y se dejaron secar antes de montarlas en un portaobjetos usando medio de montaje Vectashield H-100, que contiene 4’,6-diamidina-2’-fenilindol dihidroclorido (DAPI, Vector Laboratories). Se evaluaron un total de 200células de cada muestra seminal y condición fisiológica (fresco, capacitada 1h y capacitada 4h) utilizando un microscopio confocal láser TCS SP2 de Leica (Alemania). Se realizaron controles negativos con el anticuerpo secundario pertinente, omitiendo la incubación con la lectina.
Fosforilación de tirosinasTanto antes como tras la incubación en medio de capacitación durante 1 y 4h las células espermáticas fueron fijadas en paraformaldehído al 2% durante 1h a 4°C. Finalmente se resuspendieron en PBS a una concentración de un millón de células por mililitro y se conservaron a 4°C. Con el objetivo de cuantificar uno de los cambios moleculares que acontecen en la capacitación se analizó la fosforilación de tirosinas flagelares, en base a protocolos estándar descritos previamente16. En resumen, las células fijadas en parafomaldehído se permeabilizaron con Tritón X-100 (Sigma-Aldrich) al 0,1% durante 10min. Las tirosinas fosforiladas se identificaron usando un anticuerpo primario monoclonal antifosfotirosina (clon PY20, Sigma-Aldrich) a concentración 1:500 durante 1h, seguido de un anticuerpo secundario policlonal conjugado con el fluorocromo Cianin-3 (Cy3, Jackson ImmunoResearch) a concentración 1:300 durante 1h en oscuridad. Después de un último lavado de 15min en PBS se montaron los cubreobjetos con medio de montaje Vectashield H-100 con DAPI (Vector Laboratories). Se evaluaron un total de 200células de cada muestra seminal y condición fisiológica (fresco, capacitada 1h y capacitada 4h) utilizando un microscopio confocal láser TCS SP2 de Leica (Alemania). Los controles negativos se realizaron omitiendo el anticuerpo primario.
Inmunolocalización de arilsulfatasaAPara evaluar la distribución de ARSA en células espermáticas, las muestras previamente fijadas se depositaron en un cubreobjetos y, una vez secas, se sometieron a una recuperación antigénica mediante inmersión en citrato de sodio de 10mM (pH6). Se calentaron en el microondas durante 10min a 1000W y se lavaron tres veces con buffer de neutralización (100Mm Tris, pH8.5). Las siguientes incubaciones se realizaron según una modificación del método previamente descrito por Bromfield et al.32 en 2016, de manera que, tras ser lavadas con PBS, las muestras se incubaron con un anticuerpo primario policlonal anti-ARSA (Sigma-Aldrich) diluido 1:10 durante 2h a 37°C. Posteriormente se lavó el exceso de reactivo con PBS y se incubaron las células con un anticuerpo secundario policlonal conjugado con FITC diluido 1:100 durante 1h en oscuridad. Por último, se lavaron las muestras tres veces en PBS y, una vez secas, se montaron con medio de montaje Vectashield H-100 con DAPI (Vector Laboratories). Se evaluó un total de 400 células de cada muestra seminal y condición fisiológica (fresco, capacitada 1h y capacitada 4h) utilizando un microscopio confocal láser TCS SP2 de Leica (Alemania). Se realizaron controles negativos omitiendo el anticuerpo primario.
Análisis estadísticoLos patrones de distribución de ARSA en la cabeza de las células espermáticas, la reacción acrosómica espontánea y la presencia de tirosina fosforilada a nivel de flagelo se cuantificaron como porcentajes (%). Los datos se analizaron estadísticamente mediante ANOVA con un análisis post-hoc de Bonferroni. Al analizar la distribución de ARSA solo se tuvieron en cuenta los patrones presentes en más del 5% de los espermatozoides, ya fuera antes o después de la incubación. Se obtuvieron resultados descriptivos y estadísticos utilizando IBM SPSS Statistics 22.0. En todos los casos el nivel de significación estadística fue p<0,05.
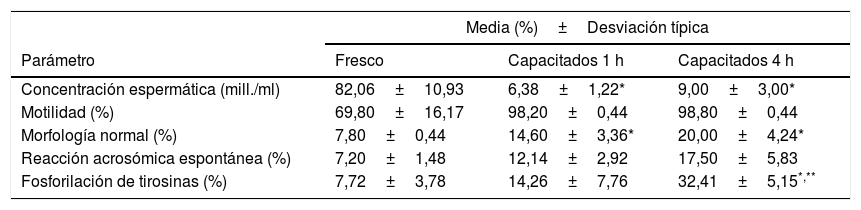
ResultadosAnálisis de muestras espermáticasLa tabla 1 muestra la media y la desviación típica de la concentración espermática, el porcentaje de motilidad, la morfología, la reacción acrosómica espontánea y la fosforilación de tirosina de las muestras seminales incluidas. Todas las muestras se clasificaron como normozoospérmicas de acuerdo con los valores de referencia de la OMS28.
Resultado del análisis seminal de las muestras utilizadas en el estudio (media (%) ±desviación típica) antes y tras la capacitación in vitro
| Media (%)±Desviación típica | |||
|---|---|---|---|
| Parámetro | Fresco | Capacitados 1 h | Capacitados 4 h |
| Concentración espermática (mill./ml) | 82,06±10,93 | 6,38±1,22* | 9,00±3,00* |
| Motilidad (%) | 69,80±16,17 | 98,20±0,44 | 98,80±0,44 |
| Morfología normal (%) | 7,80±0,44 | 14,60±3,36* | 20,00±4,24* |
| Reacción acrosómica espontánea (%) | 7,20±1,48 | 12,14±2,92 | 17,50±5,83 |
| Fosforilación de tirosinas (%) | 7,72±3,78 | 14,26±7,76 | 32,41±5,15*,** |
Diferencias significativas con p<0,01:
* Con respecto a las muestras en fresco.
** Incubadas 1h en condiciones capacitantes.
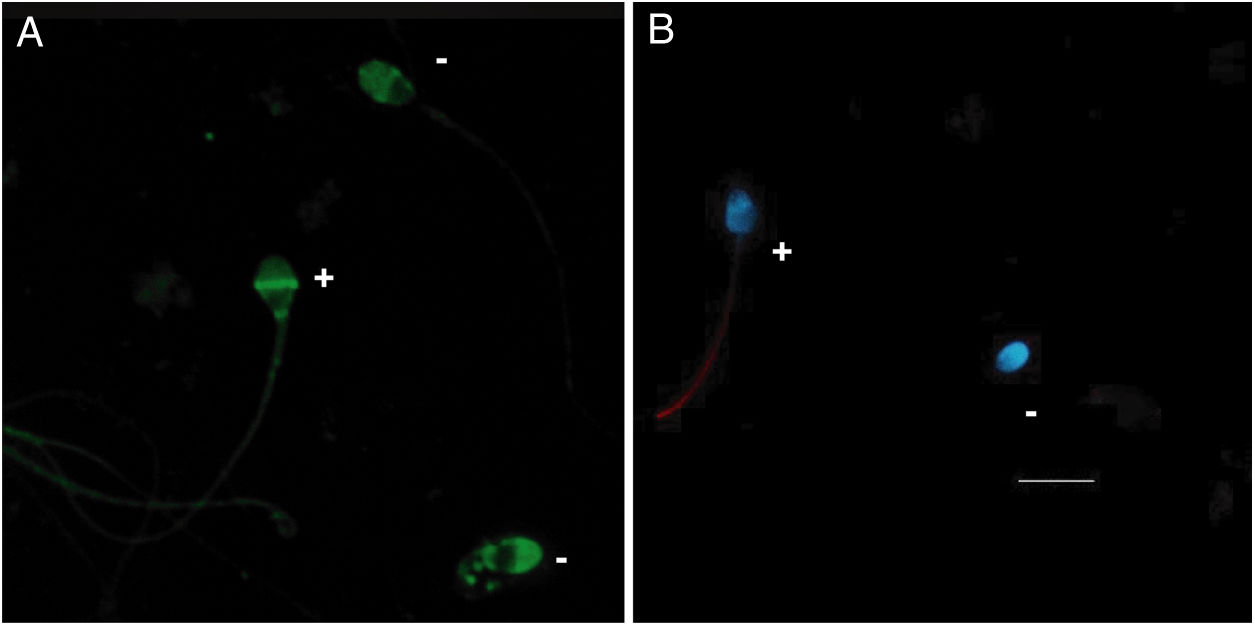
Los espermatozoides que presentaban fluorescencia en la región acrosomal se consideraron con el acrosoma intacto, mientras que las células marcadas en la banda ecuatorial o sin marcaje se consideraron como reaccionadas (fig. 1A). No hubo diferencias significativas entre el porcentaje de células reaccionadas espontáneamente tras 1 y 4h de incubación en medio de capacitación (12,14% vs 17,50%, respectivamente, p=0,103) (tabla 1). De igual manera, tampoco se encontraron diferencias significativas en la integridad acrosomal de las células en fresco comparadas con espermatozoides incubados con medio de capacitación (p=0,198).
Fosforilación de tirosinasSe clasificaron como fosforilados los espermatozoides que mostraban fluorescencia total o parcial en el flagelo (fig. 1B). En espermatozoides en fresco, el 7,72% de las células presentaban tirosina fosforilada en su flagelo. Después de la incubación en medio de capacitación durante 1h este porcentaje aumentó al 14,26%, mientras que, tras 4h, este incremento fue significativamente mayor (32,41%) tanto al compararlo con las células en fresco (p<0,001) como con el porcentaje de fosforilación observada tras 1h de incubación (p=0,001) (tabla 1).
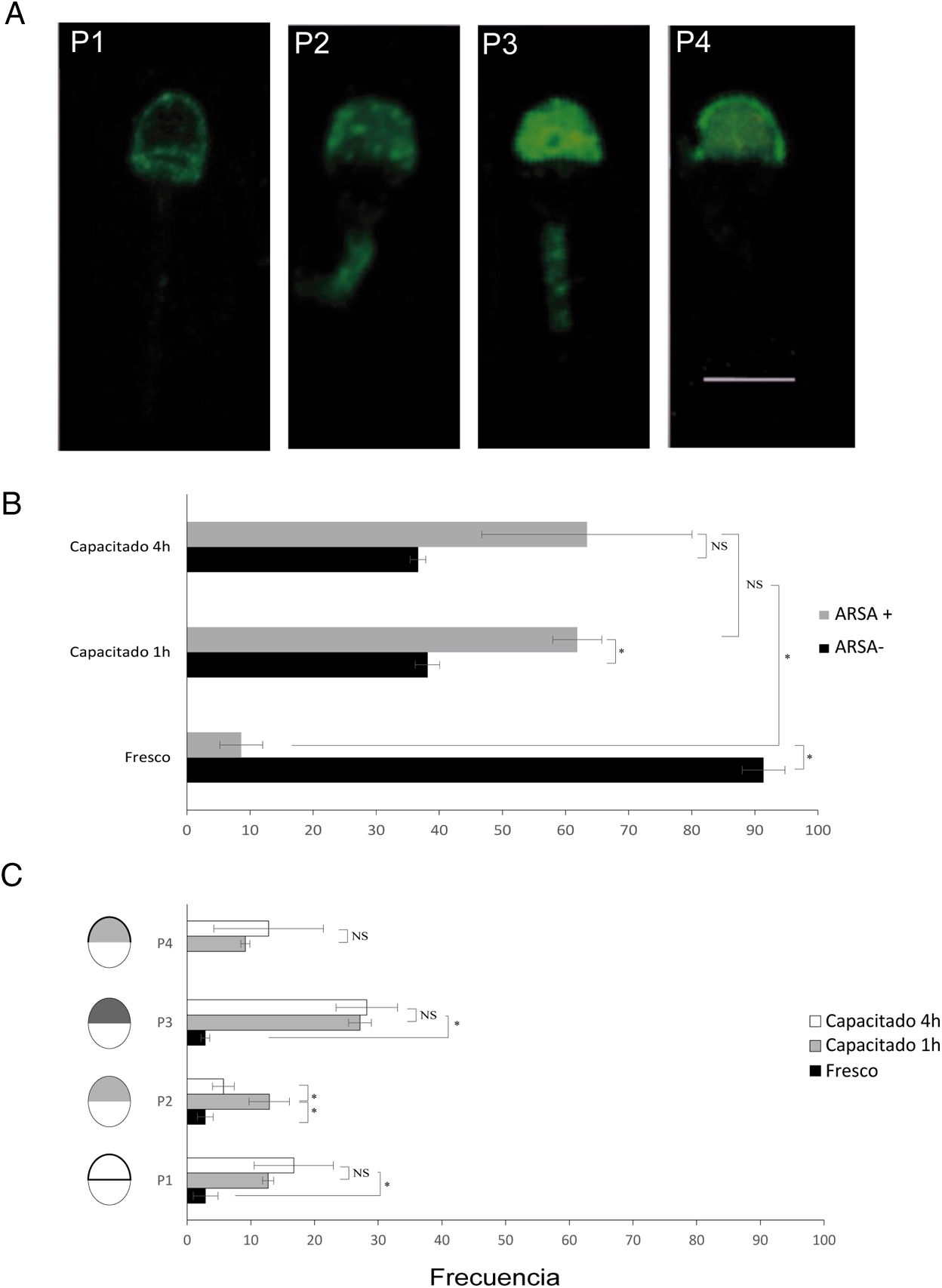
Inmunolocalización de arilsulfatasa ALa evaluación de ARSA en la superficie de la cabeza del espermatozoide mostró diferencias significativas entre el porcentaje de células con presencia de inmunomarcaje antes y después de 1h de incubación con medio de capacitación (8,61% vs 61,86%, respectivamente; p<0,001). Esta tendencia se siguió observando tras capacitar los espermatozoides durante 4h (63,38%; p<0,001), aunque sin aumentar de manera significativa con respecto a una hora de incubación. En las células con inmunofluorescencia para ARSA se identificaron 4 patrones principales de distribución de esta proteína en la cabeza de las células espermáticas (fig. 2A): el patrón1 (P1) se caracterizó por un marcaje en la banda ecuatorial y la zona periacrosomal; el patrón2 (P2) mostró una fluorescencia tenue en la región acrosómica; el patrón3 (P3) se expresó como una fluorescencia intensa en la región acrosomal, y el patrón4 (P4) mostró fluorescencia intensa en la región periacrosomal con un marcaje menos intenso pero homogéneo en toda la región acrosómica.
A)Patrones de fluorescencia observados: marcaje en la banda ecuatorial y zona periacrosomal (P1), fluorescencia tenue en la región acrosómica (P2), fluorescencia intensa en la región acrosomal (P3), fluorescencia intensa en la región periacrosomal con un marcaje menos intenso pero homogéneo en toda la región acrosómica (P4). Escala de 10μm común a todas las imágenes. B)Frecuencia de células con y sin inmunofluorescencia para ARSA (ARSA+, ARSA−) en cada condición fisiológica. C)Frecuencia de patrones de ARSA en espermatozoides humanos que presentaron inmunofluorescencia para ARSA (ARSA+) en diferentes condiciones fisiológicas.
* Diferencias significativas en p<0,05.
NS: diferencias no significativas.
La comparación de las medias de cada patrón de localización de ARSA en cada uno de los estados fisiológicos (fig. 2B y C) mostró que el porcentaje de P1 aumentó significativamente (p<0,005) con la incubación, desde el 2,89% en células en fresco hasta el 12,72% y el 16,73% en las células capacitadas 1 y 4h, respectivamente. De la misma manera, P2 aumentó significativamente (p<0,001), del 2,86% al 12,89%, tras 1h de incubación en medio de capacitación. Sin embargo, cuando se capacitó durante 4h este patrón disminuyó de manera significativa con respecto a 1h de incubación, hasta el 5,67% (p<0,005). Independientemente del tiempo de incubación, la localización de ARSA de manera intensa en la región acrosomal (P3) fue el patrón más representativo en las células capacitadas (27,11 y 28,20% 1 y 4h, respectivamente). Sin embargo, este patrón fue muy poco representativo (2,86%; p<0,001) en las células sin capacitar. Destacar que solo en los espermatozoides capacitados se caracterizó un nuevo patrón, no observado en células en fresco, cuya localización fue en la zona periacrosomal (P4: 9,13% y 12,78% 1 y 4h, respectivamente).
DiscusiónEn este trabajo hemos descrito la distribución de la proteína ARSA en espermatozoides humanos antes y después de su incubación en medio de capacitación durante 1 y 4h. Estos hallazgos sobre la distribución de una proteína de reconocimiento de la ZP tienen implicaciones para el conocimiento sobre los mecanismos moleculares que subyacen al reconocimiento primario entre gametos, así como una vía para la mejora de la selección espermática en reproducción asistida.
Tras los diferentes tiempos de incubación se valoró la fosforilación de tirosina flagelar, ya que este es uno de los eventos moleculares que ocurren durante la capacitación5,14,25. Nuestros resultados mostraron un aumento de la fosforilación dependiente del tiempo, ya que se observó un mayor número de espermatozoides con tirosina fosforilada a medida que se incrementó el tiempo de incubación. Este incremento concuerda con estudios anteriores que confirman la presencia de fosforilación de tirosina en el flagelo espermático y su aumento dependiente de la capacitación14,15,25.
Al evaluar la presencia de ARSA por microscopia de fluorescencia pudimos observar que antes de la incubación esta proteína se inmunolocalizó en una minoría de células espermáticas, mientras que tras la incubación en medio capacitante, independientemente del tiempo de incubación, ARSA estaba presente en la superficie de más del 60% de los espermatozoides. Estos resultados concuerdan con estudios previos realizados con citometría de flujo en los que se vio un aumento de células con marcaje para ARSA en la superficie espermática tras 3h de capacitación (5 y 80% antes y después de la capacitación, respectivamente)27,29. A diferencia de nuestro estudio, en estos trabajos de citometría27,29 no se pudo mapear la ubicación de ARSA.
En las células con fluorescencia para ARSA se observaron 4 patrones de distribución de ARSA a nivel cefálico en las células espermáticas. Los trabajos previos con esta proteína se han realizado mediante citometría de flujo o comarcaje con otras proteínas27,30, lo que imposibilita la determinación de dichos patrones.
En los espermatozoides antes de la incubación observamos diferentes subpoblaciones espermáticas en lo que respecta a la localización de ARSA. Trabajos previos han caracterizado de igual manera diferentes subpoblaciones de células espermáticas previas a la capacitación con diferentes biomarcadores, como colesterol12, fosforilación de proteínas33 o glicoconjugados34. En este último estudio se observó que tras largos periodos de incubación (4h) la subpoblación celular recuperada fue más homogénea en lo que respecta al glicocáliz34. De igual manera, nosotros observamos que tras la incubación en medio de capacitación se cuantificó un aumento de células espermáticas cuya distribución de ARSA fue homogénea e intensa en todo el acrosoma, independientemente del tiempo de incubación.
Otro de los patrones observados fue a nivel de la banda ecuatorial y la zona periacrosomal. Esta distribución se observó en alrededor del 12 y del 17% de las células capacitadas (1 y 4h, respectivamente), siendo estas tasas similares al porcentaje de células reaccionadas de manera espontánea encontradas en estos tiempos de incubación. Estos espermatozoides podrían estar reaccionados, ya que diferentes autores informaron sobre el hecho de que varias proteínas implicadas en la fusión de gametos se reubican en la banda ecuatorial durante la reacción acrosómica de los espermatozoides con el fin de realizar su función tras la desaparición de la membrana plasmática externa7,35,36.
A medida que el tiempo de incubación fue mayor, el porcentaje de células con inmunomarcaje en la región acrosomal y periacrosomal aumentó. A pesar de que este patrón no ha sido el más representativo en espermatozoides tras la incubación en medio de capacitación, es lógico asociar esta distribución con el reconocimiento primario de los gametos, ya que la zona periacrosomal de la cabeza del espermatozoide es la primera en entrar en contacto con el ovocito durante las primeras fases de la fecundación37. Además, otros autores han descrito la colocalización de esta proteína con la chaperona HSPA2 en la zona periacrosomal en espermatozoides capacitados27,29, sugiriendo una posible relación entre esta localización del complejo proteico SPAM1/HSPA2/ARSA y su implicación en el reconocimiento entre gametos.
A partir de los resultados presentados en este estudio se podría deducir que cuando los espermatozoides se incuban con medio de capacitación, independientemente del tiempo, aumenta de manera significativa el número de células con inmunomarcaje para ARSA. De igual manera se observa una tendencia al alza del porcentaje de espermatozoides con una distribución de ARSA a nivel de la zona de interacción con el ovocito tras ambos tiempos de incubación. La presencia de ARSA en la región acrosomal y/o periacrosomal de las células incubadas podría significar que esta proteína desempeñase un papel en el reconocimiento primario del ovocito, siguiendo el modelo propuesto por Redgrove26,27,29,32.
Estos resultados nos llevan a sugerir que ARSA, propuesta por diferentes autores27,29,30 como proteína de reconocimiento de ZP, podría ser un biomarcador de capacitación y madurez espermática, ya que los espermatozoides que, tras la incubación en medio de capacitación, no presenten esta proteína en la región acrosomal y periacrosomal no podrán interaccionar correctamente con el ovocito25-27,29,32. No obstante, a pesar de la evidente tendencia y de la utilidad que ha demostrado la incubación en medio capacitante durante 4h con otros biomarcadores6,7,22,23,34,38, para poder recomendar dichos tiempos de incubación a la práctica clínica es necesario seguir ampliando el conocimiento sobre estos eventos moleculares. En este sentido, se realizarán futuros estudios con muestras seminales de pacientes sometidos a técnicas de reproducción asistida para conocer el papel de este receptor en la capacidad fecundante de los espermatozoides, teniendo en cuenta parámetros adicionales como la fragmentación del ADN, la capacidad de unión al ácido hialurónico o la hiperactivación espermática39,40.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en este artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste trabajo ha sido subvencionado por la Cátedra Human Fertility de la Universidad de Alicante y el proyecto de I+D+I ViGrob-186 y UAIND17-03.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.