INTRODUCCIÓN
La aprobación de la Ley 14/2006 de 26 de mayo1 nos llenó de perplejidad al leer el anexo I, ya que no se recogen técnicas de reproducción asistida (TRA) que son de práctica normalizada en los centros de reproducción. Específicamente nos referimos al empleo de espermatozoides obtenidos de epidídimo (punción-aspiración de epidídimo, PESA, MESA) o testículo (punción-aspiración percutánea testicular, TESA; biopsia abierta, TESE) ya sea en fresco o tras su criopreservación -descongelación y empleo en la microinyección intracitoplásmica (ICSI)-. Con anterioridad, en la Ley 35/1988 de 22 de noviembre2 y sus posteriores modificaciones (modificaciones 19963 y Ley 45/2003 de 21 de noviembre4) no se especificaba la procedencia de los espermatozoides para su uso en las TRA. Sin embargo, en el anexo I al que nos referimos, se indica que en las TRA se emplearán "espermatozoides de eyaculado", lo cual dejaría a las técnicas mencionadas fuera de las aceptadas para fecundación in vitro (FIV), requiriendo permisos y tutela como técnicas experimentales. Además, se sanciona la práctica de cualquier técnica que no esté recogida en el mencionado anexo I.
A nuestro juicio, no creemos que se trate de técnicas experimentales, ya que se llevan realizando de forma regular hace años, con resultados publicados muy positivos tanto en el ámbito nacional como internacional5-10.
Objetivo
Nos proponemos aportar nuestra experiencia en TRA con espermatozoides no procedentes de eyaculado y valorar el desarrollo de los niños nacidos.
MÉTODOS
Se ha llevado a cabo un estudio retrospectivo de 57 parejas que han realizado 80 ciclos de FIV-ICSI, con unas patologías masculinas que se diferenciaron en: azoospermias no obstructivas (ANO); azoospermias obstructivas (AO); aneyaculación (ANEY). Todos los procesos para la obtención de espermatozoides se realizaron inicialmente antes de la estimulación ovárica. El tejido testicular se procesó por disgregación mecánica con agujas de insulina 0,33 × 12,7 mm. Una vez confirmada la presencia de espermatozoides, las muestras se criopreservaron de acuerdo al protocolo de rutina, diluidas vol/vol con TEST Yolk Buffer (Irvine Scientific, USA) y se introdujeron en pajuelas de 0,25 ml. La criopreservación se realizó en máquina de congelar programable (Nicoolbag MS21) con una rampa de enfriamiento de temperatura ambiente a -2,0 ºC/min hasta -50 ºC y, finalmente, inmersas en nitrógeno líquido. Posteriormente, se realizó el test posdescongelación con una pajuela testigo para valorar la supervivencia de los espermatozoides descongelados. La estimulación ovárica, la punción folicular y la preparación de los ovocitos para FIV-ICSI se realizó de acuerdo al método estándar. El día de la punción folicular, previa a la ICSI, se descongeló a temperatura ambiente el número de pajuelas adecuado y se procedió a su tratamiento enzimático con colagenasa y ADNsa11 o el método que fuese más conveniente12. Tras centrifugar la muestra en microcentrífuga, se resuspendió el pellet en un volumen final de 20 µl. Una vez preparada la placa de ICSI, se realizó la activación in situ añadiendo pentoxifilina (5 mM) (Hemovas, Lab. Roberts, España) directamente en la gota de medio sin PVP, donde previamente se había añadido un pequeño volumen del pellet. Dado que la activación de la motilidad espermática se produce en 2 o 3 min, no es necesaria la incubación u otras condiciones especiales13,14. Los espermatozoides activados nadaron a la interfase medio-aceite donde fueron capturados y trasladados a la gota de PVP de lavado. Al espermatozoide seleccionado se le quebró la cola y tras varios lavados se llevó a cabo la microinyección del óvulo según técnica convencional7.
Los ovocitos inyectados fueron examinados 16 h más tarde para comprobar su fecundación. La calidad embrionaria se catalogó según criterio ASEBIR15 en 4 categorías teniendo en cuenta los tiempos de observación (D+2: 44-47 h; D+3: 67-71 h), el número de células y ritmo de división, la tasa de fragmentación, la semejanza de tamaño de las blastómeras, el grado de multinucleación, el aspecto del citoplasma y la zona pelúcida. Así, distinguimos embriones tipo A: de alta calidad con máxima capacidad de implantación; B: buena calidad con elevada capacidad de implantación; C: regular con una probabilidad de implantación media; D: mala calidad con probabilidad de implantación baja.
Las transferencias fueron realizadas en D+2 o D+3, según los criterios rutinarios de nuestro laboratorio. Los embriones sobrantes de buena calidad fueron criopreservados. Los embriones de pobre pronóstico pasaron a cultivo prolongado, y si no llegaban a estado de blastocisto se desecharon en D+6.
La gestación se consideró positiva tras observar mediante ecografía el número de sacos gestacionales con latido cardíaco, 6 semanas después de establecer el embarazo bioquímico.
Dado que nuestras pacientes, una vez confirmada su gestación, se remiten a su ginecólogo, para recabar información acerca de datos obstétricos, neonatales y de desarrollo evolutivo, se les realizó una encuesta telefónica para que respondieran a una serie de preguntas (semanas de gestación; datos acerca del parto; peso y sexo [cálculo de la ratio] de los niños nacidos; incidencias neonatales; necesidad de incubadora; enfermedades o anomalías detectadas; desarrollo en la escuela; etc.).
RESULTADOS
Se realizaron 80 ciclos correspondiente a 57 parejas, con una edad media de la mujer de 33,5 ± 0,66 años, no se realizó ninguna selección en función de la patología femenina. La patología masculina se clasificó en:
- Grupo 1, ANO: 13 pacientes con completa o incompleta parada madurativa, completa o incompleta aplasia de células germinales (Céls. Sertoli Solo) y esclerosis y atrofia tubular. Ninguno de los casos fue S. Klinefelter.
- Grupo 2, AO: 35 pacientes, de los cuales la mitad correspondía a vasectomías.
- Grupo 3, ANEY: 9 pacientes con problemas de eyaculación.
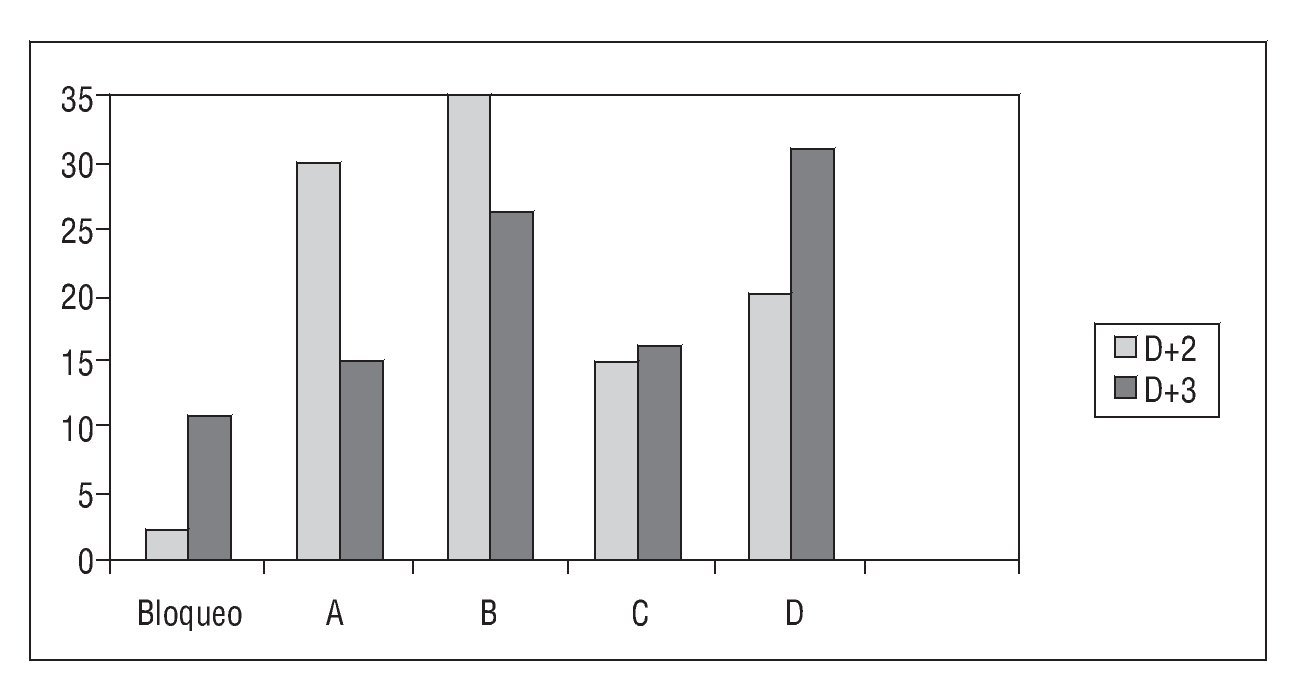
Se obtuvieron 947 ovocitos, de los cuales 737 fueron microinyectados, y se obtuvo una tasa de fecundación global del 60,2%. El desarrollo embrionario en D+2 fue de un 98,1%, donde un 57,8% corresponde a embriones de buena calidad (categorías A+B) y en D+3 un 88,6% de los embriones seguía evolucionando y el 41,3% era de buena calidad (categorías A+B) (fig. 1). Se transfirieron una media de 2,45 ± 0,79 embriones/transferencia, y se obtuvo una tasa de embarazo del 46,2%/ciclo y del 63,7%/paciente. La tasa de implantación fue del 26%. En el estudio del seguimiento de los niños nacidos se han incluido las gestaciones obtenidas de embriones criopreservados (tabla 1). Se criopreservaron 132 embriones (32%), y en 23 ciclos realizados se transfirieron 44 embriones con una media de 1,91 ± 0,66 embriones por ciclo, con una tasa de embarazo del 21,7% y una tasa de implantación de 11,3%.
Figura 1. Calidad embrionaria expresada según catalogación embrionaria ASEBIR. Calidad embrionaria expresada en porcentaje. Bloqueo: no división; A: embrión óptimo; B: buena calidad, fragmentación < 25%; C: embrión regular (asimetría, vacuolas escasas, anomalías de la zona pelúcida y fragmentación < 35%); D: embrión de mala calidad (criterio ASEBIR, 2007).
Los resultados respecto a tasa de embarazo, gestación, según patología masculina, se recogen en la tabla 2. La mayor tasa de embarazo se obtuvo en AO y las gestaciones múltiples fueron elevadas en los 3 grupos. En cuanto a la tasa de abortos, fue más elevada en ANO (si bien el número de casos fue pequeño).
Los datos recopilados tras la encuesta telefónica se exponen en la tabla 3. Comprende las edades de 8 años a 12 meses. Respecto al sexo de los niños se detectó una ratio baja, del 41,9%, para varones (número de varones/número varones + hembras). Los nacimientos con bajo peso (< 2.500 g) se dieron en las gestaciones gemelares, no observándose muy bajo peso (< 1.500 g) en ninguno de los grupos. Se produjo una muerte intraútero en un caso de ANEY, un feto procedente de embarazo gemelar (varón de 7 meses), y una muerte neonatal en un caso de AO, una niña, procedente de un embarazo gemelar. Se registró un 15,6% de nacimientos pretérmino (antes de las 37 semanas de edad gestacional). En cuanto a la necesidad de incubadora sólo 5 niños recurrieron a ella, 4 niños nacidos de casos de AO y 1 de ANEY.
En ninguno de los casos consultados se apreciaron malformaciones mayores. Por lo que respecta a las malformaciones menores, no fueron concluyentes, se detectó un caso de sufrimiento fetal donde se sospechó un problema renal pendiente de estudio (caso de ANO); un segundo caso donde se sospechó soplo cardíaco no confirmado (caso gemelar, AO), y un tercer caso en el que se detectó un problema de oído pendiente de estudio (AO). En general los niños son sanos, con buen desarrollo psicomotor, adaptación escolar y sin mayores incidencias.
DISCUSIÓN
La Ley de reproducción asistida 14/2006 de 26 mayo1, se "olvidó" de recoger en su anexo I el empleo de espermatozoides procedentes de epidídimo o testículo. Esto dio pie a un revuelo y perplejidad entre los profesionales que trabajamos con las TRA. Ante la posibilidad de que estas técnicas pasasen a ser experimentales, se decidió realizar este estudio retrospectivo sobre ciclos de FIV-ICSI en los que se emplearon espermatozoides no procedentes de eyaculado, para valorar nuestra experiencia y recoger información acerca del desarrollo de los niños nacidos por estas técnicas.
Desde 199316, estas técnicas están bien implantadas en los laboratorios de reproducción asistida, con trabajos publicados tanto en el ámbito nacional como en el internacional7-10,17-22.
Nuestros resultados, comparados con la bibliografía, están normalizados en cuanto a tasa de fecundación, desarrollo embrionario, tasa de embarazo e implantación. Si bien, el bajo número de casos no permite establecer comparaciones con base estadística, nuestros resultados coinciden con los de otros trabajos en que la tasa de embarazo de AO es normalizada y la de ANO es inferior, debido en parte a su propia patología23.
La encuesta realizada a los padres telefónicamente, con las limitaciones que ello conlleva, permitió reunir datos del 84,2% de las gestaciones obtenidas. Dado que hay muy pocos trabajos acerca del desarrollo de los niños nacidos que distingan grupos dentro del uso de espermatozoides no procedentes de eyaculado, en este estudio las causas de azoospermia se separaron en 3 grupos (AO, ANO, ANEY). Si bien el bajo número de casos por grupo no permitió realizar tratamiento estadístico, cabe destacar la tendencia hacia una baja edad gestacional en todas las gestaciones. Uno de los primeros datos que arroja el estudio es el elevado número de gestaciones gemelares en todos los grupos.
La alta incidencia de embarazos múltiples, que en este estudio es más elevada en el grupo AO. Los problemas asociados a las gestaciones múltiples están relacionados con la prematuridad (18,7%), bajo peso (34%) y mortalidad, en nuestro trabajo se registra una muerte intraútero y una muerte posnatal.
Respecto al sexo de los niños nacidos llama la atención a la baja ratio del 41,9% para varones (número de varones/número varones + hembras) en el grupo de AO, que es el que mayor número de nacimientos registra. Estos datos coinciden con los recientemente presentados por Fedder et al24 en este mismo año, que como bien puntualizan los autores, no es posible saber actualmente la razón de esta baja ratio, una posible causa puede ser el empleo de células germinales inmaduras.
No se han detectado malformaciones mayores -entendiendo por malformaciones mayores las que causan impedimento funcional o requieren intervención quirúrgica, o ambas-. Respecto a malformaciones menores, éstas están sin confirmar o pendientes de estudio. Los trabajos publicados coinciden en que las malformaciones congénitas en niños de ICSI empleando espermatozoides de epidídimo y testículo, no aparecen con una frecuencia mayor que en los niños nacidos por FIV o concepción natural. Sin embargo, dentro de las malformaciones congénitas en niños de ICSI, éstas se detectan específicamente en el sistemas urogenital, donde destacan las hipospadias24.
En general, la información recogida en este estudio nos indica que los niños con edades comprendidas entre los 8 años y 12 meses son sanos, con buen desarrollo psicomotor, adaptación escolar, y en los rangos de peso y talla para su edad. Si bien es cierto que los niños en general presentan un buen desarrollo, es necesario enfatizar la importancia de hacer un buen cribado paterno. Informar pertinentemente a los pacientes acerca del riesgo de transmitir aberraciones cromosómicas, de los cromosomas sexuales y de novo, así como los posibles problemas de fertilidad6. Se recomienda la realización de diagnóstico genético preimplantacional en todos estos casos límite25. Sería deseable realizar seguimiento evolutivo de los niños nacidos por estas técnicas y recoger los datos, tanto en el ámbito nacional como internacional, para corroborar su validez.
El "olvido" en la Ley sobre la utilización de espermatozoides no procedentes de eyaculado dejó a muchas parejas afectadas con este problema con las puertas cerradas. El revuelo ocasionado llevó a la Federación de Asociaciones para el Estudio de la Reproducción a realizar una reclamación al Ministerio de Sanidad y Consumo (MSC) para hacerle ver la realidad clínica, demanda de pacientes y que el empleo de espermatozoides no procedentes de eyaculado reúne las garantías de seguridad y eficacia que justificaría su inclusión en la ley. Pero dado que la tramitación del cambio en la Ley, con rango de real decreto, conllevaría un período muy largo, el MSC y la Comisión Nacional de Reproducción Asistida emitieron un documento en el que se considera una práctica provisional tutelada siempre que la autoridad sanitaria competente la autorice. Resumiendo, la técnica está bien implantada en los laboratorios, los resultados son satisfactorios y aunque la salud de los niños nacidos no parece verse comprometida de forma significativa, queda pendiente el elaborar estudios de seguimiento del desarrollo de los niños nacidos.
AGRADECIMIENTOS
Los autores agradecen a Cherola Sillero su colaboración en archivos.
Correspondencia:
Dra. M.V. Hurtado de Mendoza.
Laboratorio de Fecundación in Vitro.
Clínica Al-Andalus.
Avda. Reino Unido, 1. 41012 Sevilla. España.
Correo electrónico: victoria.hurtadom@ono.com