INTRODUCCIÓN
La extracción de espermatozoides testiculares en combinación con ICSI (intra-cytoplasmatic sperm injection) se ha demostrado como un método efectivo para el tratamiento de la azoospermia obstructiva y no obstructiva1-4. El éxito del ICSI con espermatozoides testiculares condujo a la utilización de estos espermatozoides congelados y descongelados5. El uso de la criopreservación de espermatozoides testiculares puede así reducir el número de procedimientos quirúrgicos necesarios para conseguir una gestación, evitando repetidas biopsias de testículo6. Sin embargo, los datos publicados que comparan resultados de ICSI con espermatozoides de testículo frescos frente a congelados, son motivo de controversia7-9. Aunque la tasa de gestación es comparable con ambos métodos10, parece ser que la movilidad de los espermatozoides testiculares puede mejorarse después de cultivo in vitro11, aunque no se conoce si la tasa de gestación e implantación puede verse afectada.
El objetivo de este trabajo es la optimización de los resultados de ICSI basándose en el método de procesamiento de los espermatozoides de testículo congelados y descongelados. Para ello, se comprueba la influencia del tiempo y momento de incubación (antes y después de la congelación) de los espermatozoides testiculares en la tasa de fecundación, división embrionaria, calidad embrionaria, tasa de implantación y tasa de gestación en ciclos de ICSI.
MATERIAL Y MÉTODOS
Pacientes
Se ha incluido en el estudio a 60 varones diagnosticados previamente de azoospermia obstructiva tras evaluación uroandrológica en la Clínica Tambre de Madrid. La media de edad fue de 35 años (rango, 28-47 años). Se han realizado un total de 90 ciclos de ICSI con espermatozoides de testículo.
La estimulación ovárica se realizó en todos los casos con antagonistas (Cetrotide® [Serono] u Orgalutran® [Organon]) y gonadotropinas recombinantes (Gonal® [Serono] o Puregon® [Organon]) o urinarias (Menopur® [Ferring]). Cuando se observó un folículo dominante de más de 18 mm con una concentración sérica de estradiol por folículo maduro de 200-300 pg/ml, se administró una dosis de 250 mg de hCG recombinante (Ovitrelle® [Serono]) para inducir la rotura folicular. La punción folicular se realizó 36 h después de la administración de la hCG.
Biopsia testicular
El procedimiento de la biopsia testicular es similar al descrito previamente por Devroey et al12, y la preparación de los espermatozoides testiculares está basada en la publicada por Liu et al11. En resumen, la muestra de tejido testicular se colocó en una placa de Petri con 2 ml de medio (Sperm-Prep [Medi Cult]). Después de la extracción del tejido conectivo que rodea los túmulos seminíferos con 2 portaobjetos, se dilaceró el tejido y se observó en un microscopio invertido la presencia de espermatozoides a x400 (Diaphot [Nikon]).
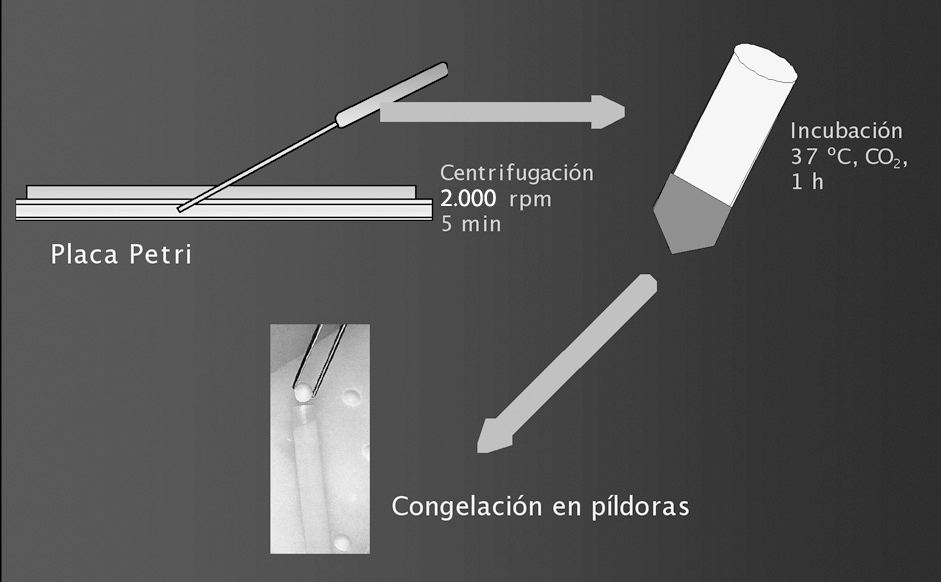
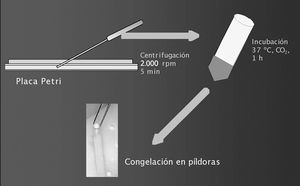
Tras la observación de algún espermatozoide, la muestra se transfirió a un tubo Falcon de 15 ml, retirando los restos de tejido que pudiera haber en la placa. La suspensión espermática se centrifugó a 300 g durante 5 min. Después de la centrifugación se desechó el sobrenadante y el sedimento se resuspendió en 0,2 ml de medio IVF (Medi Cult) (fig. 1). Una vez resuspendida la muestra se colocó 1 gota de 10 µl en un portaobjetos para observar espermatozoides móviles. La movilidad de los espermatozoides se clasificó como: inmóviles, movilidad de tipo c (sin desplazamiento) y movilidad de tipo a o b (con desplazamiento rectilíneo o no).
Figura 1. Preparación de las muestras de biopsia de testículo para su congelación: dilaceración del tejido en medio de cultivo Sperm-Prep para aislar espermatozoides, centrifugación, retirada del sobrenadante e incubación del sedimento con medio IVF.
Cultivo in vitro de espermatozoides testiculares
El medio utilizado para la incubación de la muestra testicular fue el IVF (Medi Cult), sin suplementos adicionales. El cultivo de los espermatozoides se realizó tras preparar una placa de ICSI con microgotas de 10 µl con la suspensión espermática y cubiertas con aceite mineral (Ovoil [Vitrolife]). La incubación se realizó en un incubador de CO2 al 6%, sin cambio del medio de cultivo.
Estimación de la movilidad espermática
La movilidad de los espermatozoides testiculares se estimó a diferentes intervalos de tiempo: 1, 2, 4, 6, 8, 24, 48 y 72 h, con un microscopio invertido (Diaphot [Nikon]) a 400 aumentos. Se realizó un recuento de un total de 100 espermatozoides para cada placa en el total de las microgotas, anotando el número de espermatozoides inmóviles y móviles progresivos o no.
Congelación y descongelación de espermatozoides
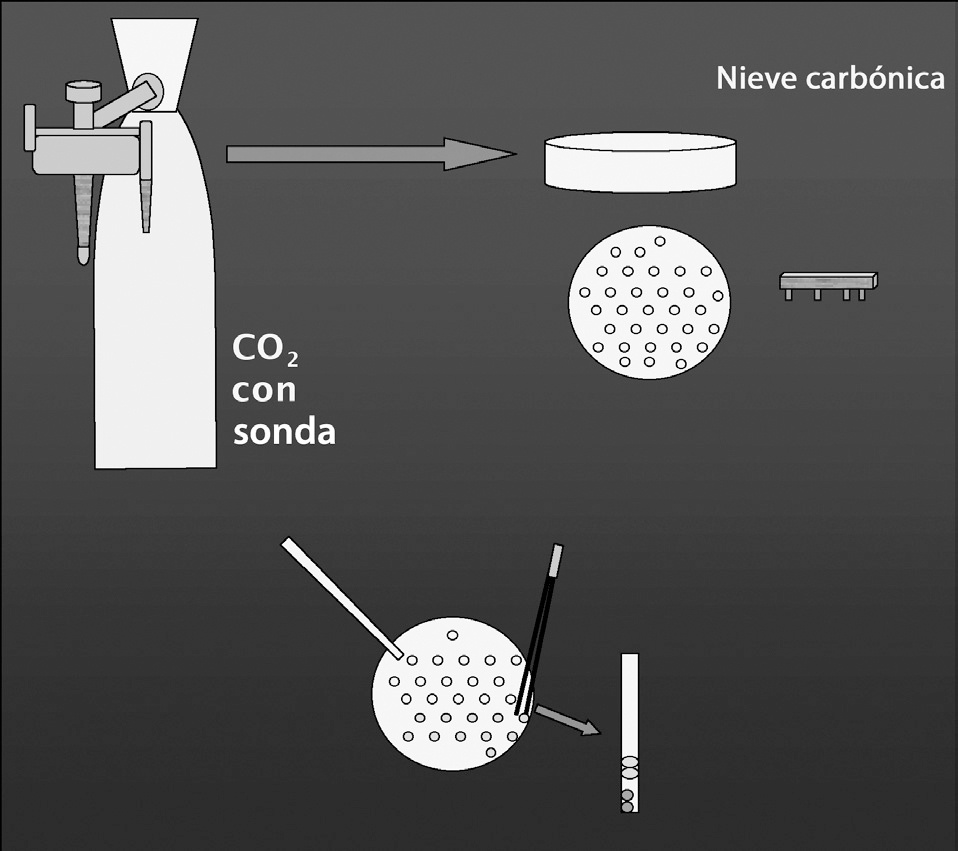
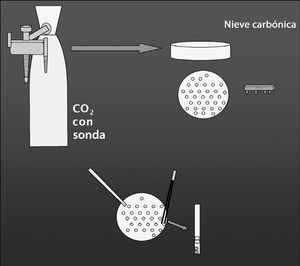
Después de la centrifugación y posterior resuspensión de la muestra testicular, se añadió el mismo volumen de crioprotector (CRIOSPERM) mezclándose bien. Esta muestra se dejó durante 45 min a 4 °C en el frigorífico y mientras tanto se preparaba el hielo seco (Snowpack [MG Gas Products]) (fig. 2). Éste es un procedimiento modificado del método de congelación de Nagase y Niwa13 adaptado a espermatozoides humanos14. Después de la refrigeración, se prepararon las píldoras de 10 µl, dejándolas en el hielo seco durante 2 min. Cada píldora se situó en un vial de 1 ml que se sumergió en nitrógeno líquido.
Figura 2. Preparación de los bloques de nieve carbónica (Snow-Pack) con una botella de CO2 con sonda, y formación de los orificios para congelar en píldoras.
Para la descongelación, se sacaron tantas píldoras como se necesitaron de los viales, y se trasladaron a un tubo Falcon de 15 ml, que se mantuvo a 37 °C en un baño María durante 3-5 min. Una vez descongelada la muestra se añadían 2 ml de medio IVF (Medi Cult), mezclándose bien. Después de homogeneizar la mezcla, se centrifugó a 300 g durante 5 min para descartar el crioprotector. Después de la centrifugación se retiró el sobrenadante y se añadió 1 ml de medio IVF (Medi Cult).
Los procedimientos de cultivo de los espermatozoides congelados y descongelados de testículo, así como el examen de la movilidad, son los mismos que los descritos previamente para espermatozoides en fresco.
Microinyección intracitoplasmática
El procedimiento del ICSI es similar al descrito por Van Steirteghem et al2. Los ovocitos se extraen mediante punción transvaginal guiada ecográficamente después de estimulación ovárica. A los ovocitos que extruyeron el primer corpúsculo polar se les realizó la microinyección con espermatozoides de testículo fresco o descongelado. Aproximadamente 18 h después del ICSI se determinó la fecundación como normal cuando se observaron 2 pronúcleos. Después de otras 24 h de cultivo in vitro se observaron los embriones, comprobando el número y la calidad de células en función del porcentaje de fragmentación, tamaño e igualdad de las blastómeras y presencia de vacuolas o multinucleación.
La transferencia embrionaria se realizó a las 48 o 72 h de la punción folicular, utilizando el catéter de Wallace (The Edwards-Wallace Embryo Replacement Catéter, Sims, Portex Ltd., Kent, UK).
La gestación se determinó por ecografía transvaginal con la presencia de saco gestacional con latido cardíaco a las 4 semanas de la transferencia embrionaria.
Grupos incluidos en el estudio
Grupo 1 (grupo control): espermatozoides de testículo en fresco de 15 pacientes (20 ciclos de ICSI) se cultivaron 4 h antes de realizar el ICSI.
Grupo 2: 34 ciclos de ICSI con espermatozoides de testículo previamente congelados de 20 pacientes. Las muestras se incubaron durante 4-6 h antes de la congelación, y el ICSI se realizó después de la descongelación espermática, cuando se encontraron espermatozoides móviles.
Grupo 3: 38 ciclos de ICSI con espermatozoides de testículo previamente congelados de 25 pacientes. Las muestras se congelaron sin incubación previa, y tras la descongelación se realizó un cultivo de los espermatozoides testiculares durante 4-6 h previo a la microinyección.
Estadística
Se realizó un test de 2 muestras (t-test) para analizar los cambios de movilidad antes y después del cultivo de espermatozoides. Para comprobar la diferencia entre los resultados de ICSI (fecundación, división, calidad embrionaria, gestación e implantación) se empleó un test de x2. Se consideraron como significativas las probabilidades < 5%.
RESULTADOS
Movilidad espermática en espermatozoides de testículo tras incubación
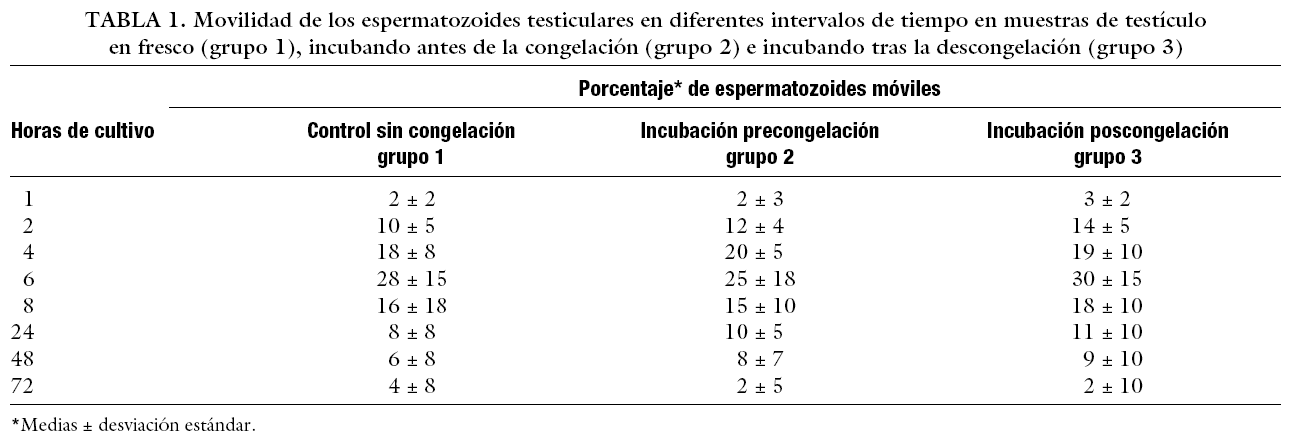
La movilidad de los espermatozoides de testículo mejoró significativamente en los 3 grupos después del cultivo. La movilidad alcanzó un pico en la mayoría de las muestras alrededor de las 6 h de cultivo, sin necesidad de suplementar los medios. No se encontró movilidad espermática en ningún caso después de las 72 h de cultivo. No se hallaron diferencias estadísticamente significativas en términos de número de espermatozoides móviles (progresivamente móviles y móviles no progresivos) entre los 3 grupos (tabla 1).
Resultados de la microinyección intracitoplasmática en los 3 grupos
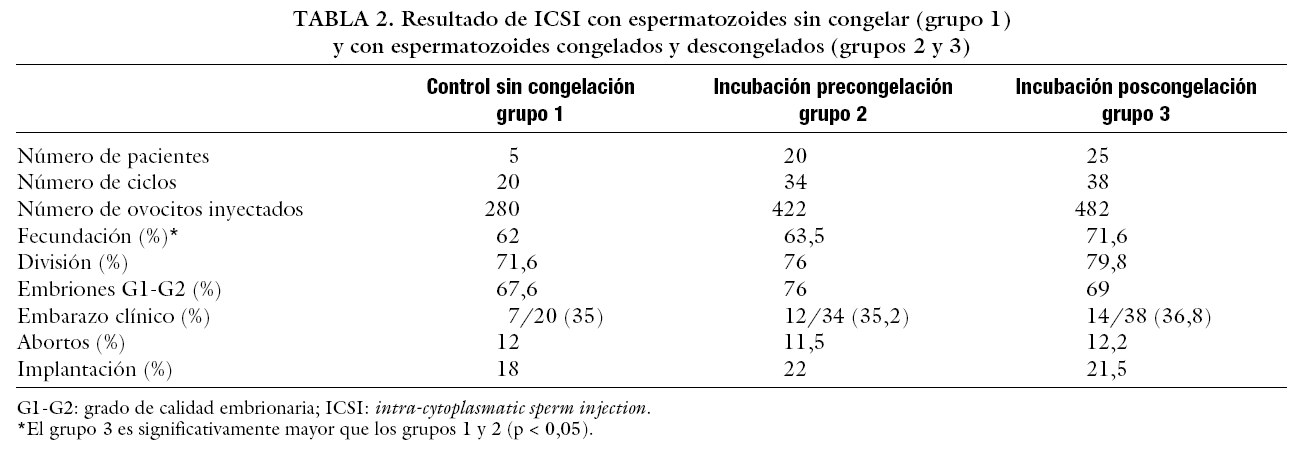
El resultado de ICSI con espermatozoides frescos y congelados, con y sin incubación previa (grupos 1, 2 y 3) se muestran en la tabla 2. La tasa de fecundación fue significativamente mayor en el grupo 3 (71,6%) (p < 0,05) y menor en los grupos 1 (62%) y 2 (63,5%).
No se encontraron diferencias estadísticamente significativas en el resto de los parámetros estudiados, tasa de división, número de embriones de buena calidad, tasa de gestación e implantación, entre los 3 grupos.
DISCUSIÓN
Varios autores han demostrado que realizando ICSI con espermatozoides testiculares frescos o congelados, los resultados son similares y que la congelación no afecta a los espermatozoides15-18. Considerando estos resultados, se podrían evitar repetidas biopsias testiculares congelando los espermatozoides extraídos del testículo en pacientes azoospérmicos. En consecuencia, algunos grupos han intentado mejorar los protocolos de congelación de espermatozoides testiculares19,20.
En nuestro deseo de desarrollar estrategias más eficientes con el uso de espermatozoides de testículo congelados, hemos comparado el número de espermatozoides móviles, la tasa de fecundación, la división, la calidad embrionaria, la gestación y la implantación empleando 2 métodos distintos: incubando 4-6 h antes de la congelación y después de la congelación espermática, y comparando a su vez con un grupo control sin criopreservación.
Nuestros resultados han demostrado que después de unas horas de incubación, en todos los grupos, la movilidad mejoró significativamente, alcanzándose el máximo aproximadamente a las 6 h en todos los grupos. Previamente, se ha observado los cambios en los patrones de movilidad durante el cultivo in vitro, describiéndose las implicaciones prácticas de utilizar espermatozoides testiculares para ICSI después de su maduración19. La movilidad de los espermatozoides testiculares en esta publicación alcanzó su máximo a las 72 h, y los resultados revelan que la criopreservación ejerce un efecto adverso en la tasa de supervivencia espermática, ya que el porcentaje de espermatozoides inmóviles aumenta significativamente tras la descongelación. Estas diferencias podrían estar relacionadas con los procedimientos utilizados en este estudio. Sin embargo, hasta ahora no se había descrito la influencia del tiempo de incubación de espermatozoides congelados y descongelados, y el momento de la incubación, en los resultados de ICSI.
En nuestro estudio, los espermatozoides de testículo cultivados durante un período de 4-6 h después de la descongelación ofrecieron las mejores tasas de fecundación (el 71,6 frente al 63,5 y al 62%). No se encontraron diferencias significativas en el resto de los parámetros.
Estos descubrimientos están en consonancia con otros estudios publicados previamente, los cuales no manifestaron diferencias de tasa de gestación entre utilización de espermatozoides frescos y congelados15-18. Sin embargo, nuestros resultados contrastan con los trabajos en los que se obtienen mejores resultados con espermatozoides frescos que con congelados21. Una posibilidad que pudiera resolver tales discrepancias es que los métodos de congelación varían entre estos grupos, y que la técnica de congelación y descongelación puede afectar significativamente a los resultados de ICSI. Son muy escasos los estudios comparativos para optimizar la preparación de tejido espermático, protocolos de congelación y crioprotectores empleados22.
En un estudio realizado por Nogueira et al 23, en el que se examinó con microscopia electrónica los espermatozoides testiculares antes y después de la congelación, se demostró que el principal daño que ejerce la congelación es en las membranas plasmática y acrosomal. Estos daños se observaron, sobre todo, en los espermatozoides maduros y en los últimos estadios de la espermatogénesis (espermátides alongadas). Esto sugiere que la maduración que ocurre durante el tiempo de incubación in vitro de los espermatozoides testiculares, no altera la capacidad de éstos para evitar los rigores de la criopreservación. En el caso de incubar espermatozoides testiculares antes de la congelación, parece que éstos pudieran ser más sensibles a la crioinjuria. Estos hallazgos podrían explicar por qué en nuestro estudio se demuestra una mejora en la tasa de fecundación con espermatozoides incubados después de la descongelación.
En un reciente trabajo, Wald et al24 encontraron resultados similares: igual tasa de gestación con espermatozoides de testículo frescos y descongelados, pero mayor tasa de fecundación con espermatozoides descongelados. Sin embargo, en este trabajo no se analiza la influencia en los resultados de la técnica de congelación empleada.
CONCLUSIÓN
Estos datos indican que un manejo más racional de las muestras de tejido testicular, en el caso de espermatozoides criopreservados, conllevaría una mejora en la movilidad espermática y mejor tasa de fecundación en ICSI. Un aumento en el porcentaje de fecundación y, por lo tanto, un mayor número de embriones obtenidos en un ciclo de ICSI con espermatozoides de testículo descongelados, permitiría una mejor selección para la transferencia embrionaria y la posibilidad de congelación de embriones, lo que permitiría, en caso de no gestación, más intentos futuros.
Correspondencia: Dra. R. Núñez Calonge.
Clínica Tambre.
Tambre, 8. 28002 Madrid. España.
Correo electrónico: rocio@clinicatambre.com