INTRODUCCIÓN
La determinación del sexo viene dada por los cromosomas sexuales. Así la penetración del ovocito por un espermatozoide portador del cromosoma X inducirá hacia el sexo femenino y si es portador de un cromosoma Y lo hará hacia el sexo masculino. Pero no siempre esto ocurre así y, en ocasiones, se puede encontrar con varones XX y con mujeres XY, por tanto, en algunos pacientes, hay una evidente discordancia entre el llamado sexo genético y el sexo gonadal1.
Normalmente es la presencia del cromosoma Y la que induce el desarrollo testicular en el embrión, y esto ocurre gracias a una región del brazo corto del cromosoma Y, llamada factor de determinación testicular (TDF)2, y más concretamente por la acción de un gen denominado SRY (sex-determining region Y). Este gen se localiza en el brazo corto del cromosoma Y (Yp11.2) y será el responsable del inicio de una cascada de interacciones de diversos genes, que finalizarán con la evolución de la cresta gonadal indiferenciada embrionaria hacia testículo. Por el contrario, normalmente ante la ausencia de este gen la evolución se declina hacia la formación del ovario.
La explicación de la existencia de varones con un sexo cromosómico femenino y, sin embargo, portadores de gónada masculina, radicaría en un posible fallo en la división meiótica de la espermatogénesis paterna, que permitiría la presencia errónea de algún fragmento del cromosoma Y en el brazo corto del cromosoma X3, lo que provocaría, en el caso de lograr la fecundación un espermatozoide X portador de dicho error, que el embrión ponga en marcha una cadena de fenómenos que originarían a un individuo cromosómicamente femenino con gónadas masculinas4-6.
La formación gonadal es, por tanto, un proceso de gran complejidad, en el que se ven involucrados un gran número de genes7, algunos conocidos como el SOX-9 y el FGF-98, que participan activamente induciendo la formación de estructuras de la vía seminal. Los genes DAX-1, SF-1, WT-1, DMRT y AMH, entre otros, estarán más implicados en el proceso de la formación testicular, proceso en el que, con toda seguridad, participan otros muchos genes, gran número de ellos aún hoy desconocidos. Pero, sin duda, es la presencia del gen SRY, y su correcta expresión, un factor clave y determinante en el proceso de la diferenciación sexual masculina del varón.
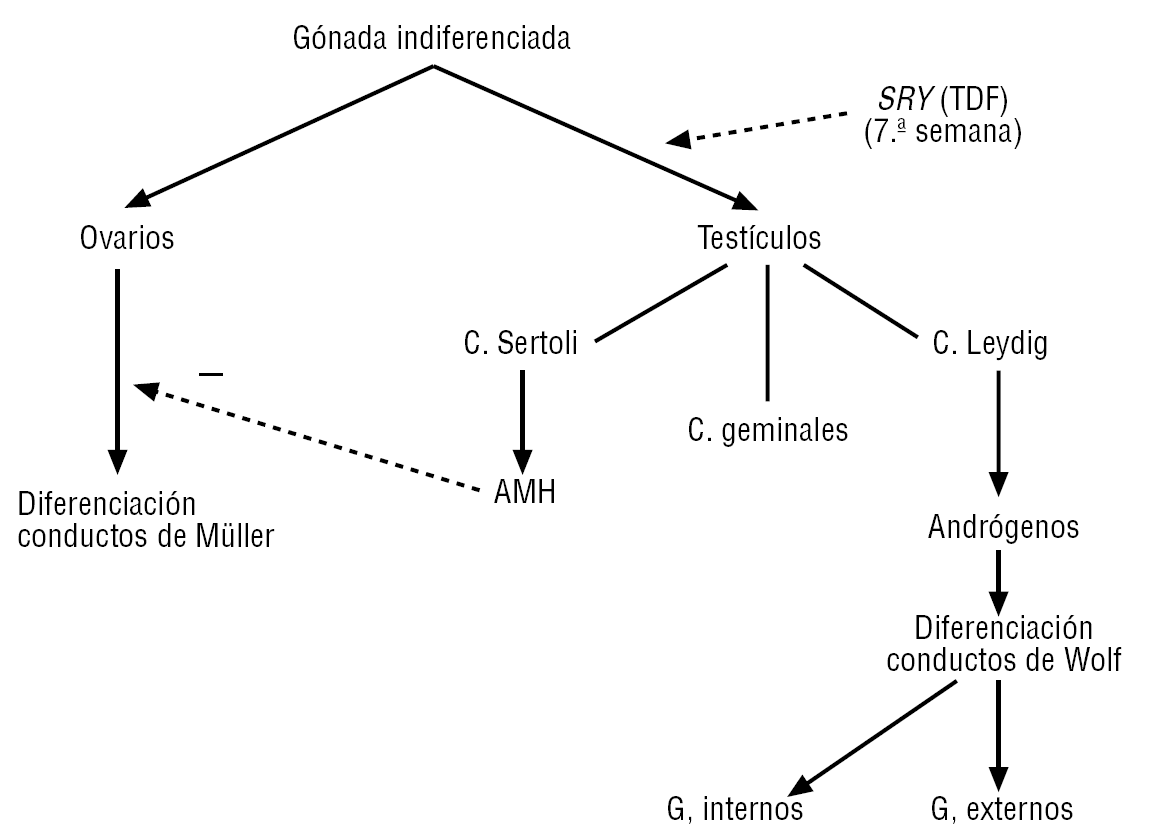
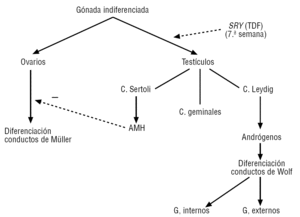
Esta diferenciación se inicia hacia la semana 6 de la vida embrionaria, completándose hacia las semanas 11-12, aunque el descenso del testículo ocurra más tardíamente9. En ausencia del gen SRY, los conductos de Müller, ante la falta de la hormona antimüllerina, inician su evolución provocando el desarrollo de los genitales femeninos10, al tiempo que se origina la involución de los conductos de Wolf (fig. 1).
Figura 1. Fases iniciales de la determinación sexual e implicación del gen SRY. El gen SRY se expresa hacia la semana 7 del desarrollo embrionario y es el principal determinante de la diferenciación de la gónada hacia testículo. Reproducida de Oliva R, Ballesta F, Oriola J, Clarià J. Genética médica. Barcelona: Publicacions i Edicions de la Universitat de Barcelona; 2003. AMH: hormona antimüllerina; TDF: factor de determinación testicular.
OBJETIVO
Estudiar la incidencia de varones 46XX en una consulta de esterilidad, sus características clínicas y de laboratorio, así como la posible presencia del gen SRY y su localización.
MATERIAL Y MÉTODOS
En el presente estudio se revisan 4 pacientes de un total de 4.560 varones que acudieron a nuestra consulta de andrología por una esterilidad conyugal, y que en su análisis cromosómico, realizado en linfocitos de sangre periférica, se detectó un cariotipo 46XX.
En estos 4 pacientes se practicó un estudio que incluía un mínimo de 2 seminogramas, en eyaculados obtenidos por masturbación, tras un período de abstinencia de 3-6 días y evaluados aplicando los criterios de la OMS, en caso de azoospermia ésta se ratificó mediante la ausencia de espermatozoides en el estudio del centrifugado de la muestra.
En los 4 pacientes se realizó una valoración clínica que incluía la determinación de su talla y peso, repartición del vello corporal y pubiano y exploración genital.
A todos los pacientes se les determinó, mediante sistemas de inmunoenzimoanálisis, sus valores plasmáticos de folitropina (FSH), lutropina (LH), testosterona, estradiol e inhibina B, estos últimos mediante sistemas de anticuerpos monoclonales de determinación de sus unidades βB y α, sistema que presenta un límite en la detección de valores < 15 pq/ml.
En estos pacientes también se practicó un análisis molecular por reacción en cadena de la polimerasa, determinando la presencia o ausencia de diversos marcadores moleculares a lo largo de todo el cromosoma Y. Mediante técnicas de hibridación in situ fluorescente (FISH), utilizando una sonda de pintado del cromosoma Y o una sonda específica del gen SRY (Yp11.2) a fin localizar el emplazamiento de dicho gen.
RESULTADOS
La incidencia de varones 46XX en nuestra consulta de esterilidad ha sido del 0,087%, cifra casi 20 veces superior a lo que cabría esperar en una población normal.
El estudio seminal de estos pacientes (tabla 1) evidenció un volumen eyaculado disminuido (hipospermia) en 3 de ellos, y normal en el cuarto. En cuanto al recuento espermático, todos los pacientes presentaron una azoospermia, corroborada tras el estudio del centrifugado del eyaculado.
Entre los antecedentes familiares y personales, ningún paciente presentó alguna incidencia que mereciera reseñarse.
A la exploración clínica todos los pacientes presentaban un fenotipo masculino con una talla y peso dentro de los rangos de normalidad, así como una repartición del vello corporal y pubiano normal, no se detectó la presencia de ginecomastia en ninguno de los pacientes (tabla 2). Tanto los pacientes como sus parejas referían una frecuencia y nivel satisfactorio en lo que se refiere a sus relaciones sexuales.
La exploración clínica evidenció una atrofia testicular bilateral, sin ninguna otra alteración peneana ni en la localización del meato uretral.
Los valores plasmáticos de gonadotrofinas se encontraban elevados, tanto de FSH como de LH, las determinaciones de testosterona se hallaron en rangos bajos, los de estradiol fueron normales y los de inhibina B indetectables (tabla 3).
El análisis molecular mostró en los 4 pacientes la presencia del gen determinante testicular SRY, responsable de la formación testicular y del fenotipo masculino, así como de otros marcadores del brazo corto del cromosoma Y.
En 3 de los pacientes, el estudio mediante FISH mostró que el material original del cromosoma Y se localizaba en los brazos cortos del cromosoma X, hallazgo que suele ser más frecuente en estos varones; sin embargo, merece destacarse que en el cuarto paciente y de forma que puede considerarse excepcionalmente atípica11, el gen SRY se localizó en los brazos largos del cromosoma 1 (tabla 4).
DISCUSIÓN Y CONCLUSIONES
Desde hace más de 50 años se relacionó la baja producción espermática a posibles factores cromosómicos, pero en los últimos años esta sospecha ha adquirido tal relevancia que creemos obligado el estudio cromosómico en todos lo factores masculinos, especialmente si éstos presentan alguna severidad12. Así, se calcula la presencia de alteraciones cromosómicas en un 21,6% de los varones azoospérmicos, en un 3,9% de lo varones con recuentos espermáticos de 1-10 x 106/eyaculado y en un 2,2% de los varones con recuentos de 21-40 x 106/eyaculado13.
La incidencia de varones 46XX en la consulta de esterilidad (0,087%) es casi 20 veces superior a la observada en la población general (0,005%)1, la presencia de esta alteración cromosómica con frecuencia se asocia a ciertas alteraciones genitales, como criptorquidias, hipospadias e incluso, para algunos autores, con ginecomastia; sin embargo, en nuestra casuística ninguno de los 4 pacientes estudiados presentaba alteraciones aparentes, salvo la atrofia testicular, cuya detección es un hallazgo consecuente a su esterilidad primaria, que lógicamente genera su azoospermia.
Una vez más se evidencia que los valores bajos de testosterona son de difícil traducción clínica y que, con frecuencia, cursan con unos caracteres secundarios y hábitos sexuales que pueden catalogarse como normales, pero que tal vez puedan explicar la hipospermia presente en 3 de los 4 pacientes estudiados.
El denominador común de todos estos pacientes es la azoospermia de mal pronóstico terapéutico reproductivo y que hace aconsejable el posible recurso a técnicas de inseminación artificial con semen donante, así como la atrofia testicular.
La presencia o ausencia del gen SRY no resuelve ni de lejos las grandes incógnitas en este terreno, ya que desde hace ya 20 años que se sospecha que en la determinación del sexo gonadal parecen implicados más de 48 genes, 20 estarían ligados al cromosoma X, 22 al Y y 2 a cromosomas autonómicos. También se ha observado que 1 de cada 100.000 mujeres presenta un cariotipo 46XY, algunas de ellas incluso con presencia del gen SRY; por el contrario, también se ha descrito algún caso de varón 46XX gen SRY negativo14,15, aunque lógicamente para establecer este diagnóstico es imprescindible un estudio exhaustivo de localizaciones anómalas o infrecuentes de este gen, como es el caso de uno de nuestros pacientes, antes de concluir su ausencia.
En la actualidad, se puede considerar el sexo desde diferentes prismas interpretativos:
Cromosómico: determinado por los cromosomas sexuales del individuo y, fundamentalmente, por la presencia del gen SRY.
Gonádico: determinado por el tejido que constituye las gónadas de dicho individuo.
Genitosomático: determinado por el aspecto de sus genitales externos y su fenotipo, generalmente ambos muy ligados.
Psíquico: determinado por la identificación sexual del propio individuo.
Social: determinado por el que la sociedad atribuye a dicho individuo.
Civil: determinado por el que se le atribuye a dicho individuo en el momento de su nacimiento y, por tanto, en su registro, lo que no siempre es tan fácil como cabría esperar.
Todos estos aspectos complejos, con importantes connotaciones, no tan sólo clínicas sino también psicosociales, incrementan el fascinante reto de la investigación en este complejo e interdisciplinario terreno de la medicina, obligando a un estudio completo de los pacientes con el fin de alcanzar un correcto diagnóstico16,17 que ayude a paliar los inconvenientes del paciente afectado. No debemos olvidar que la población afectada no debe considerarse como algo excepcional, ya que 1 de cada 2.500 nacidos puede presentar algún tipo de ambigüedad genital.
Correspondencia: Dr. J.L. Ballescá.
Institut Clínic de Ginecologia, Obstetrícia i Neonatologia.
Hospital Universitari Clínic-Institut d'Investigacions Biomèdiques August Pi i Sunyer (IDIBAPS). Barcelona. España.
Correo electrónico: ballesca@clinic.ub.es