La presente investigación se realizó con el objetivo de evaluar el potencial genotóxico del extracto oleoso de la semilla de Carapa guianensis para inducir anomalías en la morfología de la cabeza del espermatozoide en ratones machos Balb/c.
Materiales y métodosSe formaron 5grupos experimentales: un grupo placebo (Tween65 al 2%), 3 niveles de dosis del extracto (400, 1.000 y 2.000mg/kg), administrados por vía oral durante 35días, y por último un grupo control positivo tratado con ciclofosfamida (CF), en dosis de 50mg/kg por vía intraperitoneal durante 5días y 35días de reposo después de la última administración con el mutágeno. Se distribuyeron 8animales/grupo. Después de los 35días de administración se eutanizaron por dislocación cervical y se extrajeron ambos epidídimos para ser procesados y evaluados según esta técnica citogenética.
Resultados y discusiónLos resultados obtenidos entre controles y tratados con el extracto no difirieron en cuanto a la frecuencia de las diferentes anomalías de la cabeza del espermatozoide encontradas, y tampoco en la concentración espermática y de espermatozoides con gota citoplasmática. Sin embargo, sí difirieron controles y tratados contra el grupo tratado con CF, validando nuestros resultados. Se concluye que el extracto oleoso de la semilla de Carapa guianensis no posee potencialidades genotóxicas para inducir aumento en la frecuencia espontánea de la morfología de la cabeza del espermatozoide de ratones machos Balb/c.
This study has aimed to evaluate the genotoxic potential of Carapa guianensis seed oil extract to induce sperm head abnormalities in Balb/c mice.
Material and methodsFive experimental groups were formed: one placebo group (Tween65, 2%), three extract dose levels (400, 1000 and 2000mg/kg) administered orally for 35days and one positive control group treated with cyclophosphamide (CP) at a dose of 50mg/kg via intraperitoneally for 5 consecutive days and then 35days of rest after the last administration with the mutagen. Were distributed 8animals per group. The animals were euthanized by cervical dislocation 35days after the administration and the epididymis was extracted to proceed with the sperm head morphology assay.
Results and discussionThere were no significant differences in the results between the controls and those treated with the extract regarding frequency of the different sperm head anomalies or in the spermatic concentration and sperms with cytoplasmic drop. However, a difference was found between the controls and treated versus the CP treated group, validating our results. We have concluded that the oleaginous extract of Carapa guianensis seeds does not have genotoxic potentialities to induce an increase in the spontaneous frequency in the sperm head morphology of male Balb/c mice.
Carapa guianensis pertenece a la familia Meliaceae. Es una planta medicinal muy popular en varios países del mundo, y en Cuba es conocida como cedro macho.
La caracterización del aceite de la semilla de Carapa guianensis ha revelado la presencia de ácidos grasos merístico, palmítico, oleico, linoleico1,2, esteárico y ácido araquidónico3. Algunos tetraterpenoides también han sido aislados de la semilla de Carapa guianensis3.
También se ha observado que los tetraterpenoides obtenidos de la semilla de Carapa guianensis tienen una significativa actividad antialérgica, debida a la inhibición del factor nuclear kB y la supresión de la IL-5 y el CCL11/eotaxina4.
Recientemente se han descrito el potencial antioxidante y la capacidad como protector solar e insecticida del extracto oleoso de Carapa guianensis5-9. Esta planta abunda en el Caribe, especialmente en Belice, Trinidad y Tobago y Cuba6,8,9. Los estudios fitoquímicos de los extractos obtenidos en estas regiones denotan la presencia mayoritaria de ácidos grasos poliinsaturados y de compuestos fenólicos tales como taninos y limonoides.
Una vez que ha sido demostrado su efecto antioxidante mediante la administración oral del extracto durante 3semanas en ratas Sprague Dawley de ambos sexos, co-administradas con una sustancia oxidante donde se demostró su efecto protector a la formación de especies reactivas del oxígeno9, se hace necesaria la evaluación de su nivel de seguridad, al menos en los ensayos de toxicidad clásica de primera y segunda barrera10.
Teniendo en cuenta estos antecedentes, el objetivo de esta investigación fue evaluar el potencial genotóxico del extracto oleoso de la semilla de Carapa guianensis para inducir anomalías en la morfología de la cabeza del espermatozoide de ratones machos de la línea Balb/c.
Fue utilizada la línea Balb/c basándonos en los resultados de nuestras investigaciones, ya que al ser comparada esta línea con otras en este ensayo resultó ser el mejor biomodelo, experimentando baja frecuencia de anomalías en la cabeza del espermatozoide, alta concentración espermática y respuesta aceptable a clastógenos químicos como la ciclofosfamida (CF)11.
Además existen investigaciones que demuestran que el extracto oleoso obtenido de la semilla de Carapa guianensis provoca problemas de infertilidad en dosis repetidas, aunque no han sido investigadas para demostrar su relación directa con la fertilidad del macho12.
Materiales y métodosAnimalesSe utilizaron ratones Balb/c de ambos sexos adultos jóvenes (5-7semanas), procedentes del Centro de Producción de Animales de Laboratorio (CENPALAB, Cuba), cuyo peso corporal oscilaba entre 25-30g al término de la cuarentena (7días), durante la cual los animales se adaptaron a las condiciones del laboratorio. La temperatura se mantuvo en 24±2°C, la humedad entre 55±10% y los ciclos de luz-oscuridad fueron de 12h. El alimento administrado a los animales durante toda la experiencia fue pienso estándar para esta especie preparado en el CENPALAB. El acceso al agua y al alimento fue ad líbitum.
Obtención del extracto oleosoSe agregó N-hexano a razón de 2kg de semilla de Carapa guianensis previamente secado y triturado. Se dejó en reposo durante 60min y luego se filtró al vacío. El solvente se adicionó hasta que la muestra botánica del aceite se saturó y luego fue removido reduciendo presión. El rendimiento del extracto fue del 29% (v/w). Se calculó la densidad aparente del aceite (0,81g/ml), y este resultado fue utilizado para definir el volumen exacto que cada animal recibió. El aceite fue conservado a –20°C hasta su uso.
Administración y dosificaciónEl extracto oleoso se suspendió en Tween65 (2%) 2h antes de la administración, y las concentraciones se ajustaron semanalmente en función del aumento del peso corporal. Se propuso emplear la vía oral por ser la que coincide con la propuesta en la terapéutica.
Los animales se distribuyeron aleatoriamente (8ratones/grupo) en 5grupos experimentales: un grupo control de vehículo (Tween65 al 2%), 3 tratados con el extracto oleoso de Carapa guianensis (400, 1.000 y 2.000mg/kg) y un control positivo tratado con CF (N,N-bis [cloruro de etilo]-N’, O-esterdiamida del ácido fosfórico propinel). Las emulsiones realizadas con el extracto y vehículo se administraron mediante intubación gástrica (2ml/kg) durante 35días, en el horario comprendido de 10:00 a 11:00a.m. La CF se administró 5días consecutivos (50mg/kg) por vía intraperitoneal en el horario de 10:00 a 11:00a.m. y luego estuvieron 35días sin administrar, según se establece para este ensayo13.
La dosis menor del extracto ha sido empleada en estudios farmacológicos preclínicos3,6,14,15 y ha demostrado ser efectiva en los modelos contra Leishmania, cáncer de útero y como antioxidante, y 2 niveles superiores múltiplos de este (1.000 y 2.000mg/kg)14,15.
Observaciones clínicasSe realizaron 2observaciones clínicas diarias, en el horario comprendido entre las 8:30-10:30a.m. y en el horario de la tarde de 3:00-4:30p.m. Durante cada observación se tuvo en cuenta el estado clínico general del animal, lo cual incluyó la palpación para la detección de lesiones y de posibles afectaciones respiratorias, del sistema nervioso, cardiovascular, gastrointestinal, estado de la piel, pelo, coloración de las mucosas y ojos.
Ensayo de la morfología de la cabeza del espermatozoideEste ensayo se realizó de acuerdo a las normas de la ICH de 2005 sobre toxicología de la fertilidad del macho13,16. Para realizar este ensayo se procedió a extraer ambos epidídimos, los cuales se redujeron a pequeños fragmentos, siendo depositados en placas de Petri que contenían 3ml de solución isotónica de NaCl al 0,9%13. La muestra se homogenizó con pipetas Pasteur13.
Recuento de espermatozoidesEl contenido de la placa se colocó en un tubo graduado, al cual se le añadieron 0,05ml de tripsina al 0,25%, y transcurridos 5min de tripsinización se le añadieron 2ml más de NaCl al 0,9%. Luego se realizó una dilución del homogeneizado tripsinizado en NaCl-formol al 1% (1:10) y se colocó en una cámara de Neubauer, conectándose ambos lados de la cámara al microscopio Olympus BH-2 a 10×13,16,17.
Morfología del espermatozoideAl tubo que contenía la dilución del homogeneizado ya diluido se le añadieron 5gotas de eosina al 1%, dejándolo reposar durante 5min. Posteriormente se extendió una gota sobre una lámina seca y se colocó el cubreobjeto13,16,17. Se prepararon 2láminas por animal y se analizaron 500espermatozoides con la ayuda de un microscopio Olympus BH-2 a 40×. Las observaciones fueron realizadas «a ciegas» por 2observadores independientes para luego establecer un promedio entre ambos. El criterio de clasificación se basó en cabezas normales y anormales, que incluyen amorfas, banana, sin gancho y con 2colas13,16,17. Además se determinó el porcentaje de espermatozoides con gota citoplasmática (EGC) como índice de fertilidad, inmadurez celular y citotoxicidad18.
EutanasiaA todos los animales se les practicó la eutanasia por dislocación cervical teniendo en cuenta el tiempo de exposición a cada una de las sustancias evaluadas19.
Procedimientos éticosEste trabajo fue confeccionado sobre la base de buenas prácticas de laboratorio preclínico presentes en el reglamento nacional de aprobación de protocolos de investigación de la República de Cuba. Además, al comenzar esta investigación se obtuvo por escrito el consentimiento de aprobación del protocolo e informe por el comité institucional de ética para la experimentación animal de nuestras instituciones.
Análisis estadísticoSe procedió a verificar los supuestos para realizar el análisis de varianza. Los resultados obtenidos están distribuidos normalmente (normalidad, según el test de Kolmogorov-Smirnov), existe dependencia entre las observaciones y presentan homogeneidad de varianzas (prueba de Levene)13. Por ello, todos los resultados se analizaron mediante el método de análisis de varianza (ANOVA)13,17. El nivel de significación establecido fue α=0,05. Todos los análisis se realizaron empleando el paquete estadístico Statsoft for Windows, StatSoft, Inc. (2003), STATISTICA (data analysis software system), versión 6.
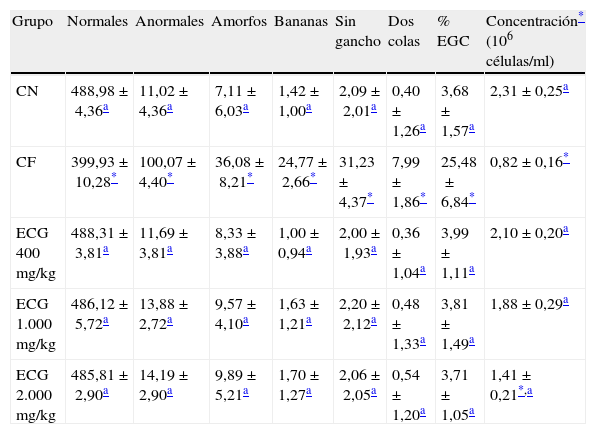
ResultadosNo hubo muertes durante el estudio ni se detectaron signos clínicos de toxicidad. No hubo diferencias significativas entre grupos tratados y controles en las variables que miden las diferentes anomalías en la cabeza del espermatozoide (variables genotóxicas); sin embargo, en el componente que mide citotoxicidad sí hubo diferencias entre el grupo control negativo y la dosis máxima administrada (2.000mg/kg) (tabla 1). El porcentaje de EGC se comportó de forma similar entre controles y tratados, sin diferencias significativas entre los promedios de estos.
Efecto del extracto oleoso de la semilla de Carapa guianensis en la morfología de la cabeza del espermatozoide en ratones machos Balb/c
| Grupo | Normales | Anormales | Amorfos | Bananas | Sin gancho | Dos colas | % EGC | Concentración* (106 células/ml) |
| CN | 488,98±4,36a | 11,02±4,36a | 7,11±6,03a | 1,42±1,00a | 2,09±2,01a | 0,40±1,26a | 3,68±1,57a | 2,31±0,25a |
| CF | 399,93±10,28* | 100,07±4,40* | 36,08±8,21* | 24,77±2,66* | 31,23±4,37* | 7,99±1,86* | 25,48±6,84* | 0,82±0,16* |
| ECG 400 mg/kg | 488,31±3,81a | 11,69±3,81a | 8,33±3,88a | 1,00±0,94a | 2,00±1,93a | 0,36±1,04a | 3,99±1,11a | 2,10±0,20a |
| ECG 1.000 mg/kg | 486,12±5,72a | 13,88±2,72a | 9,57±4,10a | 1,63±1,21a | 2,20±2,12a | 0,48±1,33a | 3,81±1,49a | 1,88±0,29a |
| ECG 2.000 mg/kg | 485,81±2,90a | 14,19±2,90a | 9,89±5,21a | 1,70±1,27a | 2,06±2,05a | 0,54±1,20a | 3,71±1,05a | 1,41±0,21*,a |
Determinaciones en 500 células/animal.
CF: control positivo, ciclofosfamida 50mg/kg por vía i.p. durante 5 días consecutivos; CN: control negativo; ECG: extracto oleoso de Carapa guianensis (administración por vía oral durante 35días); EGC: espermatozoides con gota citoplasmática.
En los grupos tratados con el extracto el promedio de espermatozoides anómalos de tipo amorfo fue entre 8,33 y 9,89, y para el caso de los de tipo banana estuvo entre 1,00 y 1,70. Los espermatozoides sin gancho se presentaron en una frecuencia entre 2,00 y 2,20 como promedio en 500células registrables, y los que tenían 2colas se presentaron como promedio entre 0,36 y 0,54. El porcentajeo de EGC estuvo entre 3,71 y 3,99, y la concentración de espermatozoides en el epidídimo experimentó resultados entre 1,41 y 2,10×106células/ml.
El grupo tratado con CF como control positivo sí experimentó diferencias significativas con los controles y tratados con el extracto en todas las variables medidas en este ensayo, tanto en las variables que miden daño genotóxico como las que miden daño citotóxico.
DiscusiónLos resultados que se aprecian en la tabla 1 demuestran que el tratamiento con el extracto oleoso de la semilla de Carapa guianensis por vía oral durante 35días en ratones Balb/c machos mantuvo los índices espontáneos del número de anomalías en la morfología de la cabeza del espermatozoide. De igual forma, no interfirió en la división celular, aunque la dosis máxima evaluada difirió con el control negativo y con el control positivo, con resultados intermedios en la concentración espermática.
Resultados similares obtuvieron Costa et al.12 cuando evaluaron el extracto oleoso de esta planta en estudios toxicológicos reproductivos, donde hubo una ligera disminución de la fertilidad en ratas Wistar en la dosis máxima, sin diferir con los controles.
Los resultados obtenidos en la morfología de la cabeza del espermatozoide en los animales tratados con las diferentes dosis del extracto coinciden sin diferir con los reportados para esta especie y línea en particular11.
Además, la concentración espermática obtenida en los grupos tratados con el extracto en las dosis de 400 y 1.000 tampoco difirió con los datos basales reportados para esta especie y línea11. Los resultados de la concentración espermática en el grupo de 2.000mg/kg, además de diferir con el grupo control negativo y positivo, también difirió con los datos espontáneos de citotoxicidad reportados para esta línea de ratón11.
El hecho de que se hayan reportado diferencias entre los tratados con el extracto y controles negativos contra el grupo tratado con CF valida la conducción de nuestro ensayo, dando mayor confiabilidad a nuestros resultados. Además, estos resultados son consistentes con los reportados para la CF en esta especie y línea, utilizando inclusive otros esquemas de tratamiento11,20,21.
El D-004, un extracto con similar composición en ácidos grasos, tampoco modificó la concentración espermática ni la frecuencia en las morfoanomalías de la cabeza del espermatozoide en ratones OF-1 tratados por vía oral con dosis máximas del extracto oleoso de Roystonea regia de 1.500mg/kg22. Además, estos resultados fueron consistentes al evaluarse en ratas SD en dosis de 2.000mg/kg utilizando este mismo ensayo23.
Los resultados de genotoxicidad obtenidos en este ensayo concuerdan con los reportados en el ensayo de micronúcleos en este mismo extracto, donde dosis de 2.000mg/kg no modificaron la formación espontánea de micronúcleos en eritrocitos de médula ósea24, sin clasificar como genotóxico este ensayo ni el biomodelo utilizado24. Sin embargo, hubo una disminución, aunque no significativa, al compararse con los controles en el indicador eritrocitos policromáticos/eritrocitos normocromáticos, índice que mide el componente citotóxico de este ensayo en los ratones macho24.
El porcentaje de EGC no se modificó, y se demostró que tiene un gran componente oxidativo como indicador de fertilidad por la formación de especies reactivas del oxígeno. Este hallazgo morfológico está relacionado directamente con la aparición de infertilidad, inmadurez celular y citotoxicidad. El hecho de que el extracto no haya aumentado y además haya mantenido la frecuencia espontánea de aparición de EGC en la línea de ratón utilizada concuerda con las propiedades antioxidantes ya reportadas con anterioridad, al ser rico en ácidos grasos y terpenoides9.
Es importante comentar que la ausencia de efecto mutagénico y citotóxico del extracto oleoso de Carapa guianensis observado en este estudio no se relaciona con una inadecuada exposición a la sustancia ensayo, ya que las dosis por vía oral de este producto entre 100 y 350mg/kg, inferiores a las utilizadas en el presente estudio, han producido efectos farmacológicos importantes3-6,9,12.
En conclusión, la administración por vía oral de dosis repetidas del extracto oleoso de la semilla de Carapa guianensis (400, 1.000 y 2.000mg/kg) durante 35días no posee potencialidades genotóxicas para inducir aumento en la frecuencia espontánea de la morfología de la cabeza del espermatozoide de ratones machos Balb/c.
Responsabilidades éticasDerecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Protección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
FinanciaciónEsta investigación obtuvo financiación del Instituto Finlay y del Instituto de Farmacia y Alimentos de la Universidad de La Habana.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.