Realizar un análisis descriptivo en pacientes diagnosticados de cáncer testicular primario y valorar posibles factores predictores de recidiva tumoral, con el fin de establecer seguimientos individualizados.
Material y métodosEstudio longitudinal retrospectivo con una cohorte de 91 pacientes intervenidos de orquiectomía radical por tumor testicular primario entre enero del 2004 y diciembre del 2014. Las variables analizadas fueron: motivo de consulta, características ecográficas, marcadores tumorales (AFP, LDH Y β-HCG), estadio tumoral, anatomía patológica, tratamiento y presencia de recaída. Para el estudio de la recaída se han realizado una curva de Kaplan-Meier y una regresión logística para valorar factores predictores.
ResultadosLa edad media fue de 31,8±10,4 años. El motivo de consulta más frecuente fue masa indolora (71,1%), seguido de dolor testicular (24,4%). En la ecografía la mayoría presentaban una masa única (78,3%) y heterogénea (85,4%). El 71,4% de los casos se encontraban en estadio i, el 24,2% en estadio ii y 4,4% en estadio iii. En 55 pacientes se realizó únicamente orquiectomía radical, en 34 se asoció quimioterapia y en 2 se aplicó radioterapia. Durante el tiempo de seguimiento han recaído 14 pacientes (15,38%) y ha habido un fallecimiento. De las 14 recaídas, 9 ocurrieron durante el primer año. El único factor predictor de recidiva detectado fue un nivel elevado de β-HCG.
ConclusiónEl cáncer testicular suele diagnosticarse en un estadio localizado y tiene altas tasas de curación. Las recidivas aparecen habitualmente en los primeros años de seguimiento y el único factor predictor hallado en nuestra experiencia es una β-HCG elevada.
To perform a descriptive study in patients diagnosed with testicular cancer and analyze the potential risk factors in order to establish an individualized follow up.
Material and methodsWe performed a longitudinal retrospective study from January 2004 to December 2014 in 91 patients with testicular cancer. They underwent to radical orchiectomy due to testicular cancer at our center. We analyzed the reason for consultation, ultrasound characteristics, tumor markers (AFP, LDH and bHGC), tumor stage, pathology, treatment and relapses during the follow up. To analyze the risk factors, we used the Kaplan Meier curve and logistic regression.
ResultsThe mean age was 31.8±10.4. The most frequent reason for consultation was painless lump (71.1%), following by testicular pain (24.4%). The main scrotal ultrasound feature was solitary tumor (78.3%) and heterogeneous (85.4%). The stage I was present in 71.4% of the cases, 24.2% were stage II and 4.4% were stage III. Regarding the treatment, 55 patients underwent to radical orchiectomy, 34 received adjuvant chemotherapy and 2 adjuvant radiotherapy. 14 (15.38%) patients had a relapse and one patient died from testicular cancer. Nine relapses from fourteen have been during the first year after the initial treatment. We only found that a bHCG high level is a predictive factor of relapse.
ConclusionTesticular cancer is diagnosed in an early stage and it has a high cure rate. The relapse has been during the first year of follow up. In our experience, we identified bHCG high level as predictor factor.
El cáncer de testículo es una entidad relativamente rara, representando aproximadamente el 1% de todas las neoplasias que afectan al varón1. Sin embargo, es el cáncer más frecuente en varones jóvenes (15-35 años de edad)2, con un aumento progresivo de su incidencia a nivel mundial desde la década de 1960. Presenta una distribución geográfica característica, siendo más frecuente en varones caucásicos que en varones de raza negra3. Específicamente en la población española la incidencia de este tipo de neoplasias ha pasado de 1,2 por 100.000 hombres en 1978 a 3,8 por 100.000 hombres en el año 2000; sin embargo, la mortalidad prácticamente no ha variado1.
Histológicamente, un 95% corresponde a tumores de células germinales4, de los cuales la mitad aproximadamente corresponde a seminomas y el resto a tumores no seminomatosos (coriocarcinoma, carcinoma embrionario, teratoma y tumor del saco vitelino)5,6.
En el momento del diagnóstico, la mayoría de los pacientes se encuentran en estadios tempranos de la enfermedad (i-ii)6 con un buen pronóstico. Sin embargo, pacientes con tumores no seminomatosos tratados solo mediante orquiectomía presentan recaídas de hasta el 30% en 5 años7, lo que resalta la importancia actual del abordaje multidisciplinar, con tratamiento quirúrgico, quimioterápico (agentes derivados del platino) y, en ocasiones, radioterápico, lo que en nuestros días permite una supervivencia cáncer específica a 5 años superior al 95%8.
Nuestro objetivo es valorar el comportamiento de este tipo de tumor en una serie de pacientes tratados en nuestro servicio. Con ello pretendemos conocer si existen factores que predigan la recaída tumoral en nuestros pacientes con el fin de poder establecer tratamientos y seguimientos individualizados.
Material y métodosEn este estudio longitudinal retrospectivo, la población evaluada se corresponde con los pacientes diagnosticados de tumor testicular primario en nuestro centro, durante el periodo comprendido entre el 1 de enero del 2004 y el 31 de diciembre del 2014. Se ha incluido a todos los varones intervenidos mediante orquiectomía radical por cáncer testicular primario durante estos 11 años, independientemente de la edad, y se ha excluido a los pacientes con cáncer testicular metastásico o con infiltración leucémica.
Para cada paciente se ha estudiado las siguientes variables: edad, presencia de factores de riesgo para cáncer testicular, motivo de consulta, características ecográficas (tamaño tumoral, número, ecogenicidad y presencia de microcalcificaciones y lesiones quísticas), niveles de marcadores tumorales en el momento del diagnóstico, estadio tumoral, tratamiento aplicado, hallazgos histológicos, presencia de recidiva tumoral y momento de ocurrencia de ésta.
En cuanto a los marcadores tumorales, se han evaluado alfafetoproteína (AFP), gonadotropina coriónica humana β (β-HCG) y lactato deshidrogenasa (LDH). Se han tomado los siguientes valores de normalidad9: para AFP < 15ng/mL, para β-HCG < 5 mIU/mL y para LDH < 460 U/L. La histología se ha agrupado según la clasificación de la Organización Mundial de la Salud de 2004 en tumores seminomatosos, tumores de células germinales no seminomatosos (TCGNS) y otros tumores10. En cuanto al estadio tumoral, se ha empleado la clasificación TNM de la Unión Internacional Contra el Cáncer (UICC) de 200911: estadio i, enfermedad localizada sin afectación ganglionar ni de órganos a distancia; estadio ii, extensión únicamente a ganglios regionales, y estadio iii, enfermedad diseminada a órganos a distancia.
Para el análisis estadístico se ha utilizado el Programa SPSS v21. Para el estudio de asociaciones se han empleado los test de Fisher, chi al cuadrado y U de Mann-Whitney con un nivel de significación p ≤ 0,05, y para el estudio de la recidiva el test de supervivencia Kaplan-Meier y la regresión logística.
ResultadosLa población estudiada se corresponde con una cohorte de 91 pacientes diagnosticados de tumor testicular. La edad media de los pacientes fue 31,8±10,4 años. El motivo de consulta más frecuente fue el hallazgo de una masa indolora (71,1%), seguido de dolor testicular (24,4%). En 3 casos (3,3%) el motivo de consulta fue inflamación testicular y sólo en un caso (1,1%) se detectó como hallazgo casual durante el estudio de infertilidad. En cuanto a los factores de riesgos descritos para cáncer testicular12-15, en 5 casos (5,5%) había antecedentes de tumor testicular contralateral, en 4 (4,4%) antecedentes de criptorquidia y 3 (3,3%) presentaban infertilidad. En el 79,1% de los pacientes no hallamos factores de riesgo.
Se han evaluado las características ecográficas de las lesiones: el tamaño tumoral medio fue de 4,46±2,65cm; en el 85,4% de los casos la lesión tenía un aspecto ecográfico heterogéneo y en el 14,6% homogéneo; en la mayoría se detectó un nódulo único (78,3%) y en menor porcentaje se objetivaron varios nódulos testiculares (14,6%); además, en el 29% de los pacientes se evidenció la presencia de microcalcificaciones testiculares y en el 14,5% de quistes testiculares.
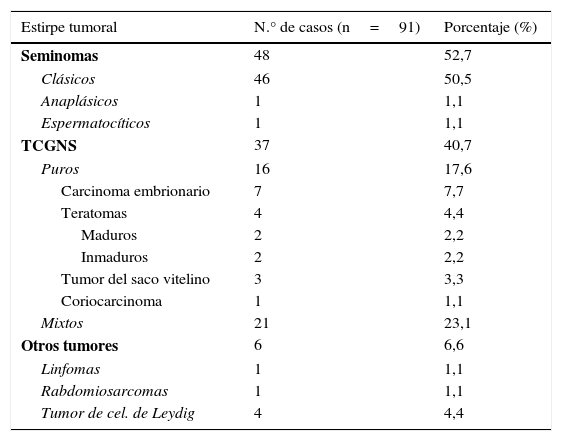
Si hablamos de los hallazgos histológicos, encontramos que la estirpe histológica más frecuente fue el seminoma puro (52,7%), seguida de los TCGNS mixtos (23,1%) y puros (17,6%). Los tipos histológicos se describen más detalladamente en la tabla 1. En cuanto a la extensión de los tumores analizados, en el 12,1% de los casos se detectó invasión de la rete testis y en 28,6% invasión vascular.
Tipos histológicos
| Estirpe tumoral | N.° de casos (n=91) | Porcentaje (%) |
|---|---|---|
| Seminomas | 48 | 52,7 |
| Clásicos | 46 | 50,5 |
| Anaplásicos | 1 | 1,1 |
| Espermatocíticos | 1 | 1,1 |
| TCGNS | 37 | 40,7 |
| Puros | 16 | 17,6 |
| Carcinoma embrionario | 7 | 7,7 |
| Teratomas | 4 | 4,4 |
| Maduros | 2 | 2,2 |
| Inmaduros | 2 | 2,2 |
| Tumor del saco vitelino | 3 | 3,3 |
| Coriocarcinoma | 1 | 1,1 |
| Mixtos | 21 | 23,1 |
| Otros tumores | 6 | 6,6 |
| Linfomas | 1 | 1,1 |
| Rabdomiosarcomas | 1 | 1,1 |
| Tumor de cel. de Leydig | 4 | 4,4 |
TCGNS: tumor de células germinales no seminomatosas.
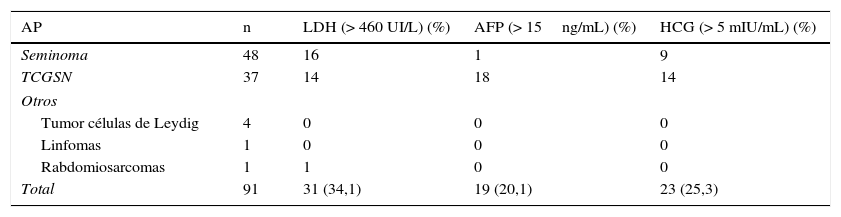
Con respecto a los marcadores tumorales, la AFP se encontraba elevada en el 20,1% de los casos, la β-HCG en el 25,3% de los casos y la LDH en el 34,1%. Su relación en cuanto a estirpe tumoral se representa en la tabla 2. La elevación de la AFP es claramente mayor en los tumores no seminomatosos y la β-HCG se encuentra más frecuentemente aumentada en los seminomas, siendo en ambos casos la diferencia estadísticamente significativa. En el caso de la LDH, no hay diferencias en cuanto a su elevación con respecto a la histología tumoral.
Marcadores tumorales por estirpe tumoral
| AP | n | LDH (> 460 UI/L) (%) | AFP (> 15ng/mL) (%) | HCG (> 5 mIU/mL) (%) |
|---|---|---|---|---|
| Seminoma | 48 | 16 | 1 | 9 |
| TCGSN | 37 | 14 | 18 | 14 |
| Otros | ||||
| Tumor células de Leydig | 4 | 0 | 0 | 0 |
| Linfomas | 1 | 0 | 0 | 0 |
| Rabdomiosarcomas | 1 | 1 | 0 | 0 |
| Total | 91 | 31 (34,1) | 19 (20,1) | 23 (25,3) |
TCGNS: tumor de células germinales.
En el momento del diagnóstico, 65 de los pacientes (71,4%) se encontraban en estadio i o enfermedad localizada, 22 (24,2%) en estadio ii o con adenopatías regionales, y 4 (4,4%) en estadio iii o enfermedad diseminada a distancia. De los 22 pacientes en estadio ii, 14 (63,6%) se correspondían a seminomas y 8 (36,4%) a TCGSN, y de los 4 con estadio iii al diagnóstico, 3 se trataban de TCGSN y uno de seminoma.
Con respecto al tratamiento, para los pacientes con seminoma en estadio i, en el 76% se empleó orquiectomía como monoterapia, en el 16% se añadió quimioterapia adyuvante y en el 6% radioterapia adyuvante. Dentro de los TCGNS en estadio i, 21 (81%) fueron tratados mediante orquiectomía y 5 (19%) mediante orquiectomía y quimioterapia. De aquellos en estadio ii, 5 (22%) fueron tratados solo mediante cirugía y 17 (88%) mediante cirugía y quimioterapia. La totalidad de pacientes con tumores en estadio iii recibieron tratamiento combinado (cirugía más quimioterapia), independientemente del tipo histológico de tumor.
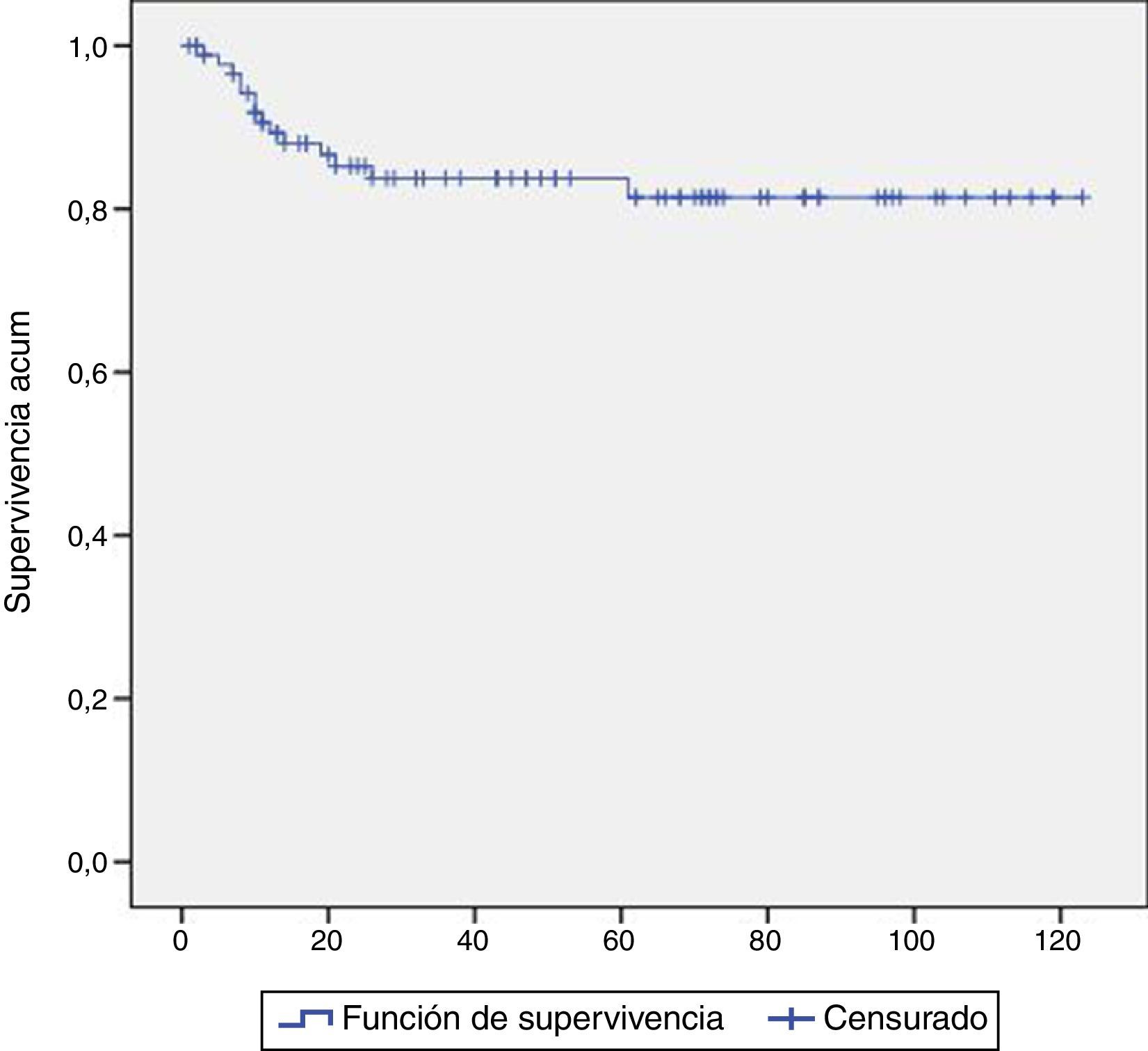
Para estudiar la incidencia y el momento de ocurrencia de la recaída hemos elaborado una curva de Kaplan-Meier (fig. 1), en la que hemos objetivado 14 recaídas durante el seguimiento y 2 pérdidas de seguimiento. Nueve de las 14 recaídas tuvieron lugar durante el primer año de seguimiento. A los 26 meses de seguimiento ya habían recaído 13 de las 14 recaídas, es decir, el 98,2% de las recaídas se produjeron durante los primeros 2 años de seguimiento. La recaída más tardía se produjo a los 61 meses de seguimiento.
De los 14 casos que recidivaron, 7 (50%) se trataban de seminomas, 6 (42,9%) de TCGNS y un teratoma (7,1%). Con respecto al estadio, 10 de los 14 que recidivaron se encontraban en estadio i al diagnóstico y los 4 restantes en estadio ii. El tratamiento llevado a cabo para la recaída fue de quimioterapia en 11 casos y de linfadenectomía retroperitoneal en 3 casos. A pesar de la curación, en 3 casos se detectó una segunda recidiva, una de las cuales derivó en fallecimiento del paciente (TCGNS mixto: carcinoma embrionario+teratocarcinoma).
Por último, para estudiar la presencia de factores predictores de la recidiva, se ha realizado un análisis univariante para cada posible factor y una regresión logística. Solo hemos encontrado relación entre la presencia de recidiva y la detección de un nivel elevado de β-HCG al diagnóstico (8 de los 14 que recidivaron tenían un nivel de β-HCG elevado), con una p=0,028. En nuestra experiencia, no hemos encontrado relación entre la recidiva y el resto de los factores estudiados (edad, características ecográficas, histología, AFP y LDH, estadio y tratamiento).
DiscusiónLa edad media de nuestros pacientes fue de 31,8 años, algo inferior a las descritas por Moreno et al.16 o Scheiden et al.17 (en torno a 33,6 años), aunque superior a la hallada por Cooper et al.18 de 26,6 años. Estas variaciones observadas en la edad media podrían atribuirse a la presencia de una proporción diferente en los tipos histológicos de tumor testicular en cada estudio.
Es destacable el aumento progresivo de la incidencia de cáncer testicular en los últimos años, de manera que en 2004 diagnosticamos 3 casos, 8 casos en 2005 y hasta 11 casos por año en 2013 y 2014. Con respecto a esto, Shanmugalingam et al.1 concluyeron que España es el país europeo con mayor incremento en la incidencia de cáncer testicular. Se han propuesto diversas teorías para tratar de explicar este aumento de incidencia a nivel mundial, postulando factores geográficos, genéticos, ambientales y hormonales; sin embargo, ninguno ha podido ser confirmado1.
En cuanto al modo de presentación clínica, nuestros hallazgos difieren algo de los descritos por Fernández Gómez et al.19, en cuya serie describen el aumento de volumen testicular como signo prioritario en el 91% de los casos frente al 71% de nuestra muestra. Con respecto a la presencia de tumor testicular contralateral, en nuestro caso dicha asociación se dio en el 5,5% de los pacientes, en concordancia con el 5% de otras series revisadas20. El 4,4% de nuestros pacientes presentaron antecedentes de criptorquidia, algo por debajo al 5-10% descritos por Thorup et al.21 y al 10,9% encontrado por Fernández Gómez et al.19. El tamaño testicular medio de nuestra serie (4,4cm) fue similar al de otras series6,22. Nuestra distribución histológica también concuerda con lo descrito en otras publicaciones, que detectan una proporción similar entre seminomas y TCGNS, con un porcentaje mucho menor de otras estirpes tumorales4-6,16,22.
Con respecto a los marcadores tumorales, en nuestra serie hemos detectado una elevación de los mismos en menor proporción que la observada en otras series más amplias, como la de Miki et al.23, de 1.121 pacientes, que observaron elevación de LDH en el 53% frente a nuestro 34%, 50% para β-HCG frente a nuestro 25% y 25% para AFP frente a nuestro 20%. Independientemente de las series, parece evidente que la sensibilidad presentada por los marcadores tumorales es baja (en el mejor de los casos de 53%), por lo que se puede afirmar que su utilidad para el diagnóstico de tumor testicular es bastante limitada, adquiriendo mayor relevancia en el seguimiento, fundamentalmente para la valoración de una posible recaída tumoral.
Si valoramos el estadio tumoral en el momento del diagnóstico, nuestro datos son similares a los de otros estudios, observando que la mayoría de los pacientes se encuentran en estadio i o localizado: 71% en nuestra serie, 77% en la serie de Moreno et al.16 y 69% en la aportada por el SEER24.
Uno de los aspectos que más se ha modificado en los últimos años ha sido el tratamiento empleado. En el caso de los seminomas en estadio i, en el 76% de nuestros casos se empleó sólo cirugía, en el 18% quimioterapia adyuvante y solo en 2 casos (6%) radioterapia adyuvante. Estos resultados difieren de los presentados por Moreno et al.16, quienes utilizaron quimioterapia adyuvante en el 47% y radioterapia en el 17% de los seminomas localizados, y los de Miki et al.23, que emplearon radioterapia en el 15%. Se observan diferencias más importantes con series más antiguas, como las de Lakomý et al.25 (de 2000 a 2004) o las de Detti et al.26 (de 1962 a 2011), que emplean radioterapia adyuvante en torno al 95% de los pacientes con seminoma en estadio i. Por tanto, se puede decir que se observa una tendencia al empleo cada vez menor de la radioterapia para los seminomas, adquiriendo mayor importancia la quimioterapia. Por otra parte, se observa cómo, tanto en el caso de los seminomas como en el de los TCGNS, la quimioterapia adyuvante se emplea con más frecuencia a medida que el estadio es más avanzado.
En cuanto a la recaída, solo el 15% de nuestros pacientes recayeron, la gran mayoría durante los primeros años del seguimiento y de manera similar entre seminomas y TCGNS (50% vs. 43%), datos concordantes con los presentados por Daugaard et al.7. Al analizar los posibles factores de recaída, en nuestra serie solo resultó significativo el nivel de β-HCG; sin embargo, tanto la LDH como la AFP también se han identificado como marcadores de recidiva tumoral en otros trabajos. El no encontrar estos hallazgos en nuestra serie puede estar justificado por no tener una muestra tan amplia como la de otros estudios, lo que sumado a una tasa de recidiva baja hace difícil encontrar significación estadística en los resultados.
Por otra parte, si aplicamos a nuestros pacientes la clasificación en grupos pronósticos en función del valor de β-HCG que podemos encontrar en la guía de la EAU (S1:<5.000 mIU/mL, S2: 5.000-50.000 mIU/mL y S3: > 50.000 mIU/mL)27, de los 23 pacientes con una β-HCG elevada, 21 de ellos se encuentran en el grupo S1, uno en el grupo S2 y uno en el grupo S3. De los 21 del grupo S1, recidivaron 7 pacientes; el paciente del grupo S2 no recidivó y el del grupo S3 sí recidivó. Ante esto, aunque no se pueden extraer conclusiones debido a que son muy pocos los pacientes en los grupos S2 y S3, sí que observamos una cierta diferencia en el tiempo de recidiva de los grupos: 11,4 meses de media para el grupo S1 frente a los 3 meses del paciente del grupo S3.
Finalmente, objetivamos que la supervivencia de nuestros pacientes es muy elevada (99% de supervivencia a los 10 años), algo superior a la determinada por Bonet et al.6 de 93,3% y similar a la descrita por Shanmugalingam et al.1.
En conclusión, los hallazgos detectados en nuestra serie de pacientes concuerdan con los de la literatura en cuanto al modo de presentación, características tumorales, tratamiento empleado y recaída. En el intento de hallar factores predictores de recidiva solo encontramos significación estadística en el nivel elevado de β-HCG por lo que podemos concluir que no pueden establecerse pautas de seguimiento individualizadas en nuestros pacientes, sino basadas en las recomendaciones de las principales guías clínicas. La principal limitación de nuestro estudio es contar con una muestra de pacientes no suficientemente amplia y con mayor tasa de recidivas que pudieran permitirnos detectar otros factores predictores de recidiva.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.