Introducción
Durante el siglo XX, la producción y uso de compuestos químicos ha aumentado de forma rápida como resultado de los procesos modernos de manufactura, dando lugar a la introducción de miles de disruptores endocrinos (EDC) en el medio ambiente. Durante las pasadas décadas, la atención prestada a los posibles riesgos que para la salud se pueden derivar de los tóxicos medioambientales se ha centrado en la posible inducción del cáncer. Actualmente, los riesgos para la esterilidad masculina, tanto real como potencial, son también centro de atención. Sin embargo, es difícil de establecer la relación entre los niveles de EDC presentes en el medio ambiente y sus efectos en la salud reproductiva humana. La evidencia que existe sobre los efectos de compuestos tóxicos medioambientales como factores clave en la génesis de la esterilidad masculina y el cáncer de testículo no es concluyente. No obstante, se considera un problema de salud pública muy importante que requiere una mayor atención.
Estudios de biomonitorización de los niveles de EDC en tejidos humanos y fluidos biológicos proporcionan una medida directa de las dosis interna de estos compuestos. La estabilidad físico-química de los bifenilos policlorados (PCB), pesticidas organoclorados (OCP) y éteres bifenilos polibromados (PBDE) determina en gran parte su presencia prolongada en humanos, mientras que su alta lipofilia determina su bioacumulación en la fracción lipídica de los tejidos. El contenido lipídico relativamente alto de la leche materna la hace una matriz ideal para la bioacumulación y el análisis de EDC. Además, los niveles de EDC en la leche materna no solo reflejan su bioacumulación en la madre sino también en el feto y el recién nacido, que son estados de desarrollo muy sensibles a los efectos de estos compuestos. Otro grupo de EDC son los compuestos perfluorados (PFC) que pueden bioacumularse uniéndose a la fracción proteica. Numerosas publicaciones han reportado estudios de bioacumulación de EDC clorados1-7 y perfluorados en la leche materna8,9.
En la última década se han publicado numerosos estudios científicos en los que se describen los posibles efectos de la polución medioambiental en la salud perinatal10. Sin embargo, otras rutas relevantes de exposición, tales como el agua y la comida, también deberían ser investigadas. En este sentido, la determinación de EDC en la leche materna es de gran importancia a la hora de valorar de forma adecuada el riesgo que supone la exposición y bioacumulación de EDC en leche materna y que, por otra parte, representa una muy valiosa fuente de información sobre una posible exposición fetal y perinatal a los EDC.
Estudios previos han reportado una disminución de la calidad seminal y un aumento en la tasa de esterilidad en áreas industrializadas, y se ha postulado una posible relación con la contaminación por EDC. Algunos de estos estudios han demostrado que, por ejemplo, los daneses tienen una concentración espermática más baja que los finlandeses11. Estudios posteriores demostraron que los daneses tienen una mayor prevalencia de criptorquidia e hipospadias12-14. Durante las últimas dos décadas, varios grupos han investigado el impacto de los EDC en la salud reproductiva. Numerosos estudios han sido diseñados para intentar demostrar el efecto disruptor de los ftalatos, PCB y OCP15. La asociación entre la exposición a EDC y la disminución de la calidad seminal ha sido confirmada en múltiples estudios realizados en diferentes países. El estudio de los mecanismos a través de los cuales los EDC aumentan la incidencia del síndrome de disgenesia testicular en hombres (es decir, criptorquidia e hispospadias en recién nacidos y cáncer de testículo y oligospermia en adultos) se ha realizado in vivo en modelos experimentales animales16. Sin embargo, el mecanismo de acción del efecto de mezclas de EDC todavía no ha sido elucidado. La relación entre la exposición a EDC en humanos y el síndrome de disgenesia testicular es difícil de establecer ya que, además de la propia exposición a estos compuestos tóxicos, otros factores tales como los estadios de desarrollo durante los cuales esta exposición tiene lugar; el papel de los procesos de detoxificación y la bioactividad de las mezclas de EDC deberían tenerse en cuenta. Estos factores deberían incluirse en los estudios epidemiológicos del síndrome de disgenesia testicular para poder diseñar así modelos experimentales animales más adecuados.
Nuestro grupo ha reportado recientemente la presencia de diferencias geográficas significativas en la tasa de oligospermia en diferentes regiones de España17. La tasa de oligospermia, definida como el porcentaje de hombres en una población con una concentración espermática por debajo de 20 millones/ml, fue significativamente más alta en regiones industrializadas como Cataluña que en regiones con una incorporación más reciente al desarrollo industrial, como es el caso de Galicia. En este estudio postulamos la hipótesis de que si la tasa de oligospermia idiopática en jóvenes sanos viniese determinada por la exposición a EDC (que se acumulan en el tejido adiposo de la madre a lo largo de su vida) durante el periodo fetal y perinatal, los niveles de EDC deberían ser más altos en la leche materna de las mujeres de regiones con una mayor tasa de oligospermia.
En este contexto, los objetivos principales de este estudio fueron a) evaluar los niveles de un grupo selecto de EDC en la leche materna de mujeres lactantes de las comunidades autónomas de Cataluña y Galicia; y b) correlacionar la bioacumulación de EDC con la tasa de oligospermia en ambas regiones. Todos los compuestos analizados en este estudio fueron seleccionados de acuerdo a su potencia como EDC y su condición de marcadores fiables de polución industrial. Que a nosotros nos conste, este es el primer estudio en el que se presentan datos que correlacionan la bioacumulación de EDC en humanos y la tasa de oligospermia en hombres jóvenes sanos.
Material y métodos
Reactivos
Las soluciones estándar PCB-Mix19, y la de pesticidas Mix164 se obtuvieron del Dr. Ehrenstorfer (Augsburg, Alemania). La solución estándar PCB-Mix 19 está compuesta por tres tri-PCB (PCB 18, 28 y 31), dos tetra-PCB (PCB 44, 52), dos penta-PCB (PCB 101, 118), tres hexa-PCB (PCB 138, 149, 153), dos hepta-PCB (PCB 170, 180), un octa-PCB (PCB 194), y un deca-PCB (PCB 209), y la solución estándar de pesticidas Mix 164 se compone de o,p-DDD, p,p DDD, o,p DDE, p,p DDE, o,p DDT y p,p DDT. Nonilfenol y octilfenol fueron obtenidos de Merck (Darmstadt, Alemania).
La mezcla de isómeros γ de hexaclorohexano y clordano se obtuvo de Sigma-Aldrich (Seelze, Alemania). Los estándares utilizados fueron una mezcla de hexaclorobenzeno13C, 4-n-nonilfenol-D8, γ-hexaclorohexano-D6, p,p-DDE-D8 se obtuvieron del Dr. Ehrenstorfer. La solución analítica estándar de PBDE, EO 4980 se obtuvo de Cambridge Isotope Laboratories (Andover, MA, EE.UU.). El sulfonato de perfluorooctano (PFOS), y el ácido perfluorooctanoico (PFOA) se obtuvieron de Wellington Laboratories Inc., Canadá. El 13C4-PFOS y el 13C4-PFOA también se obtuvieron de Wellington Laboratories Inc. Los cartuchos de 5 g utilizados para la extracción en fase sólida (SPE) se obtuvieron de International Sorbent Technology (IST), Reino Unido. Hidromatrix se obtuvo de Varian (EE.UU.). El nitrógeno utilizado para la evaporación de solventes fue de una pureza del 99,995% y se obtuvo de Air Liquide (España) y el ácido sulfúrico se obtuvo de Merck. La columna de LC utilizada para el análisis de PFC fue una columna analítica LiChro-CART® Purosphere Star-18e (125 mm × 4 mm i.d., 5 μm) de Merck. La columna de GC fue de fused-silica (HP-5MS; 30 m × 0,25 mm, df = 0,25 μm).
Recogida de muestras y método de extracción
Tras la aprobación por el Comité Ético de Investigación Clínica (CEIC), un total de 69 mujeres fueron incluidas en el estudio. Un total de 35 muestras de leche materna fueron obtenidas de mujeres residentes en la comunidad autónoma de Galicia y 34 muestras se obtuvieron de mujeres residentes en la comunidad autónoma de Cataluña.
El protocolo experimental fue aprobado por el CEIC local de acuerdo con la legislación vigente en España, y se obtuvo consentimiento informado de todas las mujeres que participaron en el estudio. Después de firmar dicho consentimiento informado, se les realizó un cuestionario exhaustivo para recabar información sobre el lugar de residencia, edad, número de hijos a los que previamente se les proporcionó lactancia natural, peso del recién nacido, hábitos de la mujer, tipo de profesión y dieta. Alícuotas de 25-30 ml de leche materna fueron recogidas en el hospital correspondiente dentro de los 40 días postparto, ya fuese utilizando un sacaleches o de forma manual, después la muestra se pasó a un recipiente de vidrio previamente lavado, almacenado a -20 ºC y posteriormente transportado al laboratorio del Centro Superior de Investigaciones Científicas (CSIC) de Barcelona donde se hicieron los análisis. Antes de la extracción, las muestras fueron liofilizadas, homogenizadas y almacenadas a -36 ºC.
Extracción de bifenilos policlorados, pesticidas organoclorados y éteres bifenilos polibromados
La extracción de las muestras se llevó a cabo mediante el método de extracción líquida presurizada (PLE) utilizando un sistema totalmente automatizado ASE 200 (Dionex, Sunnyvale, CA, EE.UU.). El protocolo de extracción fue como se indica a continuación: todas las muestras liofilizadas se colocaron en celdas de extracción de acero inoxidable con filtros de celulosa. El volumen muerto se rellenó con anhídrido de sulfato sódico para análisis de residuos de Panreac Química S.A. (Montcada i Reixac, Barcelona, España) previamente activado a 150 ºC durante 4 horas. El extracto se calentó a 100 ºC y se rellenó con una mezcla de CH2Cl2: hexano (2:1, v/v) hasta que la presión alcanzó los 2.000 psi. Se realizaron dos extracciones estáticas de 5 minutos a presión y temperatura constante. Tras este período estático se añadió solvente fresco para purgar las líneas y las celdas, y el extracto final se recogió en un vial. El volumen utilizado representó el 100% de la celda de extracción. La extracción se recicló dos veces. El volumen del extracto osciló entre 15 y 20 ml. Tras la extracción, los extractos fueron concentrados a 3 ml y después sometidos a un paso de purificación utilizando ataque con ácido sulfúrico concentrado (3 × 2 ml). Las muestras fueron finalmente concentradas y redisueltas en 100 μl de hexano.
Extracción por par-iónico de compuestos perfluorados
Se añadieron 5 ml de agua destilada a 0,5 g del residuo seco de las muestras de leche materna. Después de la homogenización en un homogenizador Ultra Turrax, se añadió 1 ml de TBA (0,5 M, pH 10) y 2 ml de una solución de carbonato sódico (0,25 M). La solución de la muestra se agitó en un vortex mixer durante 20 segundos y se añadieron 5 ml de metil ter-butil éter (MTBE). Después de agitar en un orbital shaker durante 20 minutos, la solución de la muestra se centrifugó a 3.000 rpm durante 10 minutos (a 25 ºC). Las capas orgánica y acuosa fueron separadas y se retiró el mismo volumen de MTBE (4,0 ml) de la solución. La fase acuosa se extrajo de nuevo dos veces con dos volúmenes de la solución de MTBE (4 ml); todos los lavados fueron combinados en un segundo tubo de polipropileno. El solvente se evaporó bajo nitrógeno utilizando un Zymark TurboVap antes de ser reconstituido en 0,5 ml metanol agua con 20 mM de sulfato amónico (10/90, v/v).
Análisis de las muestras de leche materna
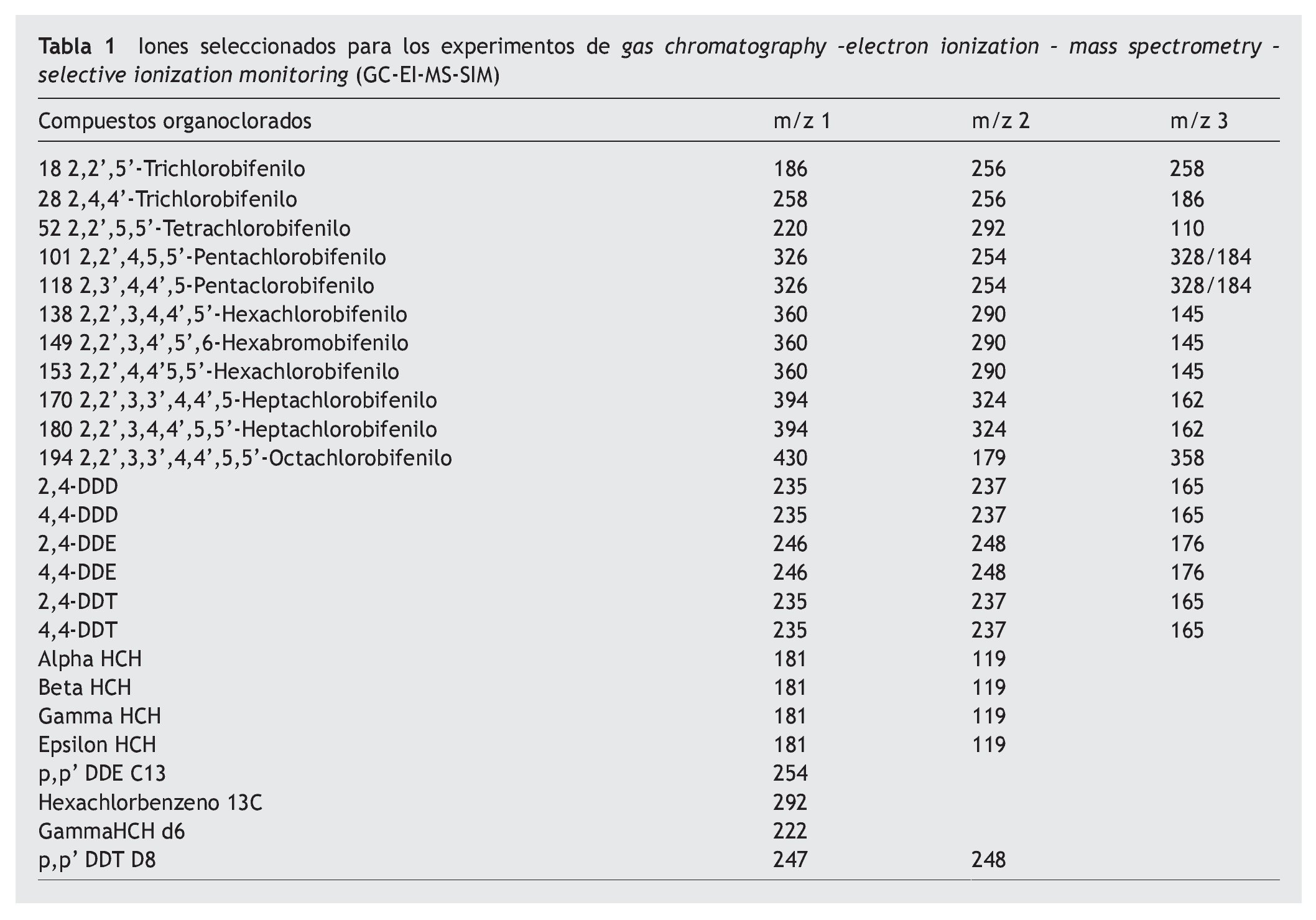
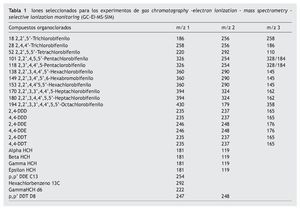
El análisis de PCB y OCP se llevó a cabo por gas chromatography-electron ionization-mass spectrometry (GC-EI-MS) en un cromatógrafo TRACE GC2000 conectado a un espectrómetro TRACE MS Thermo Finnigan (Manchester, Reino Unido). Se utilizó una columna capilar HP- 5 ms (30 md 0,25 mm i.d., 0,25 μm de grosor) con un contenido de 5% fenil metil siloxano (Ref 19091S-433, Agilent) con helio (99,999% Air Liquide) como gas portador a 1,2 ml/min. La temperatura del programa osciló de 60 a 175 ºC (se mantiene durante 1 min) a 3 ºC/min, de 175 a 240 ºC (se mantiene durante 5 min) a 10 ºC/min y de 240 a 320 ºC (se mantiene durante 2 min) a una tasa de 0,5 ºC/min. La inyección se realizó en el modo splitless. El inyector, la línea de transfer y una fuente de temperatura iónica programada a 250, 270 y 200 ºC, respectivamente y una energía de ionizacion programada a 70 eV. La adquisición se llevó a cabo mediante la modalidad de monitorización iónica programada (SIM) en tiempos previamente seleccionados para aumentar la sensitividad y la selectividad. La cuantificación se llevó a cabo mediante el método del estándar interno. La identificación y cuantificación se llevaron a cabo automáticamente utilizando un software Xcalibur. Los iones diagnósticos utilizados para el análisis de GC-SIM-MS (EI) se muestran en la tabla 1.
El análisis de los diferentes PBDE que contenían de 1 a 7 átomos de bromo se llevó a cabo mediante un método de GC/NCI-MS de acuerdo al protocolo previamente publicado por nuestro grupo18. Los análisis se llevaron a cabo en un cromatógrafo de gases, Agilent 6890, conectado a un espectrómetro de masas, Agilent 5973 Network. Se utilizó una columna capilar HP-5 ms (30 md 0,25 mm d.i., 0,25 μm de grosor) con un 5% de fenil metil siloxano (Model HP 19091S-433) utilizando helio como el gas portador a 1,2 ml/min. La temperatura del programa fue de 110 ºC (mantenida durante 1 min) a 180 ºC (mantenida durante 1 min) a 8 ºC/min, y después de 180 a 240 ºC (mantenida durante 5 min) a 2 ºC/ min, y finalmente de 240 a 280 ºC (mantenida durante 6 min) a 2 ºC/min, utilizando el modo de inyección splitless durante 1 min. Brevemente, las condiciones del GC/NCI-MS fueron las siguientes: las temperaturas del cuadrupolo y líneas de transfer fueron programadas a 150 ºC y 300 ºC. Sistema de presión a 1,9 × 10-4 Torr, fuente de temperatura a 250 ºC y el reactivo NCI (NH3). La identificación y cuantificación mediante el modo SIM se llevó a cabo automáticamente utilizando software Chemstation. La cuantificación se llevó a cabo mediante el modo SIM para aumentar la sensitividad del análisis.
Finalmente, dos de los compuestos perfluorados (PFC) más abundantes: el ácido perfluorooctanoico (PFOA) y el sulfonato de perfluorooctano (PFOS) fueron analizados por liquid chromatography-quadrupole-linear ion trap mass spectrometry (LC-QqLIT MS) utilizando un protocolo basado en el método recientemente desarrollado y validado por nuestro grupo19. Los PFC fueron analizados en un sistema 4000 Q TRAPTM MS/MS de Applied Biosystems/MDS Sciex (Concord, Ontario, Canadá) acoplado a un sistema SymbiosisTM Pico (Spark Holland, Emmen, Holanda). Este último integra un sistema LC y Online SPE pero únicamente se utilizó el sistema de HPLC que básicamente consiste en un autosampler AliasTM que maneja volúmenes de muestras de 10 μl a 10 ml y que puede añadir, mezclar y diluir las muestras de manera previa a su análisis, con dos bombas de gradiente LC de alta presión, con un selector de solventes de 4 canales por cada bomba. Las separaciones se llevaron a cabo en una columna analítica LiChroCART- LiChrospher 100 RP-18 de 250 × 4 mm y 5 μm de diámetro de partícula de Merck a temperatura ambiente. La fase móvil consistió en 20 mM acetato de amonio en agua (solvente A) y 20 mM acetato de amonio en metanol (solvente B) a un flujo de 0,5 ml min-1. El programa de elución de gradiente lineal fue el siguiente: 10-80% B por 5 min, 80-90% B sobre 5 min seguido de una parada isocrática en 90% B por otros 8 min. A los 18 min, el solvente B se volvió de nuevo al 10% por 2 min. El tiempo total de cada separación por inyección fue de 20 min y el volumen de inyección de 20 μl. El espectrómetro de masas fue operado en el modo iónico negativo utilizando un turbo ion spray. Los otros parámetros de ionización fueron los siguientes: gas cortina (CUR), 30 (unidades arbitrarias); fuente iónica gas 1 (GS1), 25 (unidades arbitrarias); fuente iónica gas 2 (GS2), 0 (unidades arbitrarias); fuente de temperatura (TEM), 350 °C; ion spray (IS), -4.500 V; potencial de entrada (EP), -10 V, potencial de colisión de salida (CXP) -10 V y potencial de ruptura (DP) -25 V.
El tiempo de espera de cada transición MRM fue de 150 ms. El espectrómetro de masas fue controlado con software Analyst 1.4.2 de Applied Biosystems/MDS Sciex y Symbiosis de Symbiosis Pico para Analyst Software.
Resultados
Las características de los pacientes incluidos en el estudio se muestran en la tabla 2. Para minimizar el posible impacto de factores exógenos en la variabilidad de las muestras, todas las muestras fueron recogidas en el hospital durante la misma época del año utilizando exactamente el mismo protocolo de recogida dentro de los 40 días postparto. No se encontraron diferencias en edad gestacional o paridad entre las mujeres lactantes de las comunidades autónomas de Cataluña y Galicia. De acuerdo al unpaired t test, la edad de las madres en ambas poblaciones no difirió de forma significativa (IC del 95%). En ambos casos, la edad materna siguió una distribución gáussica de acuerdo a la prueba de normalidad de Kolmogorov-Smirnov.
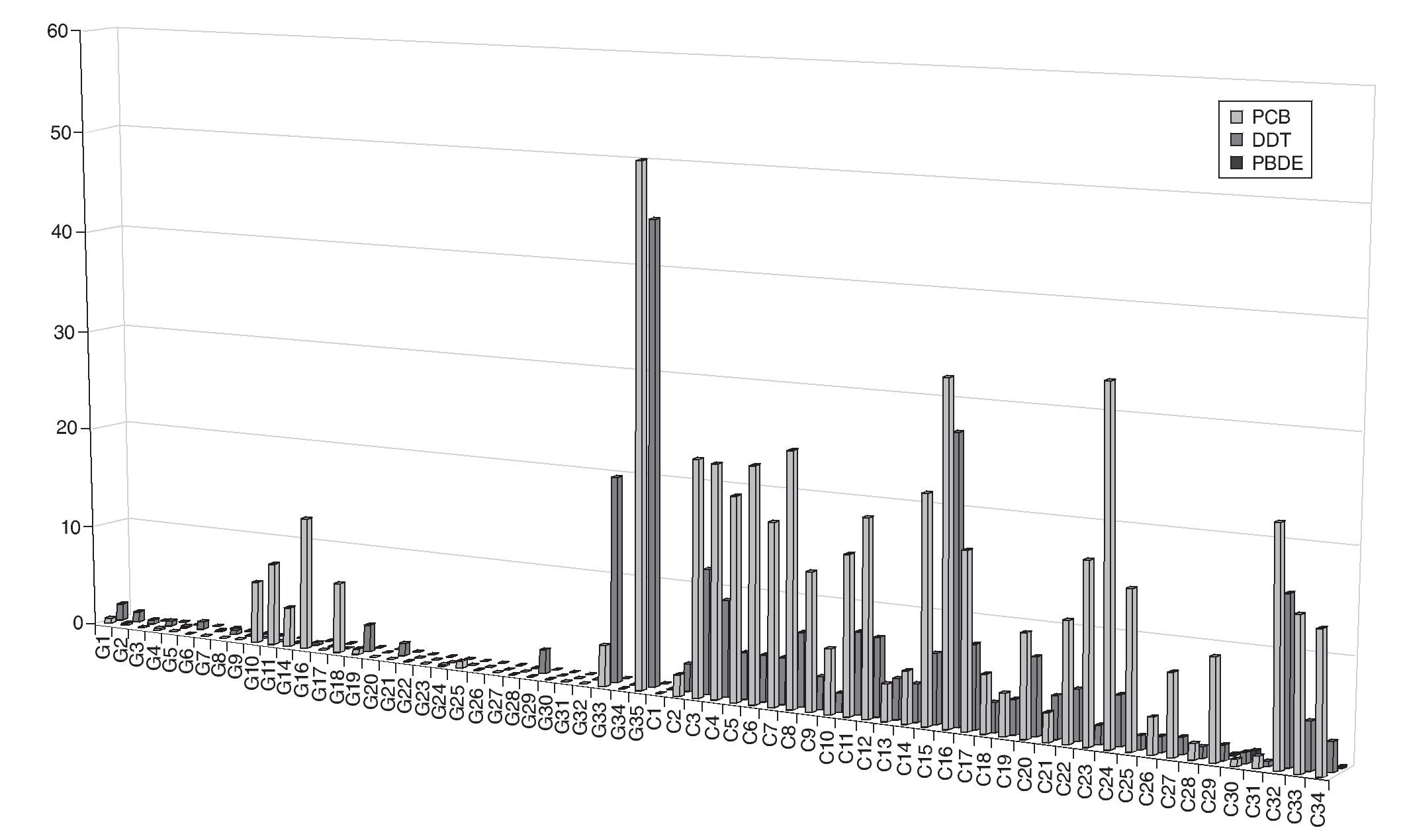
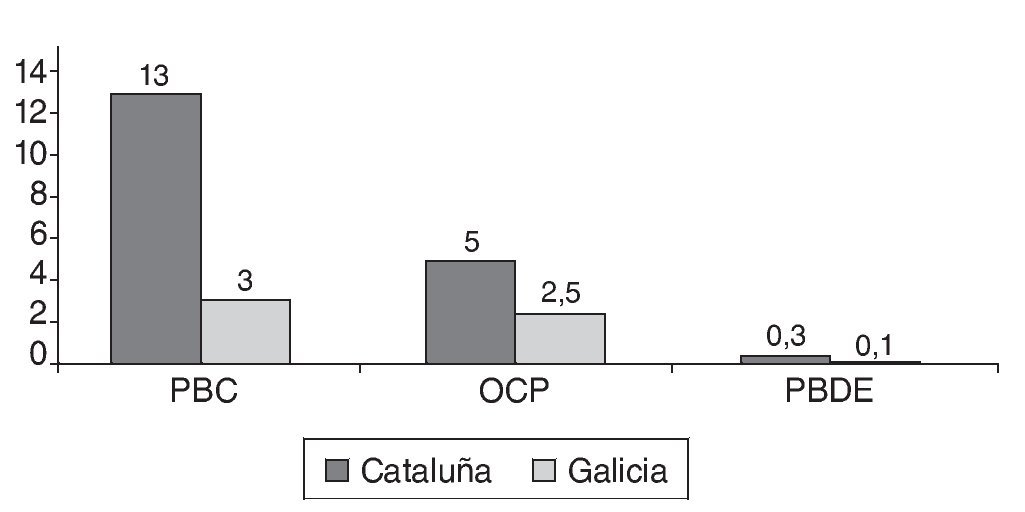
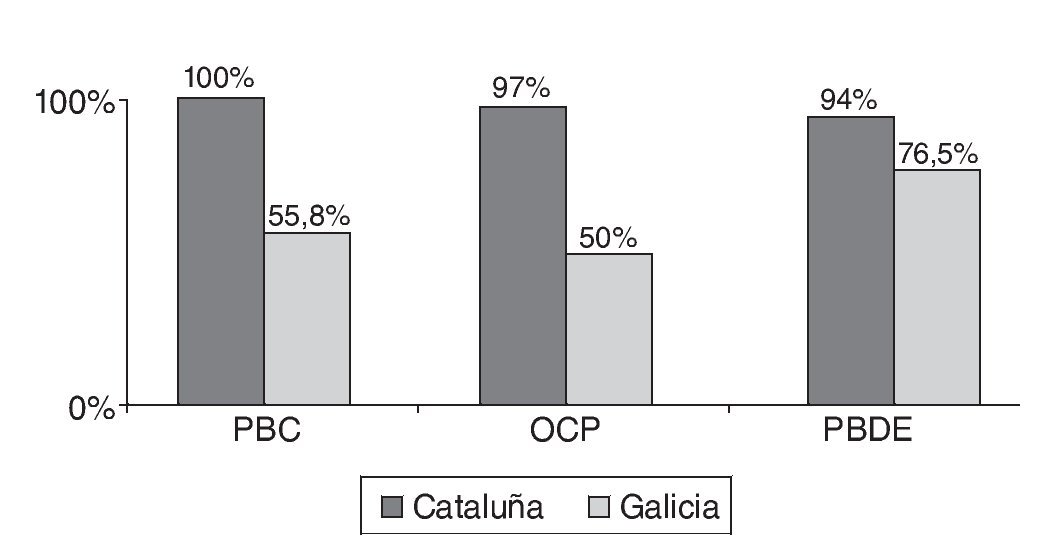
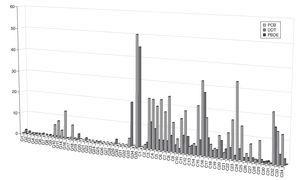
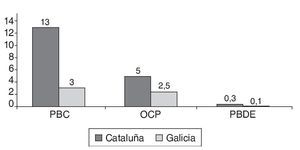
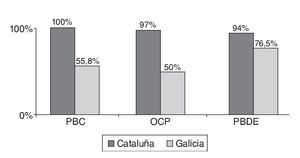
En las figuras 1a, 1b y 1c se detallan las concentraciones de EDC en las muestras de leche materna analizadas. Las concentraciones medias de la suma de PCB, OCP y PBDE en las muestras de Cataluña fueron respectivamente 13, 5 y 0,3 ng/g de grasa, mientras que en las de Galicia estos valores fueron significativamente más bajos, 3, 2,5 y < 0,1 ng/g de grasa. Los compuestos encontrados en concentraciones más altas fueron PCB 194, PCB 28, PCB 52, p,p'-DDE, γ-HCB y PFOS. Los compuestos más frecuentemente encontrados fueron PCB 153, PCB 170, PCB 180 p,p'-DDE, p,p'-DDD, PBDE 47 y PFOS.
Figura 1a Concentraciones de disruptores endocrinos en las muestras de leche materna analizadas. OCP: pesticidas organoclorados; PBDE: éteres bifenilos policlorados; PCB: bifenilos policlorados.
Figura 1b Concentración de tóxicos analizados según el lugar de residencia de la madre (nanogramos por gramo de grasa). OCP: pesticidas organoclorados; PBDE: éteres bifenilos policlorados; PCB: bifenilos policlorados.
Figura 1c Porcentaje de muestras en las que se detectaron tóxicos sobre el total de muestras analizadas. OCP: pesticidas organoclorados; PBDE: éteres bifenilos policlorados; PCB: bifenilos policlorados.
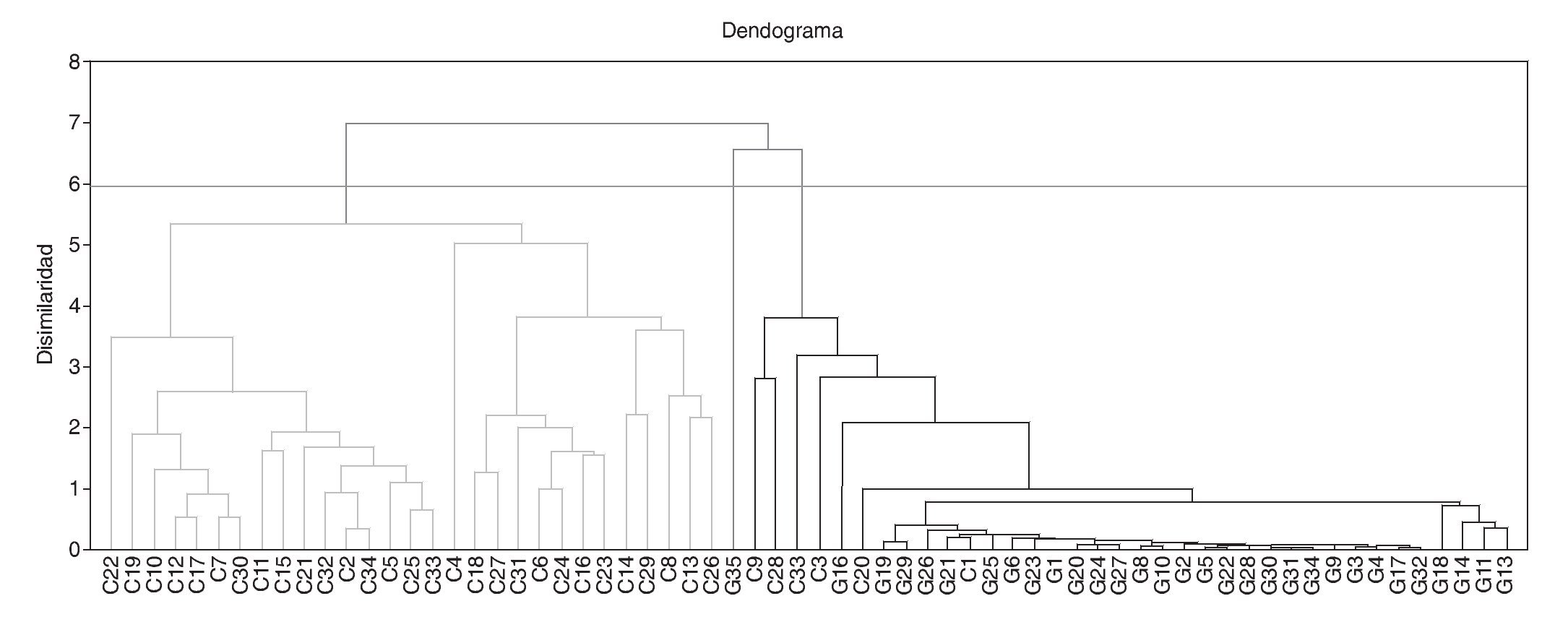
La figura 2 muestra el dendograma que ilustra el análisis de clúster jerárquico. Los participantes en el estudio fueron agrupados de acuerdo a los resultados de los 40 EDC bioacumulados, la edad de la madre, el tipo de profesión y el lugar de residencia (urbana, rural, o industrial). La disimilaridad entre los diferentes grupos de muestras fue calculada utilizando el método de distancias euclídeas. La aglomeración fue llevada a cabo de acuerdo al método de linkage analysis, y se definieron 3 grupos: un grupo mayormente compuesto por los participantes de Galicia; otro grupo formado principalmente por participantes de Cataluña; y un grupo de muestras individuales que mostraron niveles altos atípicos de algunos EDC y que no pudieron ser agrupados en los otros dos.
Figura 2 Dendograma del análisis de clúster jerárquico.
Discusión
El hallazgo principal que emerge de este estudio son las diferencias altamente significativas en los niveles de EDC en la leche materna de mujeres lactantes de las comunidades de Cataluña y Galicia. Como se puede apreciar en la figura 2, la clasificación utilizada, siguiendo la disimilaridad entre la bioacumulación de EDC, distinguió dos grupos principales, de acuerdo a su origen geográfico y a las tasas de oligospermia. Las muestras de leche materna de mujeres lactantes de Galicia mostraron niveles muy bajos de EDC mientras que las muestras de Cataluña mostraron niveles muy altos. Esta remarcable diferencia en los niveles de EDC se hace todavía más relevante cuando se compara con las diferencias en las tasas de oligospermia previamente reportadas para estas regiones. Como puede verse en la figura 1a, las concentraciones de PCB y OCP encontradas en la leche materna de las muestras de mujeres lactantes de Cataluña fueron en algunos casos unas 10 veces más altas que los valores obtenidos en las muestras de Galicia. Por lo tanto, la exposición fetal y perinatal a PCB y OCP en Cataluña fue respectivamente, unas 4,3 y 2 veces más alta que en Galicia (fig. 1b), en excelente acuerdo con las tasas de oligospermia reportadas en Cataluña del 22,7% y en Galicia del 8,5%, y las concentraciones espermáticas medias en semen de 59,3 y 91,7 millones/ml, respectivamente17,20. Estos resultados son consistentes con la hipótesis previamente postulada de que si la tasa de oligospermia idiopática en hombres jóvenes sanos fuese determinada por la exposición a EDC durante el período fetal y perinatal, los niveles de EDC deberían ser más altos en la leche materna de madres de aquellas regiones con una prevalencia más alta de oligospermia. Los EDC que se acumulan en el tejido adiposo de la madre a lo largo de su vida podrían ser liberados a la circulación atravesando la placenta y afectar al feto17,20. Un órgano que es especialmente sensible a los EDC durante el período fetal es el testículo. De llegar a ocurrir esto, explicaría, al menos en parte, por qué la incidencia de anomalías testiculares congénitas y de oligospermia es más alta en hombres de regiones con una exposición más alta a EDC. Como soporte adicional a esta hipótesis, la incidencia de criptorquidia en los recién nacidos de la comunidad de Galicia fue del 2,5% mientras que en Cataluña fue del 10,1%.
Una variable de confusión potencial en este estudio podrían haber sido las diferencias en paridad entre ambos grupos de mujeres lactantes, dado que se ha reportado que los niveles de EDC disminuyen con el número de partos21. Sin embargo, como se muestra en la tabla 2, el porcentaje de primíparas, secundíparas y multíparas fue similar en ambos grupos de mujeres.
Conclusiones
En conclusión, la bioacumulación y exposición a EDC durante el período fetal y perinatal en mujeres de Cataluña y Galicia parece estar correlacionada con la tasa de oligospermia en hombres jóvenes sanos de estas regiones. Si bien esto no prueba que exista una relación causa-efecto, sí apoya una vez más la noción de que la exposición a EDC durante el período fetal y perinatal podría resultar en daño testicular y oligospermia22-24.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Nos gustaría agradecer a la Fundación Leonardo Marqués la financiación de este estudio.
Correo electrónico:Marisa.Lopez-Teijon@institutomarques.com
Recibido el 19 de marzo de 2011;
aceptado el 8 de abril de 2011