INTRODUCCIÓN
Una de las causas más comunes de esterilidad en cualquier pareja con fallos reproductivos es la pobre calidad seminal1 . Sin entrar en el debate de su prevalencia resulta obvio que en el estudio básico del varón se debe solicitar un seminograma, en el que se analizarán parámetros como concentración, movilidad y morfología, principalmente. Con los avances en técnicas de reproducción asistida se hace necesario profundizar más en el estudio seminal, porque queda patente que el seminograma básico no es suficiente para evaluar con precisión la calidad del espermatozoide.
Con la introducción de la ICSI (inyección espermática intracelular) se observó una tendencia a minimizar la importancia de los parámetros seminales basándose en unos resultados aparentemente independientes de la calidad del semen empleado. "Cualquier semen puede ser válido para ICSI si hay al menos unos pocos espermatozoides en él" se decía. Sin embargo, el paso del tiempo ha devuelto protagonismo al estudio del varón, el llamado "factor masculino". Ya con el incremento de experiencia en ICSI, se hizo evidente que hay paciente cuyos espermatozoides muestran fallos repetidos para formar embriones viables, independientemente de que sean capaces de fecundar al óvulo2.
La fertilización involucra la interacción directa del espermatozoide y el óvulo, la fusión de las membranas celulares y la unión de los genomas. La complejidad de este proceso y el desarrollo posterior del embrión dependen, en parte, de la integridad del ADN espermático. Parece que el daño del ADN, es decir, el anormal empaquetamiento o la deficiencia de protaminas en él, resulta clave para el desarrollo embrionario y es un factor limitante en la tasa de embarazo3. Un mal empaquetamiento de ADN espermático parece correlacionarse con un efecto paterno tardío, provocando fallos de implantación o pérdidas tempranas de embarazos4,5.
Por otro lado, una característica del semen de varones infértiles, principalmente con oligoastenozoospermia, es la producción excesiva de especies reactivas del oxígeno (ROS, del inglés: reactive oxigen species)6. Una consecuencia de esas especies es el daño que se produce en la membrana plasmática del espermatozoide, que conlleva un descenso en el porcentaje de embarazos, tanto in vivo como in vitro7-9. Las ROS no sólo dañan los lípidos de las membranas plasmáticas de los espermatozoides sino también a otras estructuras, particularmente el ADN10-13. Aunque no está demostrado que el daño en el ADN del espermatozoide se relacione con un fallo de fertilización, no se puede descartar la transmisión de esa alteración al embrión6.
El ácido ascórbico protege al ADN espermático del daño provocado por el estrés oxidativo exógeno. Según los estudios de Gyun et al, hay una correlación entre los valores de este ácido en el plasma seminal y el porcentaje de ADN desnaturalizado en el espermatozoide (DFI, del inglés: DNA fragmentation index), los pacientes con un DFI alterado presentan un déficit. Estos pacientes con bajos valores de ácido ascórbico también presentan los parámetros seminales convencionales alterados14.
El objetivo de nuestro estudio es evaluar la fragmentación del ADN de los pacientes que consultan por esterilidad y de los donantes voluntarios, y tratar de evidenciar alguna relación con los diferentes patrones de alteraciones seminales.
MÉTODO
El estudio se ha llevado a cabo analizando 212 muestras seminales de pacientes que iban a ser sometidos a ciclos de reproducción asistida 2 meses antes de la iniciación. Las muestras normozoospérmicas se obtuvieron de donantes voluntarios. En todos lo casos se guardó una abstinencia de 3 a 5 días, las muestras se obtuvieron por masturbación en recipiente estéril y analizadas en menos de 1 h desde su obtención.
Las muestras se dejaron 20 min que licuaran a 30 ºC, a continuación se realizó el análisis de la concentración (× 106/ml) y movilidad (en %) en una cámara Makler con un volumen de 5 µl.
La morfología se estudió sobre una extensión de 5 µl de semen fresco teñido con diff quik. Las formas normales se consideran las que tienen un acrosoma bien definido que ocupa del 40-70% de la cabeza, no tienen defectos de cuello, pieza intermedia o cola y las medidas de la cabeza son 5-6 µm de largo y entre 2,5-3,5 µm de diámetro.
Preparación de las muestras seminales
El análisis de la fragmentación se llevó a cabo en muestras sin capacitar por el SCD (sperm chromatin dispersion) (halosperm) según el manual.
Determinación de fragmentación
La tinción se realizó con diff quik y el conteo se llevó a cabo en un microscopio óptico con objetivo de 100 ×bajo aceite de inmersión. En cada muestra se contabilizó un total de 500 espermatozoides, separados en:
- Espermatozoides con halo grande: espermatozoides cuyo grosor del halo es igual o mayor a la longitud del diámetro menor del core.
- Espermatozoides con halo mediano: el grosor del halo está comprendido entre mayor que un tercio del diámetro menor del core y menor que el diámetro menor del core.
- Espermatozoides con halo pequeño: el grosor del halo es igual o menor que un tercio del diámetro menor del core, pudiendo ser de forma irregular o prácticamente inapreciable.
- Espermatozoides sin halo.
- Espermatozoides sin halo y degradados: los que sin mostrar halo presentan el core fragmentado en gránulos o muestran una tinción muy débil.
Los espermatozoides con halo grande o mediano se consideraron normales, siendo el resto los que presentaron fragmentación.
RESULTADOS
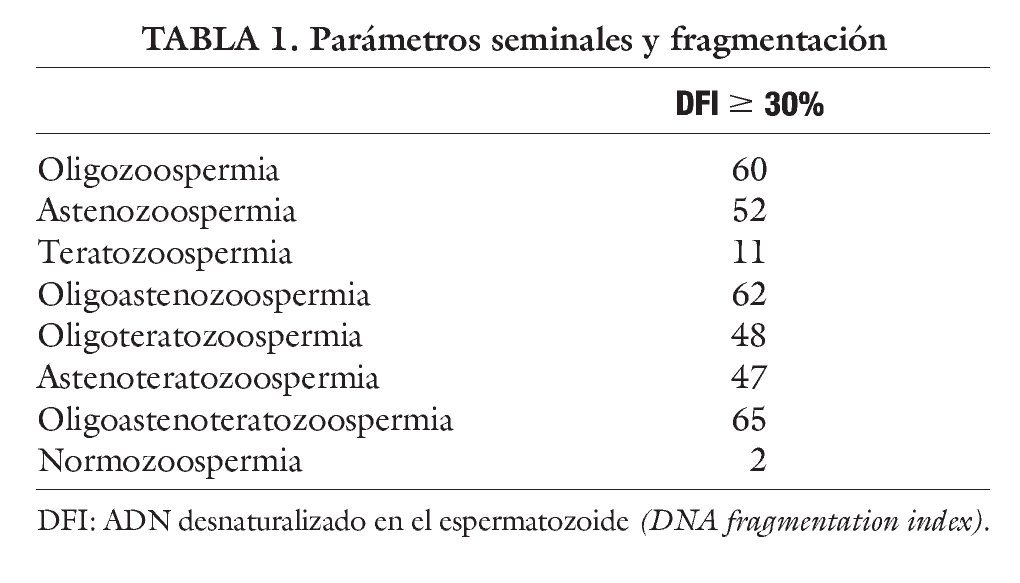
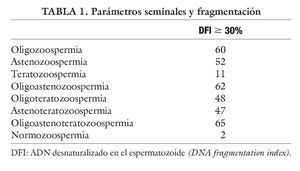
El semen de los 212 pacientes se clasificó según las recomendaciones de la Organización Mundial de la Salud en oligozoospermia (< 20 [H11003] 106/ml), astenozoospermia (< 50% de movilidad a+b), teratozoospermia (< 15% de formas normales) y sus combinaciones. La fragmentación del ADN se consideró patológica cuando se obtenía más del 30% de espermatozoides fragmentados. En la tabla 1 se reflejan los valores seminales y el porcentaje de fragmentación obtenido.
En nuestro estudio se ha separado a los pacientes en varios grupos en función de la alteración o alteraciones que presentaban en el seminograma. De los pacientes que presentaban una única alteración, tanto los que mostraban la concentración como la movilidad disminuida, más del 50% de los casos tenía el ADN fragmentado. En los casos en los que mostraban sólo alterada la morfología, únicamente el 11% presentaba fragmentación. Cuando se combinan varios parámetros alterados la fragmentación aparece en alrededor del 50% de los casos, siendo superior en los pacientes oligoastenos y oligoastenoteratozoospérmicos. El grupo control presentó fragmentación sólo en el 2% de los casos.
DISCUSIÓN
Los datos presentados en este estudio prueban una clara relación entre la calidad seminal y la fragmentación del ADN espermático. Se observa que muestras con una concentración y movilidad disminuidas presentan una fragmentación aumentada. Hecho que se hace más patente cuando se combinan varios parámetros y cuando lo comparamos con muestras normozoospérmicas.
No se encontró una relación estadísticamente significativa entre el daño del ADN y la morfología espermática. En un estudio previo en el que se compararon las tasas de fecundación y embarazo en ciclos de ICSI en función de la morfología espermática, tampoco se encontró relación alguna15. Las tasas de embarazo no se modificaban en función de la morfología y los resultados comparados resultaron similares. Estos resultado son apoyados por los de Tomlinson et al16, que tampoco encontraron asociación entre el daño del ADN y la morfología espermática.
Nuestros hallazgos de correlación negativa entre el daño del ADN y la calidad seminal se ven apoyados por otros laboratorios. Así lo comunicaron con anterioridad, por ejemplo, Irvine et al6 y Sun et al17. Sin embargo Hughes et al18, que examinaron el ADN de pacientes donantes y los que presentaban astenozoospermia, no encontraron diferencias significativas.
A diferencia de las células somáticas, en el núcleo de los espermatozoides se encuentra únicamente el ADN fuertemente empaquetado y predominantemente con proteínas básicas. Durante los estados tardíos de la espermatogénesis, los núcleos de las espermátides son remodelados y condensados, pasando a estar asociados a protaminas en lugar de a histonas. Las cadenas de ADN se asocian íntimamente a las protaminas formando lazos con uniones disulfuros responsables de la compactación y estabilización del núcleo espermático. Esta compactación es importante para proteger al genoma espermático de los agentes externos de estrés, como la oxidación o la elevación de la temperatura. Los varones infértiles tienen, comparado con el grupo control, un aumento de histonas con respecto a las protaminas (ratio histona/protamina)3.
Por otro lado, se estima que la apoptosis destruye aproximadamente el 75% de los espermatozoides en potencia. La apoptosis selectiva evita la formación de espermatozoides anormales. Sakkas et al19 sugieren que hay espermatozoides con ADN dañado que han escapado de esa apoptosis controlada, ya sea por la edad de los pacientes, la presencia de gonadotoxinas u otros tóxicos sistémicos como ciertas terapias anti-neoplásicas.
Ante una pareja en reproducción, en la que se encuentra una elevada tasa de fragmentación del ADN en el espermatozoide del varón, hay una serie de parámetros que hay que tener en cuenta, como son el número de ciclos previos fallidos, la edad materna y la asociación a otras patologías como puede ser un estudio de meiosis alterado2.
Aunque se han sugerido diferentes pautas de actuación para el manejo de estos pacientes, entre las más aceptadas estarían el tratamiento con antioxidantes20, el empleo de alta magnificación para evitar microinyectar utilizando espermatozoides con vacuolas21 y utilizar espermatozoides directamente del testículo22.
CONCLUSIONES
Aunque la proporción de pacientes con alteraciones seminales y fragmentación elevada es bastante significativa, se considera que es importante realizar esta prueba complementaria a todos los pacientes con algún parámetro alterado, para saber así qué protocolo hay que seguir si se somete a un ciclo de reproducción y aumentar las expectativas de embarazo. La fragmentación del ADN espermático se está revelando útil en la toma de decisiones en nuestra práctica diaria. Los resultados de nuestra serie evidencian una baja tasa de fragmentación de ADN espermático en pacientes con teratozoospermia pura. Parece evidente que futuros estudios van a ir dando mayor protagonismo en el futuro inmediato a este test, permitiendo trasladar a la práctica clínica andrológica pautas apoyadas en evidencias cada vez más sólidas.
Correspondencia:
Dra. M. Dorado Silva Farmacéutico Murillo Herrera, 3.
41010 Sevilla. España.
Correo electrónico: mdorado@ginemed.es