INTRODUCCIÓN
La valoración de la morfología espermática se ha considerado desde hace tiempo como un componente esencial del análisis seminal. No obstante, la dificultad de conseguir una reproducibilidad satisfactoria tanto intra- como intertécnicos ha hecho difícil su estandarización1,2. Pese a ello, diversos estudios han examinado la relación entre la morfología espermática y la capacidad fecundante in vitro, y se ha demostrado un incremento de esta al utilizar muestras seminales con un alto porcentaje de espermatozoides de morfología normal, en la que la consideración combinada de varios parámetros seminales presenta el mayor poder predictivo3.
En este contexto, los primeros analizadores computarizados de morfología espermática (CASMA) aparecieron en el mercado en los años noventa del pasado siglo4. Uno de ellos, el Sperm Class Analyser (SCA®), precursor del utilizado en este trabajo, resultó útil en el análisis morfológico de muestras de semen humano, tanto de la cabeza como de la pieza intermedia4. Los sistemas de análisis de movilidad anteriores (CASA) valoran objetivamente la cinética celular, y por lo tanto pueden categorizar los espermatozoides de un modo equivalente a lo recomendado para el análisis subjetivo en grados a, b, c y d. De forma similar, los sistemas ASMA analizan una serie de parámetros morfométricos objetivos que pueden ser usados para definir un espermatozoide con morfología "normal" de forma equivalente a como lo haría un técnico especializado. No obstante, la mayor ventaja de estos instrumentos no es la substitución de los técnicos, sino el hecho que aportan parámetros métricos y objetivos que pueden reflejar de forma mucho más interesante la realidad de la muestra seminal que la valoración subjetiva de lo que consideramos un espermatozoide normal5-7.
En el presente estudio, se ha utilizado el Integrated Semen Analysis System® (ISAS®), una evolución del anterior SCA, con el fin de obtener una batería de datos morfométricos a partir de eyaculados de varones a los que se ha aplicado diversas técnicas de reproducción asistida. Los resultados indicaron que estos fueron mejores en la tasa de fertilización y embarazo tras inseminación intrauterina (IIU) e inyección intracitoplasmática de espermatozoides (ICSI) con muestras cuyas cabezas espermáticas eran de menor tamaño, mientras que no se obtuvo correlación alguna en los casos de fecundación in vitro (FIV).
MATERIAL Y MÉTODOS
Pacientes y consideraciones terapéuticas
Se obtuvo eyaculados de 54 varones, que se destinaron a IIU (n = 15, edad media 36,9), FIV (n = 20, edad media 39,3) e ICSI (n = 19, edad media 39,7). En algunos de los estudios, este tercer grupo se dividió en 2 subgrupos de acuerdo a la concentración espermática observada, el primero de los cuales incluyó a los pacientes con valores normales, mientras que el segundo contenía los casos de oligospermia grave (tabla 1).
Las indicaciones para derivar a un paciente a IIU fueron la interacción anormal entre el moco cervical y los espermatozoides, las alteraciones en la maduración folicular y factor masculino leve. Las referentes a FIV incluyeron factor masculino, infertilidad idiopática e infertilidad inmunológica. Finalmente, se derivó a ICSI los casos con oligospermias graves (< 5 millones/ml), astenospermias (movilidad progresiva < 30%), baja tasa de recuperación tras swim-up (< 1 millón/ml) o fallo tras intento de FIV.
Análisis y procesado del semen
Los eyaculados se obtuvieron por masturbación en el Instituto de Medicina Reproductiva de la Universidad de Münster (Alemania), y se procesaron inmediatamente después de la licuefacción. De cada muestra se analizó la concentración, el porcentaje de células con morfología normal y de cada grado de movilidad, siguiendo las recomendaciones de la Organización Mundial de la Salud (OMS)8. Las extensiones utilizadas para la valoración morfológica subjetiva se tiñeron usando la técnica de Papanicolaou. En cambio, para las muestras usadas en el análisis morfométrico con el ISAS®, tanto en fresco como tras swim-up, se utilizó el kit Hemacolor® (Merck, Darmstadt, Alemania, Cat. no. 11661). En los procedimientos de FIV e ISCI, se aisló espermatozoides móviles por la técnica del swim-up9, y se utilizó el medio Medi-Cult (Medi-Cult, Møllehaven, Dinamarca).
Inseminación intrauterina
La estimulación se siguió de acuerdo con el protocolo corto, utilizando un agonista de la GnRH (Decapeptyl® 0,1: 0,1 mg triptorelina s.c.; Ferring, Kiel, Alemania) y FSH recombinante (Puregon®, Organon, Oberschleissheim, Alemania o Gonal F®, Serono Pharma, Unterschleissheim, Alemania). La ovulación se indujo por 10.000 unidades de hCG (Choragon®, Ferring) en el momento en que el folículo dominante alcanzó los 18 mm de diámetro, tal y como se detectó por ultrasonografía. Entre 36 y 40 h tras la inducción de la ovulación, se inyectó 200 µl de una suspensión con espermatozoides obtenidos por swim-up. La inyección se realizó en la cavidad uterina con un catéter (Cook, Spencer, USA). En el caso de que hubiera más de 3 folículos mayores de 14 mm en el día de la inseminación, se procedió a su reducción por aspiración transvaginal, hasta dejar sólo 310.
Fecundación in vitro convencional
Las gonadotropinas endógenas se controlaron con una actuación a largo o corto plazo con agonista de la GnRH (Decapeptyl Depot®: 3,75 mg triptorelin i.m.; Decapeptyl® 0,1) de acuerdo con el protocolo largo. El crecimiento folicular se estimuló con hMG (Pergonal®, Serono Pharma), FSH purificada (Fertinorm®, Serono Pharma) o FSH recombinante (Gonal-F®, Serono Pharma). El agonista de la GnRH de actuación corta se combinó solo con la FSH recombinante. Tras realizar el seguimiento del crecimiento folicular por ultrasonografía y por medida de los valores de estradiol (inmunoenzimoanálisis SR1, Biochem, Freiburg, Alemania), se indujo la ovulación por inyección de 10.000 U de hCG (Choragon®) 36 h antes de la punción folicular10.
Los ovocitos se recogieron por aspiración transvaginal guiada por ultrasonidos. Para el FIV convencional se inseminó 10 ovocitos maduros con concentraciones espermáticas entre 32.000-200.000, dependiendo de la movilidad de cada muestra11, y se incubaron durante la noche en un pocillo con 100 µl de medio para FIV Medi-Cult universal.
Inyección intracitoplasmática de espermatozoides convencional
El ICSI se llevó a cabo tras remoción del cumulus y la corona radiata mediante incubación en medio Medi-Cult suplementado con hialuronidasa (80 U/ml; Sigma), seguido de una aspiración repetida con una pipeta de control manual. El ICSI se llevó a cabo siguiendo el protocolo de Van Steirteghem et al12.
Valoración de la fecundación
Se valoró los ovocitos tras 16-18 h del FIV o el ICSI para constatar la presencia de los 2 pronúcleos. El cleavage del estado pronuclear se valoró 24 h después e inmediatamente antes de la transferencia embrionaria. El segundo día tras la aspiración folicular se transfirió un máximo de 3 embriones en la cavidad uterina mediante un catéter especial (Wallace, Lancing, West Sussex, UK). Los embarazos se detectaron 12 días después de la transferencia por medición de la hCG sérica ("embarazo bioquímico"), y se confirmó por ultrasonidos para la localización del saco fetal cuando los valores del CG excedieron las 1.000 U/l ("embarazo clínico").
CASMA
Como ya se comentó, los frotis se tiñeron con Hemacolor®, de acuerdo con Soler et al4 y se examinaron con un microscopio Olympus BH-2, equipado con un objetivo de campo claro de x100 y un foto-ocular de x3.3. La señal de vídeo fue procesada con el equipo CASMA ISAS® (Proiser R+D, SL, Buñol, Spain). De cada muestra, se capturó 200 espermatozoides, y se analizaron con el ISAS® siguiendo las pautas descritas anteriormente (Soler et al4, 2000). Tras el procesado de las imágenes, se descartó algunas células por una binarización defectuosa, sobre todo en muestras de ICSI, como consecuencia de interacciones con el medio, con un promedio de 155 células por muestras (con un rango entre 125 y 193). En cada célula se midió 8 parámetros directos (área, perímetro, longitud y anchura de la cabeza, porcentaje de la cabeza ocupado por el acrosoma y área, anchura, ángulo y distancia entre los ejes de cabeza y la pieza intermedia) y cuatro parámetros de forma4.
Análisis estadístico
Se utilizó la mediana como estadística central para representar la población espermática de cada una de las muestras. Se comparó los datos morfométricos en semen fresco y tras swim-up para las muestras correspondientes a cada técnica de reproducción asistida (TRA) mediante ANOVA de una vía, seguida del test a posteriori de Tukey-Kramer para comparaciones múltiples. Por otra parte, se aplicó el análisis lineal de regresión múltiple de Pearson a los valores de las medianas en cada caso de TRA respecto de las tasas de fecundación o embarazo observadas.
RESULTADOS
Análisis seminal
La calidad seminal varió de forma significativa entre las distintas muestras seminales, en función de la TRA a la que se ubicó cada grupo de pacientes (tabla 1).
Morfometría espermática en muestras destinadas a las diferentes TRA
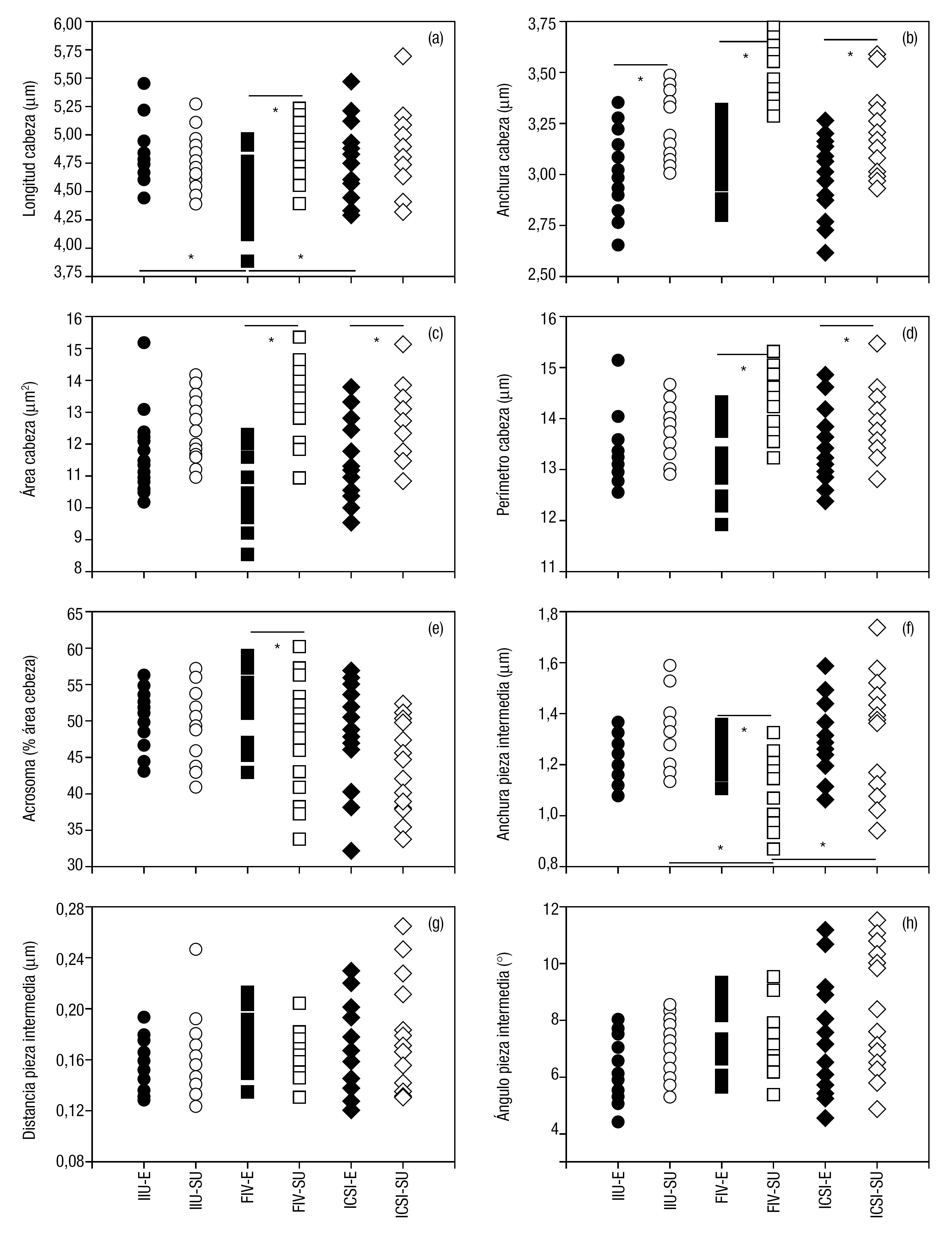
Los eyaculados de pacientes sometidos a FIV presentaron cabezas espermáticas menores que los correspondientes a IIU o ICSI (fig. 1a). También se observó diferencias significativas entre los valores medios de algunos parámetros morfométricos entre muestras frescas y las sometidas a swim-up. Los espermatozoides correspondientes a muestras de swim-up destinadas a IIU mostraron cabezas más anchas que el semen fresco. En los casos de FIV, todos los parámetros morfométricos fueron mayores tras swim-up (figs. 1a-d), y presentaron un área acrosómica (fig. 1e) y una anchura de la pieza intermedia (fig. 1f) menores. Finalmente, en los casos correspondientes a ICSI, las cabezas también fueron mayores (figs. 1b, c, d).
Figura 1. Distribución de los parámetros morfométricos correspondientes a semen fresco (EJS, símbolos en gris) y tras swim-up (SU, símbolos en blanco) para muestras destinadas a inseminación intrauterina (IIU, círculos), fecundación in vitro (FIV, cuadrados) o inyección intracitoplasmática de espermatozoides (ICSI, rombos). Los valores son medias de unos 200 espermatozoides por muestra.
Los espermatozoides analizados tras swim-up difirieron únicamente en un estrechamiento de la pieza intermedia entre los diferentes grupos, con los valores menores en las muestras destinadas a FIV (fig. 1f). El ángulo de la pieza intermedia y la distancia entre el punto de inserción de ésta y el eje de la cabeza no mostraron diferencias en ningún caso (fig. 1g, h).
Parámetros morfométricos y tasas de fecundación y embarazo
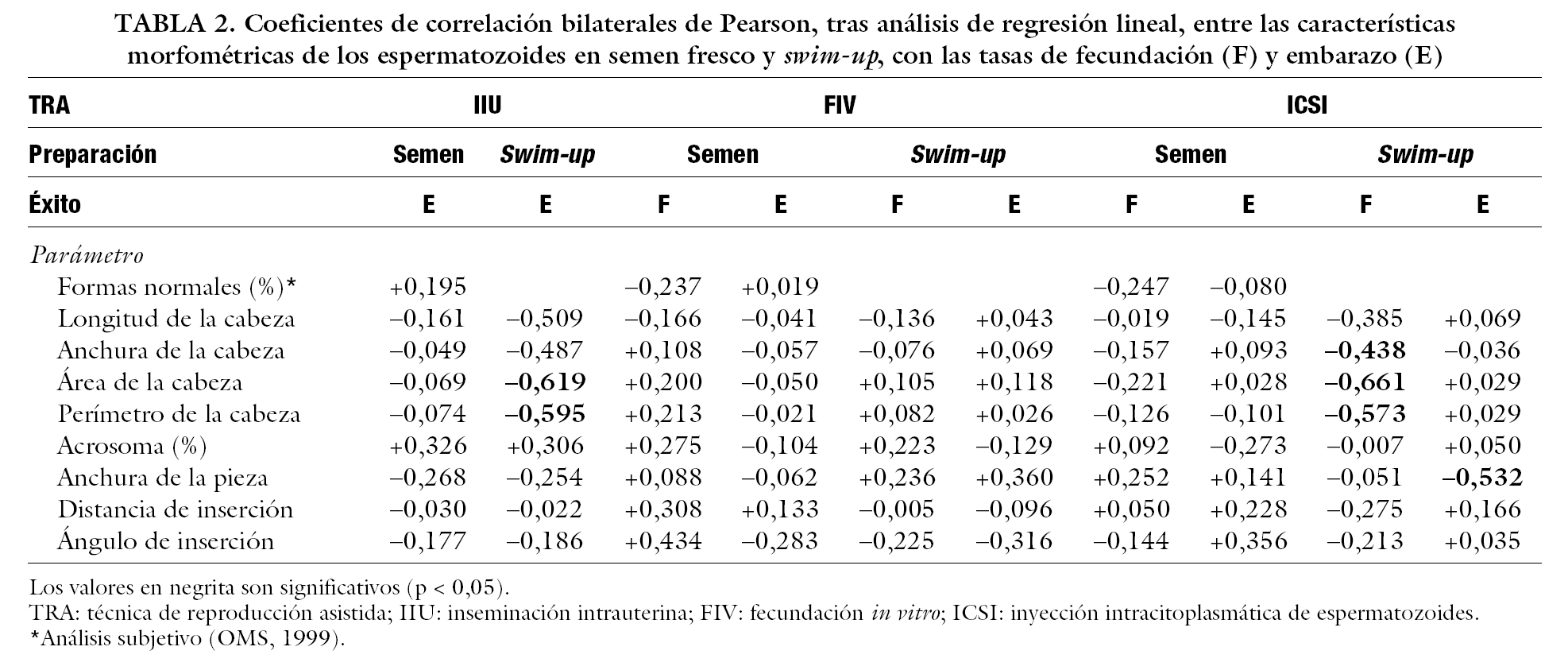
No se observó correlación entre la morfología espermática, valorada de modo subjetivo, en ninguno de los casos considerados (tabla 2).
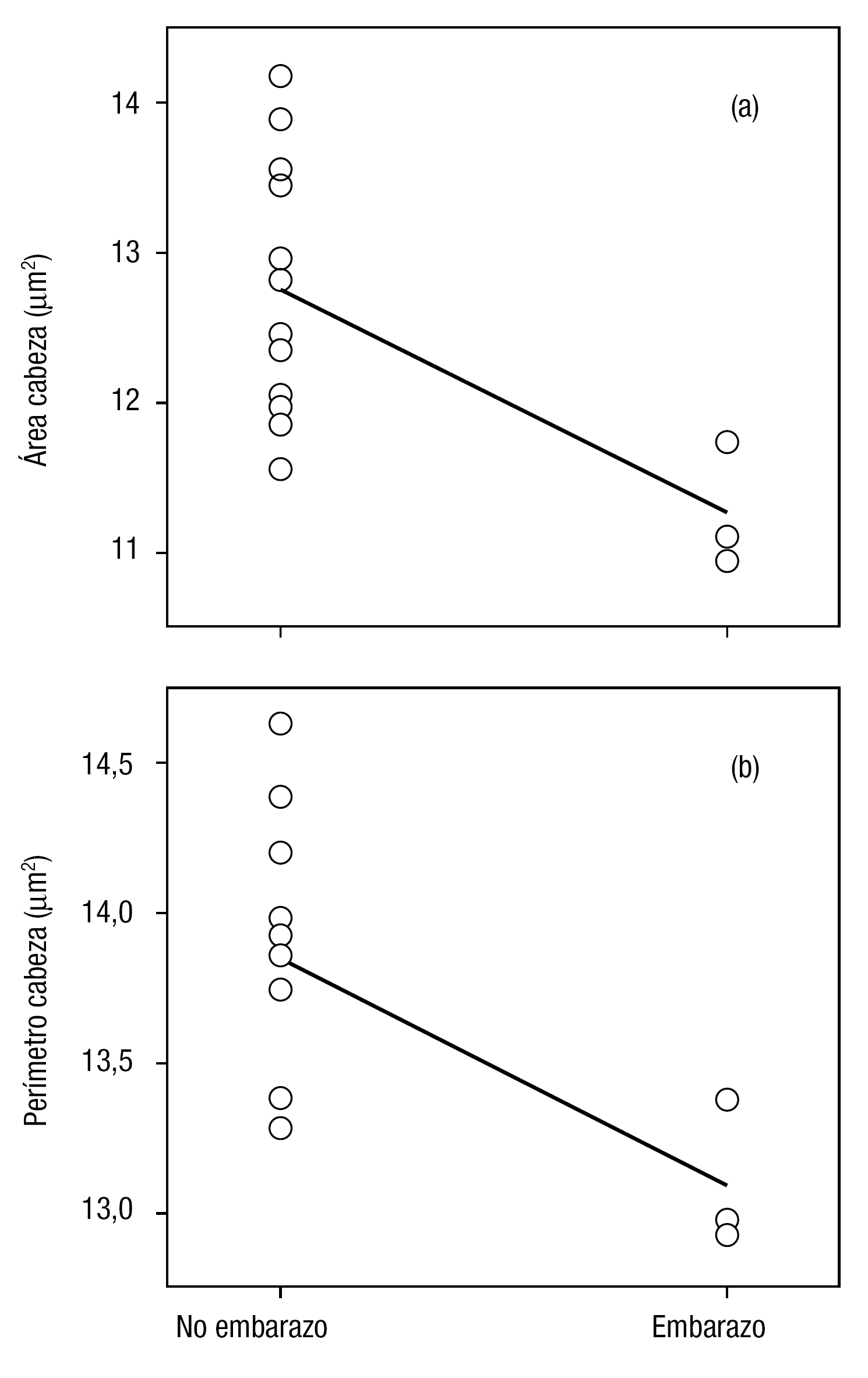
El análisis morfométrico no mostró correlación significativa entre los parámetros correspondientes al semen fresco en los casos de IIU, mientras que sí se observaron en las correspondientes a muestras tras swim-up para el área (fig. 2a; r = 0,619, p < 0,05) y el perímetro (fig. 2b; r = 0,595, p < 0,05) de la cabeza en relación con la tasa de embarazo (tabla 2).
Figura 2. Regresiones lineales significativas (p < 0,05) entre el establecimiento del embarazo y los parámetros morfométricos de espermatozoides seleccionados por swim-up, para pacientes dirigidos a IIU (a, área de la cabeza: r = 0,619; b, perímetro de la cabeza: r = 0,595).
En los espermatozoides utilizados para FIV, no se observó correlación alguna en ninguna de las condiciones consideradas (tabla 2).
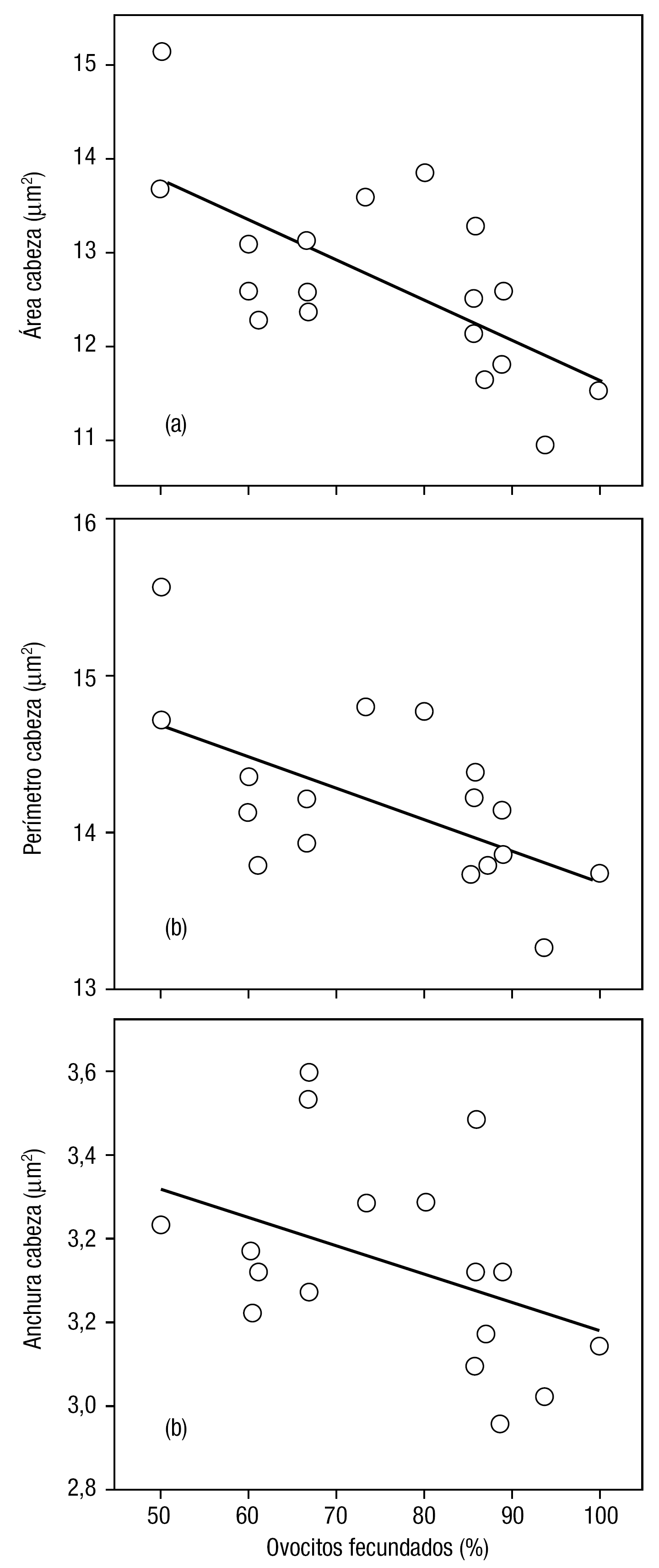
Finalmente, en los correspondientes a ICSI y tras swim-up, se obtuvo una correlación negativa significativa entre la tasa de fecundación y el área (fig. 3a; r = 0,661, p < 0,05), el perímetro (fig. 3b, r = 0,573, p < 0,05) y la anchura (fig. 3c, r = 0,438, p < 0,05) de la cabeza (tabla 2).
Figura 3. Regresiones lineales significativas (p < 0,05) entre la tasa de fecundación y los parámetros morfométricos de la cabeza de espermatozoides seleccionados por swim-up, para pacientes dirigidos a ICSI (a, área: r = 0,661; b, perímetro: r = 0,573; c, anchura: r = 0,438).
Los factores de forma no presentaron correlación en ninguno de los casos considerados (datos no mostrados).
DISCUSIÓN
Uno de los resultados más sobresalientes del presente estudio fue el relativo a la inesperada presencia de diferencias entre las muestras destinadas a las diferentes TRA. Las muestras de pacientes sometidos a FIV contuvieron espermatozoides menores que los correspondientes a IIU e ICSI.
El procedimiento de swim-up, que selecciona los espermatozoides en función de su movilidad progresiva, también mostró una selección de subpoblaciones morfológicas7,13. Las muestras de semen destinadas a ciclos de IIU tienden a ser ricas en espermatozoides con cabezas anchas. Los parámetros de tamaño de la cabeza del espermatozoide y de la pieza intermedia, así como el porcentaje del área acrosómica, difirieron de forma significativa tras swim-up respecto del semen fresco. Este hecho sugiere que la población espermática analizada en este caso es diferente de la que presenta una menor movilidad, lo que puede relacionarse con problemas tanto en el ámbito de la espermatogenia como, sobre todo, al proceso de maduración epididimario.
En este sentido, cabe abundar en el hecho de que los espermatozoides recuperados tras swim-up presentaron un área de la cabeza mayor, con un porcentaje de ésta ocupado por el acrosoma menor. El hecho de que este procedimiento seleccione células con un acrosoma de tamaño menor es de interés, pues se relaciona con células de mayor tamaño. La OMS8 sugiere que el tamaño del acrosoma de una célula considerada normal debe oscilar entre el 40 y el 70% del área total de la cabeza. En el presente estudio, no hubo diferencias en la extensión del acrosoma entre eyaculados en fresco y tras swim-up, si bien se asoció con las tasas de fecundación y embarazo, variando entre 33-60% (media 49%, mediana 50%).
Otra observación relevante es la correlación entre parámetros morfométricos y las tasas de fecundación y/o embarazo en algunas TRA. En concreto, la morfometría espermática de muestras preparadas para IIU por swim-up se relacionó con la tasa de embarazo bioquímico, y se correlacionaron negativamente, y de forma significativa, con el tamaño de las cabezas espermáticas. Ahora bien, a partir de los datos obtenidos, aún no podemos dilucidar si estos resultados son consecuencia de que las cabezas mayores no fertilizan los ovocitos o porque hay muerte embrionaria tras dicha fertilización. En todo caso, y dado el hecho de que no haya cambios entre las características, antes y después del swim-up, se puede pensar que los resultados obtenidos reflejan las características reales referidas a los espermatozoides producidos por esos pacientes. El mayor tamaño de las cabezas espermáticas puede estar asociado con una condensación inadecuada de la cromatina y/o un incorrecto intercambio de histonas por protaminas durante la espermatogenia, lo que podría interferir con los primeros estadios tras la fertilización.
En el caso de FIV, tan sólo se observó relaciones no significativas para todos los parámetros evaluados y las condiciones de trabajo. No esperábamos esta falta de correlación, ya que algunos trabajos previos han puesto de manifiesto que el porcentaje de células "normales" valoradas de forma subjetiva se correlacionaba con las tasas de FIV3,14. Ello parece conducir a la necesidad de revisar el concepto de qué es un espermatozoide de morfología "normal", pues, desde el punto de vista morfométrico una célula puede tener una décima de micra más o menos de área y pasar a ser clasificada como normal o anormal sólo por eso. En cambio, si se utiliza el número como tal, no hay barreras subjetivas previas, lo que conduce a unos resultados de mayor significación.
Así pues, igual que pasó en el caso del tratamiento por IIU, se obtuvo valores significativos de correlación negativa entre los valores morfométricos y las tasas de fecundación y/o embarazo tras ISCI. El análisis morfométrico de espermatozoides en el eyaculado en fresco de estos pacientes no manifestó correlaciones con las tasas de fecundación ni embarazo. Por el contrario, tras el procesado por swim-up, las muestras con espermatozoides de mayor tamaño presentaron mal pronóstico de fertilización. Puesto que la movilidad no es un requisito para el ICSI, si bien se considera un índice de la viabilidad celular, la "normalidad" morfológica de la célula se convierte en el principal criterio de selección. La definición de qué puede considerarse como una morfología "normal" no se realiza siguiendo los principios establecidos por la OMS, basados en muestras fijadas y teñidas, lo mismo que sucede con lo realizado en este trabajo con un sistema computarizado, sino localizando un espermatozoide móvil que no presente defectos morfológicos patentes, tal y como se observa a x100 y en muestra en húmedo12. Ahora bien, los resultados obtenidos aquí indicarían la conveniencia de utilizar espermatozoides de menor tamaño, siempre que se dispusiera de éstos en la muestra. Este hecho podría estar relacionado con la observación reciente de que la normalidad del núcleo espermático, examinado por microscopía de contraste de fase diferencial, es un factor importante para el éxito de la fecundación15.
A pesar de que los sistemas CASMA (o de forma más general CASA) están disponibles comercialmente desde hace algún tiempo, su incorporación a los laboratorios de andrología aún no se ha generalizado. Este hecho se debe a su elevado coste y a que, si bien introducen una mayor precisión e información, no se dispone de estándares adecuados4. Ahora bien, el conjunto de los resultados aquí expuestos, si bien se refieren aún a una muestra reducida, indican con suficiente rotundidad la utilidad de esta tecnología como criterio diagnóstico, al menos en las condiciones dadas para IIU e ICSI, minimizando e incluso eliminando el componente de subjetividad en la valoración de la morfología espermática16-18. Cabe señalar que ya se habían obtenido resultados similares respecto de la significación de la morfometría en estudios previos, donde se correlacionó con la tasa de embarazos in vivo19.
Como conclusión, se ha encontrado un número de parámetros relativos al tamaño de la cabeza y de la pieza intermedia de los espermatozoides que se correlacionan negativamente con las tasas de fecundación y/o embarazo después de TRA. En contraste con estos resultados, no se observó correlación alguna cuando se utilizó el criterio de "normalidad" usado de acuerdo con la observación subjetiva. Por ello, se recomienda el uso de sistemas CASMA, adecuadamente estandarizados, en la valoración seminal de muestras, tras el swim-up, que vayan destinadas a TRA, especialmente en los casos de IIU e ICSI, donde debería evitarse el uso de muestras con espermatozoides grandes.
AGRADECIMIENTOS
Queremos agradecer a Ele Kürten, Sabine Rehr, Daniela Schmidt, Diane Kösters y Anne Erpenbeck-Leuer por realizar los espermiogramas subjetivos y preparar las muestras para TRA.
Correspondencia: Dr. C. Soler.
Departament de Biologia Funcional i Antropologia Física. Universitat de València.
Dr. Moliner, 50. 46100 Burjassot. Valencia. España.
Correo electrónico: csolerv@uv.es