El tratamiento de la enfermedad del cartílago de la cadera es complejo y aún no contamos con algoritmos definidos para hacer frente a esta entidad. El uso de biomarcadores como herramientas diagnósticas podría desempeñar un papel clave en la detección de cambios preartrósicos y como factor pronóstico antes y después del tratamiento. Los tratamientos biológicos menos invasivos se muestran prometedores. Con las innovaciones y el perfeccionamiento quirúrgico en artroscopia de cadera, las técnicas de restauración del cartílago están evolucionando de una manera rápida y exponencial. El propósito de esta revisión es exponer nuevas evidencias terapéuticas disponibles para defectos focales del cartílago o degenerativos de la cadera.
Treatment of hip cartilage disease is challenging and there is no clear algorithm to address this condition. Biomarkers are emerging as promising diagnostic tools, as they could play a role in the early assessment of the pre-arthritic joint, as well as a prognostic factor before and after surgical or biological treatment. A trend towards a less invasive biological treatment is promising. With the growth of surgical skills in hip arthroscopy, cartilage restoration techniques are evolving in a fast and exponential manner. The purpose of this paper was to review new evidence available on the treatment options for chondral lesions and early osteoarthritis of the hip.
Las técnicas de preservación articular de la cadera han experimentado un incremento exponencial en las últimas décadas. La mejoría en la calidad de las imágenes, así como el perfeccionamiento de las técnicas artroscópicas han llevado a una mejor comprensión de la patología y al incremento en la cantidad de pacientes diagnosticados con lesiones condrales y cambios artrósicos precoces1,2.
El tratamiento de las lesiones condrales de cadera y la artrosis precoz continúa siendo un desafío. Estas lesiones del cartílago aún no poseen una solución definitiva, y de no ser tratadas pueden causar efectos deletéreos articulares considerables3. Si bien gran parte de la literatura está basada en procedimientos quirúrgicos en la rodilla, la extrapolación de estos resultados a la cadera deben ser evaluados con detenimiento, debido a las diferencias biomecánicas y a las propiedades del cartílago articular entre ambas articulaciones4-6.
El continuo desarrollo de los estudios por imágenes ha sido fundamental en el diagnóstico precoz y en la evaluación de la reparación del cartílago. La resonancia magnética convencional (RM) y las secuencias de RM específicas para cartílago —como d-GEMRIC, el mapeo en T2 y T1 rho— son las modalidades más utilizadas para el diagnóstico de lesiones condrales, condropenia y para la evaluación de la reparación condral7. Sin embargo, en la cadera es necesario mejorar la sensibilidad y especificidad del diagnóstico de las lesiones condrales mediante RM8.
Recientemente, una nueva era de «la articulación preartrósica» ha surgido mediante el uso de los biomarcadores. El tratamiento de la enfermedad articular preartrósica constituye un nuevo concepto, que hace hincapié en el empleo de estrategias biológicas no invasivas que modifiquen el curso de la enfermedad. El enfoque actual para el tratamiento de la artrosis se basa en la paliación de los síntomas derivados de la enfermedad en etapa tardía. La enfermedad en estadios tempranos o enfermedad preartrósica es clínicamente silenciosa, ya que normalmente los cambios metabólicos preceden los signos y síntomas, como el dolor, la deformidad y la limitación funcional. Los cambios metabólicos en el cartílago articular, membrana sinovial y hueso subcondral pueden representar los primeros cambios mensurables en la condición preartrósica. Por ello, la identificación y la validación de biomarcadores en estadios de preartrosis y en «articulaciones en situación de riesgo» pueden ser de gran valor en el desarrollo de nuevas estrategias terapéuticas, como factores pronósticos y de retorno al deporte o a la actividad. La posibilidad de detectar lesiones precoces y reversibles a nivel del cartílago estimula a desarrollar terapias que modifiquen la evolución de la enfermedad. El diagnóstico de enfermedad articular preartrósica permitirá a los cirujanos ortopédicos realizar un tratamiento profiláctico precoz, y de este modo prevenir cambios degenerativos irreversibles en el cartílago.
El manejo de las lesiones condrales y de la artrosis precoz de cadera es complejo y demandante. A la hora de tratar a estos pacientes, debemos evaluar a su vez numerosas patologías frecuentemente asociadas, como el síndrome de fricción femoroacetabular (SFFA), la displasia y la inestabilidad de cadera. Las patologías asociadas deben ser tratadas de manera concomitante a la lesión del cartílago.
Se han propuesto numerosos tratamientos biológicos y quirúrgicos para el manejo de las patologías condrales de la cadera. Los tratamientos biológicos más utilizados incluyen el plasma rico en plaquetas (PRP), el concentrado de aspirado de médula ósea (BMAC), el uso de células madre, el ácido hialurónico y el aceite de pescado, entre otros. Los tratamientos quirúrgicos descritos incluyen microfractura aislada o suplementada biológicamente9-12, la reparación directa13,14, el implante de condrocitos autólogos15,16, el implante de condrocitos inducidos en matriz17, condrogénesis autóloga inducida en matriz17, mosaicoplastia18-20, trasplante osteocondral21,22 e implante de células madre en membrana23. El propósito de este trabajo es presentar las nuevas evidencias de tratamiento disponibles para las lesiones condrales y la artrosis precoz de cadera.
La articulación preartrósicaBiomarcadoresLos biomarcadores, como indicadores objetivamente cuantificables de la fisiopatología de la artrosis de cadera, tienen el potencial de facilitar el diagnóstico, estadificar la enfermedad y brindar un pronóstico de la misma. Los marcadores moleculares biológicos de la artrosis como indicadores de un proceso patológico han demostrado una buena correlación entre el estado clínico y la evolución de la enfermedad. Sin embargo, por el momento no se ha aislado ningún biomarcador con la sensibilidad y especificidad adecuada para recomendar su uso24-26. Los pacientes con SFFA poseen valores elevados de marcadores inflamatorios y de la degeneración consecuente del cartílago27. En una revisión sistemática realizada por Nepple et al.26 concluyeron que aunque hay más de 70 biomarcadores detectados para la artrosis de cadera, ninguno ha sido recomendado para el uso clínico, debido a la falta de especificidad. Las referencias bibliográficas sobre biomarcadores en la artrosis de cadera son extensas, aunque resulta difícil formalizar un concepto.
Tratamientos biológicos actuales para la artrosis precozPlasma rico en plaquetas autólogoEl PRP ha sido utilizado desde hace más de 50 años en patologías dermatológicas y maxilofaciales. Sin embargo, su aplicación en cirugía ortopédica se ha difundido recientemente28. El PRP es el «volumen de plasma que posee un recuento de plaquetas por encima del basal»29 y resulta del centrifugado de sangre periférica que conduce a una muestra altamente concentrada en plaquetas. Estas plaquetas serán sometidas a una degranulación luego de una activación endógena (cloruro de calcio, quitosano) o exógena para liberar factores de crecimiento y otras moléculas activas (quimioquinas, matriz extracelular, proteínas, nucleótidos), mejorando la calidad de la respuesta inflamatoria y ayudando al proceso de curación28. En modelos experimentales en conejos con artrosis inducida y tratados con un hidrogel incrustado en PRP se observó una disminución en la progresión de la enfermedad30-32. Clínicamente, existe una evidencia limitada sobre los efectos del PRP en la articulación de la cadera para el tratamiento de la artrosis precoz. Sánchez et al.33 evaluaron los efectos de la inyección intraarticular de cadera con PRP en 40 pacientes con artrosis grave, y señalaron una mejoría significativa del dolor y de la función articular con un seguimiento a medio plazo. Ciertos estudios sugieren que el PRP es capaz de reducir el dolor y mejorar el estado funcional, sobre todo en pacientes con artrosis precoz o moderada34. En los estadios más avanzados no se observaron diferencias clínicamente significativas al utilizar PRP o ácido hialurónico35. Asimismo, a la hora de analizar los resultados del PRP, se observa una gran variabilidad dependiendo de los autores y los diferentes productos utilizados, con diferentes respuestas a dichos tratamientos36. El PRP rico en leucocitos (leukocyte rich PRP) ha demostrado inducir un mayor crecimiento celular al estimular las vías anabólicas. Este tipo de PRP es más adecuado para lesiones crónicas, donde hace falta una remodelación de los tejidos. Asimismo, al tener una alta concentración de leucocitos, se han apreciado mayor número de efectos secundarios asociados, como la inflamación o la sinovitis reactiva. El PRP con bajo índice de leucocitos (leukocyte poor PRP) promueve las vías catabólicas que involucran diferentes citoquinas37 y se recomienda en las lesiones agudas38. Múltiples interrogantes siguen sin respuesta con estas terapias, incluyendo el número de inyecciones, el volumen adecuado o las dosis, y tampoco sabemos las indicaciones ideales o la posibilidad de utilizarlo como terapia adyuvante en las cirugías35.
Aceite de pescadoLos ácidos eicosapentaenoico y docosahexaenoico son ácidos grasos omega-3 que se encuentran en el aceite de pescado. Estos ácidos grasos inhiben parcialmente ciertos procesos de la cadena inflamatoria, incluyendo la quimiotaxis de leucocitos, la adhesión de moléculas de expresión e interacciones adhesivas leucocito-endoteliales, la producción de citoquinas inflamatorias, y la reactividad de los linfocitos T-helper139. Madden et al.40 sugirieron que también podrían alterar la expresión de los monocitos CD-44, que es otro receptor de la cadena inflamatoria. Así mismo, estos ácidos grasos promueven la condrogénesis en modelos de cartílago humano y bovino in vitro41. Al reducir la inflamación y promover la condrogénesis, los ácidos grasos omega-3 actuarían en los mecanismos fisiopatológicos predominantes de la artrosis; la suplementación dietaria con ácidos grasos poliinsaturados omega-3 posee un efecto beneficioso al retardar la progresión y disminuir la inflamación en la patogénesis de las enfermedades degenerativas articulares41.
Ácido hialurónicoNumerosos artículos sugieren que el uso de ácido hialurónico intraarticular es una buena opción terapéutica para pacientes con artrosis incipiente de rodilla42. El ácido hialurónico tiene la capacidad de unirse a receptores específicos como CD 44, ICAM-1 y al receptor de la motilidad mediada por hialuronato (RHAMM)43. Estos receptores, al ser activados, desencadenan ciertos eventos intracelulares como la liberación de citoquinas y la formación proteica. El peso molecular (PM) del ácido hialurónico utilizado influye en los resultados clínicos de los pacientes con artrosis. Para el tratamiento articular de la cadera, se ha descrito que el uso de ácido hialurónico de alto PM (1.500-2.000kDa) tendría mejores resultados que los de bajo peso44-46. Migliore et al.46 evaluaron 120 pacientes a los que se les realizó una infiltración intraarticular de cadera con ácido hialurónico de alto PM, observando una mejoría significativa en el índice funcional de Lequesne y en la escala visual análoga del dolor a los 3 meses, mientras que al año, el 80% de los pacientes obtuvo una mejoría de la sintomatología de al menos un 30%.
Células mesenquimales pluripotenciales adre y concentrado de aspirado de médula óseaEs fundamental comprender las diferencias entre el BMAC y las células mesenquimales pluripotenciales (MSC). El BMAC es una fuente de MSC. Ciertos estudios sugieren que solo entre el 0,001 y el 0,01% del BMAC son MSC47. Sin embargo, el BMAC es una fuente rica en factores de crecimiento, incluyendo TGF-β e IL-1ra (IL1 receptor antagonista), que podrían contribuir a la condrogénesis, generando un efecto anabólico y antiinflamatorio48.
El tratamiento con MSC requiere del aspirado de médula ósea, aislamiento, cultivo y expansión de las mismas por un periodo de 4 a 6 semanas. A través de este proceso, se pueden obtener de 80 a 200 millones de MSC/ml, y a mayor concentración de células, mejores serán los resultados clínicos obtenidos49. Sin embargo, la dosis óptima, el tiempo y el número de aplicaciones continúan sin estar consensuados50.
Las MSC pueden ser obtenidas de diferentes fuentes, y pueden ser MSC de adulto (MSCa) o de origen embrionario (MSCe)51. La inducción de MSC52 (iMSC) se ha propuesto como otra fuente posible para su obtención. Esta técnica consiste en obtener fibroblastos adultos de la piel y modificarlos genéticamente para rediferenciarlos en células madre pluripotenciales. Las MSCa pueden obtenerse de la médula ósea, del tejido adiposo, del tejido sinovial y del cordón umbilical. A diferencia de las MSCe, su uso no está restringido por conflictos éticos51. La fuente de obtención celular para el uso en lesiones condrales varía por sus beneficios y sus potenciales desventajas. Las MSC obtenidas del tejido adiposo son autólogas, y su extracción es sencilla. Sin embargo, se ha sugerido que su capacidad condrogénica es menor en comparación con la de las MSC obtenidas de médula ósea53. A pesar de que hay un gran potencial en el desarrollo de las terapéuticas con MSC, quedan muchos interrogantes a descifrar, desde el tipo de célula con mejor capacidad de diferenciación, la mejor fuente de obtención, si debe ser autóloga o alogénica, hasta cuál es la mejor manera de estimular las células implantadas. Se ha propuesto el uso de factores biológicos, como el ácido hialurónico, asociados a las terapias de MSC que promoverían el direccionamiento de estas células a tejidos específicos, como podrían ser el cartílago o tejido sinovial. Otra de las preguntas que queda aún sin responder es el comportamiento de estas células una vez inoculadas en la articulación. Se ha sugerido que las MSC serían como los «directores de orquesta» en el proceso de regeneración condral. Las MSC proporcionan las señales al resto de los tejidos, incrementando la respuesta anabólica de los mismos. Las MSC tienen la capacidad de localizar y colaborar en el proceso de reparación de estructuras articulares lesionadas54.
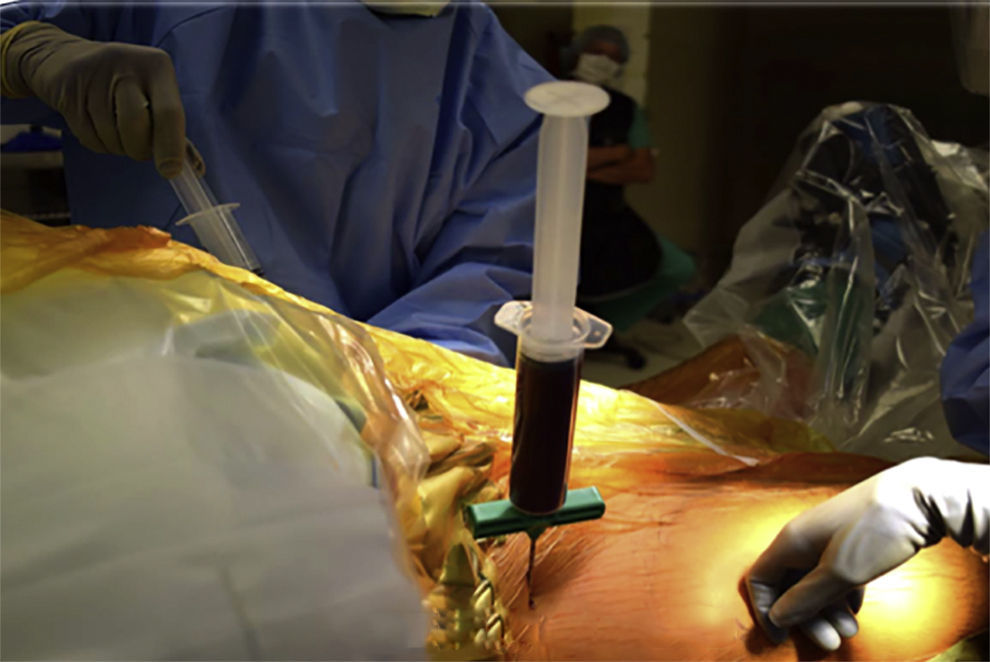
La fuente de extracción predilecta es la médula ósea, debido a su mayor actividad condrogénica y antiinflamatoria55, sin olvidar sus propiedades inmunosupresoras y de fácil extracción56 (fig. 1).
Algunos sugieren que las MSC poseen características de diferenciación superiores a las obtenidas en otras fuentes57,58. En los Estados Unidos no está permitida la expansión de MSC, y la FDA ha determinado que las células deben ser mínimamente manipuladas y utilizadas en un breve intervalo de tiempo59. Esto limita la aplicabilidad de estas terapias a la expansión del aspirado de médula ósea (fig. 2).
En la actualidad, no existe mucha bibliografía para determinar los resultados clínicos de estas terapias. Davatchi et al.60 observaron una mejoría clínica, tras la aplicación en rodillas artrósicas, de moderada a grave, de MSC (8-9×106). Evaluaron el tiempo de andar, subir escaleras, la crepitación rotuliana y la escala visual análoga del dolor durante los primeros 6 meses, comenzando a declinar luego de este periodo, aunque mantenían valores, a los 5 años, mejores que la línea de base.
Las MSC como coadyuvante a terapias quirúrgicas del cartílago proponen la inoculación 2 semanas después del procedimiento quirúrgico, suponiendo un estímulo regenerativo54.
Técnicas quirúrgicas para lesiones condrales focales. Estimulación de la médula ósea y aumentación biológicaMicrofracturas o microperforacionesLa técnica de las microfracturas ha sido descrita extensamente, y los resultados publicados para microfracturas en cadera son controvertidos4. La selección del paciente es clave para obtener buenos resultados. Los criterios para la indicación han sido extrapolados de los procedimientos de rodilla: pacientes menores de 40 años, con un índice de masa corporal menor a 30, mínima artrosis (Tönnis 0-1) y lesiones focales contenidas de menos de 2cm261. A su vez, es importante comprender que en la cadera las patologías asociadas como el SFFA, la inestabilidad y la displasia deben ser tratadas concomitantemente para prevenir el futuro deterioro de la reparación del cartílago.
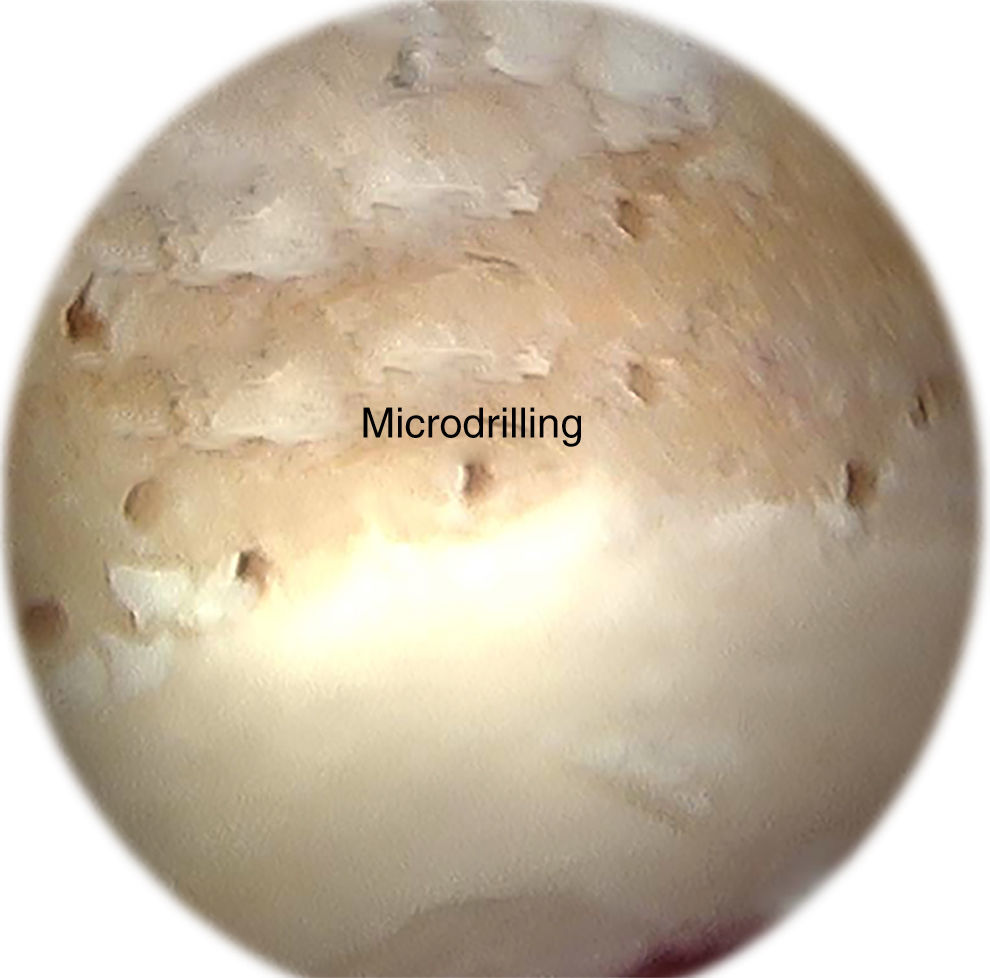
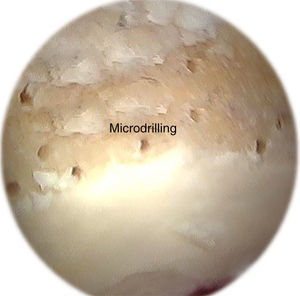
Otra técnica ampliamente difundida son las microperforaciones o método de Pridie62, en la cual se realizan perforaciones con el uso de un motor, lo que permite realizar orificios cilíndricos, a diferencia de las microfracturas que generan orificios cónicos. Esta terapia brinda un mejor control de la profundidad de los orificios. Ciertos autores han promulgado que la realización de microfracturas prevendría la necrosis térmica, en contraste con las microperforaciones, generando una mejor reparación que el método de Pridie63,64. Sin embargo, no se han encontrado diferencias en la necrosis generada por ambos métodos. Así mismo, las microperforaciones previenen la lesión de la placa subcondral. Dicha lesión ha sido relacionada con hipertrofia de la misma, lo cual tendría efectos deletéreos en la articulación65,66 (fig. 3). Tanto las microfracturas como las microperforaciones permiten la formación de un coágulo de sangre con gran concentración de MSC procedentes de la médula ósea, y factores de crecimiento que permiten la generación de un tejido fibrocartilaginoso de reparación4. Los pacientes deben permanecer 6 semanas sin apoyar para prevenir la desorganización del coágulo.
Imagen artroscópica de microperforaciones realizadas con una guía de 1mm en el acetábulo durante la artroscopia de cadera. Similar a la microfractura, las microperforaciones requieren la remoción de la capa calcificada de cartílago. Las microperforaciones se realizan con una guía flexible (Stryker, Phoenix, AZ, EE.UU.).
Los resultados clínicos son prometedores. Philippon et al.9 presentaron una serie de 9 pacientes a los que se les realizó una revisión artroscópica de cadera luego de un procedimiento inicial de microfracturas. El tiempo medio entre el procedimiento inicial y la revisión fue de 20 meses. El porcentaje de relleno de los defectos condrales fue del 91%. Byrd y Jones12 realizaron 58 microfracturas en defectos condrales de grado IV con cartílago circundante saludable. En la evaluación, con el Harris Hip Score (HHS), se obtuvo una mejoría de 20 puntos con un seguimiento medio de 16 meses. Domb et al.67 publicaron una serie de 30 pacientes a los que se les realizó microfracturas con un seguimiento medio de 2 años, donde obtuvieron mejorías clínicamente significativas.
Microfractura biológicamente aumentadaLa aumentación biológica consiste en realizar una terapia biológica (PRP o BMAC o MSC) acompañando a la microfractura. El fibrocartílago que tapiza los defectos condrales, luego de realizada la microfractura, genera beneficios limitados a largo plazo, debido a la menor calidad de su tejido68. La aumentación biológica podría lograr mejores resultados al ayudar a generar un tejido de reparación más natural y evitar el fibrocartílago. Las publicaciones sugieren que la aumentación con BMAC o MSC a las 6 semanas incrementa la calidad del cartílago regenerado69. En un estudio experimental, realizado en caballos, se compararon las microfracturas aisladas frente a las microfracturas aumentadas con MSC (20×106), concluyendo que la aumentación mejora la calidad del cartílago reparado con un mayor contenido de agrecanos, brindando mayor firmeza en el tejido de reparación70.
Condrogénesis inducida en matriz autólogaLa condrogénesis inducida en matriz autóloga (AMIC) es una nueva propuesta para potenciar las microfracturas con matriz de colágeno tipo I/II (Chondro-Gide; GeistlichPharma AG, Wolhusen, Suiza)71. La membrana cubre la microfractura realizada logrando mantener el coágulo generado por la microfractura. Este procedimiento se realiza en un solo tiempo, no requiere de la extracción, cultivo y reimplante de células autólogas y puede realizarse por vía artroscópica72.
Implantación de condrocitos autólogos inducidos en matrizLa técnica de implantación de condrocitos autólogos inducidos en matriz (MACI) puede ser realizada por vía artroscópica. Esta técnica consiste en cultivar células autólogas en una matriz tridimensional biocompatible, que luego es implantada en el defecto condral73,74. Basad et al.75 compararon el MACI con procedimientos de microfractura en defectos de rodilla con un seguimiento a corto plazo (1-2 años). Los resultados obtenidos fueron superiores en aquellos pacientes en los que se utilizó la técnica de MACI. Mancini y Fontana76 compararon los resultados clínicos obtenidos con el uso de MACI (n=26) y AMIC (n=31) para el tratamiento de defectos condrales acetabulares (2 y 4cm2) y obtuvieron resultados similares con ambos procedimientos. Sin embargo, concluyeron que el AMIC puede realizarse en un solo tiempo y reduce el tiempo total de tratamiento, disminuyendo la morbilidad y brindando efectos similares a los obtenidos con el procedimiento MACI en 2 tiempos.
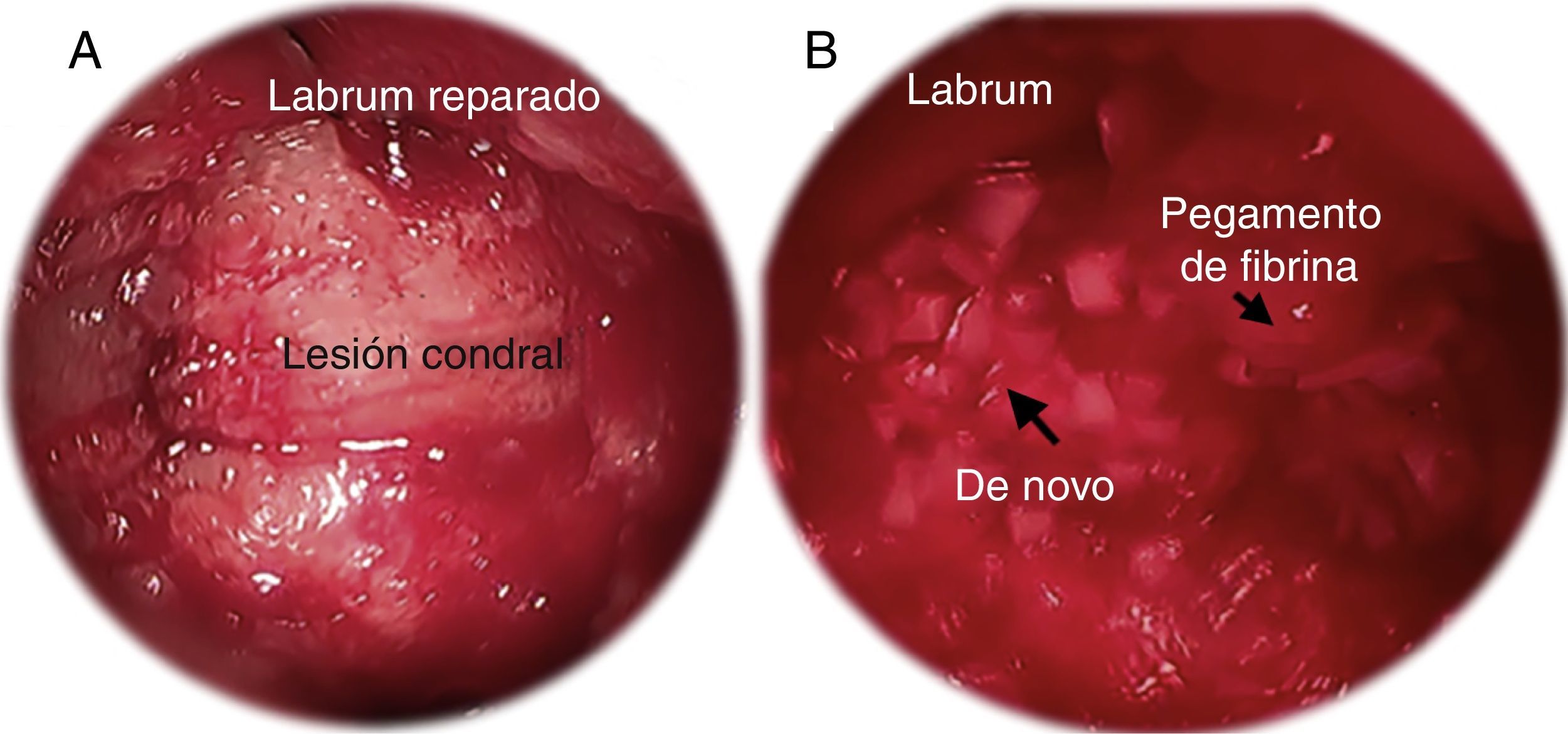
Nuevas terapiasEl De Novo Natural Tissue (Zimmer, Warsaw, IN, EE.UU.) es un injerto morselizado proveniente del tejido cartilaginoso obtenido de donantes menores de 13 años de edad. Debido a la corta edad de estos donantes, la densidad celular en este tipo de injertos es mayor a la observada en muestras de cartílago articular maduro. De Novo NT ha sido ampliamente utilizado para lesiones condrales de rodilla y tobillo77,78. Actualmente, De Novo NT se utiliza en artroscopia de cadera para el tratamiento de las lesiones condrales acetabulares. Las indicaciones son similares a las mencionadas previamente para las microfracturas. Sin embargo, reservamos este tipo de procedimiento para los pacientes de mayor edad (>40 años) en los cuales la regeneración condral luego de las microfracturas per se es menor que en pacientes más jóvenes, y para defectos condrales más grandes. Habitualmente se realiza al final de la cirugía, cuando tanto el compartimento central como el periférico han sido tratados. El injerto debe ser colocado una vez que el defecto condral se encuentre completamente seco. Puede utilizarse un arpón guía curvo para facilitar la colocación del injerto dentro del defecto condral. Se debe utilizar una capa de pegamento de fibrina antes y después de colocar el injerto. En el postoperatorio, los pacientes deben permanecer sin cargar peso por un periodo de 6 semanas (fig. 4).
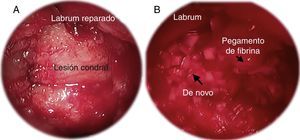
Imágenes artroscópicas de: A) preparación en seco de la lesión condral;
B) implantación de De Novo NT. El pegamento de fibrina se aplica primero en la base de la lesión. Luego De Novo NT es colocado de manera artroscópica. Para finalizar, una segunda capa de pegamento de fibrina es aplicada sobre el lecho de De Novo NT.
Existe evidencia preliminar con otros procedimientos avalados para el tratamiento de los defectos condrales de rodilla como el BST-CarGel (Smith & Nephew), que es una forma acuosa de chitosan (polisacárido de glucosamina) mezclado con sangre autóloga fresca. Otro procedimiento es el BioCartilage (Arthrex, Naples, FL, EE.UU.), aloinjerto de cartílago deshidratado y micronizado en partículas de 100 a 300 micras mezclado con sangre y fibrina para formar un coágulo de sangre estable72.
Trasplante de células madre asociadas a matrizSimilar al MACI, este procedimiento consiste en aplicar las células en una matriz en el defecto condral. La diferencia con el MACI es que la línea celular es diferente, las células se cultivan en monocapa por un periodo de 28 días y luego son transferidas a una matriz (Chondroguide, Geistlich® o Hyalofast®). Esta matriz puede implantarse sobre el defecto por vía artroscópica. Mardones et al. (comunicación personal) dieron a conocer sus resultados en 15 pacientes tratados con esta técnica. Todos los pacientes tuvieron mejorías en la escala de cadera de Harris y un seguimiento de 2 años. No se describieron complicaciones. Se les realizó d-GEMRIC a 4 de estos pacientes, obteniendo un relleno completo del defecto e integración con el cartílago nativo.
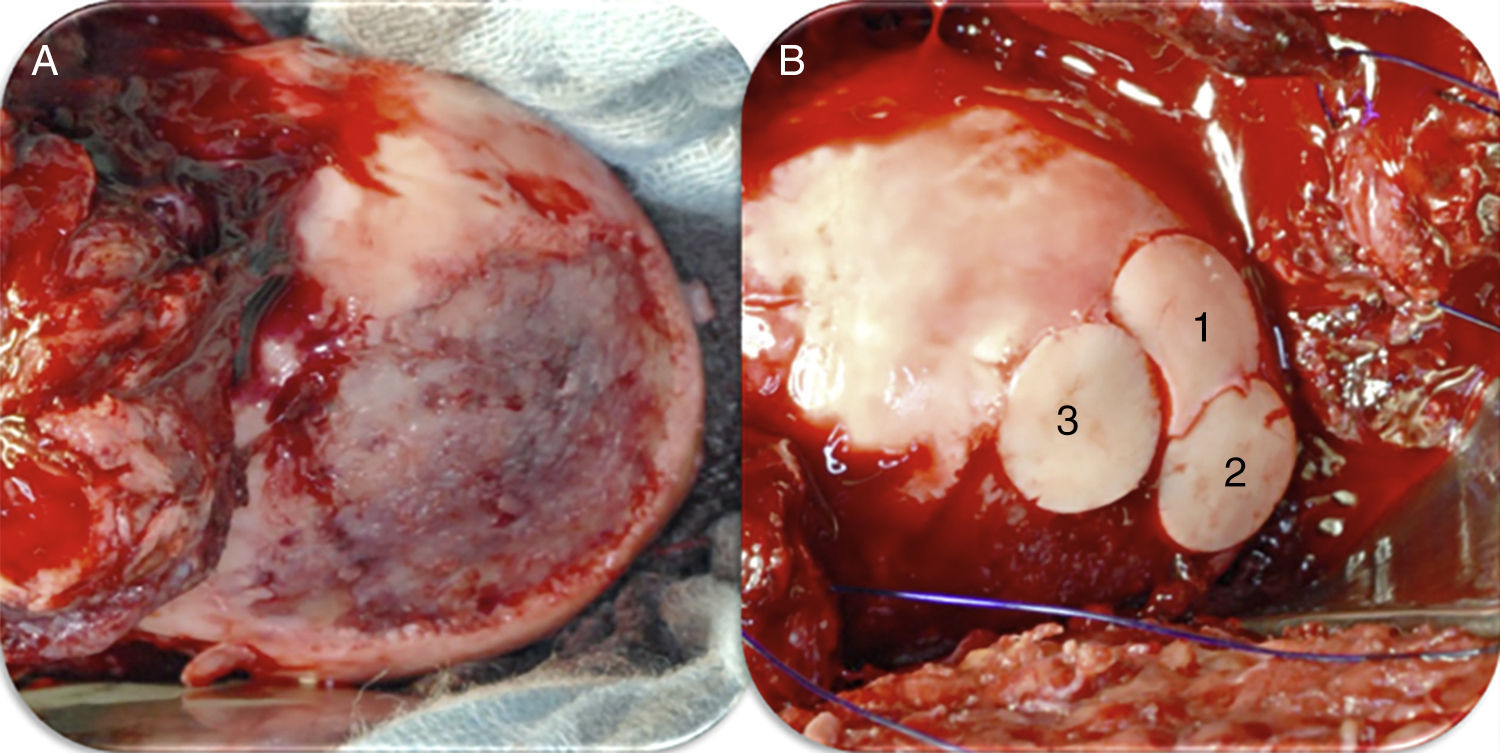
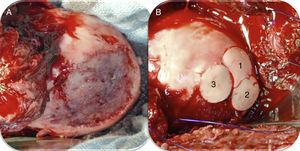
Aloinjertos osteocondrales frescosEl uso de aloinjertos osteocondrales frescos está recomendado en pacientes jóvenes (<50 años) con defectos condrales grandes (>2,5cm)4. La ventaja de este procedimiento radica en la posibilidad de tratar lesiones condrales de gran tamaño en un solo tiempo quirúrgico. A su vez, el uso de aloinjertos brinda al paciente cartílago hialino en lugar de fibrocartílago79. Dentro de las desventajas nos encontramos con la necesidad de realizar una cirugía abierta (luxación controlada de cadera) y la restricción en la carga de peso por un periodo de hasta 12 semanas79. Los aloinjertos osteocondrales son más frecuentemente utilizados para la cabeza femoral en la cadera. En un estudio prospectivo79 se publicaron los resultados de 17 pacientes tratados con aloinjertos osteocondrales frescos en la cabeza femoral con un seguimiento medio de 42 meses. La escala de cadera de Harris mejoró significativamente luego de la cirugía y 13 pacientes tuvieron resultados de regulares a buenos. Uno de los pacientes requirió un nuevo aloinjerto y 3 pacientes terminaron en un reemplazo total de cadera79. Los autores concluyeron que el aloinjerto osteocondral fresco es una alternativa terapéutica razonable para defectos condrales de cadera en pacientes jóvenes (fig. 5).
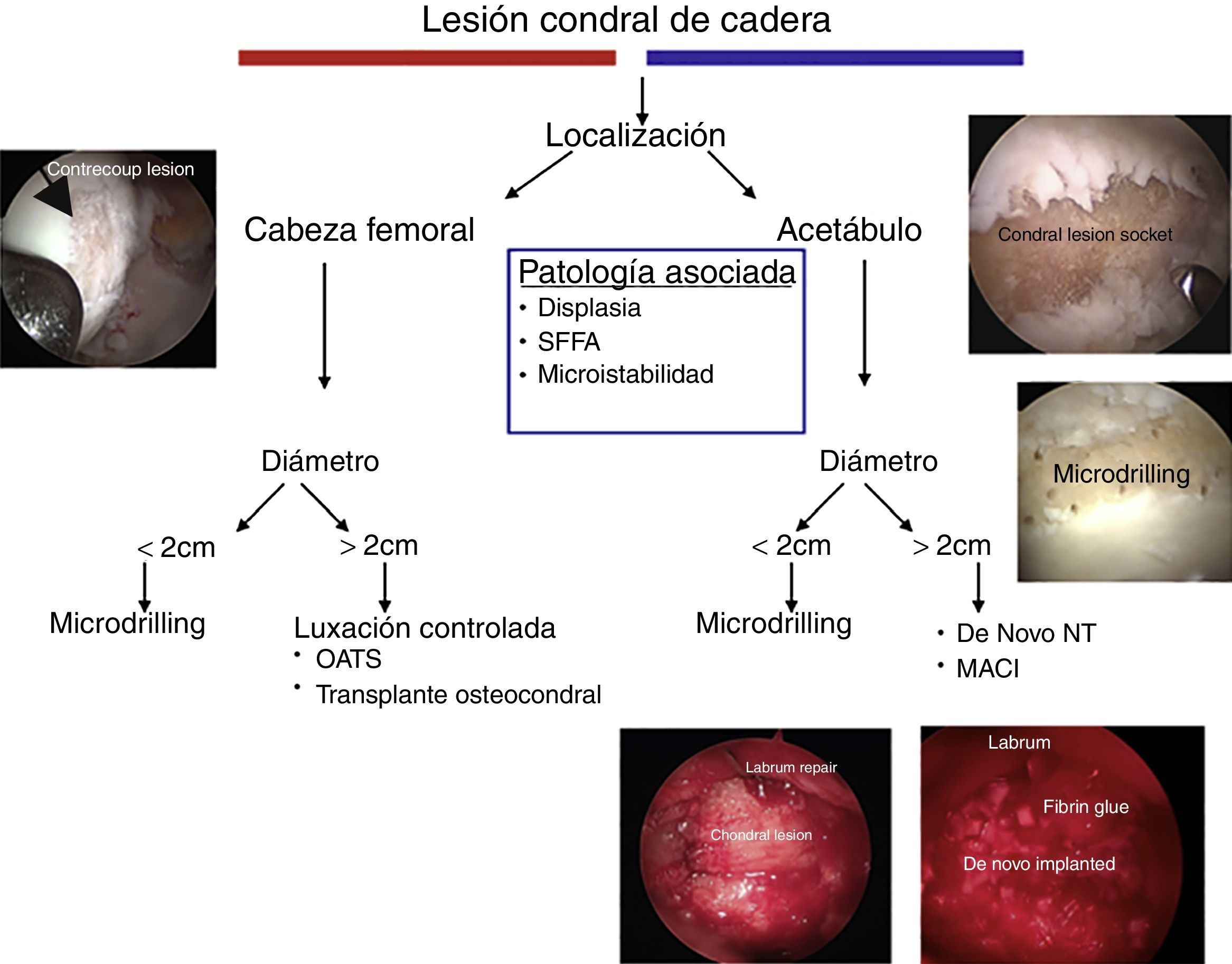
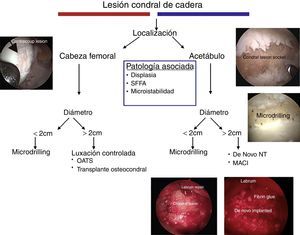
Propuesta de un algoritmoNuestro algoritmo prioriza, en primer lugar, la localización de la lesión. Lesiones pequeñas tanto del acetábulo como de la cabeza femoral pueden ser tratadas satisfactoriamente con microperforaciones o microdrilling. En lesiones más grandes, dependiendo de la localización, se puede optar por un aloinjerto osteocondral (en cabeza femoral) o un tratamiento de superficie, con el De Novo NT o MACI para el acetábulo. Las terapias celulares de superficie son óptimas para el acetábulo, debido a las características cóncavas del mismo y al grosor de su cartílago. Así mismo, el algoritmo remarca la importancia de realizar el tratamiento de las lesiones concomitantes (fig. 6).
Ensayos clínicos aleatorizados comparando tratamientosLas publicaciones de reparación del cartílago de la cadera son de difícil interpretación debido a la heterogeneidad entre los grupos de estudios. A su vez, ciertas publicaciones podrían tener conflicto de intereses o estar sesgadas. Los trabajos clínicamente relevantes de nivel I son los detallados a continuación. Cabe destacar que no existen publicaciones de índole quirúrgica con nivel de evidencia I. Pavelka et al.80 no observaron cambios estructurales con el uso de glicosaminoglicanos para la artrosis de cadera en un estudio con un seguimiento de 60 meses. De la misma manera, Rozendaal et al.81 observaron que los glicosaminoglicanos no tenían diferencias significativas en la reducción de los síntomas y en la progresión de la artrosis en comparación con el uso de placebos. Qvistgaard et al.82 publicaron que el uso de los corticoides para la artrosis de cadera tendría un efecto beneficioso, aunque de corta duración. Sin embargo, este estudio no pudo cuantificar los efectos del uso de ácido hialurónico para la artrosis de cadera. Publicaciones de estas características, pero con mayor tiempo de seguimiento, confeccionarán las futuras guías de tratamiento en esta área.
ConclusionesEl tratamiento de las lesiones condrales de cadera es complejo. Los biomarcadores están surgiendo como una herramienta diagnóstica prometedora, ya que podrían mejorar la detección de la articulación preartrósica y actuar como factor pronóstico pre y postratamiento. Nuevas tendencias hacia tratamientos biológicos menos invasivos están surgiendo en la bibliografía. Con el desarrollo de las habilidades quirúrgicas en artroscopia de cadera, las técnicas de reparación de cartílago han evolucionado exponencialmente, pero los resultados a medio y largo plazo del uso de estas técnicas continúan sin conocerse.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.