Los fenómenos alérgicos han aumentado en todo el mundo, incluyendo cuadros provocados por alimentos y aditivos. La alergia alimentaria es altamente prevalente en los primeros años de vida, su persistencia parece ser más frecuente que lo que se pensaba y puede ser causa de cuadros inmunes graves. La literatura en el tema es abundante y la información publicada disímil, lo que hace necesario seguir criterios estrictos para evaluar la calidad de la información publicada. Hasta que no contemos en el país con estudios locales sólidos que respalden Guías de Diagnóstico y Tratamiento, es recomendable que estos pacientes sean manejados por especialistas. En este artículo se revisa y discuten aspectos relacionados con la definición, epidemiología, principales alérgenos, tipos de reacciones inmunes asociadas a los cuadros alérgicos, diagnóstico y tratamiento de las alergias alimentarias.
Allergic phenomena have increased globally, including conditions induced by foods and additives. Food allergies are most prevalent in the first years of life, their persistence seems to be more frequent than previously thought and they may cause severe immune responses. There is profuse literature on this topic and the published information may differ substantially, making necessary that criteria to evaluate the quality of published data should be followed strictly. Until sound local evidence is available to support Guidelines for diagnosis and treatment these patients should be managed by specialists.
In this article we review and discuss relevant aspects of food allergy definition, epidemiology, allergenic proteins, types of immune reactions that support diagnosis, diagnosis and treatment.
Que los fenómenos alérgicos están aumentando en el mundo fue una ¡dea que tomó fuerza paulatinamente desde hace muchos años. El año 2002 apareció publicado un artículo señero que daba cuenta que, en el último siglo, la prevalencia de las enfermedades alérgicas y autoinmu-nes se habían duplicado o más en Europa (1). El autor destacaba la correlación que se encuentra entre mayor desarrollo de un país e incidencia de asma, diabetes tipo 1 y esclerosis múltiple, en países europeos, y la alta prevalencia de infecciones en los países de menor desarrollo, donde alergias y condiciones autoinmune tenían francamente menor prevalencia. Desde entonces la “hipótesis de la higiene” rápidamente se generalizó y ha habido múltiples intentos por demostrarla en diversos contextos. De esos estudios se ha aprendido que, así como los hallazgos acerca de las manifestaciones alérgicas gastrointestinales y de piel parecen favorecer dicha hipótesis, la relación entre alergia respiratoria e higiene es más difícil de demostrar.
Actualmente, nadie duda del aumento de las manifestaciones alérgicas (2, 3). El problema, sin embargo, se ha complicado porque frecuentemente es difícil demostrar el diagnóstico y la posibilidad de sub diagnóstico y sobre diagnóstico es alta. El número de publicaciones en este tema crece día a día, y a menudo se sacan conclusiones contradictorias; por eso hoy día ha tomado fuerza la necesidad de contar con criterios que ayuden a evaluar la calidad de la información que se nos entrega.
En el tema de la alergia alimentaria esto se ha transformado en un asunto de primordial importancia, por lo que revisaremos, como primer punto, cómo debemos evaluar la información que leemos (Tabla 1).
Niveles de evidencia
| NIVEL 1 | La evidencia disponible incluye por lo menos un ensayo controlado randomizado, una revisión sistemática o un meta-análisis. |
| NIVEL 2 | Existe algún tipo de ensayo comparativo, no randomizado, cohorte o estudio epidemiológico. En estos casos, ojalá haya más de un estudio. |
| NIVEL 3 | Basada en opiniones de expertos o declaraciones de consensos. |
¿Cómo se aplica esto? Cuando decimos que la alergia a proteína de vaca (APLV) es la manifestación alérgica más frecuente, con incidencias entre 2 y 5%, nos referimos a ensayos basados en evidencia de nivel 1 (4). Que la incidencia de alergia a proteína de leche de vaca (APLV) en lactantes amamantados se describe en 0,5% se ha hecho en base a dos ensayos que dan evidencia tipo 1 (5, 6). Que el grupo de niños de alto riesgo tenga un riesgo de APLV seis veces mayor que a proteína de soya también se basa en evidencia de nivel 1 (7). Es lamentable que hoy en día una proporción considerable de los artículos que leemos sobre alergia en general, y alergia alimentaria en especial, mezclan información basada en información de nivel 1 con estudios sin capacidad de sacar conclusiones, sin hacer ninguna diferenciación entre ellas.
Conceptos generales y epidemiologíaDentro del gran capítulo de reacciones adversas a alimentos se incluyen respuestas no inmune -como por ejemplo las deficiencias enzimáticas (disacaridasas)-y las inmunes, que constituyen las alergias. Así, la alergia alimentaria consiste en una reacción adversa de origen inmune, a alimentos. Durante los primeros años de vida las manifestaciones alérgicas son frecuentes y puede ser difícil diagnosticarlas, dependiendo de las metodologías de estudio que se usen. En un metaanálisis de 51 estudios, la frecuencia de alergia definida por la percepción de los individuos varió entre 3 y 35%, pero cuando el diagnóstico se hizo mediante pruebas de desafío la frecuencia bajó a 1-10,8% (8-10). La alergia puede ser gatillada por cualquier alimento; sin embargo, algunos la producen con mayor frecuencia, como la leche, maní, nueces de diversos tipos, mariscos, pescados, trigo y soya (11). Es conocido que la frecuencia con que diversos alimentos inducen alergia varía de un país a otro; el fenómeno depende de la frecuencia de consumo de ese alimento. No es que el alimento sea más o menos alergénico en uno u otro lugar, sino que cuando la exposición de la población aumenta, la probabilidad de gatillar la reacción alérgica en las personas susceptibles aumenta. En un informe del Centro de Control y Prevención de Enfermedades de Estados Unidos, el 2008 se publicó que había un 18% de aumento del número de niños con alergias alimentarias (12). En Chile no hay estudios como este, pero una revisión reciente de los datos nacionales disponibles (información de nivel 2) coincide con que las enfermedades de base alérgica-autoinmune también han aumentado en el país (13).
La evidencia acumulada en la última década sugiere que la alergia alimentaria, lejos de ser autolimitada y de duración más bien corta, que se resuelve espontáneamente dentro de los primeros tres años de vida, puede tener una evolución más lenta. Estudios de Savage (14) y de Skripak (15) muestran que a los 4 años de edad sólo el 11% de las alergias al huevo y 19% de la alergia a la leche que cursan con IgE altas se habían resuelto; de éstas, el 80% había desaparecido a los 16 años. Algunos autores han intentado explicar este aumento de las alergias por los cambios de la dieta; el uso de antiácidos también puede jugar un rol, ya que producen un aumento de la exposición a proteínas más complejas. Son interesantes los datos que sugieren que el retraso de la introducción de ciertos alimentos pudiera ser más perjudicial que beneficioso. Un estudio de niños judíos de 8-14 meses que habitaban en Israel o en Inglaterra, mostró que la alergia al maní era 0,2% en los primeros y 10 veces mayor en los segundos, mientras que el consumo de maní era de 7,1g en Israel en comparación a los niños ingleses que no consumen maní a esas edades (16). Se conoce también el caso de una niña que falleció en el curso de una reacción anafiláctica después de llevar más de 20 años de una muy estricta dieta de eliminación, que evitó toda exposición a al leche de vaca (17). Un estudio recientemente publicado encontró en una cohorte de niños nacidos en la Clínica Las Condes, que 7,2% reportaron síntomas potencialmente alérgicos durante el primer año de vida. A los 12 meses, la prevalencia de alergia fue de 3.4% según la metodología aplicada, que representaba el 48% de los niños que habían reportado síntomas probables de alergia alimentaria; en todos los casos la proteína ofensora fue de leche de vaca (8).
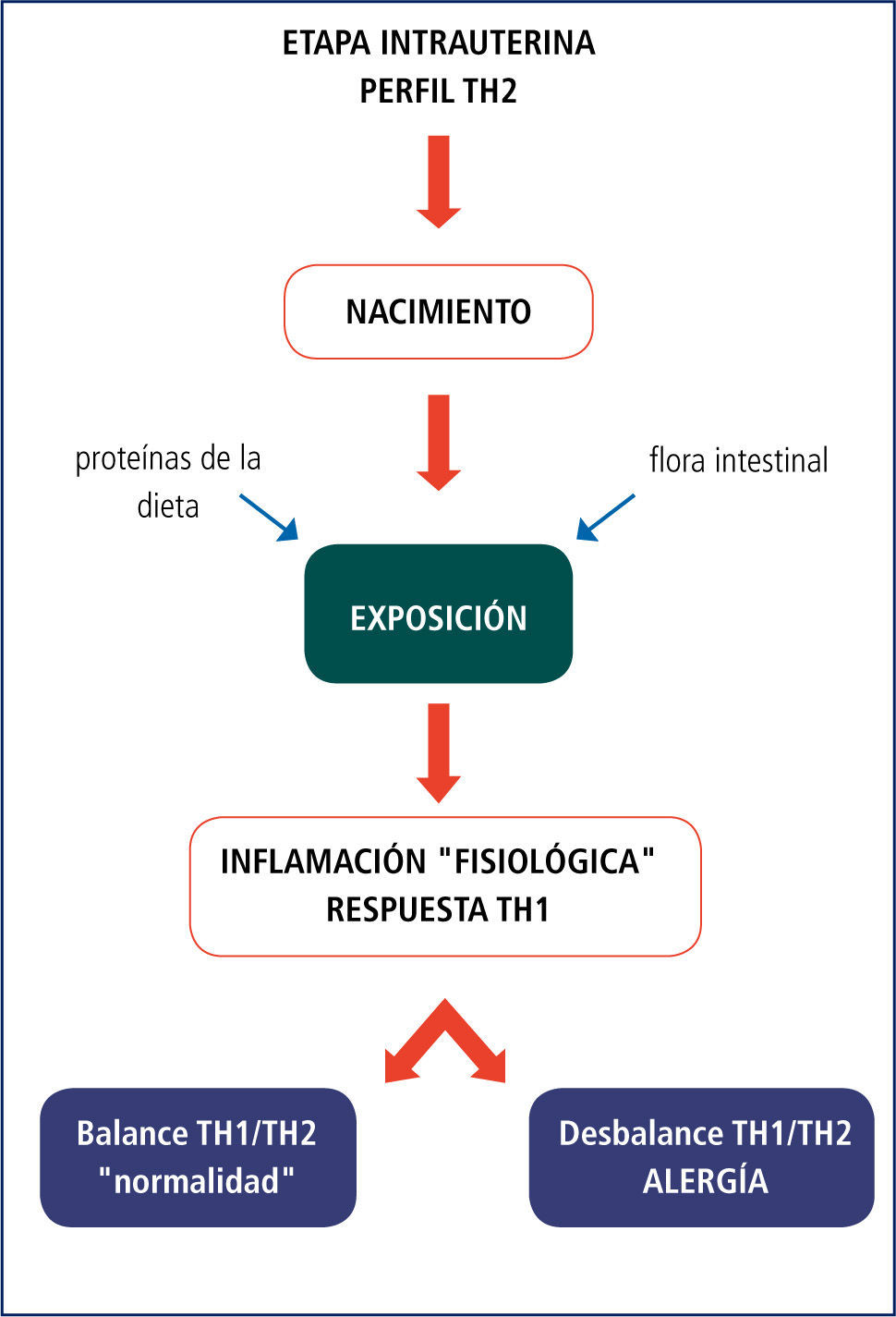
Tolerancia oral, respuesta inmune y alimentosEl contenido del lumen intestinal representa una situación especial en el organismo, ya que los alimentos y demás componentes ingeridos representan el medio externo y mientras transitan por el tracto digestivo aún no forman parte del medio interno. La enorme superficie epitelial, formada por los enterocitos y las “tight junctions” que las unen, más células inmuno competentes (principalmente linfocitos inter epiteliales CD8) constituyen la potente barrera que separa ese medio externo del medio interno. Desde el nacimiento se desarrolla un activo intercambio entre el contenido luminal y la mucosa intestinal (“crossed talk”), la llamada “barrera” gastrointestinal, responsable de que por un lado se lleve a cabo la digestión y absorción de alimentos en magnitudes tales que permita la nutrición del individuo, y al mismo tiempo proteja al individuo de las infecciones. Los componentes inmunológicos de la mucosa están presentes al nacer, pero sin experiencia, incluyendo representantes de la inmunidad innata (células “natural killers”, macrófagos, neutrófilos, ”toll-like receptors”) y de la inmunidad adquirida (linfocitos intraepite-liales y de la lámina propria, placas de Peyer, inmunoglobulinas poliméri-cas y citoquinas). El fenómeno de nacer implica un enorme cambio para el recién nacido, quien deberá desarrollar su sistema inmune mucosal hasta alcanzar un equilibrio entre las respuestas Th1 y Th2 que monte, y si lo logra, evitará montar respuestas inmunológicas contra antígenos dietarios que darían origen al fenómeno alérgico (Figura 1).
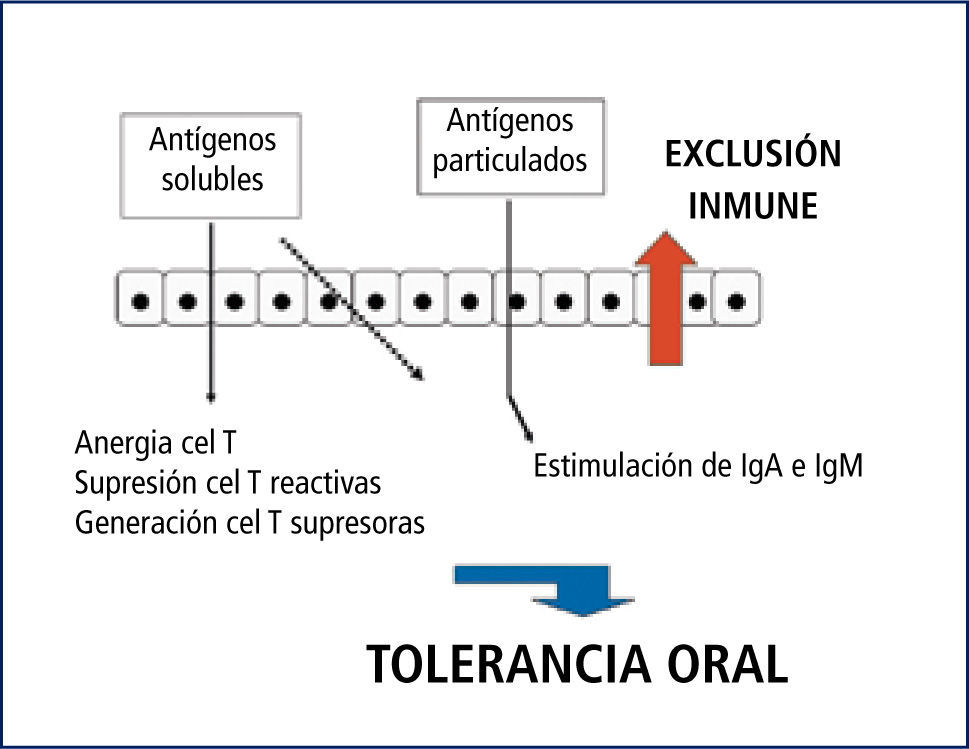
Como el sistema inmunológico madura paulatinamente a lo largo de los primeros cuatro años de edad, las infecciones gastrointestinales y fenómenos alérgicos son más frecuentes en los primeros años de vida. La leche, por ser la principal proteína ingerida en el primer año es la más frecuente causa de alergia en este período.Al inicio de la vida post natal la lactancia materna es relevante porque provee los componentes que favorecen los cambios adaptativos y funcionales para la transición a la vida extrauterina (18), facilitando el establecimiento de una flora intestinal más segura para activar el sistema inmune de la mucosa (19). La alimentación implica ingresar una gran cantidad de antígenos varias veces al día, por lo que el sistema debe aprender, al mismo tiempo, a realizar los procesos de digestión y absorción y a suprimir la reactividad inmune a las proteínas de la dieta y a los comensales inofensivos; esto es lo que se denomina el desarrollo de la “tolerancia oral” (20) (Figura 2).
Los enterocitos son capaces de procesar antígenos luminales y presentar antígenos a linfocitos de la lámina propria mediante el complejo HLA, pero carecen de la segunda señal necesaria para que el proceso de activación de los linfocitos sea exitosa; se postula que actuarían como células presentadoras de antígeno “no profesionales” y tendrían un rol en la inducción de tolerancia a antígenos dietarios. Es interesante tener en cuenta que en el adulto, cuando el sistema inmune está completamente desarrollado, el 2% de las proteínas de la dieta pasan intactas a través del epitelio (21).
La inducción de tolerancia depende, entre otros factores, de la cantidad de antígeno que se ofrece a la mucosa. En modelos animales se ha determinado que dosis altas de antígeno inducen tolerancia mediante deleción de las células T efectoras, mientras que el fenómeno inducido por dosis bajas de antígenos depende de la activación de células T reguladoras con funciones supresoras (Figura 2). Actualmente se discute la posibilidad de manipular la flora intestinal para mejorar el fenómeno de tolerancia; el uso de probióticos con estos fines ha dado resultados atractivos, pero hasta ahora no son suficientes para sacar conclusiones.
Alergenicidad de las proteínasEs interesante analizar las características de las proteínas que son alergénicas. Los principales alérgenos dietarios para seres humanos comparten numerosas características: son glico proteínas solubles en agua, su tamaño es entre 10 a 70 kd, son relativamente estables al calor, al ácido y a las proteasas. Se han comparado proteínas que ejercen acción como alergenos dietarios en animales y el hombre. Se ha encontrado que una identidad de secuencia mayor al 62% típicamente excluye a esa proteína como causa de alergia en el ser humano (22).
La forma cómo se prepara el alimento es un factor que influye en la aler-genicidad de las proteínas que contiene. Por ejemplo, se han estudiado las tasas de alergia por maní en China y EE.UU. En China existe alto consumo y la frecuencia de alergia a maní es baja. Se ha especulado que la alta tasa de alergia al maní en EE.UU. podría deberse a que se consume tostado, en vez de cocido o frito, como se consume en China. Otro ejemplo son los niños alérgicos a la leche y/o al huevo y que toleran consumir estos alimentos cuando están cocinados. La hipótesis en este caso es que la cocción denaturaría la estructura de las proteínas; estos niños harían anticuerpos principalmente a epitopes conformacionales, que se pierden durante la cocción del alimentos.
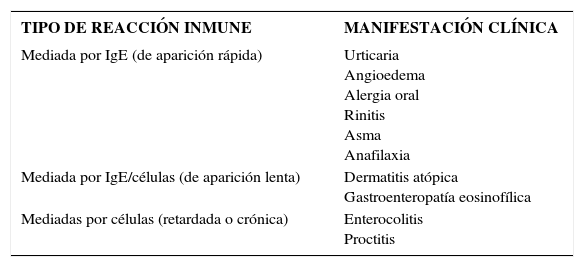
Reacciones inmunológicas y manifestaciones alérgicasLas manifestaciones clínicas son enormemente variables y deben guiar el estudio del paciente. Para diagnosticar alergia alimentaria debemos generar la convicción de que se trata de una reacción mediada por un mecanismo inmunológico y que no es una reacción adversa a alimentos; para esto es necesario identificar el tipo de reacción inmune que está en la base de las manifestaciones clínicas observadas. Tomemos como ejemplo APLV. Las manifestaciones pueden o no estar mediadas por IgE (23) (Tabla 2).
Bases inmunológicas de los trastornos alérgicos por alimentos
| TIPO DE REACCIÓN INMUNE | MANIFESTACIÓN CLÍNICA |
|---|---|
| Mediada por IgE (de aparición rápida) | Urticaria Angioedema Alergia oral Rinitis Asma Anafilaxia |
| Mediada por IgE/células (de aparición lenta) | Dermatitis atópica Gastroenteropatía eosinofílica |
| Mediadas por células (retardada o crónica) | Enterocolitis Proctitis |
Ref. 23.
La reacción por IgE (reacción de tipo I) se produce cuando existen antí-genos que se unen a anticuerpos IgE de los mastocitos. Esta unión hace que el mastocito libere histamina, un potente mediador inflamatorio, responsable de la sintomatología aguda que se observa. En la APLV no mediada por IgE se desarrolla un fenómeno multifactorial, que incluye la unión de complejos de anticuerpos IgA o IgG con antígenos de la leche (reacción tipo III) y/o la estimulación directa de linfocitos T por antígenos de la leche (reacción tipo IV). Las reacciones primarias descritas en los últimos dos casos llevan a la liberación de citoquinas y a un aumento de los anticuerpos que reconocen los antígenos de la leche, con lo que aumenta la cascada inflamatoria. Cuando algunos especialistas afirman que cuadros sugerentes de alergia, que presenten estrías de sangre, son casos de alergia no mediada por IgE, estamos ante información de nivel 3.
La aparición de alergia en individuos susceptibles puede deberse no sólo a la falla de la tolerancia oral, en estudios en ratas se ha observado que el antígeno también puede adquirirse por vías no digestivas, por ejemplo, por el aparato respiratorio y la piel (24). La interpretación de los niveles de anticuerpos de tipo IgG, IgM e IgA en sangre es difícil y con frecuencia no permite concluir cuál sería la patogenia de los cuadros no IgE. En general, la concentración de estos anticuerpos en el suero de individuos no alérgicos es baja, suben paulatinamente después de introducir la comida en la alimentación del lactante, y luego bajan, aunque el alimento en cuestión se continúe consumiendo. La presencia de tasas altas de estos anticuerpos se ha descrito en varias enfermedades intestinales crónicas, como la enfermedad celíaca y las enfermedades inflamatorias crónicas, sin que se haya logrado identificar un patrón de respuesta específico.
DiagnósticoEn general existe clara discrepancia entre la convicción de los padres acerca del cuadro potencialmente alérgico de su hijo(a) y la confirmación del diagnóstico siguiendo metodología científica (25). Los pediatras que ven las primeras consultas de un niño saben lo difícil que puede ser decidir si la sintomatología que presenta es o no de alergia alimentaria. Parece razonable que en este tema habría que guiarse por los criterios más recientes consensuados por paneles de expertos (26, 27).
La historia clínica detallada y el examen físico son cruciales para pesquisar elementos que guíen y sugieran que tipo de reacción es (rápida/lenta), y qué alimentos son los responsables; sin embargo, por si solo, ningún elemento clínico asegura el diagnóstico. La medición de IgE aclara si se trata de alergia mediada por esta vía, pero por sí sola tampoco hace diagnóstico. Es posible medir niveles de IgE específica; en algunos países incluso se han calculado puntos de corte para definir su valor predictivo, sin embargo, tampoco es diagnóstica. Los estudios cutáneos deben ser guiados por la historia clínica y no incluir paneles generales y extensos de antígenos. La guía dada por el panel de expertos aconseja no usar los tests de parches para hacer diagnóstico de alergia alimentaria ya que la evidencia disponible es insuficiente. Contrario a lo que puede suponerse, la evidencia sobre el uso de la combinación de IgE, pruebas cutáneas y de parche es escasa, de manera que, a pesar de su amplio uso, no es claro que el conjunto rendimiento para hacer diagnóstico. El panel de expertos sugiere que el uso de dietas de eliminación puede ser útil cuando se refiere a la eliminación de unos pocos alimentos específicos y se hace una evaluación programada de los efectos. En muchas ocasiones la falta de pruebas diagnósticas definitivas y la aprensión familiar por provocar sintomatología potencialmente adversa, hace que el diagnóstico se base en la buena respuesta a la dieta de eliminación, con lo que la prueba de desafío se aplica solamente para determinar si el paciente adquirió tolerancia y puede salir de la dieta. Es necesario tener presente que las dietas de eliminación pueden producir alteraciones nutricionales variadas, incluyendo desnutrición grave (28). Las pruebas de desafío en ciego y con placebo continúan siendo el método aconsejado por el panel de expertos para diagnosticar alergia alimentaria; sin embargo, dadas las dificultades que hay para hacerlas las pruebas con ciego simple o abierta pueden ser útiles, ayudándose para el diagnóstico con la historia clínica y los resultados de laboratorio. Actualmente ha surgido la postura que en lactantes pequeños la prueba puede reducirse a un período de alimentación de prueba con fórmulas en base a aminoácidos (29). El panel no recomienda el uso de pruebas de estimulación in vitro, de jugo gástrico, provocaciones endoscópicas u otras. Es interesante que recientemente se ha apoyado el uso de parches en recién nacidos (30). En el caso de pacientes con alergia alimentaria no mediada por IgE, a lo ya descrito cabe agregar que los tests de parches toman relevancia y puede ser útil buscar la participación de linfocitos (ejemplo, ensayos de activación de linfocitos T), activación de ba-sófilos y biopsias endoscópicas. Este último examen es fundamental para diagnosticar colitis esosinofílica, cuadro que se caracteriza por presentarse en un lactante en buen estado general y muchas veces alimentado con lactancia materna (31).
TratamientoBásicamente, el tratamiento consiste en la eliminación de él o los agentes causales de la dieta, debiendo mantenerse una dieta equilibrada para el niño, y para la madre en caso que el niño sea amamantado (27). Más allá de estos conceptos básicos no hay consensos claros sobre los métodos más efectivos de manejo. No hay evidencia suficiente para decidir si los casos mediados por IgE y los no mediados por IgE ameritan algún tratamiento diferente. En pacientes con alergia alimentaria y asma, dermatitis atópica, proctocolitis alérgica se recomienda eliminar la ingestión los alimentos alergénicos más conocidos, ya que la evidencia sugiere que disminuiría la sintomatología, sin embargo, no está demostrado que el curso del asma, dermatitis o esofagitis se modifiquen por ello.
Cuándo se debe re-evaluar al paciente con alergia alimentaria, depende de la edad del paciente y su historia clínica. Hacer re-evaluaciones anualmente parece ser la práctica generalizada, pero no existen estudios que permitan recomendar cuál sería el calendario óptimo. Se sabe que los niños tienden a terminar su alergia (o adquirir tolerancia) más rápido a algunos alimentos en comparación a otros, por ejemplo a la leche, huevos, soya y trigo, en comparación con maní, nueces, pescado y crustáceos, lo que podría estar relacionado al mecanismo inmunológico de base. La Tabla 3 resume algunos elementos relevantes en el tratamiento de la alergia alimentaria, destacados por National Institute of Allergy and Infectious Diseases (NIAID).
Elementos destacables en relación al tratamiento de alergia alimentaria
|
En resumen, la alergia alimentaria se ha transformado en un cuadro de alta prevalencia, que requiere de definiciones y consensos tanto para el diagnóstico como para el manejo. En nuestro país, hasta que no contemos con Guías de Diagnóstico y Tratamiento es recomendable que estos pacientes sean manejados por los especialistas que correspondan.
Las autoras declaran no tener conflictos de interés, en relación a este artículo.