La sordera es uno de los defectos congénitos más frecuentes en el mundo y puede llegar a alcanzar hasta un 50% en los adultos mayores de 70 años. La mayor parte de la pérdida de audición se produce por daño en las células ciliadas (CC), que son las encargadas de transformar las ondas acústicas mecánicas en señales electroquímicas que se dirigen al área auditiva de la corteza cerebral. Estas células ubicadas en el órgano de Corti (OC) no tienen capacidad regenerativa, por lo que al verse severamente afectadas, se pueden dañar irreversiblemente, produciéndose sordera en el individuo. Sin embargo, durante una ventana de tiempo existe un potencial regenerativo donde células del OC aún jóvenes pueden ser reprogramadas con fines regenerativos. Teniendo esto en cuenta, se han intentado diversos métodos para regenerar las CC o las células de sostén (CS) que las rodean. Terapias como la inyección de células madre (CM) en el oído interno, manipulación de genes que participan en la salida del ciclo celular para inducción de proliferación y trans-diferenciación de las células mencionadas, han sido probadas en roedores jóvenes con diferentes grados de éxito. Por otro lado, se ha mostrado la posibilidad de inducir la producción de CC durante el desarrollo uterino, lo que parece un enfoque prometedor para el tratamiento de sordera en individuos jóvenes. A pesar de esto, son necesarias más investigaciones para probar con éxito cualquiera de estas terapias, en individuos humanos adultos y de esta manera, poder inducir la regeneración celular en el oído humano dañado extensamente.
Deafness is one of the most frequent birth defects reaching up to 50% of population older than 70 years old. The main reason of the hearing loss is the damage in the hair cells (HC), which transform acoustic mechanical waves into electrochemical signals that run the auditory pathway towards the brain cortex. This cells located in the organ of Corti (OC) don’t have regenerative capacity, reason why when they are severely affected the damage is irreversible and deafness is produced. Nevertheless there is a window of time when exists a regenerative potential where OC cells can be reprogrammed with regenerative purposes. Taking this into account, there are different methods to regenerate or replace the HC or the supporting cells that surround them. Therapies as the injection of Stem Cells into the inner ear, the manipulation of genes that participates in the cell cycle exit for proliferation induction and trans-differentiation of the SC have been tested with variable success that is reviewed. Spite of that, more research should be conducted in order to get a more spread, reliable and stable regenerative response.
La sordera es una condición común, forma parte de los defectos congénitos más frecuentes, hasta 3/1000 recién nacidos la padecen. Su incidencia aumenta con la edad, llega a alcanzar hasta un 50% en la población mayor a 70 años (1,2).
El órgano de Corti (OC), es el principal responsable de la sensación auditiva y corresponde a un epitelio altamente organizado y diferenciado. Cualidades que se inician en la vida intrauterina de los mamíferos por lo que no presentan reemplazo celular o regeneración espontánea luego de nacer (3-5). De esta manera, daños severos se vuelven irreversibles. Este órgano contiene células sensoriales o ciliadas (CC) y células de soporte de diferentes tipos (CS). Ambos tipos celulares desempeñan papeles fundamentales e interdependientes, sin embargo, la mayoría de las patologías auditivas se relacionan con un daño irreversible de las CC (6,7), siendo las CS más resistentes al daño (8,9). Cuando se produce un daño moderado las células ciliadas son expulsadas del epitelio neurosensorial y los espacios restantes son reemplazados por prolongaciones de CS cercanas para mantener su integridad electroquímica y supervivencia. Por esto, las CS son un posible blanco terapéutico de terapias regenerativas. Sin embargo, ante daños severos o prolongados el epitelio sensorial es reemplazado por un epitelio plano, comprometiéndose la salud de todo el oído interno, sus conexiones con el sistema nervioso central y los potenciales beneficios de tratamientos futuros. Así como lo produce el daño de otras estructuras del oído interno fuera el epitelio sensorial ya que también producen repercusiones en todo el órgano. Así es como las células del nervio auditivo pueden lesionarse irreversiblemente, disminuyendo la densidad de fibras nerviosas disponibles tanto para conexiones con CC remanentes o regeneradas, como para recibir la estimulación de un implante coclear. O como la estría vascular que también puede dañarse permanentemente, afectando el potencial endococlear y por lo tanto la transducción auditiva y la supervivencia del OC y sus conexiones.
Al parecer a lo largo de la evolución, la cóclea de mamíferos ha perdido la capacidad de regeneración espontánea. Se cree que esto es debido a procesos aún intrauterinos como la salida permanente y precoz del ciclo proliferativo, la diferenciación temprana y la maduración subsecuente alcanzándose una necesaria pero también rígida y compleja estructura. La mayoría de las células cocleares derivan de ancestros comunes ubicados en los otocitos. Luego con un complejo, secuencial y aun no completamente comprendido patrón de expresión génica los progenitores se diferencian a neuronas del ganglio espiral, y todos los tipos celulares presentes en el conducto coclear. Brevemente, una vez formado este conducto parte de sus células conforman el dominio prosensorial que luego dará origen a todos los tipos celulares presentes en el órgano de Corti. Como primer paso el dominio prosensorial indiferenciado deja de proliferar permanentemente siendo al parecer p27Kip1 la principal molécula responsable de este proceso (3,4,10). Al controlar la progresión de G1 a S en el ciclo celular y manteniendo su expresión en las células de sostén hasta la adultez (3-11). Luego de este proceso las células de este dominio inician su diferenciación a células ciliadas o células de sostén proceso determinado fundamentalmente por la expresión de Atoh1 y los genes de la vía de Notch definiendo el mosaico de CC y CS del OC. Atoh1 estimula la diferenciación de CC (12) y activa Notch en las células contiguas, promoviéndose la diferenciación de CS e inhibiéndose la de CC (13, Lewis 2005). Una vez que se activa Notch, su dominio intracelular es dirigido al núcleo donde promueve la transcripción de genes pro-destino CS y contrarios al destino CC (15). Luego de la elección de destino celular las células del órgano de Corti progresan en maduración formando la funcional pero rígida estructura coclear que probablemente constituya el factor más determinante en impedir la capacidad regenerativa y frenar que luego el potencial regenerativo latente pueda ser activado.
PROGRESO EN EL CONOCIMIENTOLos tratamientos modernos y rehabilitación para la sordera, son efectivos en cuanto a la compensación de la pérdida de audición, pero involucran altos costos y no se enfocan directamente en la etiología de la enfermedad. Es por esto que se han probado diversos abordajes para restaurar las células en el epitelio neurosensorial de un oído dañado.
Células madreLas células madre (CM) son una de las herramientas más prometedoras de la medicina regenerativa, por lo que constituyen una alternativa para futuras terapias para restituir la audición. Teóricamente pueden ser diferenciadas a cualquier tipo celular, por lo que podrían servir para reparar cualquier estructura dañada en el oído (OC, ganglio espiral o la estría vascular). Sin embargo, las CM deben administrarse específicamente, escapar al sistema inmune, implantarse adecuadamente, sobrevivir, proliferar solo de acuerdo a las necesidades del tejido, respetar la arquitectura, diferenciarse y finalmente ser funcionales. Para lograr estos últimos puntos se exige un conocimiento acabado del desarrollo embrionario de los distintos tipos celulares a producir para poder ser programado en ellas.
Es así como se ha logrado reproducir in vitro con éxito el fenotipo CC con CM de diferentes orígenes: CM de origen embrionario (ESC) (16), CM pluripotentes inducidas de origen fibroblástico (iPS) (16), células madre mesenquimales de la médula ósea (17) y CM neurales (NSC) clonales (embrionarias mantenidas en cultivo) (18). También se ha logrado diferenciar CM a fenotipo neural ótico utilizando ESC de diferentes especies, NSC adulto y clonales. Sin embargo, con baja eficiencia relativa para producir neuronas, produciéndose principalmente células gliales.
Se han inyectado in vivo diversos tipos de CM de diferentes orígenes en el oído interno con éxito variable. El uso de CM se ha centrado en la sustitución de las CC y de las células del ganglio espiral de la cóclea. Para esto, se han probado diferentes formas de administración: inyecciones en la rampa timpánica, la escala media y el modiolo. A través de la rampa timpánica, las CM han sido capaces de alcanzar el revestimiento de células perilinfáticas (18, 19) y la región de la estría vascular (20), con menor eficiencia para el ganglio (19, 21) y muy pocas veces alcanzando el OC (22). Las CM han demostrado capacidad in vivo de sobrevivir y diferenciarse en los tipos celulares donde se hayan insertado, sin embargo con baja eficiencia para CC o CS y mejor eficiencia para células gliales y neuronas. Teóricamente, la forma más directa para alcanzar el OC es la inyección a través de la escala media, donde se ha demostrado que las CM pueden sobrevivir hasta 9 semanas inyectando en perilinfa artificial (23, 24), sin embargo, no existe evidencia exitosa in vivo que las CM hayan alcanzado el OC. Esto podría ser debido a que el dominio luminal del epitelio OC está estrechamente adherido, dificulta la llegada de células luego de la inyección a través de la escala media y además la composición de la endolinfa rica en potasio limita la sobrevida de las CM. Esto es relevante ya que si no hay evidencia de que las CM pueden sobrevivir y llegar a una posición apropiada en el OC, la capacidad de diferenciación en distintos tipos celulares resulta inútil. Sin embargo, un estudio reciente sugiere que la capacidad de migración de las CM podría aumentar al ser inyectadas en oídos dañados (20). Más allá de estos datos, la reparación de las células del ganglio espiral por CM si ha resultado exitosa, siendo la inoculación directa la forma más eficiente de injertarlas (25,26). Hay evidencia de que las células injertadas son capaces de diferenciarse a neuronas y glia in vivo, emitir proyecciones hasta el SNC (27) y conducir una recuperación funcional en un modelo murino de neuropatía auditiva (26).
En síntesis, a pesar de que las CM ofrecen gran potencial para convertirse en las células del OC diferenciado, aún su rol es limitado y exige futuros avances.
Terapia génica y farmacológicaLas terapias génica y farmacológica en este caso no están destinadas a reparar un defecto genético o a compensar un daño, sino a restituir la audición invocando el programa de desarrollo del órgano de Corti. Ante un daño auditivo severo se necesita repoblar el órgano y luego producir los distintos tipos celulares. Lo que teóricamente requeriría que las células del oído proliferen y luego se diferencien.
A diferencia de otros vertebrados como las aves, reptiles y peces, los mamíferos no tienen capacidad de regeneración espontánea en el oído (28-30). Sin embargo, se ha visto que en mamíferos jóvenes existe un potencial regenerativo latente al persistir la expresión de algunos genes que participan en el desarrollo del oído y que luego al modificarse genética o farmacológicamente se puede invocar el programa de expresión génica que ocurre durante el desarrollo, haciendo que proliferen las células de sostén y que luego se trans-diferencien a células ciliadas. De esta manera, por ejemplo, al manipular la expresión de genes que participan en la salida del ciclo celular del OC para inducir proliferación como p27Kip1 in vivo o in vitro, ha sido posible inducir la proliferación de CS luego del nacimiento (31-33). Sin embargo, la respuesta proliferativa ha sido en general pobre y no seguida de transdiferenciación a nuevas CC, además de evidenciarse en algunos casos toxicidad, deterioro auditivo o muerte celular en el OC (34). En otro sentido y con más éxito, se han explorado modificaciones en la vía Notch y AtoH1 para obtener trans-diferenciación de células de sostén a células ciliadas lográndose in vitro e in vivo cambios de destino celular de células de sostén a células ciliadas funcionales lográndose en algunos casos también mejoría de la audición (35-39). Es así como experimentos in vivo en roedores jóvenes ensordecidos tratados con estos métodos, inyectando la escala media con vectores virales o usando la ventana redonda para administrar fármacos han demostrado aumento en las CC y mejora en umbrales auditivos después de uno o dos meses (40,41). Sin embargo, los resultados publicados hasta el momento han sido sólo transitorios no informando resultados en un plazo mayor de 3 meses después de la inducción de la sordera.
El potencial regenerativo reside en el órgano de Corti remanente luego del daño y por tanto, si no hay CS no hay potencial regenerativo (9). El potencial se evidencia en individuos jóvenes, ya que todos los resultados positivos en proliferación o inducción de la transdiferenciación in vitro e in vivo han sido reportados en animales jóvenes, evidenciándose luego una disminución en la respuesta junto con el envejecimiento o maduración. El potencial aumenta cuando se reduce la acción inhibitoria sobre la regeneración de las células ciliadas, viéndose una mayor facilidad para invocar el potencial regenerativo cuando existe daño auditivo, aparentemente debido a que la estructura intacta del órgano de Corti inhibe también este potencial.
La transdiferenciación de CS a CC como aproximación más exitosa en terapia génica para restaurar la audición tiene el problema que consume CS necesarias para el buen funcionamiento del epitelio. Por lo tanto, nuevos estudios son deseables combinando las dos aproximaciones primero aumentando el pool de CS y luego transdiferenciándolas a CC para no perder importantes CS al producir más CC.
Factores tróficosAdemás de intentar regenerar estructuras dañadas, la posibilidad de mejorar el bienestar o las conexiones entre las estructuras remanentes al daño es muy relevante. Es así como se han utilizado tanto las terapias celular, génica y farmacológica para la administración en el órgano de Corti de neurotrofinas. El principal objetivo de su aplicación ha sido mejorar la supervivencia de neuronas de los ganglios espirales y consecutivamente, aumentar las conexiones de éstas, por ejemplo con un eventual implante coclear. La neurotrofina 3 y BDNF han sido las sustancias más relevantes teniendo éxito por ejemplo luego de ser sobre expresadas en el oído interno en cuanto al aumento de proyecciones de los ganglios espirales al ligamento espiral (42,43) y protegiendo el oído del trauma acústico induciendo regeneración de la sinapsis perdidas por exitotoxicidad (44). También NSC previamente injertadas en el oído interno han demostrado ser capaces de secretar factores neurotróficos (45) al oído interno.
Tratamiento de defectos antes del nacimientoEn ratones hay evidencia que demuestra la posibilidad de inducir producción de nuevas CC funcionales durante el desarrollo intrauterino (46). Luego el potencial regenerativo es mayor para inducir proliferación o trans-diferenciación en individuos jóvenes, sobretodo antes de que se inicie la audición (en ratones ocurre al décimo día de vida extrauterina y en seres humanos ocurre durante la 18 semana de embarazo). Estos resultados podrían tener aplicaciones para el tratamiento de la sordera congénita ya que teóricamente defectos congénitos o susceptibilidades se podrían tratar durante su producción en forma intrauterina. Sin embargo, la tecnología que involucra cirugía en útero en humanos aún es limitada no alcanzando las edades necesarias aún para poder reproducir estos resultados en humanos.
IMPLICANCIAS CLÍNICAS Y COMENTARIO FINALTodas las aproximaciones descritas y estudios realizados hasta el momento han constituido avances enormes en el estudio y desarrollo de nuevos tratamientos contra la sordera. Sin embargo, todavía queda mucho por estudiar. Es importante por ejemplo entender mejor el desarrollo del oído interno con el fin de disponer de medios más eficaces para diferenciar células en los diferentes fenotipos que se pueden encontrar al interior del OC. Faltan también estudios para poder hacer más eficiente la llegada de estas terapias al oído. Es deseable también diseñar formas de tener éxito tratando individuos de edades más avanzadas donde la hipoacusia es más frecuente. Así como es fundamental con los actuales tratamientos preservar al máximo las estructuras remanentes luego de un daño, pensando en mantener el potencial regenerativo para futuras terapias. Entre las diferentes alternativas actuales se podría decir que no hay mejores ni peores. Las CM tiene la ventaja de aportar con material celular nuevo para repoblar el órgano, en cambio las terapias génica y farmacológica si bien dependen del epitelio remanente luego del daño tienen mejor llegada al oído medio y tienen más facilidad para sobrevivir en la endolinfa y respetar la anatomía. En el futuro probablemente todas las aproximaciones serán complementarias en la formación de una terapia regenerativa eficaz y estable lo que hace válida y necesaria toda investigación en el campo regenerativo.
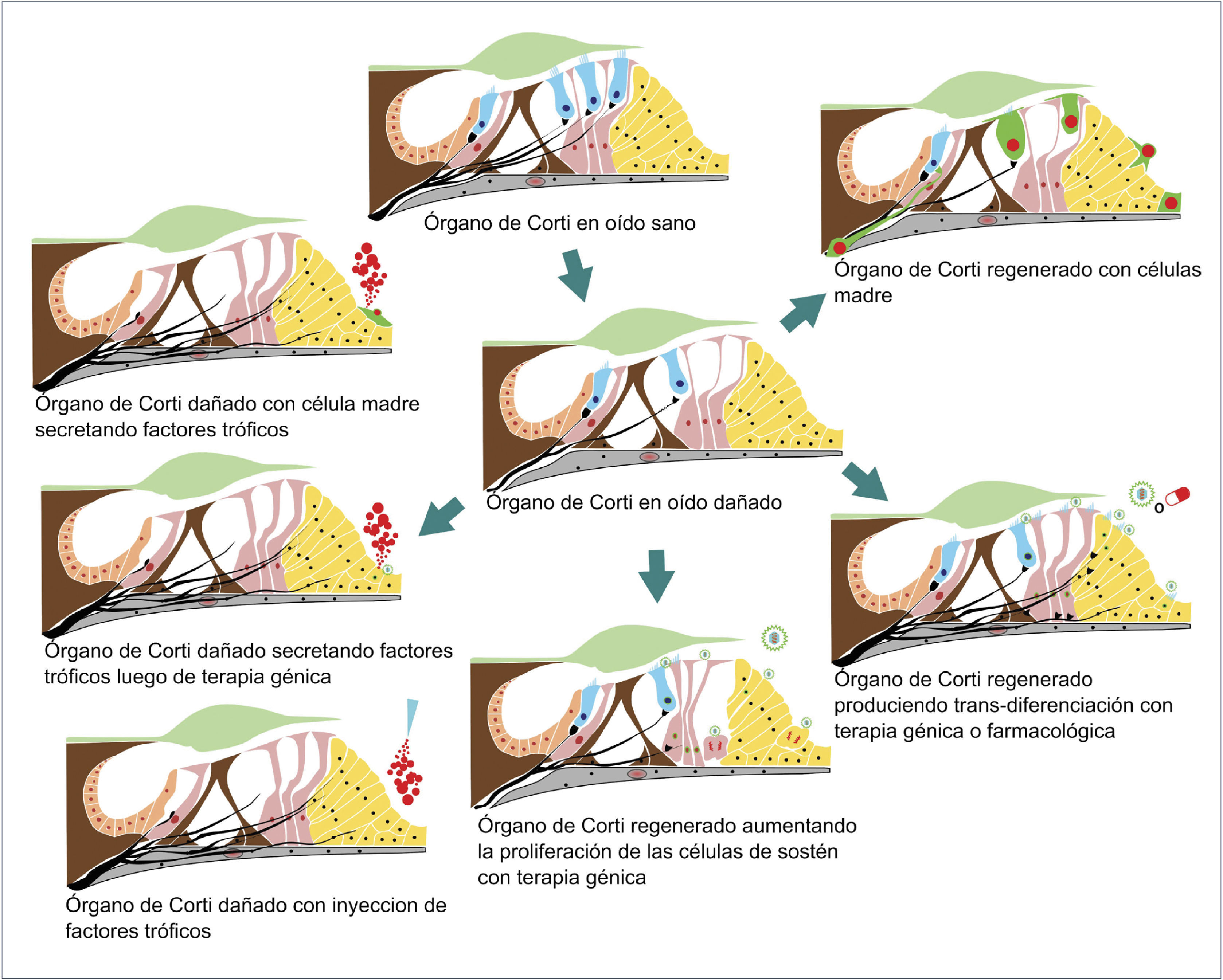
SE ESQUEMATIZAN DISTINTAS ALTERATIVAS DE TRATAMIENTO PARA REGENERAR O MEJORAR LA FUNCIÓN DEL ÓRGANO DE CORTI
Arriba y al centro esquema de órgano de Corti normal. Al centro: Órgano de Corti con daño moderado con pérdida de algunas células ciliadas, con pérdida de algunos cilios y pérdida de algunas sinapsis, desde allí se esquematizan los cambios posibles producidos con distintos tratamientos como terapia génica, células madre o uso de factores tróficos.
Esta revisión fue apoyada por el proyecto FONDECYT 11130247 CONICYT (Chile).
Los autores declaran no tener conflictos de interés, en relación a este artículo.