La población envejece en forma acelerada, y la comprensión de los cambios fisiológicos asociados al envejecimiento es una herramienta importante para enfrentar las demandas biomédicas y sociales de ese grupo etario.
El objetivo de la presente revisión es definir los principales cambios morfológicos y funcionales en los sistemas cardiovascular, renal, nervioso central, muscular y metabolismo de la glucosa asociados a la edad.
La evidencia de estudios clínicos y experimentales muestra que el envejecimiento de los vasos sanguíneos y el corazón se asocia a la pérdida de células musculares y menor distensibilidad. La fracción de eyección se mantiene constante. El riñón muestra disminución moderada de la velocidad de filtración glomerular, esclerosis vascular y glomerular, menor capacidad de concentración/dilución y de hidroxilación de la vitamina D. El cerebro disminuye su volumen, pero no por una pérdida generalizada de neuronas ni de arborización dendrítica. Hay menor capacidad de atención, memoria de trabajo y trastornos motores. La masa muscular disminuye y aumenta su infiltración grasa, asociado a disminución progresiva de la fuerza. El aumento de grasa corporal, especialmente visceral, participaría en una mayor resistencia insulínica que asociada a la disminución de la masa de células beta facilitaría el desarrollo de diabetes.
La evidencia disponible muestra importantes cambios morfológicos y funcionales asociados a la edad. El conocimiento de la población en edad media de la vida no debiera generalizarse a los adultos mayores. El reconocimiento de cambios debidos al envejecimiento normal es difícil por la gran variabilidad entre sujetos y la alta prevalencia de comorbilidad.
The population worldwide is aging rapidly and the understanding of physiological changes associated with aging is a key tool for answering the biomedical and social needs of elderly people. The aim of the present review is to describe the main morphological and functional changes of the cardiovascular system, central nervous system, kidney, skeletal muscle and glucose metabolism associated with normal aging. Clinical and experimental studies show that cardiovascular aging is associated with a reduction of muscular cells and wall distensibility. The cardiac ejection fraction does not change. With aging, the kidney develops vascular and glomerular sclerosis, with moderate reduction in glomerular filtration rate, lower concentration/dilution ability and a reduction of vitamin D synthesis. Aging associates with reduced brain volume, but without a generalized loss of neurons or dendritic arborization. Elderly people presents reduced attention span, lower work memory and motor impairment. There is a decrease in skeletal muscle mass, with increased in adipose infiltration associated with progressive force loss. The proportion of body fat, particularly the visceral fat, could play a role in the development of insulin resistance, which associated with a decrease in pancreatic beta cells may lead to the development of diabetes mellitus.
The available evidence shows important morphological and physiological changes associated with aging. The knowledge of morphological characteristics and functional capabilities of middle age adults may not be extrapolated to elderly people. The identification of changes due to normal aging is hampered by the high variability among individuals and the high prevalence of co-morbidities.
El envejecimiento implica una serie de cambios morfológicos y fisiológicos en todos los tejidos, y su conocimiento permite comprender las diferencias fisiopatológicas entre los adultos mayores y el resto de la población adulta. Los cambios asociados al envejecimiento son múltiples, y su análisis completo pudiera terminar en una lista interminable. Por esta razón, elegimos centrarnos en cinco sistemas específicos, cuyos cambios asociados al envejecimiento nos parecen de alta relevancia, tanto por la elevada prevalencia de sus alteraciones, como por las consecuencias funcionales que ellas tienen.
Envejecimiento renalDiversos autores han mostrado que el envejecimiento se asocia a la aparición de cambios estructurales y declinación de la función renal (1,2). Sin embargo, no existen a la fecha estudios que demuestren cambios específicos del envejecimiento (1). Tampoco es claro qué proporción de la caída en la función renal es fisiológica y qué proporción es secundaria/asociada al daño cardiovascular o a factores clásicos de riesgo de Enfermedad Renal Crónica (hipertensión arterial, diabetes mellitas, tabaquismo) (1,3). De hecho, estudios poblacionales han demostrado una mayor prevalencia de Enfermedad Renal Crónica (ERC) en ancianos (15%-50% en los mayores de 70 años) (4), siendo la edad el principal factor de riesgo para ERC (5).
Con la edad se observa pérdida de parénquima renal, que es de aproximadamente 10% con cada década de la vida después de los 40 años (1,6). El peso renal normal se ha estimado en 250-270 gramos (40-50 años de edad) disminuye a 180-200 gramos entre los 70-90 años (2), fundamentalmente por adelgazamiento de la corteza renal (1,2).
El envejecimiento se asocia además a cambios en la vasculatura: engrosamiento de la pared arterial, esclerosis de las arterias glomerulares, disminución de glomérulos funcionales por oclusión (2). El flujo plasmático renal disminuye aproximadamente 10% con cada década después de los 40 años, lo que se asocia con redistribución del flujo sanguíneo hacia la médula renal (7). La velocidad de filtración glomerular (VFG) alcanzaría hasta 140 mL/min/1,73 m2, con una caída de 0,4 -1,02 mL/min por año después de los 40 años (aproximadamente 8 mL/min/1,73 m2 por año) (1, 3). Sin embargo, hay que recordar que existe mucha variabilidad interpersonal en la disminución de la VFG con la edad (3, 8). A nivel histopatológico, la membrana basal glomerular presenta engrosamiento, que en ciertos glomérulos se asocia al depósito de material hialino y colapso capilar (arteriolas aglomerulares). La esclerosis glomerular llega hasta a un 30% de la población glomerular en la octava década de la vida (3).
Además de los trastornos estructurales mencionados, se ha sugerido que el aumento de flujo sanguíneo medular renal se debe a la disminución en la producción/respuesta a las sustancias vasodilatadores, como el óxido nítrico (NO), prostaciclina y el factor hiperpolarizante endotelial (2).
En cuanto a la función de los túbulos renales, se ha demostrado una disminución de aproximadamente un 20% en la capacidad de concentrar la orina de sujetos en la sexta década de la vida (2). Estudios en animales muestran disminución en la respuesta a vasopresina a nivel de receptores de membrana celular, acompañada por la caída en la expresión de canales de agua (Aquaporina 2 y 3) y disminución en los transportadores de urea (UT-A1) (9). La disminución de la capacidad de dilución de la orina haría a los sujetos de mayor edad más propensos a la hiponatremia en el contexto de sobrecarga acuosa (2).
Normalmente el envejecimiento no afecta los valores basales de electrolitos plasmáticos (Na, K, Cl), y tampoco se observa alteraciones manifiestas en la capacidad de mantención del balance hidroelectrolítico en condiciones de dieta balanceada y disponibilidad libre de agua para ingesta (2). Sin embargo, la capacidad de adaptarse frente a cambios agudos en el balance hidroelectrolítico se ve disminuida, lo que explicaría la mayor incidencia de trastornos hidroelectrolíticos en los ancianos hospitalizados (10). En general, diversos estudios han mostrado cambios en los ritmos circadianos de excreción de sodio, cambios en la respuesta de natriuresis por presión, alteraciones en la respuesta a Angiotensina II y una mayor dificultad en la excreción de sobrecargas agudas de sodio (2,11,12). Los niveles de renina plasmática son 40-60% menores en los ancianos, con una sensibilidad a los estímulos que inducen liberación de renina menor, y 30-50% de reducción en los niveles de aldosterona plasmática (13,14). Estos cambios se asociarían a declinación de la capacidad de excretar cargas de potasio, mayor riesgo de hiperkalemia y mayor sensibilidad a fármacos que inhiben la excreción de potasio urinaria (diuréticos ahorradores de potasio, inhibidores de la enzima convertidora, antiinflamatorios no-esteroidales y beta bloqueadores) (2).
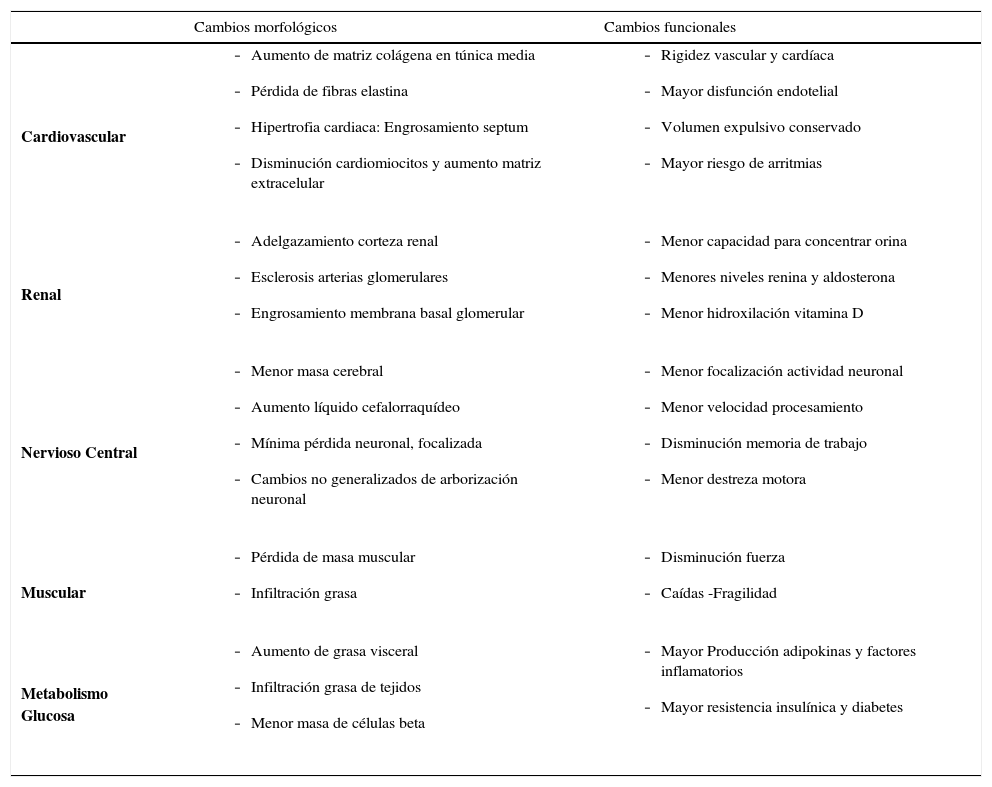
Algunos cambios morfológicos y funcionales esociados al envejecimiento
| Cambios morfológicos | Cambios funcionales | |
|---|---|---|
| Cardiovascular |
|
|
| Renal |
|
|
| Nervioso Central |
|
|
| Muscular |
|
|
| Metabolismo Glucosa |
|
|
La función reguladora del balance ácido-base en ancianos ha sido poco estudiada. El pH sanguíneo y el bicarbonato plasmático no muestran variaciones significativas. Sin embargo, se ha reportado que los ancianos presentan mayor propensión al desarrollo de acidosis metabólica moderada frente a sobrecarga ácida, con disminución de acidificar la orina y de la excreción de amonio urinario (2,10).
Aunque es reconocida la mayor prevalencia de anemia en los ancianos (15), los valores de eritropoyetina plasmática aumentan con la edad (16). Sin embargo, la respuesta normal de aumento de eritropoyetina frente a la anemia se encuentra disminuida en ancianos, (2,17) lo que sugeriría una menor respuesta renal frente a las señales inductoras de la expresión de eritropoyetina y/o la disminución de células productoras.
La caída en el clearance de creatinina por debajo de los 65 mL/min ha sido identificada como un factor de riesgo independiente para caídas y fractura en ancianos con osteoporosis (18). Los niveles plasmáticos de 1,25-dihidroxivitamina D (1,25(OH)2D) en ancianos con clearance <60 mL/min se encuentran disminuidos, lo que se asocia a menor absorción de calcio intestinal y renal, pero con niveles normales de 25OHD (19). Todos estos resultados muestran que la producción renal de la 1,25(OH)2D está disminuida. Adicionalmente, sólo un 15% de los mayores a 65 años tienen niveles plasmáticos de 25OHD sobre el umbral recomendado para prevenir efectos adversos (30 ng/mL). Además de la alteración en la producción de 1,25(OH)2D en los ancianos, recientemente se ha postulado que Klotho, una proteína anti-envejecimiento que es cofactor de Fibroblast Growth Factor 23 (FGF23, factor promotor de excreción de fosfato renal) y es producida por células del túbulo proximal renal y liberada a la circulación, podría participar en los cambios en el metabolismo del calcio/fósforo presentes en los ancianos. La expresión de Klotho disminuye en pacientes con ERC (20), y Klotho estimula directamente la reabsorción de calcio actuando sobre canales de calcio de la familia de los transient receptor potential (TRPV5). En animales de experimentación se ha encontrado disminución de la expresión renal de Klotho en relación a envejecimiento, (21) lo que sugiere que una disminución fisiológica de la expresión de Klotho en el riñón con la edad podría estar implicada en la menor reabsorción renal de calcio.
Envejecimiento cardiovasculara) Envejecimiento arterialEl aumento de la rigidez arterial es una de las características del envejecimiento. Ocurre como resultado de los cambios estructurales de la pared arterial, principalmente en las arterias de conducción (diámetro mayor a 300 micrómetros) y puede preceder el desarrollo de hipertensión arterial.
Estudios en animales muestran que los aumentos del estrés/tensión de la pared arterial van acompañados por proliferación de las células musculares lisas de la túnica media. Sin embargo, a medida que los humanos progresan más allá de la edad media, el número de células musculares lisas de la pared arterial (VSMC) en la media túnica media disminuye, principalmente por apoptosis (22). El envejecimiento arterial implica también remodelación de la matriz extracelular, con aumento de fibras colágenas, disminución de elastina, expresión y activación de metaloproteinasas, expresión de moléculas de adhesión y proliferación de VSMC (2). Las fibras elásticas sufren degeneración, adelgazamiento, ramificación y fractura, con una disminución en el volumen proporcional que ocupan en la pared arterial (22). Paralelamente aumenta la cantidad de fibras colágenas (esclerosis), la piridinolina (producto del entrecruzamiento de las fibras colágenas) y la microcalcificación en la túnica media (arterioesclerosis) (22). Estos cambios se acompañan en grado variable de el depósito de productos finales de glicación (23).
La disfunción endotelial es otro de los cambios en los vasos sanguíneos que se observan con el envejecimiento (24). La disfunción endotelial, caracterizada como la disminución de la función vasodilatadora dependiente de endotelio y el desarrollo de procesos inflamatorios (25), se puede observar desde la infancia (26), y precede a los cambios estructurales del vaso sanguíneo. En el envejecimiento se ha encontrado disminución de la producción de NO, aumento en la producción de factores vasoconstrictores derivados de la ciclooxigenasa, aumento en la producción de especies reactivas del oxígeno y del nitrógeno, estrés oxidativo y aumento de la NADPH oxidasa productora de especies radicalarias del oxígeno (23, 24, 27). El aumento en la producción de citoquinas proinflamatorias también participaría en el envejecimiento endotelial, un paso inicial en el desarrollo de la ateroesclerosis (27), aun en ausencia de factores promotores de ateroesclerosis (28, 29). Estos cambios, conocidos como “activación endotelial”, implican el aumento en la expresión de moléculas de adhesión celular, aumento en la interacción leucocito-endotelio y aumento de la permeabilidad, así como la secreción de factores autocrinos y paracrinos con acciones pro-inflamatorias (27).
Con el envejecimiento se observa también hipertrofia de las arterias de resistencia (30-300 micrómetros de diámetro), caracterizada por engrosamiento de la pared y reducción del lumen. El aumento de la rigidez de las arterias de conducción y de la resistencia periférica total contribuye en el aumento de la reflexión de la onda de pulso y al aumento de la presión arterial. La presión arterial sistólica aumenta en forma continua con la edad; la presión arterial diastólica aumenta sólo hasta los 55 años y luego se estabiliza o disminuye levemente.
Entre los signos clínicos de envejecimiento cardiovascular que es fácil pesquisar en los pacientes de mayor edad encontramos el aumento de la presión de pulso (PP) y onda de pulso en las arterias periféricas. En ausencia de disfunción ventricular izquierda, los aumentos en la presión de pulso indican aumento de la rigidez arterial (24, 30) y mayor riesgo de isquemia. Otra forma de estimar el aumento de la rigidez arterial es la medición de la Velocidad de Conducción de la Onda de Pulso, que es inversamente proporcional a distensibilidad arterial (31) y es un predictor independiente de riesgo coronario, particularmente en los mayores a 60 años (24, 31). Otra forma de estimar la rigidez arterial es la medición de la onda de pulso braquial (por tonometría) y el cálculo del Índice de Aumento (Alx), que estima la contribución de la reflexión de la onda de pulso en el árbol arterial periférico en el aumento de la presión arterial sistólica en la aorta central (31).
Todas las condiciones que aceleran el remodelado arterial y la disfunción endotelial producen aumentos más rápidos de la rigidez arterial (hipertensión arterial, diabetes mellitus, síndrome metabólico y enfermedad renal crónica) (23).
b) Envejecimiento cardíacoLa función cardíaca en reposo en ancianos sanos no sufre grandes cambios, evaluada como la función sistólica del ventrículo izquierdo (fracción de eyección y/o fracción de acortamiento), volumen diastólico final o volumen sistólico final (32-35). Sin embargo, el envejecimiento disminuye la distensibilidad cardíaca, y la respuesta fisiológica del corazón al ejercicio (reserva funcional cardíaca) (32, 33, 35-37).
En forma similar a lo que describimos para el árbol arterial, la rigidez de la pared ventricular aumenta con la edad. Esto que resulta en el aumento de la presión de fin de diástole ventricular en reposo y durante el ejercicio (32, 33, 38), con aumento moderado del espesor de la pared ventricular izquierda, observado aun en ausencia de hipertensión arterial u otras causas de aumento en la postcarga (38). La remodelación del ventrículo izquierdo (VI) (hipertrofia concéntrica) se correlaciona con la disminución regional de la función sistólica (39).
En el corazón de sujetos jóvenes, se ha estimado que los cardiomiocitos ocupan aproximadamente el 75% del volumen del tejido miocárdico, pero dan cuenta sólo de 30%-40% del número total de células (40). Estudios recientes indicarían que el corazón humano posee células madre (41) y que hasta un 40% de los cardiomiocitos son reemplazados por nuevos cardiomiocitos durante 100 años de vida (42, 43). Sin embargo, la hipertrofia cardíaca que se observa en el envejecimiento se acompaña de una disminución en el número total de cardiomiocitos, secundaria a necrosis y apoptosis (37, 40). Ya que la pérdida e hipertrofia de cardiomiocitos precede a la hipertrofia cardíaca, se acepta que ésta es una consecuencia de la hipertrofia celular de los cardiomiocitos, sumada a cambios en la composición de la matriz extracelular y otros componentes celulares del miocardio (37, 38). Estudios de función celular en cardiomiocitos aislados sugieren que el envejecimiento se asocia con alteraciones en la activación, contracción y relajación, asociados a cambios de la expresión génica. (37). En cardiomiocitos envejecidos se ha reportado reducción en la expresión de proteínas del shock térmico, disminución en la expresión de proteínas protectoras del estrés oxidativo, alteración de proteínas de la cadena respiratoria mitocondrial y alteración en la expresión de proteínas transportadoras responsables de la homeostasis del calcio libre intracelular (37, 44)
La matriz extracelular miocárdica entrega los elementos de anclaje celular y soporte a los vasos sanguíneos, determinando la estructura y geometría cardíaca. Además de los cambios en el componente contráctil, el envejecimiento se asocia a fibrosis miocárdica: aumento en el contenido total de colágeno miocárdico y aumento en el entrecruzamiento de las fibras colágenas de la matriz extracelular (40,45). Los cambios en la matriz extracelular afectarían la eficiencia del acoplamiento excitación-contracción, aumentan el riesgo de arritmias, disminuyen la efectividad de la transmisión de la fuerza del acortamiento del cardiomiocito para el desarrollo de fuerza y para la disminución de volumen ventricular. Además, el cambio de las proteínas de la matriz extracelular modula negativamente la homeostasis del cardiomiocito, disminuyendo la interacción de los receptores de la membrana celular con las moléculas de la matriz, que normalmente modulan la homeostasis celular (por ejemplo laminina) (40). El remodelamiento fibrótico del intersticio cardiaco se asociaría con activación de la metalopropteinasa, degradación de las proteinas de la matriz y deslizamiento de los cardiomiocitos, lo que determina una caída en el número de capas musculares en una sección de pared ventricular (40). Resultado del aumento en la rigidez de la pared ventricular, la fase temprana de llenado ventricular va disminuyendo con la edad, un cambio que se evidencia ecocardiográficamente como cambios en la razón E/A.(32, 33, 36).
Con el envejecimiento son más frecuentes además los cambios estructurales en los velos valvulares (38). La prevalencia de aumento de la rigidez, calcificación y cicatrización de los velos valvulares aórticos llega hasta el 80% en adultos mayores. Estos cambios estructurales son causales en la prevalencia creciente con la edad de estenosis e insuficiencia aórtica (38). Cambios estructurales de la válvula mitral, como la calcificación del anillo mitral, también han sido asociados con la edad. En general, el deterioro de la estructura y función valvular son contribuyentes al aumento de postcarga y de la remodelación de la pared ventricular (38).
Los efectos más importantes del envejecimiento sobre la función cardíaca se observan en el ejercicio. El volumen expulsivo (VE) de jóvenes y adultos mayores en respuesta al ejercicio es similar. Sin embargo, el aumento de VE con ejercicio en los mayores ocurre en gran medida a expensas de un aumento en el volumen diastólico final; en los jóvenes se observa predominio de un aumento en la fracción de eyección (33,46). Durante el ejercicio, los ancianos muestran menores aumentos en la frecuencia cardíaca, acompañados de mayores aumentos en la presión arterial (32, 33, 46). La caída en la capacidad de aumentar la frecuencia cardíaca se explica por la disminución en la respuesta fisiológica a las catecolaminas y a la degeneración axonal de las neuronas que inervan los atrios (33). Además, el número de células marcapasos en el nodo sinoatrial disminuye desde 50% en la juventud a aproximadamente 30% en los adultos mayores (33). El deterioro en la función del Sistema Nervioso Autónomo sobre el corazón también se refleja en la pérdida de la variabilidad del ritmo cardíaco en resposo (38). Finalmente, la Fibrilación Atrial, la arritmia crónica más frecuente en el ser humano, muestra una prevalencia directamente proporcional a la edad y podría deberse en parte a los cambios de la matriz extracelular y cambios estructurales que sufre el corazón con el envejecimiento (47).
Envejecimiento cerebralLos cambios en el desempeño cognitivo asociados al envejecimiento, se correlacionan con múltiples cambios morfológicos y funcionales en el sistema nervioso central los que son de gran relevancia biomédica puesto que además de ser muy frecuentes, dependiendo de su magnitud, pueden ser importantes determinantes de discapacidad (48–51). El estudio de estos cambios no ha sido fácil en gran parte porque muchos de los estudios han incluido en sus series a pacientes con enfermedades neurodegenerativas o vasculares, lo que dificulta separar lo normal de lo patológico (52).
El cerebro humano disminuye progresivamente su masa en relación al envejecimiento, a una tasa de aproximadamente un 5% de su peso por década desde los 40 años de vida (51). El contenido intra-craneano se mantiene estable porque la disminución de masa cerebral se asocia a un aumento progresivo del volumen de liquido cefalorraquídeo, probablemente secundario a una disminución del clearence de éste (53).
Las células del sistema nervioso central, al igual que otras células del organismo, presentan cambios en sus componentes en relación al envejecimiento, tales como aumento del estrés oxidativo, acumulación de daño en proteínas, lípidos y ácidos nucleicos (54). La disfunción mitocondrial parece jugar un rol muy importante en el envejecimiento cerebral, puesto que participa en la generación de especies reactivas del oxígeno y nitrógeno, implicadas en el daño celular (55). En esta línea, se sabe que la restricción calórica sin malnutrición, una intervención capaz de disminuir la producción mitocondrial de radicales libres y el daño oxidativo en tejido cerebral, disminuye la caída del rendimiento cognitivo asociado a la edad (56,57).
Durante los años cincuenta se estableció el concepto erróneo de que el envejecimiento se asocia a una disminución importante y generalizada del número de neuronas corticales (52). Sin embargo, datos más recientes, desarrollados con mejoras tecnológicas en el procesamiento e interpretación de imágenes, han establecido que la pérdida de neuronas asociado al envejecimiento es mínima y no generalizada. La pérdida neuronal se concentra en regiones bien delimitadas, como por ejemplo el área 8A de la corteza prefrontal dorsolateral, lo que correlaciona con deterioro en la función ejecutiva (51,52,58).
De manera similar, clásicamente se había descrito una disminución importante y generalizada del largo de las dendritas, de su arborización y del número de espinas sinápticas en múltiples nichos de la corteza cerebral. Sin embargo, actualmente se sabe que en el envejecimiento normal estos cambios no son generalizados, ocurren en regiones muy delimitadas, y no todos apuntan hacia un deterioro de la morfología neuronal; de hecho se ha demostrado que en algunas zonas del cerebro incluso hay un aumento de la arborización dendrítica en relación a la edad (59, 52).
Existen cambios en la expresión de genes y proteínas relevantes para la transmisión sináptica, como por ejemplo canales de calcio y receptores GABA (60), lo que pudiera alterar el balance entre la neurotransmisión inhibitoria y estimuladora, a favor de ésta última en relación a la edad. Este desbalance, contribuiría a la mayor actividad neuronal observado en la corteza prefrontal, lo que podría generar daño por exitotoxicidad (61).
La dopamina, uno de los neurotransmisores más estudiado en relación al envejecimiento, muestra una disminución de sus niveles totales en el SNC, especialmente en la pars compacta de la substancia nigra (62). Además el número de receptores de dopamina se reduce especialmente los subtipos D1 y D2 en el tálamo, la corteza frontal, el girus cingulado anterior, corteza temporal y cuerpo estriado (63). Este deterioro de la actividad dopaminérgica asociada a la edad ha hecho plantear que el cerebro estaría en un continuo preclínico de la Enfermedad de Parkinson (64). Se han descrito además alteraciones en otras vías de neurotransmisores como la colinérgica y la serotoninérgica, las que se han asociado a la patogenia de enfermedad de Alzheimer y trastornos del ánimo, entre otros.
Actualmente es ampliamente aceptado que en el cerebro adulto, incluyendo el humano, existe neurogénesis, la que se mantiene activa durante toda la vida (65, 66). Estas nuevas neuronas se originan en dos nichos específicos, la región subventricular y en el hipocampo, y han demostrado capacidad para insertarse en los circuitos ya existentes, siendo importantes en procesos como el aprendizaje y la memoria (67). En relación a la edad y algunas enfermedades neurodegenerativas existen alteraciones de la neurogénesis, y su rol fisiopatológico en estos proceso es materia de estudio actual (68).
El ejercicio físico aeróbico ha mostrado mejorar el rendimiento cognitivo en humanos (66, 69). El beneficio cognitivo asociado al ejercicio físico puede ser explicado por muchos mecanismos tales como aumento de la perfusión cerebral con estímulo de la angiogénesis, aumento de la neurogénesis, entre otras (70).
Estudios con imágenes funcionales cerebrales han revelado que los cerebros de sujetos añosos muestran una activación menos coordinada y menos localizada, espacialmente en respuesta a estímulos de función ejecutiva, particularmente en la corteza prefrontal. La pérdida de localización es llamativa, puesto que sujetos añosos con pérdida de localización tienen mejores rendimientos cognitivos que sus pares de edad que mantienen la alta localización observada en sujetos jóvenes (61).
De manera similar a los cambios en número de neuronas y dendritas, los cambios en la función cognitiva asociados a la edad no son uniformes, siendo la memoria y la atención las esferas cognitivas más afectadas (71).
Se describe un enlentecimiento generalizado en el procesamiento de la información (72) y una disminución en la capacidad de cambiar o alternar el foco de atención (73, 74). Estas capacidades muestran si gran variabilidad entre los sujetos y se ha planteado que su disfunción de pudiera ser parte del deterioro de otras esferas cognitivas como la memoria (71, 74). La capacidad de retener información sin manipulación por períodos cortos de tiempo (memoria de corto plazo) en general sólo muestra un mínimo deterioro con la edad. Sin embargo hay una gran percepción de su deterioro, puesto que la memoria de trabajo (un constructo entre memoria de corto plazo, atención y concentración, (75) se encuentra afectada, siendo difícil diferenciar si su compromiso es primario, o tiene relación con el deterioro de alguno de sus componentes (71). Este deterioro en la manipulación de la memoria a corto plazo pudiera tener su origen en el deterioro de la función ejecutiva asociada al envejecimiento, y se ha planteado que ésta pudiera tener un sustrato anatómico en los cambios degenerativos y funcionales que presenta la corteza prefrontal (58). En relación a la memoria de largo plazo, la memoria semántica (memoria a largo plazo asociada al conocimiento) tiende a mantenerse conservada durante el envejecimiento, mientras que la memoria episódica (memoria a largo plazo asociada a lo vivido y su contexto), está disminuida (71). Si bien hay evidencia de que los cambios cognitivos recién descritos pudieran tener un sustrato en el deterioro de la percepción del medio, secundario a la disminución de la capacidad visual y auditiva que acompaña a la edad, la relación de causalidad entre estos dominios aún es materia de estudio y discusión (76, 77).
Envejecimiento muscularPara mantener la independencia funcional es imprescindible mantener una adecuada masa muscular. La fuerza y la masa muscular alcanzan su máxima expresión entre la segunda y la cuarta décadas de la vida y desde entonces se produce una declinación progresiva (78).
El músculo esquelético sufre importantes cambios en relación a la edad. Disminuye su masa, es infiltrado con grasa y tejido conectivo, hay una disminución especialmente significativa de las fibras tipo 2, desarreglo de las miofibrillas, disminución de las unidades motoras, y disminución del flujo sanguíneo (79). A nivel subcelular hay acumulación de moléculas con daño por estrés oxidativo, disfunción mitocondrial, acumulación de lipofuccina, falla en la síntesis de nuevas proteínas relevantes para la formación de miofibrillas, entre otros (80). Todos estos cambios se traducen en una menor capacidad del músculo para generar fuerza (81).
A la pérdida de masa y función muscular asociada a la edad se le conoce como sarcopenia (82). La sarcopenia es un síndrome caracterizado por la pérdida generalizada y progresiva de masa de músculo esquelético. Suele acompañarse de inactividad física, disminución de la movilidad, enlentecimiento de la marcha, reducción de la capacidad de realizar ejercicios de resistencia (83). Además de estas consecuencias en la movilidad, la sarcopenia tiene importantes repercusiones metabólicas, tanto en la regulación de la glucosa, de la masa ósea, del balance de proteinas, del control de la temperatura entre muchas otras (83, 84). Todas son además características compartidas con el síndrome de fragilidad (80). La fragilidad se entiende como el deterioro acumulativo en múltiples sistemas fisiológicos incluyendo el neuromuscular lo que deriva en la sarcopenia.
La sarcopenia causa una disminución en la fuerza y la capacidad de ejercicio (81). Además es predictora de morbilidad y mortalidad en los adultos mayores (85), y se asocia a altísimos costos para los sistemas de salud (86)
No existe una causa clara para su inicio, y se han planteado múltiples mecanismos en relación a su desarrollo, destacado la actividad hormonal, con la reducción de la hormona de crecimiento, el factor de crecimiento símil a la insulina y los andrógenos (80, 87), mecanismos pro-inflamatorios evidenciados por la presencia aumentada de interleuquina 6 y de factor de necrosis tumoral alfa (88, 82). Se ha planteado también que la misma la disminución de la fuerza muscular y la reducción de la masa muscular participaría de la génesis, asociado a la reducción de las fibras musculares y a la denervación de las unidades motoras, las que son reinervadas por neuronas más lentas (79).
Envejecimiento del metabolismo de la glucosaLos trastornos del metabolismo de la glucosa son muy frecuentes en los adultos mayores, estimándose que hasta un 25% de ellos padecen Diabetes Mellitus (89). Se espera que en los próximos años la incidencia/prevalencia aumente en función de los cambios en patrones alimentarios y de actividad física, y debido a la mayor sobrevida de pacientes diabéticos (89, 91).
El adulto mayor experimenta importantes cambios en relación a su constitución corporal. Como ya se mencionó, a contar de la tercera década de la vida se observa una disminución sostenida de la masa muscular, fenómeno conocido como sarcopenia (92, 82). La sarcopenia ha mostrado ser un factor contribuyente al desarrollo de resistencia insulínica, probablemente en relación a la menor masa muscular y disfunción mitocondrial de las fibras remanentes (93). Asociada a la sarcopenia, con el envejecimiento se observa un aumento progresivo de la proporción del peso corporal compuesto por grasa, siendo especialmente llamativo el aumento de la grasa visceral (94, 95). El tejido adiposo ha demostrado ser un órgano endocrino muy activo, productor de mediadores pro-inflamatorios tales como TNF-α e IL-6 y de adipokinas como leptina y adiponectina entre otras, que median el metabolismo de la glucosa (96). Además, el tejido adiposo visceral ha demostrado ser especialmente importante en la producción de mediadores inflamatorios, participando así en el desarrollo de resistencia insulínica (97).
Esta combinación de pérdida de masa muscular y aumento del tejido adiposo con repercusiones negativas en el perfil metabólico de los sujetos añosos es muy frecuente, y recibe la denominación de obesidad-sarcopénica, unidad que en algunos estudios ha mostrado ser un mejor predictor de sindrome metabólico que obesidad y sarcopenia por separado (98).
Se ha descrito también un rol en la senescencia de las células β como parte del proceso que lleva a la disminución de la producción de insulina. Se sabe que las células β mantienen un potencial replicativo durante la vida adulta, el que disminuye en forma progresiva con la edad (99). Esta disminución del potencial replicativo, conocida como senescencia celular, junto con un aumento de la apoptosis participaría de la disminución de la masa de células β, es un mecanismo importante de la falla en la producción de insulina (91).
Es importante considerar también el sedentarismo (no siempre voluntario) y los hábitos alimentarios de los sujetos mayores. El requerimiento calórico disminuye en forma progresiva con la edad a contar de la tercera década de la vida, y la actividad física realizada también disminuye, sin embargo los aportes calóricos (y nutricionales en general) rara vez son ajustados a las demandas energéticas personales (100).
Los sujetos adultos mayores tienen una respuesta de contrarregulación del metabolismo de la glucosa disminuida, que se evidencia como menor respuesta de glucagón y hormona del creamiento frente a la hipoglicemia. Esta condición, asociado a las alteraciones cognitivas y motoras de la edad hace a la población adulto mayor presentar un mayor riesgo de hipoglicemia y sus graves efectos secundarios (89).
ConclusionesLos sujetos adultos mayores experimentan una serie de cambios asociados al envejecimiento que determinan que su fisiología sea muy distinta a la de los sujetos en edad media de la vida. Esto debiera implicar ajustes específicos en su cuidado y supervisión de salud.
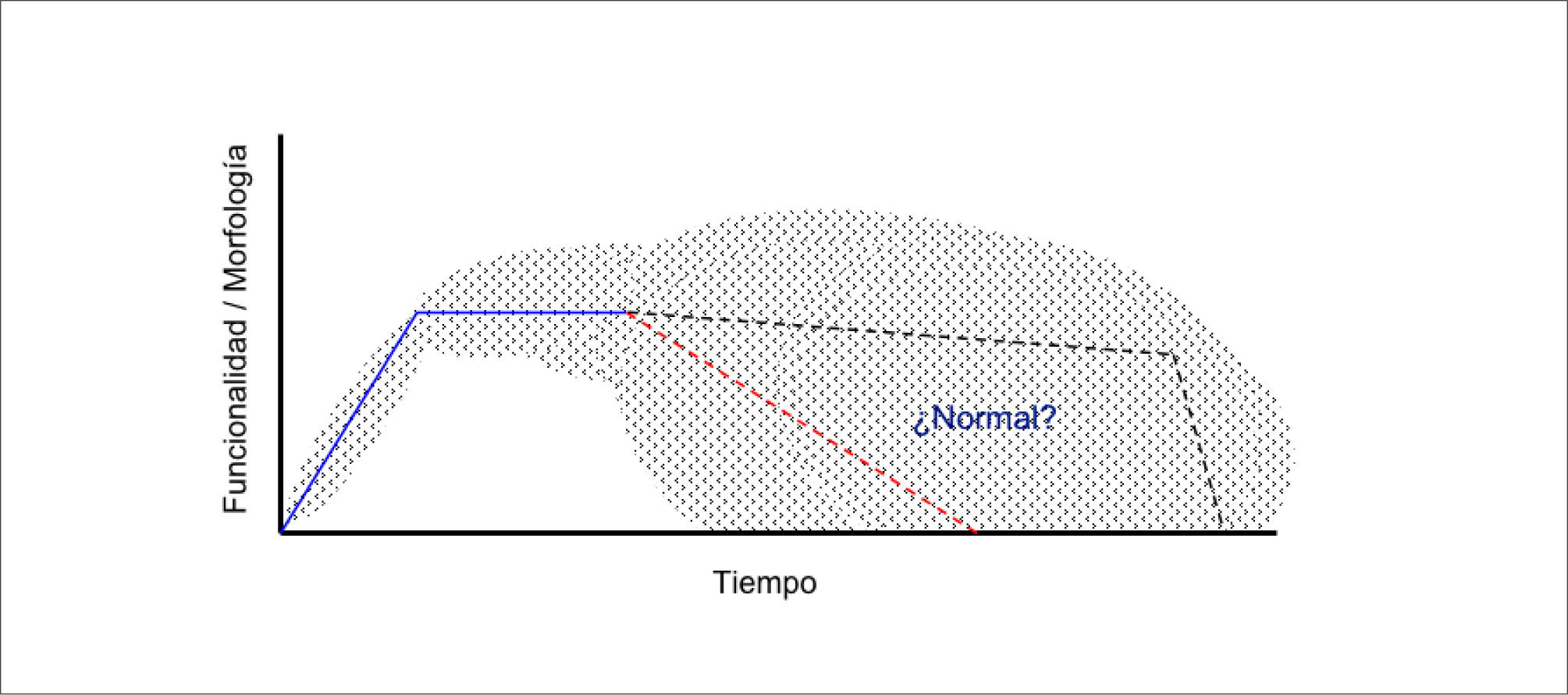
El estudio de los cambios asociados la edad es difícil por la alta frecuencia de comorbilidad y la gran variabilidad inter-individuo (Figura 1). Sin embargo dada la tremenda importancia biomédica que implica el envejecimiento de la población en términos sociales y de gasto en salud, es fundamental impulsar la investigación para avanzar en la compresión de los cambios asociados al envejecimiento con miras a disponer de mejores herramientas diagnósticas y terapéuticas para nuestra población.
A diferencia de las edades tempranas, donde por ejemplo los niños tienen estimaciones precisas del peso y talla asociados a una edad determinada, los sujetos añosos muestran gran dispersión en sus características, lo que dificulta de sobremanera la interpretación del envejecimiento normal. En líneas entrecortadas se exponen dos evoluciones temporales hipotéticas, ambas plausibles, pero muy divergentes entre sí.
El Dr. Felipe Salech recibe financiamiento de la beca de doctorado Conicyt y de la Iniciativa Científica Milenio P-09-095.