Se analizan los diferentes factores de riesgo de cáncer de mama agrupándolos en categorías según su nivel de riesgo. Se establecen 4 categorías de riesgo; la categoría 1 corresponde al riesgo de la población general, la categoría 2 a riesgo moderado (hasta 2 veces el riesgo), la categoría 3 a alto riesgo (2 a 10 veces el riesgo) y la categoría 4 a altísimo riesgo de desarrollar cáncer de mama (más de 10 veces). Se establecen recomendaciones de vigilancia y seguimiento a las mujeres según su categoría de riesgo, como también recomendaciones de prevención que incluye cambios del estilo de vida, diferentes tamizajes, quimioprevención, estudio genético y cirugías de reducción de riesgo. Se concluye que es posible distinguir diferentes grupos de mujeres de alto riesgo de cáncer de mama, clasificarlas según su nivel de riesgo y con ello elaborar estrategias de prevención que permitan disminuir el riesgo de desarrollar la enfermedad en el futuro.
Breast cancer risk factors are analyzed and placed into categories according to their level of risk. Risk factors are classified in four categories : Category 1 corresponds to the general population risk, Category 2 to moderate risk (up to 2 times the risk), Category 3 to high risk (2 to 10 times the risk) and Category 4 corresponds to very high risk of developing breast cancer (more than 10 times). Follow-up and surveillance recommendations are established according to the risk category as well as recommendations regarding prevention that includes changes in life-style, several screening methods for breast cancer, chemoprevention, genetic assessment and a variety of surgical risk-reduction options. In conclusion, it is possible to identify different groups of women at high risk of breast cancer, to classify them according to their level of risk and thereby carry out prevention strategies to reduce the risk of developing the disease in the future
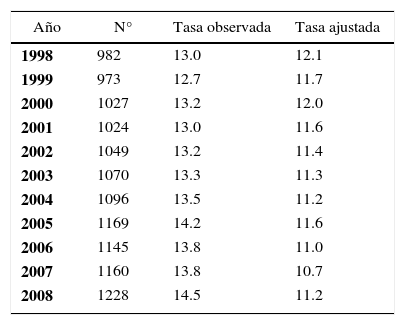
Cambios en el perfil epidemiológico de la población mundial y el aumento de la esperanza de vida al nacer, han elevado la prevalencia de enfermedades crónicas como el cáncer, transformándolo en un importante problema de salud pública. El cáncer de mama es la primera causa de muerte por cáncer en la mujer en el mundo, falleciendo más de 410.000 mujeres por año, constituyendo una tasa de 13.2 x 100.000 mujeres. La tasa de incidencia se estima en 37.4 por 100.000 mujeres mayores de 15 años con 1.151.298 nuevos diagnósticos por año en el mundo (1). En Chile, el año 2008, el cáncer de mama alcanzó una tasa de mortalidad de 14.5 por 100.000 mujeres con tasa de Años de Vida Potencialmente Perdidos (AVPP) por cáncer de mama de 100 por 100.000, ocupando el 2° lugar después del cáncer de cuello uterino. La Tabla 1 muestra la mortalidad por cáncer de mama en Chile desde el año 1998 al 2008 (1).
Mortalidad por cáncer de mama. tasas por 100.000 mujeres (OBSERVADA Y AJUSTADA POR EDAD). CHILE 1998 - 2008*
| Año | N° | Tasa observada | Tasa ajustada |
|---|---|---|---|
| 1998 | 982 | 13.0 | 12.1 |
| 1999 | 973 | 12.7 | 11.7 |
| 2000 | 1027 | 13.2 | 12.0 |
| 2001 | 1024 | 13.0 | 11.6 |
| 2002 | 1049 | 13.2 | 11.4 |
| 2003 | 1070 | 13.3 | 11.3 |
| 2004 | 1096 | 13.5 | 11.2 |
| 2005 | 1169 | 14.2 | 11.6 |
| 2006 | 1145 | 13.8 | 11.0 |
| 2007 | 1160 | 13.8 | 10.7 |
| 2008 | 1228 | 14.5 | 11.2 |
Los esfuerzos para combatir el cáncer de mama se han concentrado principalmente en diagnóstico precoz y tratamientos oportunos. Con la incorporación de programas de pesquisa precoz o “tamizaje” por mamografía se diagnostican cánceres mamarios cada vez más pequeños, lo que ha logrado disminuir la mortalidad por cáncer de mama. En la actualidad, se han identificado diversos factores de riesgo que están presentes en mujeres sanas, pero que las hacen aumentar su probabilidad de presentar la enfermedad. La ventaja de conocer estos factores de riesgo, es poder reconocer grupos de mujeres de alto riesgo, cuantificar su riesgo, clasificarlas según su nivel de riesgo y con ello elaborar estrategias de prevención que permitan disminuir el riesgo de desarrollar cáncer de mama en el futuro. Para mejor comprensión de este importante tema, se agrupará a las mujeres en 4 categorías de riesgo de cáncer de mama, de menor a mayor riesgo, para luego, según la evidencia científica actualmente existente, recomendar la mejor estrategia de vigilancia y prevención según su categoría de riesgo (2).
Categorías de riesgoCategoría 1: riesgo de cáncer de mama de la población generalEsta categoría agrupa a la población general sin factores de riesgo conocidos, el riesgo variará según la edad de cada mujer. A los 30 años, el riesgo de cáncer de mama es menor de 0.5%; a los 50 años el riesgo llega a 2%, y, a los 70 años el riesgo alcanza a 7% (2, 3). Esta categoría de mujeres puede ser útil para comparar y medir el riesgo de las otras categorías que se analizan más adelante. La vigilancia o seguimiento de las mujeres de esta categoría se analizará en conjunto con las mujeres de la categoría 2.
Categoría 2: riesgo moderado de cáncer de mamaEstá constituida por mujeres que tienen un aumento de hasta 2 veces el riesgo de desarrollar cáncer de mama (Riesgo relativo 1.2 - 2.0). En ellas existe uno o más factores de riesgo denominados “menores”. A continuación se resumen los principales factores de riesgo menores: Edad. Es el factor aislado más importante en el riesgo de cáncer de mama (3, 4). A mayor edad mayor riesgo. A partir de los 60 años se considera factor de riesgo para cáncer de mama (2).
Factores ReproductivosExiste correlación entre la duración de la vida menstrual y reproductiva de la mujer con el riesgo de desarrollar cáncer de mama, probablemente relacionado con mayor exposición a hormonas esteroidales (2, 3, 4). Aumentan levemente el riesgo de cáncer de mama la menarca precoz, menopausia tardía, la nuliparidad y el primer parto tardío después de los 30 años. Disminuyen el riesgo la menarca tardía, menopausia precoz, primer parto antes de los 25 años y lactancia prolongada.
Enfermedades mamarias benignas proliferativas sin atipiasBiopsias mamarias previas que informen lesiones proliferativas que incluyan tumores papilares, cicatriz radiada e hiperplasias ductales sin atipias constituyen también los llamados factores de riesgo menores (5).
Terapia de Reemplazo Hormonal en la menopausiaDespués de años de debate, los estudios han concluido que el eventual aumento del riesgo de cáncer de mama con el uso de estos tratamientos va a depender del tipo de preparado usado, en especial del tipo de progestina empleado en cada formulación. Por lo tanto, si una mujer necesita tratamiento hormonal en la menopausia, puede usarlo sin riesgo, siempre que esté indicado correctamente, en la dosis correcta y por el tiempo adecuado (6, 7).
Involución mamaria incompletaInvolución mamaria es la disminución en número y tamaño de las unidades ducto-lobulillares terminales. Es un fenómeno fisiológico a través de los años de la mujer. Se ha demostrado que, si no existe involución o la involución es incompleta, habría aumento del riesgo de cáncer de mama. La falta de involución mamaria en la postmenopausia se asocia clínicamente con mamas densas en el examen mamográfico (8).
Sobrepeso después de la menopausiaEl mayor riesgo se debe a la mayor aromatización de andrógenos a estrógenos en el tejido adiposo, los que actúan sobre la mama. Un índice de Masa Corporal (IMC) mayor a 21 eleva su riesgo en alrededor de 20% (2, 9, 10, 11).
AlcoholEl consumo de alcohol se asocia con moderado aumento del riesgo de cáncer de mama que depende del tiempo de consumo y de la dosis ingerida. Sobre 8 gramos diarios de alcohol (2 copas de vino) comienza a elevarse el riesgo. Sobre 12 gramos diarios el riesgo se eleva al doble (3, 12).
Mayor densidad mamográficaAquellas mujeres cuya mamografía indica aumento de la densidad mamaria tendrían mayor riesgo, que depende del grado de aumento y extensión de la densidad. No está aclarado la causa exacta de esta asociación, probablemente la mayor densidad radiológica representa a tejido mamario con mayor proliferación de sus estructuras y menos involucionado (13).
Seguimiento o vigilancia a mujeres en categorías 1 y 2Para estas mujeres, que constituyen la gran mayoría de la población, se sugieren las siguientes recomendaciones aprobadas en la III Jornada Chilena de Consenso en cáncer de mama en agosto del año 2009 (2, 3).
1Modificaciones del Estilo de vidaLo que ha demostrado algún efecto en disminuir el riesgo de cáncer de mama es evitar o combatir el sobrepeso, en especial en mujeres postmenopáusicas; disminuir o evitar el consumo de alcohol y el aumento de la actividad física con ejercicios físicos programados en forma regular y continua. Con relación a la dieta ideal, la sugerencia es dietas balanceadas con aumento de ingesta de vegetales y frutas pero la evidencia científica aún no es concluyente (3, 9-13, 15). Esta recomendación es común a todas las categorías de riesgo.
2Autoexamen mamarioLa evidencia sobre la eficacia del auto-examen es limitada. Los estudios randomizados no demuestran impacto en reducir la mortalidad por cáncer de mama. Por ello, el autoexamen debe considerarse más bien un complemento que un sustituto de la mamografía o del examen físico mamario por personal entrenado. En caso de ser recomendado, debe enseñarse y practicarse cuidadosamente a partir de los 40 años de edad. Antes tiene riesgo de falsos positivos (1, 3).
3Examen clínico mamario anual realizado por profesional entrenado a partir de los 40 años4Mamografía anual a partir de los 40 - 50 años
La mamografía anual de tamizaje tiene sensibilidad de 77 a 95%, especificidad de 94 a 97% y aceptabilidad en la mayoría de las mujeres (16). La Tabla 2 muestra los estudios publicados de tamizaje según la edad de la mujer. Considerando que los estudios de tamizaje tienen sesgos de selección y duración, el tamizaje muestra beneficios a partir de los 40 años. Entre los 40 y 50 años existen 8 estudios prospectivos que reportan un riesgo relativo de 0.85 (IC 95%= 0.75-0.96) lo que indica que se requieren 1904 exámenes para evitar una muerte por cáncer de mama. Entre los 50 y 60 años, 6 estudios indican un riesgo relativo de 0.86 (0.75-0.79) requiriéndose 1.339 exámenes para evitar una muerte por cáncer de mama. Entre los 60 y 70 años, 2 estudios señalan un riesgo de 0.68 (0.54-0.87) necesitando sólo 377 exámenes para evitar una muerte. Sobre 70 años no hay estudios disponibles (16, 17).
Beneficio del tamizaje con mamografía para todas las edades
| Edad (años) | Ensayos | RR mortalidad por cáncer de mama | NNI para prevenir 1 muerte x cáncer |
|---|---|---|---|
| 40 - 49 | 8 | 0.85 (0.75-0.96) | 1904 |
| 50 - 59 | 6 | 0.86 (0.75-0.99) | 1339 |
| 60 - 69 | 2 | 0.68 (0.54-0.87) | 377 |
| 70 - 74 | 1 | 1.12 (0.73-1.52) | No disponible |
Nelson Ann Intern Med 2009;151:727-737
El tamizaje con mamografía tiene beneficios y riesgos. Entre los 40 y 50 años, la probabilidad de muerte por cáncer a 10 años sin tamizaje es 3.5 por 1000. Con tamizaje es 3.0 por 1000 evitando 0.5 muertes por 1000 mujeres. Entre los 50 y 60 años, el tamizaje con mamografía evita 0.7 muertes por mil mujeres. Los riesgos del tamizaje son los falsos positivos con biopsias probablemente innecesarias y el sobre diagnóstico, es decir, cánceres de muy buen pronóstico que de no ser detectados por la mamografía, nunca habrían causado morbilidad o mortalidad (18). Un aspecto que no está definido es hasta qué edad debe continuar el tamizaje por mamografía. La mayoría de los estudios incluyen mujeres hasta los 70 años por lo que no hay evidencia científica después de esa edad. Sin embargo, existe la recomendación de continuar con mamografías mientras la mujer tenga una expectativa de vida de buena calidad de 5 años o más (3, 16, 17).
El año 2009, la US Preventive Services Task Force (USPSTF) de los Estados Unidos de América examina la eficacia del tamizaje con mamografía, para actualizar las recomendaciones del año 2002, basado en revisiones sistemáticas de la evidencia de los beneficios y riesgos. Después de revisar la evidencia científica, la USPSTF recomienda eliminar el tamizaje con mamografía anual rutinaria entre los 40 y 49 años, comenzar el tamizaje a los 50 años, realizarlo cada 2 años y extenderlo desde los 70 años hasta los 74 años (19). La racionalidad de la USPSTF para esta determinación está basada en que el beneficio absoluto del tamizaje antes de los 50 años es pequeño (1904 exámenes para evitar una muerte). En el análisis de decisión, estima que el 3% adicional de reducción de la mortalidad con tamizaje entre 40 y 49 años, es menor que el 7% de beneficio por extenderlo hasta los 79 años. El tamizaje bianual reporta sólo 70 - 90% del beneficio del tamizaje anual con reducción del 50% de los riesgos (18, 19).
A pesar de la estimación de la USPSTF, la Sociedad Americana de radiología continúa recomendando el tamizaje con mamografía a partir de los 40 años ya que, en ese país, 18% de los cánceres de mama son diagnosticados en la década de los 40 años. Además, su expectativa de vida es mayor, por lo que más años de vida son potencialmente salvados por cada muerte evitada. Por otra parte, en mujeres jóvenes el período preclínico de la enfermedad es más corto por lo que se benefician con el tamizaje anual (20). En conclusión, cada mujer, con la correcta información otorgada por su médico, debe considerar si opta por tamizaje anual a partir de los 40 o de los 50 años.
Categoría 3: alto riesgo de cáncer de mamaEsta categoría incluye mujeres que tienen 3 a 10 veces más riesgo que la población general de desarrollar cáncer de mama durante su vida (2, 3, 4). Considera los siguientes grupos de mujeres:
1Historia familiar de cáncer de mama que incluya dos o más parientes de primer grado con cáncer sin mutaciones demostradasDesde el punto de vista de factores de herencia, 66% de los cánceres de mama diagnosticados son de tipo esporádico, es decir, sin antecedentes familiares, al menos durante las dos últimas generaciones. 29% son de tipo familiar, asociado con historia familiar de cáncer mamario que incluye uno o más parientes de primero o segundo grado. Sólo 5% a 10% de los cánceres de mama corresponden al llamado cáncer de tipo hereditario debido a mutaciones de determinados genes (2, 3, 21-23). En el cáncer de tipo familiar, el riesgo aumenta en presencia de antecedentes de cáncer de mama en hermanas, madre, abuelas, tías y primas, en especial si se ha desarrollado antes de la menopausia y ha sido bilateral. El riesgo se eleva mientras mayor sea el número de familiares afectados como también mientras menor es la edad del pariente en el momento del diagnóstico (24). El cáncer de mama familiar se debe probablemente a interacción de factores medioambientales con factores genéticos aún no identificados. Existen modelos matemáticos (Claus, Myriad, BRACA-PRO, Cancer-gene) que ayudan a estudiar el riesgo a través de la historia familiar. Estos modelos permiten cuantificar el riesgo de desarrollar cáncer de mama en un periodo o a una edad determinada. El poder expresar este valor en términos objetivos y cuantitativos facilita la educación de las mujeres, al igual que permite diseñar racionalmente una estrategia para el manejo del riesgo (3, 25, 26).
2Antecedentes de biopsia mamaria que informa lesiones histológicas de alto riesgo o “lesiones precursoras”Lesiones precursoras son lesiones histológicas proliferativas benignas con atipias, en las que se ha demostrado relación con riesgo aumentado de desarrollo posterior de cáncer de mama (2, 3, 5, 27-30). Se aceptan como precursoras, la Neoplasia lobulillar, la Hiperplasia ductal atípica y la Atipia plana. La Neoplasia lobulillar (NL) comprende la Hiperplasia Lobulillar Atípica (HLA) y el Carcinoma Lobulillar in situ (LCIS). Se origina en la unidad ducto-lobulillar terminal caracterizada por proliferación de células epiteliales que llenan y distienden el acino. Su incidencia en biopsias de mama por procesos benignos es 0.5 - 3.8%. El diagnóstico suele ser incidental principalmente en biopsias percutáneas de microcalcificaciones asociadas a lesiones proliferativas benignas. Suele presentarse en forma multifocal y bilateral.
La Hiperplasia ductal atípica (HDA) es una lesión proliferativa intraductal en que coexisten patrones de hiperplasia ductal usual y carcinoma ductal in situ de bajo grado. Suele asociarse a carcinomas de bajo grado. El riesgo relativo de desarrollo a cáncer de mama es entre 4 y 5.
La Atipia Plana se caracteriza por células nativas de la unidad ductolobulillar terminal que son reemplazadas por capas de células cuboides, columnares con atipia celular. Parece constituir una proliferación neoplásica precursora o el primer cambio morfológico de Carcinoma intraductal (DCIS) de bajo grado o de un carcinoma Tubular. Se asocia en 9-22% con HDA, NL, DCIS de bajo grado y Carcinoma Tubular.
3Antecedente personal de cáncer de mamaEl antecedente de haber sido tratada con anterioridad de un cáncer de mama aumenta el riesgo de presentar un segundo cáncer primario en la mama tratada u otro cáncer en la mama contralateral. El riesgo relativo se ha calculado entre 1.7 y 4.5. Si la mujer es menor de 40 años el riesgo relativo de cáncer de mama se eleva a 8.0. El riesgo de desarrollar un segundo cáncer de mama en la mujer ya tratada por la enfermedad es de 4 a 8 por 1.000 años-mujer, es decir, un riesgo menor de 1% por año (31, 32).
4Densidad mamográfica aumentada (controversial)Existen estimaciones controversiales que otorgan alto riesgo a mujeres cuyas mamografías presentan densidad aumentada en más del 50% del tejido mamario (13).
Seguimiento, vigilancia y prevención a mujeres en categoría 3 (ALTO RIESGO DE CÁNCER DE MAMA)A este grupo de mujeres se sugieren las siguientes recomendaciones, discutidas y aprobadas en la III Jornada Chilena de Consenso en Cáncer de mama en agosto del año 2009 (3):
1Modificaciones del estilo de vidaRecomendación similar para todas las categorías, ya detallada anteriormente.
2Examen clínico mamario protocolizado semestralmente por profesional entrenado3Mamografía anual
Constituye la base del tamizaje de cáncer de mama aunque la tasa de cáncer de intervalo con mamografía es 36 a 50% (33). Se recomienda en forma digital cuando sea posible, en especial a mujeres con mamas densas y/o menores de 50 años. Con relación a la edad de comienzo del tamizaje se sugiere lo siguiente:
- -
Independiente de la edad de la mujer con antecedente personal de cáncer de mama como también frente al antecedente de lesiones histológicas precursoras.
- -
En mujeres de Alto Riesgo por historia familiar, se recomienda comenzar el tamizaje 10 años antes de la edad de presentación del cáncer del familiar de primer grado con un tope de 30 años. No se recomienda comenzar antes de los 30 años a menos que se sospeche una mutación BRCA.
- -
Ultrasonido complementario de tamizaje sólo en mujeres con mamas densas (3, 33).
Quimioprevención del cáncer es la administración de preparados químicos para impedir o revertir la carcinogénesis evitando el desarrollo de un cáncer (34). Los más estudiados son los que actúan por competencia como los Moduladores Selectivos de Receptores de Estrógenos que incluye Tamoxifeno y Raloxifeno.
TamoxifenoCuatro estudios prospectivos en mujeres de alto riesgo de cáncer de mama suman 28.419 mujeres que se randomizan a tamoxifeno, 20 mg/día vs placebo durante 5 años (35, 36, 37, 38). En los dos primeros estudios, si bien no reportan clara prevención de cáncer de mama, sugieren beneficio para el subgrupo de mujeres que recibieron concomitantemente terapia de reemplazo hormonal en la menopausia y tamoxifeno (6 de 793 mujeres vs 17 de 791). Los otros dos estudios sí reportan clara disminución del riesgo de cáncer de mama en mujeres de alto riesgo de 35% a 50%. La reducción de la incidencia se observa para tumores receptores estrógenos positivos (RR 0.31 CI 0.22-0.45). Si se suman los 4 estudios de prevención con tamoxifeno se reporta un efecto protector de 38%, Hazard ratio de 0.62 (38).
RaloxifenoDos estudios randomizados que suman 27.400 mujeres demuestran que raloxifeno, en dosis de 60 mg. diarios por 5 años, es tan efectivo como tamoxifeno en reducir el riesgo de cáncer de mama infiltrante y con menos efectos adversos (39, 40). Como efectos adversos, tamoxifeno y raloxifeno aumentan 2 a 3 veces el riesgo de eventos venosos tromboembólicos, Tamoxifeno aumenta además 2 a 3 veces el riesgo de cáncer de endometrio en mujeres postmenopáusicas.
En conclusión, es posible prevenir el cáncer de mama receptores hormonales positivos a mujeres de alto riesgo de cáncer de mama con tamoxifeno o raloxifeno durante 5 años. Grupos de mujeres de alto riesgo se benefician con estos tratamientos pero los posibles efectos adversos desaconsejan su uso indiscriminado. La quimioprevención puede realizarse en mujeres de alto riesgo premenopáusicas y postmenopáusicas.
Categoría 4. Altísimo Riesgo de cáncer de mamaSon mujeres que tienen más de 10 veces el riesgo de desarrollar cáncer de mama durante su vida (RR >10.0). Esta categoría incluye sólo a dos grupos de mujeres:
1Portadoras de mutaciones de alta penetrancia en genes BRCA 1 y BRCA 2(Cáncer de mama hereditario).
2Antecedentes de radioterapia al tórax, generalmente por cáncer linfático, antes de los 30 añosCáncer de mama hereditario. Corresponde a 5-10% de los casos de cáncer de mama. En cáncer hereditario se han identificado dos oncogenes supresores denominados BRCA1 y BRCA2 relacionados con el control de proliferación, expresión génica y reparación del daño producido en el DNA (2, 3, 21, 32). Se transmiten por herencia autosómica dominante y la pérdida de su funcionalidad requiere de la alteración de ambos alelos del cromosoma. Las alteraciones corresponden a diversas y numerosas mutaciones que incluyen inserciones, deleciones, etc. Cuando estos genes están mutados y son heredados, se asocian a un riesgo de 50% a 80% de desarrollar cáncer de mama y de 20% a 40% de cáncer de ovario durante toda la vida. Esto debido a que las proteínas codificadas por estos genes mutados influyen en la reparación del DNA y en el control de la replicación de las células epiteliales de la mama (21, 23, 41). Los portadores de las mutaciones descritas desarrollarán la enfermedad a edades más tempranas que lo observado en casos de cánceres esporádicos. Como se trata de herencia autosómica dominante, cada hijo tiene 50% de probabilidades de heredar la mutación, es transmitido igualmente por ambos sexos y lo habitual es que no se salten generaciones. La presencia de una determinada mutación del BRCA1 o BRCA2 constituye un riesgo al cual debe agregarse la posibilidad de portar otras mutaciones de esos genes o de otros por identificar.
Seguimiento, vigilancia y prevención a mujeres en categoría 4 (ALTÍSIMO RIESGO DE CÁNCER DE MAMA)Las recomendaciones discutidas y aprobadas para este grupo de mujeres son las siguientes (2, 3):
1Modificaciones del estilo de vidaYa detallada anteriormente.
2Examen clínico mamario protocolizado semestralmente por profesional entrenado3Mamografía anual
La recomendación de tamizaje en estos casos difiere de lo habitual con relación a la edad de comienzo (3, 33):
- -
Desde los 25 años en mujeres con mutación demostrada BRCA 1 y 2.
- -
Desde los 25 años o después de 8 años de finalizada la radioterapia al tórax y/o mediastino por cáncer linfático.
- -
Ultrasonido complementario de tamizaje en casos de mamas densas o en aquellas mujeres que no toleren o se encuentre contraindicada la Resonancia Magnética mamaria (claustrofobia, marcapasos, implantes metálicos, etc.)
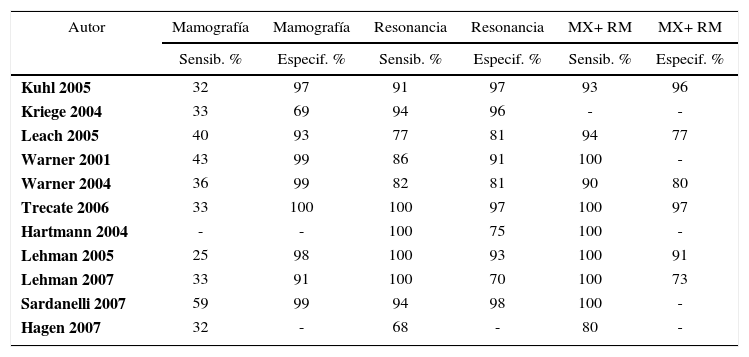
Estas mujeres son mayoritariamente de menor edad y con mamas densas por lo que la resonancia magnética ha demostrado mayor sensibilidad que la mamografía en la detección de cánceres precoces. La edad de comienzo es similar a la edad de inicio del tamizaje por mamografía. La Tabla 3 resume una revisión sistemática de comparación de mamografía, resonancia magnética y asociación de mamografía más resonancia en mujeres de altísimo riesgo, demostrando que la asociación de los dos exámenes realizados anualmente, tiene una sensibilidad cercana al 100% y especificidad de 73% a 96% (3, 33, 42).
Comparación entre mamografía, resonancia magnética y asociación de exámenes en la detección de cáncer de mama en mujeres de altísimo riesgo
| Autor | Mamografía | Mamografía | Resonancia | Resonancia | MX+ RM | MX+ RM |
|---|---|---|---|---|---|---|
| Sensib. % | Especif. % | Sensib. % | Especif. % | Sensib. % | Especif. % | |
| Kuhl 2005 | 32 | 97 | 91 | 97 | 93 | 96 |
| Kriege 2004 | 33 | 69 | 94 | 96 | - | - |
| Leach 2005 | 40 | 93 | 77 | 81 | 94 | 77 |
| Warner 2001 | 43 | 99 | 86 | 91 | 100 | - |
| Warner 2004 | 36 | 99 | 82 | 81 | 90 | 80 |
| Trecate 2006 | 33 | 100 | 100 | 97 | 100 | 97 |
| Hartmann 2004 | - | - | 100 | 75 | 100 | - |
| Lehman 2005 | 25 | 98 | 100 | 93 | 100 | 91 |
| Lehman 2007 | 33 | 91 | 100 | 70 | 100 | 73 |
| Sardanelli 2007 | 59 | 99 | 94 | 98 | 100 | - |
| Hagen 2007 | 32 | - | 68 | - | 80 | - |
MX= Mamografía
RM= Resonancia magnética.
Warner, E, H. Messersmith, et al. “Systematic review: using magnetic resonance imaging to screen women at high risk for breast cancer.” Ann Intern Med 2008; 148(9): 671-9.
La identificación de mujeres y hombres para realizar el estudio genético ha sido controversial. Se han diseñado numerosos sistemas para cuantificar el riesgo genético, los que requieren de tiempo para investigar detalladamente los antecedentes oncológicos familiares de al menos tres generaciones. Existen criterios clínicos para definir cáncer de mama hereditario, que corresponden a los criterios de historia familiar con los que se han seleccionado familias a las que se les ha realizado el estudio genético para la identificación de los genes (2, 3, 21, 23, 41). La edad recomendada es sobre 25 años. Los criterios clínicos para recomendar el estudio genético son los siguientes:
- -
Tres familiares de 1° grado con cáncer de mama, en dos generaciones sin importar la edad de aparición del cáncer.
- -
Dos familiares con cáncer de mama, uno con diagnóstico antes de los 40 años.
- -
Dos familiares de 1° grado con cáncer, uno de mama y otro epitelial del ovario.
- -
Dos familiares de 1° o 2° grado con cáncer de mama, uno de ellos en un hombre.
- -
Familiar con cáncer de mama bilateral sincrónico.
- -
Familiar de 1°/2° grado con cáncer de mama antes de los 35 años.
- -
Familiar con cáncer de mama y cáncer epitelial del ovario.
Los modelos matemáticos ayudan a seleccionar mujeres para el estudio genético. El modelo BRCA-PRO®, diseñado para determinar la probabilidad de mutación en los genes BRCA1 y BRCA2, presenta correlación en la predicción de mutaciones. Sobre 10% de probabilidad sugiere test genético, ya que estas mujeres tienen 100 veces más riesgo de mutaciones al compararlas con la población general de 0.1% (2, 3, 21). La indicación del examen genético debe ser siempre evaluada por el médico y ofrecerse al individuo afectado. Si ello es imposible, al familiar asintomático con grado de parentesco más cercano. En los pacientes con cáncer de mama no de origen Askenazi el estudio debe incluir la secuenciación completa del DNA de los genes BRCA 1 y 2. Si a un individuo enfermo de cáncer mamario se le detecta una determinada mutación, en los familiares se recomienda buscar sólo esa mutación y no secuenciar todo el gen. Si se trata de un paciente judío Askenazi la sugerencia es realizar el estudio de las tres mutaciones propias de esta población. Si ellas son negativas, se sugiere entonces la secuenciación completa. Por último, es fundamental asegurar la confidencialidad del examen y de sus resultados
6QuimioprevenciónYa fue analizado anteriormente. Constituye una herramienta más en la vigilancia de este grupo de mujeres.
7Cirugía profiláctica o de Reducción de riesgoSe distinguen tres tipos de cirugías de Reducción de Riesgo o profilácticas en mujeres de altísimo riesgo de cáncer de mama: la mastectomía bilateral, la mastectomía contralateral en mujeres con cáncer de mama unilateral y la ooforectomía bilateral (3, 43-45). La III Jornada Chilena de Consenso en Cáncer de Mama realizada en agosto del 2009, después de revisar la evidencia científica disponible, sugiere las siguientes recomendaciones (3):
- -
La Mastectomía de Reducción de Riesgo bilateral y la Mastectomía de Reducción de riesgo contralateral disminuyen el riesgo de cáncer de mama en 90%.
- -
La Ooforectomía profiláctica realizada en mujeres antes de los 45 años, disminuye la incidencia de cáncer de mama en 50% y de cáncer de ovario en 90%.
- -
La combinación de Mastectomía de Reducción de Riesgo con Ooforectomía profiláctica parece reducir aún más el riesgo de cáncer de mama a 95%, pero falta evidencia para recomendarlo.
- -
No existe evidencia con relación a la edad a realizar las cirugías profilácticas. Se recomienda la Mastectomía de Reducción de Riesgo al comprobar portación de mutaciones BRCA 1-2. Respecto a la ooforectomía debe ser recomendada previo a la menopausia, en especial antes de los 45 años.
En el Centro Integral de la Mama de Clínica Las Condes (CIM), el año 2009 se inicia un Programa de Alto Riesgo de Cáncer de Mama. Mujeres con alto riesgo son derivadas por sus médicos al Programa donde primeramente son entrevistadas por la enfermera del CIM quien realiza una evaluación de la historia familiar, de los factores de riesgo y aplica diversos modelos matemáticos construyendo un pedigrí. Los antecedentes de cada mujer son analizados y discutidos en el Comité de Alto Riesgo que funciona semanalmente, donde se entregan al médico tratante las recomendaciones de vigilancia y prevención según su categoría de riesgo. Hasta marzo del 2011 han participado en el programa 120 mujeres. De ellas 54 se han clasificado en categoría 3 y 4 en categoría 4. Han surgido 25 recomendaciones de quimioprevención y 27 recomendaciones de estudio genético. El Programa de Alto Riesgo del CIM se encuentra en pleno desarrollo y próximamente se publicaran los primeros resultados.
ConclusionesEs importante reconocer los diferentes factores de riesgo de cáncer de mama y con ello identificar a las mujeres de alto riesgo y agruparlas según su nivel o categoría de riesgo de desarrollar la enfermedad en el futuro.
En mujeres con alto riesgo por historia familiar de cáncer de mama, es útil conocer los requisitos para seleccionar aquellas que requieran realizarse el estudio genético por sospecha de riesgo de cáncer hereditario.
Aquellas mujeres con mayor riesgo de cáncer de mama pueden participar en protocolos de vigilancia, desarrollados en centros especializados, los que dependerán del nivel de riesgo de cada mujer
Las mujeres de mayor riesgo pueden también participar en las diferentes estrategias de prevención de cáncer de mama y su aplicación dependerá de su categoría. El manejo clínico racional de mujeres de alto riesgo constituye un desafío que deberá incorporarse en todos los centros de diagnóstico y tratamiento de cáncer de mama.
El autor declara no tener conflictos de interés, en relación a este artículo.