La enfermedad inflamatoria intestinal es una patología inflamatoria del tubo digestivo que comprende la colitis ulcerosa (CU), la enfermedad de Crohn (EC) y la enfermedad inflamatoria intestinal no clasificable (EII-nc). Casi un 30% de los casos son diagnosticados en edad pediátrica. El objetivo de este trabajo es describir las características de presentación, el comportamiento y el tratamiento de un grupo de pacientes en un centro de referencia del interior de Argentina.
Población y métodométodo: Estudio retrospectivo de niños de 1 a 16 años que recibieran atención entre 2012 y 2020 por el Departamento de Gastroenterología Pediátrica de un centro de referencia de la provincia de Córdoba.
ResultadosSe reportaron 22 pacientes, con un 59,1% de mujeres. La media de edad fue de 7,7 años. El 68,2% tenían CU, 13,6% EC y 18,2% EII-nc. La mediana del tiempo entre el inicio de los síntomas y el diagnóstico fue de 4 meses para la CU, 7 meses para EC y 15 meses para EII-nc. El síntoma principal fue el dolor abdominal recurrente. El 36,4% de los pacientes tenían anemia. Todos los pacientes con EC presentaban compromiso ileocolónico mientras que en la CU y EII-nc predominó la pancolitis. A las 12 semanas de tratamiento, el 25% de los pacientes presentaba remisión clínica.
ConclusionesEsta es la primera serie que describe un número significativo de pacientes fuera de Buenos Aires. La CU fue la forma de presentación más frecuente y el dolor abdominal el principal síntoma descrito. Se necesitan más series nacionales con el fin de mejorar la descripción clínica y la respuesta al tratamiento.
Inflammatory Bowel Disease is an immune mediated, chronic inflammatory disorder of the gastrointestinal tract. It includes ulcerative colitis (UC), Crohn's disease (CD) and IBD-unclassified (IBD-U). About 25-30% of patients with CD and 20% of patients with UC are diagnosed in the pediatric age. The objective of this study was to describe the onset characteristics, behavior and treatment of a group of patients in a reference center in Argentina.
Materials and MethodsThis is a retrospective study that describes all IBD patients aged between 1 and 16 years that attended to the Department of Pediatric Gastroenterology between 2012 and 2020 in a referral center in Cordoba Province.
ResultsTwenty-two patients were included in the registry; 59.1% were girls. Mean age at diagnosis was 7.7 years. UC was diagnosed in 15 patients (68.2%), CD in 3 patients (13.6%) and IBD-U in 4 patients (18.2%). The median delay between the onset of symptoms and the diagnosis of IBD was 4 months for UC, 7 months for CD and 15 months for IBD-U. The most common symptom at diagnosis was recurrent abdominal pain. We found 36.4% of patients had anemia at diagnosis. In patients with CD, the involvement of all patients was ileocolonic, and nearly 60% of UC and IBD-U patients had pancolitis extention. Four out of 16 patients had clinical remission of their disease activity (25%) after twelve weeks of treatment.
ConclusionsThis is the first series of cases that describe a significant number of patients outside of Buenos Aires, Argentina. We found that UC was the most frequent form of IBD and abdominal pain was the most frequent symptom at diagnosis. More national series of pediatric IBD patients, including patients from the public and private healthcare system, are needed in order to improve the clinical description of inflammatory bowel disease and response to therapy.
.
La enfermedad inflamatoria intestinal (EII) es un trastorno inflamatorio crónico del tracto gastrointestinal, inmunomediado, que incluye la colitis ulcerosa (CU), la enfermedad de Crohn (EC) y la enfermedad inflamatoria intestinal no clasificable (EII-nc), variante que no logra clasificarse en ninguna de las dos anteriores, siendo la evolución de la enfermedad la que permitirá su diferenciación. La EII se caracteriza por alternar periodos de recaída y remisión, con un curso imprevisible y una morbilidad significativa1–4.
Su etiología es desconocida, pero sería el resultado de una suma de fenómenos inmunológicos desencadenados por factores ambientales que darían lugar a una respuesta de la mucosa intestinal contra la microbiota en individuos genéticamente susceptibles5–7.
Está descrito que alrededor del 25-30% de los pacientes con EC y el 20% de los pacientes con CU se diagnostican en la edad pediátrica y tendrían una presentación más agresiva de la enfermedad8,9.
La mayoría de los datos publicados en pediatría se obtienen de estudios realizados en Norteamérica y Europa, y sugieren que la incidencia de la EII en población pediátrica ha aumentado progresivamente en los últimos años10–13. En Argentina, un estudio publicado en 2017 que incluyó datos de 17 centros de salud de diferentes regiones reportó una incidencia anual de 0,4/100 000 en niños menores de 18 años y una edad media al diagnóstico de 9,7 años14. La difusión del conocimiento de la enfermedad ha logrado un mejor abordaje terapéutico en los últimos años15,16. Aun así, son escasos los estudios que informan sobre la epidemiología y el comportamiento clínico de la EII pediátrica en América Latina17. El objetivo de este trabajo fue describir las características de presentación, el comportamiento y el tratamiento de un grupo de pacientes en un centro de referencia del interior del país.
Materiales y métodosSe trata de un estudio observacional, descriptivo, retrospectivo, que incluyó a todos los pacientes de entre 1 y 16 años diagnosticados de EII que acudieron al Servicio de Gastroenterología Pediátrica del Hospital Privado Universitario de Córdoba entre 2012 y 2020.
Los datos se registraron en formularios estandarizados que incluían características demográficas de los pacientes, diagnóstico, presentación clínica, hallazgos endoscópicos y tratamiento.
Las variables demográficas y los factores de riesgo analizados incluyeron: edad al diagnóstico, sexo, antecedente de familiar de primer grado con diagnóstico de EII, apendicetomía, tiempo de la lactancia materna exclusiva y estado de vacunación. Dentro de las variables clínicas de la enfermedad se incluyeron: tiempo desde el inicio de los síntomas hasta el diagnóstico, síntomas asociados y el antecedente de enfermedades gastrointestinales.
Se estudiaron los valores de hemoglobina, hematocrito y plaquetas en sangre, albúmina sérica, proteína C reactiva (PCR), velocidad de eritrosedimentación (VSG) y calprotectina fecal. Para definir anemia, se utilizó como referencia los valores publicados por las directrices 2017 de la Sociedad Argentina de Pediatría18.
Las escalas de valoración clínica utilizadas fueron el índice de actividad de la enfermedad de Crohn pediátrica (PCDAI, por sus siglas en inglés) y el índice de actividad de la colitis ulcerosa pediátrica (PUCAI, por sus siglas en inglés)4,17,19.
Para describir la extensión en la CU se utilizó la clasificación de Montreal, y para la localización de la EC su variante respectiva. Como índices de gravedad endoscópica se utilizaron la puntuación Mayo en la CU (0=mucosa normal; 1=disminución del patrón vascular, eritema, frialdad leve; 2=ausencia de patrón vascular, eritema marcado, erosiones; 3=sangrado espontáneo, presencia de úlceras), y la puntuación Simple Endoscopic Score for Crohn's Disease (SES-CD) en la EC. Se describió el tratamiento inicial y se evaluó la respuesta a los 3 meses.
Diagnóstico y clasificación de la enfermedadTodos los pacientes con EII fueron diagnosticados según la historia clínica, la exploración física, el laboratorio, los estudios radiológicos y la apariencia endoscópica con biopsia escalonada para su revisión por patólogos clínicos. El grupo se subdividió en pacientes EC, CU y EII-nc. Los casos en que no se podía distinguir entre CU y EC basado en estos criterios se designaban como EII-nc.
Análisis estadísticoLos datos se analizaron con Excel (Microsoft Office Standard 2013; Microsoft), y SPSS 25 (IBM). La significación estadística se definió como un valor p<0,05. Las manifestaciones clínicas, el examen de laboratorio, los hallazgos endoscópicos, los cambios patológicos y genéticos, y el tratamiento se compararon entre los diferentes grupos de edad con la prueba de chi-cuadrado o el test de Fisher. Para comparar los datos de laboratorio se utilizó la prueba T de Student, según el caso. Para el análisis estadístico, todos los EII-nc fueron clasificados como CU por el comportamiento de su enfermedad.
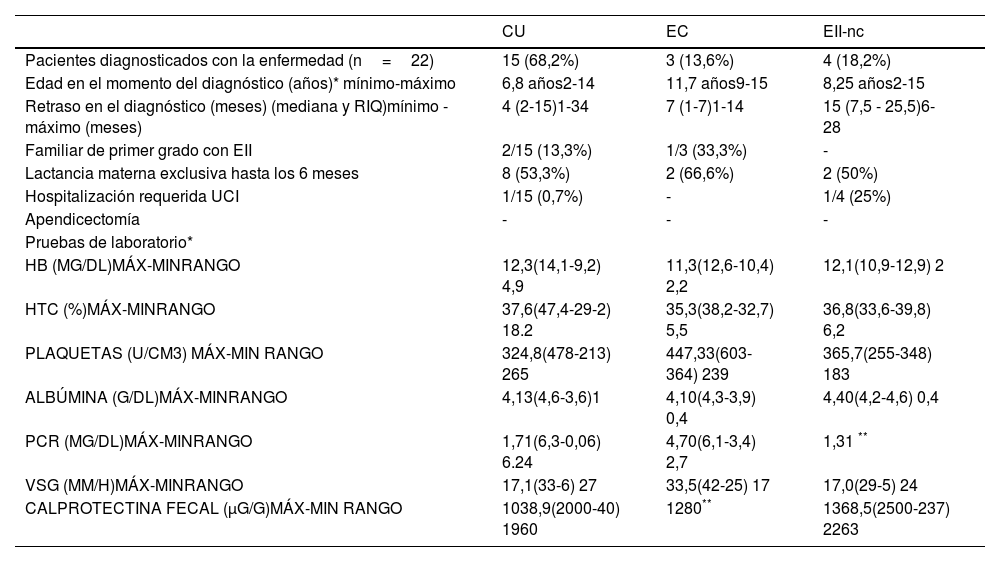
ResultadosSe incluyeron en total 22 pacientes, de los cuales 13 eran niñas (59,1%). Se diagnosticó CU en 15 pacientes (68,2%), EC en 3 pacientes (13,6%) y EII-nc en 4 pacientes (18,2%). La edad media al momento del diagnóstico para la EII en general fue de 7,7 años, siendo de acuerdo a la patología específica de 6,8 años para la CU, 11,7 para la EC y 8,25 para la EII-nc. Para la EII en general, la mediana del tiempo transcurrido entre el inicio de los síntomas y el diagnóstico fue de 6,6 meses, siendo de 4 meses para la CU, 7 meses para la EC y 15 meses para la EII-nc. Las características demográficas y resultados de laboratorio se describen en la tabla 1.
Características demográficas y valores de laboratorio de los pacientes al momento del diagnóstico de la enfermedad
| CU | EC | EII-nc | |
|---|---|---|---|
| Pacientes diagnosticados con la enfermedad (n=22) | 15 (68,2%) | 3 (13,6%) | 4 (18,2%) |
| Edad en el momento del diagnóstico (años)* mínimo-máximo | 6,8 años2-14 | 11,7 años9-15 | 8,25 años2-15 |
| Retraso en el diagnóstico (meses) (mediana y RIQ)mínimo - máximo (meses) | 4 (2-15)1-34 | 7 (1-7)1-14 | 15 (7,5 - 25,5)6-28 |
| Familiar de primer grado con EII | 2/15 (13,3%) | 1/3 (33,3%) | - |
| Lactancia materna exclusiva hasta los 6 meses | 8 (53,3%) | 2 (66,6%) | 2 (50%) |
| Hospitalización requerida UCI | 1/15 (0,7%) | - | 1/4 (25%) |
| Apendicectomía | - | - | - |
| Pruebas de laboratorio* | |||
| HB (MG/DL)MÁX-MINRANGO | 12,3(14,1-9,2) 4,9 | 11,3(12,6-10,4) 2,2 | 12,1(10,9-12,9) 2 |
| HTC (%)MÁX-MINRANGO | 37,6(47,4-29-2) 18.2 | 35,3(38,2-32,7) 5,5 | 36,8(33,6-39,8) 6,2 |
| PLAQUETAS (U/CM3) MÁX-MIN RANGO | 324,8(478-213) 265 | 447,33(603-364) 239 | 365,7(255-348) 183 |
| ALBÚMINA (G/DL)MÁX-MINRANGO | 4,13(4,6-3,6)1 | 4,10(4,3-3,9) 0,4 | 4,40(4,2-4,6) 0,4 |
| PCR (MG/DL)MÁX-MINRANGO | 1,71(6,3-0,06) 6.24 | 4,70(6,1-3,4) 2,7 | 1,31 ** |
| VSG (MM/H)MÁX-MINRANGO | 17,1(33-6) 27 | 33,5(42-25) 17 | 17,0(29-5) 24 |
| CALPROTECTINA FECAL (μG/G)MÁX-MIN RANGO | 1038,9(2000-40) 1960 | 1280** | 1368,5(2500-237) 2263 |
n: número total; CU: colitis ulcerosa; EC: Enfermedad de Crohn; EII-nc: Enfermedad inflamatoria intestinal no clasificable. RIQ: Rango intercuartil. UCI: Unidad de Cuidados Intensivos; Hb: Hemoglobina; Htc: Hematocrito; PCR: Proteina C reactiva; VSG: Velocidad de eritrosedimentación.
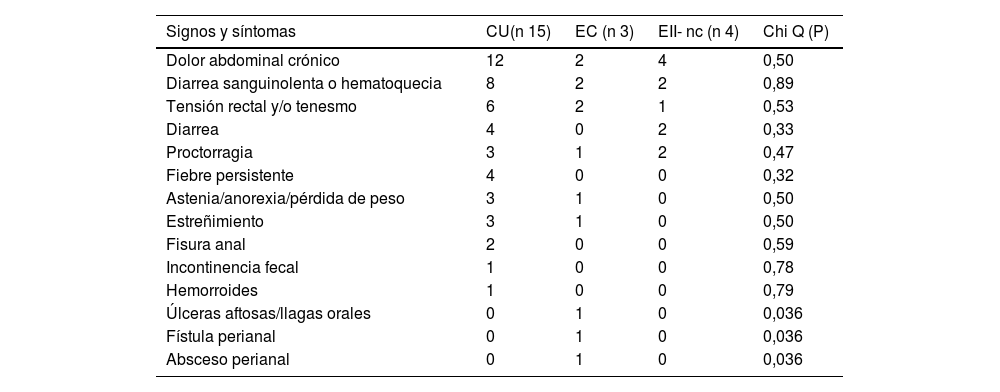
El síntoma más frecuente al momento del diagnóstico fue el dolor abdominal recurrente (81,8%), siendo de un 80% en la CU y de 67% en la EC. Solo un paciente con EC presentaba aftas orales. Ninguno de los pacientes con CU y EII-nc presentó manifestaciones extraintestinales. La tabla 2 recoge los demás síntomas descritos.
Presentaciones clínicas de los pacientes en el momento del diagnóstico
| Signos y síntomas | CU(n 15) | EC (n 3) | EII- nc (n 4) | Chi Q (P) |
|---|---|---|---|---|
| Dolor abdominal crónico | 12 | 2 | 4 | 0,50 |
| Diarrea sanguinolenta o hematoquecia | 8 | 2 | 2 | 0,89 |
| Tensión rectal y/o tenesmo | 6 | 2 | 1 | 0,53 |
| Diarrea | 4 | 0 | 2 | 0,33 |
| Proctorragia | 3 | 1 | 2 | 0,47 |
| Fiebre persistente | 4 | 0 | 0 | 0,32 |
| Astenia/anorexia/pérdida de peso | 3 | 1 | 0 | 0,50 |
| Estreñimiento | 3 | 1 | 0 | 0,50 |
| Fisura anal | 2 | 0 | 0 | 0,59 |
| Incontinencia fecal | 1 | 0 | 0 | 0,78 |
| Hemorroides | 1 | 0 | 0 | 0,79 |
| Úlceras aftosas/llagas orales | 0 | 1 | 0 | 0,036 |
| Fístula perianal | 0 | 1 | 0 | 0,036 |
| Absceso perianal | 0 | 1 | 0 | 0,036 |
n: número total; CU: colitis ulcerosa; EC: enfermedad de Crohn; EII-nc: enfermedad inflamatoria intestinal no clasificable.
Dos pacientes con CU habían sido diagnosticados previamente con alergia a la proteína de la leche de vaca. Además, dos pacientes con CU y uno con EC tenían familiares de primer grado con EII. Existieron doce pacientes (12/22) que recibieron lactancia materna exclusiva por 6 meses, y fue el mismo porcentaje (54,5%) que tenía el calendario de vacunación completo para su edad (tabla 1). Dos pacientes habían sido hospitalizados en Unidades de Cuidados Intensivos a causa de gastroenteritis con deshidratación.
Estudios de laboratorioOcho pacientes (36,4%) tenían anemia al momento del diagnóstico de la enfermedad. Todos los pacientes presentaban valores de plaquetas y de albúmina sérica en rangos normales. La PCR se estudió en 15 pacientes y nueve tenían niveles patológicos (6/11 de CU, 2/3 de EC y 1/4 EII-nc). La VSG se evaluó en 12 pacientes y fue patológica en cuatro de ellos (1/2 de CU, 2/2 de EC y 1/4 EII-nc). El valor más alto correspondía a un paciente con EC (42mm/h). Se analizó la calprotectina fecal en once pacientes. Diez de ellos (90,9%) presentaban valores patológicos (>200μg/mg).
Severidad, extensión endoscópica y localización de la enfermedadECAcorde al score PCDAI, uno de los pacientes con EC presentaba una actividad leve (25 puntos) y los otros dos una actividad severa de la enfermedad (40 y 45 puntos). Un único paciente reportaba manifestaciones extraintestinales.
Dos pacientes presentaban actividad endoscópica leve y el restante moderada. La afectación de todos los pacientes fue ileocolónica (L3).
CU y EII-ncDebido al comportamiento clínico de la enfermedad, los pacientes diagnosticados de CU y EII-nc fueron incluidos en el mismo grupo. Se realizó el índice PUCAI en 17 de los 19 pacientes. Siete de los 17 pacientes (41,2%) tenían una enfermedad leve en el momento del diagnóstico. El mismo número (7/17) presentaba una enfermedad moderada, dos con enfermedad grave (2/17) y uno sin enfermedad activa.
La extensión fue caracterizada como pancolitis en 11/19 pacientes (57,9%), proctitis en 5/19 (26,3%) y colitis izquierda en 3/19 (15,8%).
La puntuación de Mayo se evaluó en 18/19 pacientes. Se encontró un grado III en 7/18 (38,9%), grado II en 4/18 (22,2%), y existieron 7/18 con grado I (38,9%).
Correlación entre la puntuación de Mayo y score PUCAISe analizó la relación entre la gravedad endoscópica hallada y el score PUCAI calculado en una visita clínica previo, siendo la mediana de tiempo entre la evaluación endoscópica y el cálculo de la puntuación de 22 días. No se encontró correlación entre ambas variables (p=0,28). Sin embargo, se encontró que el 72,7% (8/11) de los pacientes con puntuaciones Mayo de 1 o 2 tenían PUCAI<25.
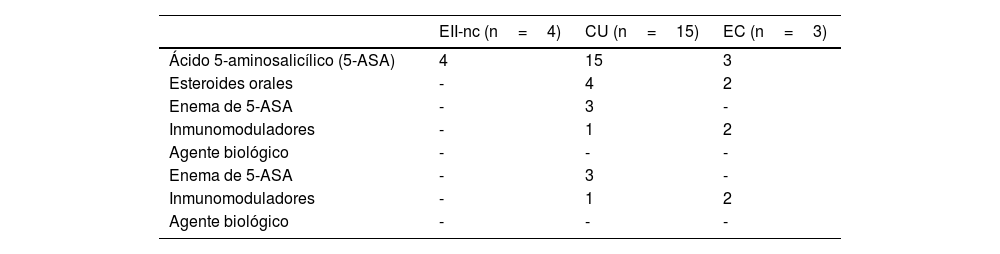
TratamientoTrece recibieron ácido 5-aminosalicílico (5-ASA) vía oral en monoterapia inicial (59,1%). Seis pacientes con CU (6/15) lo recibieron en combinación con otra medicación. Los tres pacientes con EC iniciaron un tratamiento combinado (1/3 con inmunosupresores, 1/3 con corticosteroides y el tercero con ambas medicaciones). En la tabla 3 se describe el tratamiento inicial indicado en cada grupo de pacientes.
Tratamiento inicial indicado en pacientes con EII
| EII-nc (n=4) | CU (n=15) | EC (n=3) | |
|---|---|---|---|
| Ácido 5-aminosalicílico (5-ASA) | 4 | 15 | 3 |
| Esteroides orales | - | 4 | 2 |
| Enema de 5-ASA | - | 3 | - |
| Inmunomoduladores | - | 1 | 2 |
| Agente biológico | - | - | - |
| Enema de 5-ASA | - | 3 | - |
| Inmunomoduladores | - | 1 | 2 |
| Agente biológico | - | - | - |
n: número total; EII-nc: enfermedad inflamatoria intestinal no clasificable; CU: colitis ulcerosa; EC: enfermedad de Crohn.
Se realizó la valoración de la actividad de la enfermedad 12 semanas posteriores a iniciado el tratamiento. Se perdió seguimiento en seis pacientes.
Para lograr una respuesta clínica, dos de los 13 pacientes con CU necesitaron intensificar el tratamiento y se les prescribió un corticoide oral y un inmunosupresor. Se indicó un inmunomodulador al paciente con EC que estaba siendo tratado con 5-ASA oral y corticoides orales. Los demás pacientes mantuvieron el tratamiento inicial.
En cuatro de los 16 pacientes se reportó la remisión clínica de su enfermedad posterior a este periodo (25%). Ninguno correspondía a casos de EC.
DiscusiónLa EII en pediatría ha mostrado un incremento considerable en la incidencia anual de casos durante la última década17. En Argentina, un estudio publicado en 2017 reportó una incidencia anual en la provincia de Córdoba de 0,3/100 000 en menores de 18 años14. Frente a la escasa información epidemiológica publicada en América Latina de esta patología, el presente estudio tuvo como objetivo describir las principales características y el comportamiento clínico de la EII en un grupo de pacientes pediátricos de una única institución privada de la capital de la provincia de Córdoba.
Se incluyeron 22 pacientes, con una proporción mujer-hombre de 1,44:1, difiriendo con distintas cohortes que refieren una mayor prevalencia en el sexo masculino10–13. A diferencia de la mayoría de los estudios europeos, pero coincidiendo con lo encontrado en el estudio argentino, la CU representó el 68,2% de los casos y la media de edad en el momento del diagnóstico observado fue de 7,7 años para la EII en general, con ligeras diferencias entre las tres variantes descritas20.
Observamos que el intervalo medio desde el inicio de los síntomas hasta el diagnóstico fue de 7,33 meses en los pacientes con EC, 9,4 meses en los de CU y 8,25 meses en los de EII-nc. En el caso de la EII en general, los intervalos de tiempo variaron desde 1 hasta 34 meses, lo que difiere claramente de lo comunicado en estudios de países desarrollados, con lapsos de tiempo de 2 a 6 meses y una ligera prolongación de este tiempo para la EC21–24.
Los factores de riesgo estudiados para el desarrollo de la EII (lactancia materna, hospitalizaciones previas, vacunación y el antecedente de apendicetomía) no establecieron asociación alguna.
La presentación más frecuente de la EII fue el dolor abdominal crónico, la diarrea sanguinolenta y el pujo y/o el tenesmo, resultados similares a los obtenidos en otras cohortes13–20. No obstante, en nuestro estudio solo un paciente manifestaba síntomas extraintestinales, a pesar de estar descrita como una de las formas más frecuentes de presentación en la infancia20,24,25. Destacamos que solo un paciente con EC presentaba aftas orales, y otro paciente, también con EC, presentó un absceso y una fístula perianal, síntomas que resultaron estadísticamente significativos para EC (p=0,036).
La presencia de anemia en el 36,4% de los pacientes nos lleva a considerar la relevancia para los pediatras en sospechar a la patología en los diagnósticos diferenciales para los pacientes que acompañen síntomas intestinales. Por otra parte, destacamos los valores tanto de plaquetas, (superiores en los pacientes con EC), y los valores de albumina, que no resultaron estadísticamente significativos26.
Se ha descrito que aproximadamente el 20% de los pacientes con EII que presentan actividad clínica y endoscópica muestran valores de PCR o VSG dentro de los rangos normales27,28. En nuestra cohorte, la PCR fue informada como patológica en el 60% de los pacientes estudiados, y la VSG solo se informó patológica en 4 de 12 pacientes. La calprotectina fecal, utilizada como indicador de curación de la mucosa, fue estudiada en once pacientes, y resultó patológica en diez de ellos (90,9%) e incluso encontramos valores superiores a 800μg/ml en ocho de ellos, por lo que damos especial importancia al uso de este método complementario al buscar orientar el diagnóstico29.
Algunos estudios describen que aproximadamente el 40% de los niños con EII infantil y de inicio muy temprano (<2 años) tienen una enfermedad colónica extensa, y que la localización de la enfermedad puede cambiar o progresar con el tiempo, lo que sugiere que una gran proporción de niños podría clasificarse en diferentes subgrupos de EII, mostrando características que no son específicas. Encontramos que el 57,9% de los pacientes con CU y EII-nc presentaban pancolitis al momento del diagnóstico, y todos los casos con EC mostraron localización ileocolónica de la enfermedad4,30.
La asociación entre la puntuación endoscópica de Mayo y el PUCAI se ha descrito con intervalos de hasta 35 días31. En nuestro estudio, con un rango intercuartil de 16 a 27,5 días, tampoco se encontró asociación entre ellas (p=0,28).
En cuanto al tratamiento inicial, se prescribió un 5-ASA oral en todos los pacientes. Se inició terapia combinada en 6 de 15 de los pacientes con CU y en todos los pacientes con EC. A las 12 semanas, 16 pacientes fueron evaluados y cuatro entraron en remisión de la enfermedad (25%). Se ha estudiado que el inicio temprano del tratamiento con azatioprina se asocia a una mejor evolución de la enfermedad a largo plazo y a una menor tasa de recidivas5,15,19. Seis de los pacientes estaban recibiendo esta medicación al momento de la valoración (37,5%). Aunque ninguno de los pacientes del estudio lo ha requerido, se sabe que la terapia con biológicos representa sin duda una de los mayores avances que se han logrado para el tratamiento de esta patología. Si bien se ha mencionado que la falta de experiencia podría representar una barrera para su uso, es conocido que en varios países de América Latina la seguridad social no cubre los costos de estos tratamientos. No obstante, coincidimos en que es responsabilidad del equipo médico indicar las terapias que consideren pertinentes de acuerdo a las guías actuales17,32,33.
El presente estudio no evaluó la calidad de vida de los pacientes, aunque la determinación de la respuesta al tratamiento y la necesidad de requerir ampliar el esquema de tratamiento logró describir o interpretar una mejora clínica en un determinado porcentaje de los pacientes32. Sin embargo, hemos de mencionar que escalas como la PUCAI y PCDAI resultan herramientas útiles en el seguimiento de nuestros pacientes, permitiéndonos evaluar la respuesta a la terapéutica indicada4.
Como es de esperar en una investigación retrospectiva, este estudio tiene varias limitaciones ya que los datos se recogieron de registros médicos históricos. La evaluación endoscópica de la enfermedad y la puntuación clínica (PUCAI) se calcularon en base a los registros, y las asociaciones que no resultaron estadísticamente significativas podrían convertirse en significativas en futuros estudios con mayor número de pacientes y prospectivos.
ConclusionesHasta donde sabemos, nuestro estudio es el primero en reportar una serie de pacientes fuera de Buenos Aires, Argentina. Se encontró que la CU fue la forma más frecuente de EII y el dolor abdominal recurrente predominó sobre los demás síntomas. Observamos un intervalo más largo desde el inicio de los síntomas hasta el diagnóstico en comparación con las series europeas y asiáticas. Cuatro pacientes entraron en remisión de la enfermedad a las 12 semanas. Se necesitan más series nacionales con el fin de mejorar la descripción clínica y la respuesta al tratamiento.
Consideraciones éticasEl estudio fue aprobado por el Comité de Investigación de la Institución. Con el fin de mantener la confidencialidad y el anonimato de todos los pacientes, y para evitar la manipulación de datos por personas ajenas al trabajo y/o institución, toda información obtenida ha sido clasificada en un sistema de códigos internos bajo un cifrado propio.
Conflicto de interésLos autores no declaran conflictos de interés.