El objetivo de este artículo es presentar un caso de raro de tumor pulmonar benigno, hemangioma esclerosante (neumocitoma), en una mujer de 24 años, asintomática, con hallazgo radiológico incidental. Se describen las características clínicas, imagenológicos y anátomo-patológicos de la entidad, con una breve revisión bibliográfica.
We present a rare case of benign lung neoplasia, sclerosing hemangioma (pneumocytoma), in a woman 24 years old, asymptomatic, with radiological incidental find. The clinical, imaging and pathological features of the entity are described, with brief bibliographic review.
El hemangioma esclerosante (neumocitoma) pulmonar, es un tumor benigno raro, inicialmente considerado de origen vascular, pero en la actualidad está su probada histogénesis en epitelio respiratorio primitivo. Tiene una marcada predilección por mujeres, siendo más común en la cuarta y quinta décadas. En muchos casos son pacientes asintomáticos con lesiones incidentales evidentes a la radiografía de tórax.
CASO CLÍNICOMujer de 24 años, con resistencia a la insulina, asintomática, referida a nuestro hospital por tumor pulmonar de lóbulo superior derecho, descubierto incidentalmente con radiografía y escáner de tórax.
Por toracotomía posterior derecha se efectuó bilobectomía superior y media, con tumor en lóbulo superior, adherido a lóbulo medio. Impresiona sólido-quístico, de aproximadamente 8cm. Se disecan además ganglios linfáticos mediastínicos, luego que biopsia intraoperatoria informara: “diagnóstico definitivo diferido (tumor pobremente diferenciado sugerente de malignidad)”.
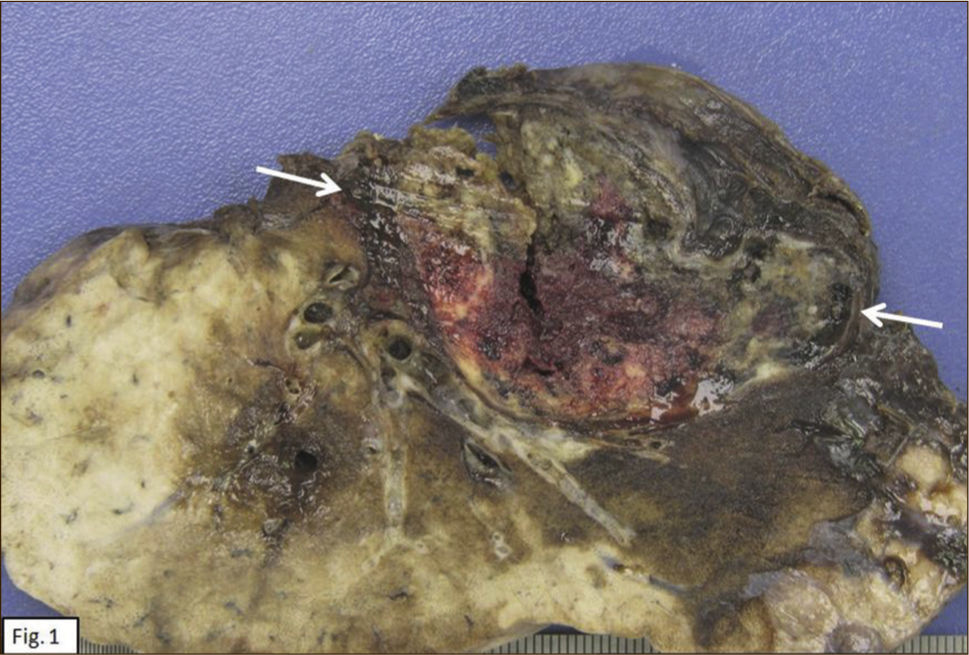
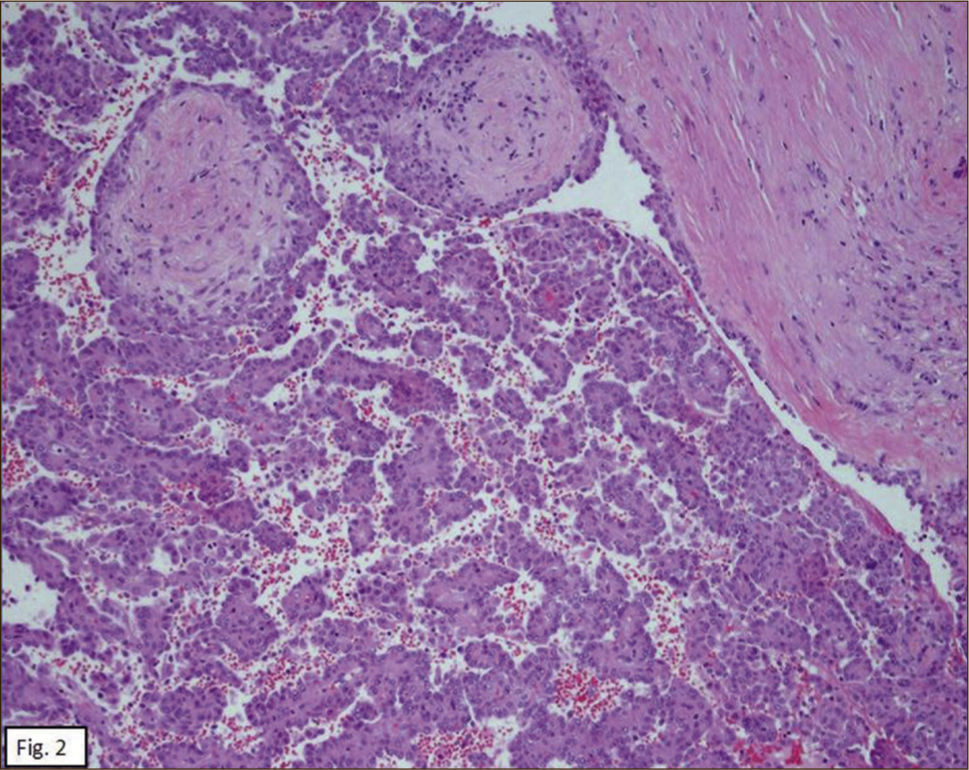
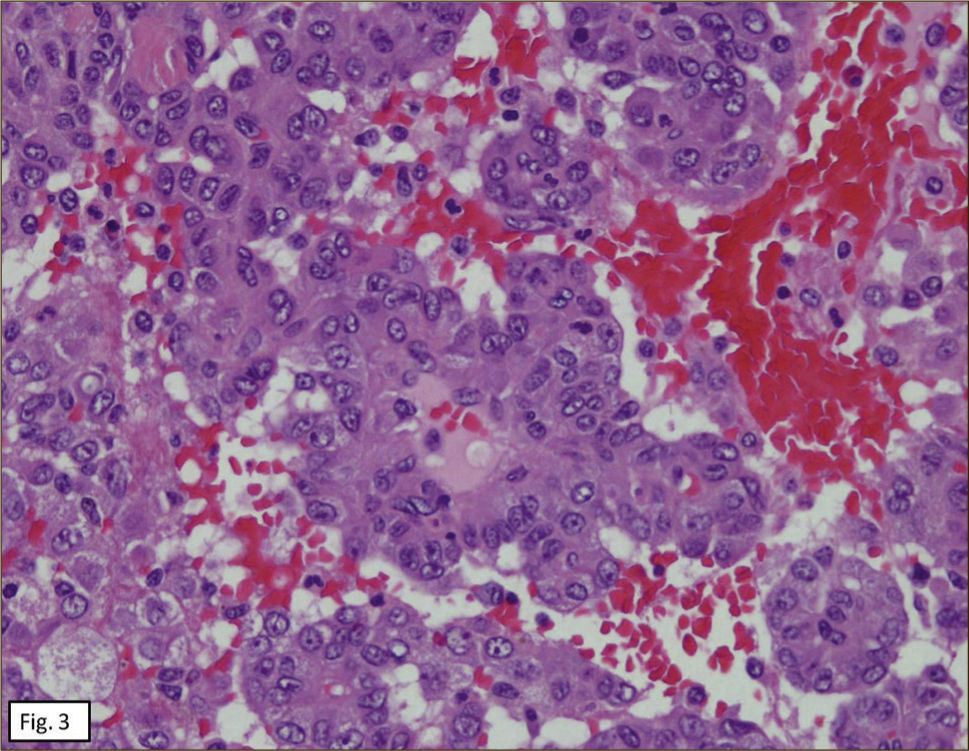
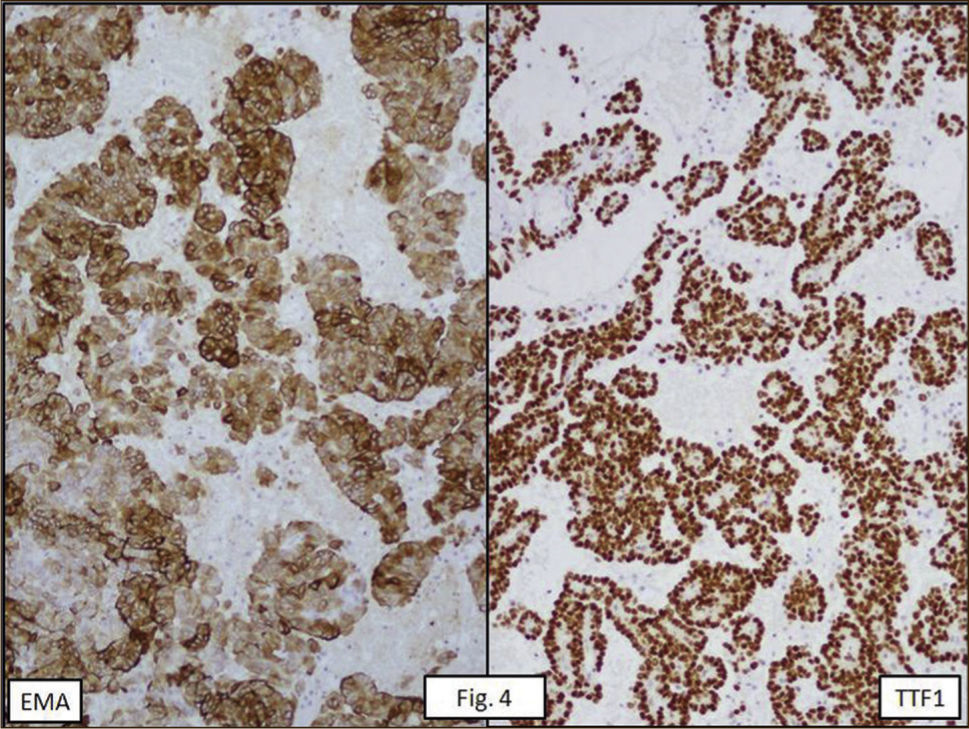
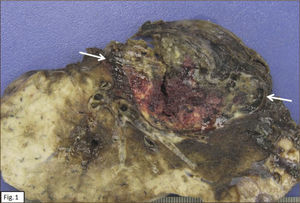
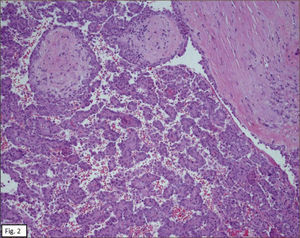
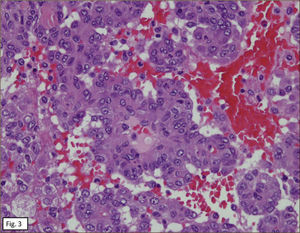
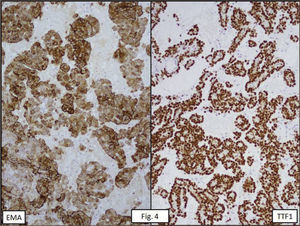
ANATOMÍA PATOLÓGICAEn lóbulo superior derecho se aprecia tumor subpleural bien delimitado, al corte, esponjoso, violáceo, con reticulado blanquecino, zonas hemorrágicas y consistencia friable (Figura 1). Al estudio histológico hay patrones sólido, papilar, trabecular, esclerótico y extensas zonas de hemorragia (Figura 2). Destacan dos poblaciones celulares, con elementos centrales pequeños, redondeados y células periféricas, superficiales, cuboides o cilíndricas (Figura 3). Ambos componentes sin atipias, mitosis ni necrosis. En el estudio inmunohistoquímico los dos componentes neoplásicos dieron positividad para antígeno de membrana epitelial (EMA) y factor transcriptor tiroideo (TTF1) (Figura 4). Hubo también positividad para pancitoqueratina (AE1/AE3) en células superficiales. El índice proliferativo (Ki-67) fue de 1%.
El aspecto histológico con sus diversos patrones arquitecturales, los dos componentes celulares y la inmunoreactividad descrita, permitieron formular diagnóstico de hemangioma esclerosante (neumocitoma).
DISCUSIÓNEl hemangioma esclerosante pulmonar (neumocitoma) es un tumor raro, con propuestas histogenéticas que han mutado en el tiempo. Se han sugerido orígenes mesotelial, mesenquimal, epitelial y neuroendocrino1–3. Resultados inmunohistoquímicos de series modernas, con positividad para antígeno de membrana epitelial (EMA), pancitoqueratina, TTF-1 y napsina A, lo vinculan a epitelio respiratorio primitivo4–8. Sus dos poblaciones celulares son estadíos madurativos distintos con patrón monoclonal uniforme9.
La neoplasia es más frecuente en mujeres (5:1), de edad mediana. Muchos pacientes son asintomáticos, con lesiones descubiertas incidentalmente con imágenes de tórax. Es bien circunscrita, usualmente solitaria y se ubica en parénquima periférico4. Hay escasos reportes de crecimiento endobronquial10,11 y de lesiones múltiples y/o bilaterales12–15. La TAC y el PET scan no son específicos, pudiendo en algunos casos sugerir metástasis16–20.
En el estudio patológico intraoperatorio, es una entidad de difícil diagnóstico, la cual muchas veces orienta a malignidad de bajo grado. El hallazgo de 3 de 4 patrones arquitecturales, puede ayudar a su correcta identificación21. En el estudio diferido también pueden haber dificultades en el diagnóstico diferencial con lesiones malignas primarias o metastásicas, sin embargo la correlación clínico-radiológica y la histopatología con dos poblaciones celulares y los patrones morfológicas variados (papilar, esclerótico, sólido y hemorrágico) ayudan a formular diagnóstico correcto4.
La mayoría de los hemangiomas esclerosantes pulmonares tienen comportamiento biológico benigno. Hay casos con metástasis linfáticas22–28, que aparentemente no afectarían el pronóstico, y excepcionales descripciones de diseminación pleural y aún de metástasis a estómago29,30.
Los autores declaran no tener conflictos de interés, en relación a este artículo.