La cirugía urológica tiene una antigüedad insospechada. El abordaje laparoscópico ha estado en el armamentario de la especialidad desde sus inicios. Sin embargo, recién en las últimas décadas y gracias al gran desarrollo tecnológico en imágenes e instrumental, es que se ha logrado introducir casi rutinariamente en la práctica urológica. Los beneficios de la cirugía laparoscópica son incuestionables y la evidencia nos muestra que cada vez será mayor la tendencia a realizar cirugías por esta vía. El advenimiento de la cirugía laparoscópica asistida por robot ha permitido en los últimos años implementar este abordaje para cirugías más complejas, que parecían imposibles de realizar de otra forma que no fuera por vía abierta. El propósito de esta revisión es describir con una perspectiva histórica el desarrollo de la cirugía mínimamente invasiva en urología y sus principales aplicaciones hoy en día.
Urological surgery has an unsuspected age. The laparoscopic approach has been in the specialty's armamentarium since its beginnings. But only in recent decades and thanks to the great technological development in images and instruments, is that it has been almost routinely introduced into urological practice. The benefits of laparoscopy are unquestionable and the evidence shows that the tendency to perform surgeries in this way will be greater every time. The advent of robot assisted laparoscopic surgery in recent years has allowed surgeons to implement this approach for more complex surgeries, which seemed impossible to perform otherwise than by open surgery. The purpose of this review is to describe with a historical perspective the development of minimally invasive surgery in urology and its main applications today.
Desde finales del siglo pasado, la cirugía urológica abierta ha sido reemplazada en gran parte por cirugías y procedimientos mínimamente invasivos, lo que se ha logrado gracias a la mejora continua de la tecnología video-endoscópica y desarrollo de nuevo instrumental, con implementación de principios físicos y la introducción de cirugía asistida por robot. En esta reseña, se resume el desarrollo de las tecnologías, se discute el rol de la laparoscopía en cirugías urológicas específicas y se especula sobre el futuro de cirugía mínimamente invasiva en urología.
Aspectos históricosEl desarrollo de la laparoscopía como técnica mínimamente invasiva es el fruto de sucesivos y progresivos eventos desde la época de Hipócrates, casi 500 años antes de Cristo. La palabra “laparoscopía” proviene de la combinación de las palabras de raíz griega “lápara” y “skopo”, que significan “abdomen” y “observar”, respectivamente; esto es, “mirar dentro del abdomen” (1).
Desde la antigüedad y en diferentes civilizaciones, se manifestaba el interés por explorar las cavidades corporales a través de los orificios naturales, con rudimentarios instrumentos que tenían esta finalidad. Existen registros en manuscritos babilónicos sobre el uso de estos instrumentos y espejos que reflejaban la luz natural, para hacer exploraciones a través del ano o la vagina.
No obstante, la primera descripción clara del uso de estos instrumentos se atribuye al cirujano español de origen árabe Abulcasis (Abu-al-Qasim-al-Zahrawi, 936-1013 d.C.). Fue él quien describió por primera vez el uso de ellos para explorar el cuello uterino. El desarrollo de estos instrumentos se mantuvo a nivel rudimentario por casi otros 700 años (2).
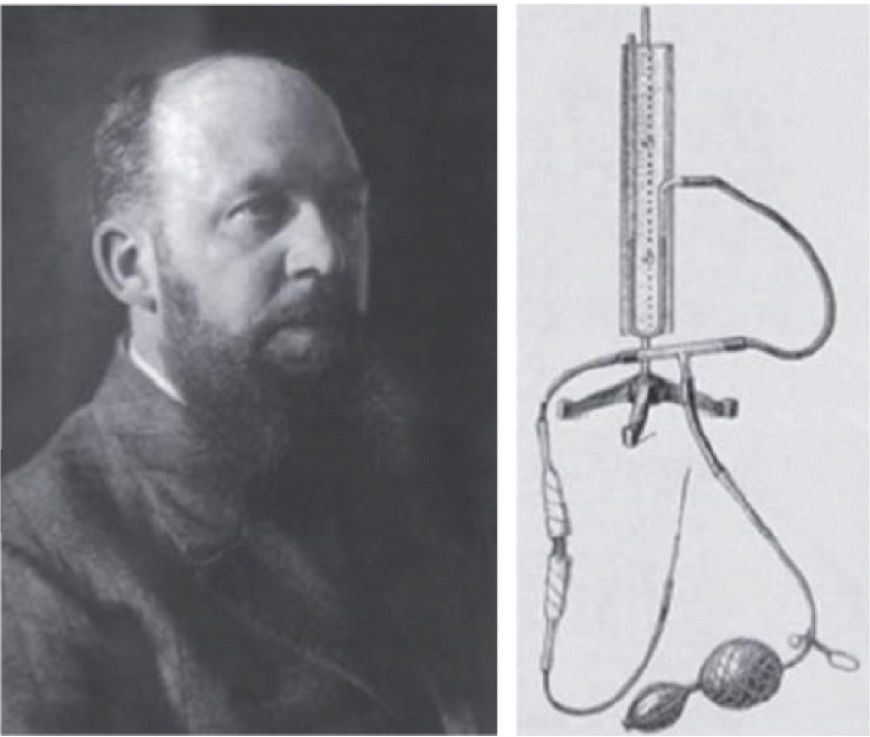
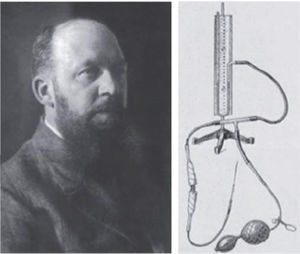
En los albores de la revolución industrial, Bozzini, médico militar alemán inventó el “Lichtleiter” o “conductor lumínico”. Consistía en una óptica con una fuente de luz de vela. En un modelo cadavérico efectuó exploraciones de la vejiga y exploró la cavidad abdominal a través de heridas causadas por trauma. El escepticismo científico y religioso de sus colegas, sumado a lo rudimentario del instrumento, impidieron su desarrollo (Figura 1) (3).
Casi 40 años después, en 1853, el urólogo francés Antonin Jean Desormeaux, mejoró el sistema óptico y la fuente lumínica, creando el primer “endoscopio”, instrumento que le permitió realizar intervenciones terapéuticas a través de la uretra tratando estenosis, papilomas y gonorreas. Gracias a sus intervenciones y aprovechando el descubrimiento de los efectos anestésicos del cloroformo, Desormeaux es considerado como el padre de la cirugía endoscópica (4).
Principalmente en Europa, se sucedieron los mejoramientos a los instrumentos endoscópicos pudiendo ampliar la gama de procedimientos terapéuticos.
Otro urólogo en 1879, Maximilian Nitze, usó lentes de aumento e incorporó en la punta del instrumento el foco eléctrico descubierto previamente por Thomas Alva Edison. En este período, gracias al trabajo de Nitze, se produjo uno de los mayores avances en endoscopía (Figura 2) (5).
A principio de 1900, el ginecólogo ruso Dimitri von Ott, utilizó el endoscopio de Nitze a través de una pequeña incisión abdominal sentando las bases para la laparoscopía ginecológica (6).
Anteriormente Georg Kelling, médico internista alemán, había utilizado un insuflador manual para cohibir sangrados digestivos intraluminales y luego, buscando menos morbilidad que una laparotomía, enfocó su interés en sangrados intraperitoneales. Uniendo las tecnologías existentes, Kelling, fue el primero en establecer un campo de trabajo para la laparoscopía abordando el abdomen insuflado y con al menos otros dos accesos para controlar sangrados intraperitoneales (Figura 3). En forma paralela, el médico internista sueco, Hans Christian Jacobeus reportó en 1910 su experiencia en laparoscopía para tratar la ascitis tuberculosa. Siendo ambos médicos internistas, no se interesaron por otras aplicaciones para su novedosa técnica (7,8).
En los años 20 comenzaron a publicarse estudios referente a los efectos de la absorción de aire insuflado en la cavidad peritoneal y el ginecólogo húngaro Janos Veress inventó una aguja con un obturador que cubría el bisel, minimizando la posibilidad de producir daño a las vísceras al ingresar al abdomen para efectuar el pneumoperitoneo. Esta aguja se ocupa rutinariamente en las cirugías laparoscópicas de la actualidad (9).
Con el desarrollo de los insufladores, el reconocimiento de los beneficios de utilizar el dióxido de carbono por sobre el aire ambiental asociado al refinamiento de los endoscopios, creció la popularidad de la laparoscopía diagnóstica. En esos años la delantera la llevaban los ginecólogos, haciendo procedimientos terapéuticos, pero limitados al utilizar una sola punción.
Después de la Segunda Guerra Mundial dos hechos revolucionaron las imágenes en laparoscopía; el primero fue el refinamiento del lente óptico por un físico británico, Profesor Harold H. Hopkins; y el segundo fue la incorporación del sistema de transmisión de luz fría por el vástago del lente por un alemán dedicado al desarrollo de instrumentos quirúrgicos, Karl Storz (Figura 4).
A mediados de los años 60 el ginecólogo alemán Kurt Semm, con su aparato de insuflación automática de CO2, de registro del flujo de gas y de la presión intraabdominal, asociado a los inventos anteriormente descritos, hizo que la laparoscopía ginecológica tuviera un auge mundial, incluso en EE.UU. que hasta entonces casi había desahuciado la técnica (10,11).
La video-laparoscopía se creó al adicionar una cámara al endoscopio rígido, permitiendo ahora que todo el equipo quirúrgico participara asistiendo al cirujano laparoscopista (12). Con esto se “democratizó” la cirugía en el pabellón, todos los presentes podían ver, opinar y asistir. Así como aprender directo de la experiencia de cirujanos expertos.
El ginecólogo Kurt Semm contribuyó al desarrollo de la cirugía laparoscópica creando múltiples aparatos que son de uso habitual en esta técnica hasta el día de hoy. Refinó técnicas quirúrgicas e ideó el Pelvitrainer (una cajas de simulación ex vivo muy útil para entrenamiento en técnica laparoscópica). Realizó la primera apendicectomía laparoscópica en 1981. Sin duda, un cirujano adelantado a su época (11,13). En el anecdotario de estos avances se recuerda que esto le trajo choques con sus propios colegas quienes decían que debía evaluarse neurológicamente ya que, “solo alguien con daño cerebral podría realizar cirugía laparoscópica”. En 1975 le propuso a los cirujanos generales de la Universidad de Kiel realizar colecistectomías laparoscópicas, lo cual fue rechazado tajantemente.
Vale la pena mencionar que, de forma mucho menos beligerante y siempre dentro de un ámbito académico, el desarrollo de la cirugía laparoscópica urológica en Chile también sufrió una fuerte resistencia por parte de algunos de nuestros colegas en el período de implementación de esta técnica. En la actualidad esta actitud no sólo ha cambiado, sino que urólogos sienten la necesidad de incorporar el aprendizaje de estas técnicas debido al beneficio que han observado en el tratamiento de sus pacientes.
El salto cuántico, el punto sin retorno de la cirugía laparoscópica, lo marca la colecistectomía laparoscópica. La historia en este punto es controvertida. Ya en 1979 se efectuó la primera colecistectomía laparoscópica experimental, siendo reportada solo en 1987. En 1983 el cirujano ruso Lukichev describió este procedimiento como tratamiento de colecistitis aguda en humanos. Pero por estar en idioma ruso, su publicación no tuvo difusión (14).
El cirujano alemán Erich Müche inspirado en el trabajo de Semm, realizó una colecistectomía laparoscópica exitosa en 1985 y fue publicada en 1986 (15).
En marzo de 1987, Philippe Mouret en Lyon, Francia, publicó la que fue reconocida por años como la primera colecistectomía laparoscópica. En EE.UU., en 1988, el cirujano Barry McKernan publicó su primera colecistectomía laparoscópica y tres meses después, el cirujano Eddie Reddick en Tennessee, hizo lo mismo. Lo curioso es que todos, desconociendo los trabajos de Müche, tampoco sabían de las experiencias de los demás antes mencionados. Se debe recordar que en esos tiempos la divulgación científica era considerablemente más lenta de lo que es hoy.
Como se puede apreciar en esta breve reseña histórica, la inquietud científica en pos de ofrecer a los pacientes un menor trauma quirúrgico, ha sido el motor del desarrollo de esta ahora difundida técnica.
Incorporación de la laparoscopía en cirugía urológicaLa primera nefrectomía abierta exitosa registrada en el mundo fue realizada por el cirujano alemán Gustav Simon en la universidad de Heidelberg el año 1869. Se reconoce el intento previo del cirujano canadiense Dr. William Hingston en 1868 en Montreal (16).
Apoyándose en la experiencia mínimamente invasiva descrita previamente en este artículo y en el uso de endoscopios desde su invención, la urología no podía permanecer indiferente a esta tecnología. El problema principal, sin embargo, lo confería la ubicación retroperitoneal de los órganos urológicos mayores y la ausencia de una cirugía frecuente (alguna “colecistectomía”) sobre estos en que “entrenarse”.
Solo después de 122 años, en diciembre del 1990 el Dr. Ralph Clayman (Figura 5), en la Universidad de Washington (St. Louis, EE.UU.), realizó la primera nefrectomía radical laparoscópica en un paciente octogenario con un tumor de 3cm, descubierto accidentalmente en un estudio radiológico por trauma (17). Después de una larga disquisición en el comité de ética e investigación, y habiendo explicado detalladamente al paciente la posibilidad de falla del procedimiento, sangrado o diseminación del tumor, éste eligió ser sometido a un procedimiento laparoscópico. Con un tiempo quirúrgico de 7 horas y la necesidad de transfundir 1 unidad de sangre, en un principio, no fueron evidentes las ventajas de esta técnica sobre la cirugía abierta convencional, sin embargo marcó el punto de no retorno en la cirugía mínimamente invasiva en el campo de la urología.
Impulsores de la laparoscopía urológica
A la izquierda Dr. Ralph Clayman, quien realizó la primera nefrectomía laparoscópica mientras trabajaba en la Universidad de Washington, St. Louis (EE.UU.). A la derecha el Dr. Octavio Castillo, padre de la cirugía laparoscópica urológica en Chile y reconocido formador de urólogos laparoscopistas en el mundo.
En Chile, la cirugía laparoscópica urológica fue impulsada y desarrollada a principios de los 90 por el urólogo Dr. Octavio Castillo Cádiz. El Dr. Castillo publicó la serie de sus primeras 20 nefrectomías laparoscópicas en 1995 (18). No deja de llamar la atención que dentro de estos 20 casos, sólo 2 correspondían a patología oncológica (1 carcinoma de células renales y 1 tumor de pelvis renal). Probablemente esto fue el reflejo de la gran resistencia inicial a incorporar esta técnica en cirugía oncológica. Desde aquellos años, el Dr. Castillo ha formado a una gran cantidad de urólogos tanto nacionales como extranjeros, mostrando su enorme talento quirúrgico y su generosidad docente, ayudando a implementar esta técnica en diversos centros y para diversas indicaciones. Estas características lo han distinguido como un referente internacional y merecedor de numerosos reconocimientos. El Dr. Castillo desarrolló luego el abordaje de la prostatectomía radical laparoscópica y fue pionero en el uso de robótica en latinoamérica (Figura 5).
Desde los años noventa hasta la actualidad la cirugía laparoscópica se ha convertido en un estándar de la especialidad. Son pocas las indicaciones actuales para un abordaje primario abierto. Las diferencias en dolor postoperatorio, sangrado, recuperación, cosmética, infecciones comparado con la cirugía abierta son extremadamente evidentes (19). Los planes de formación de urólogos actuales han tenido que modificarse fuertemente por esta razón.
Incorporación de la Robótica a la Cirugía UrológicaLos avances tecnológicos llevaron a varios intentos de incorporar “robots” en cirugía. La cirugía laparoscópica hacía esto tecnológicamente posible y esto encendió la intención tanto de la NASA como del ejército de Estados Unidos a avanzar en la creación de una plataforma robótica que permitiera realizar cirugía a distancia. Soñar con operar inmigrantes en otro planeta o soldados en el campo de batalla, sin arriesgar a los cirujanos empezó a dejar de ser ciencia ficción.
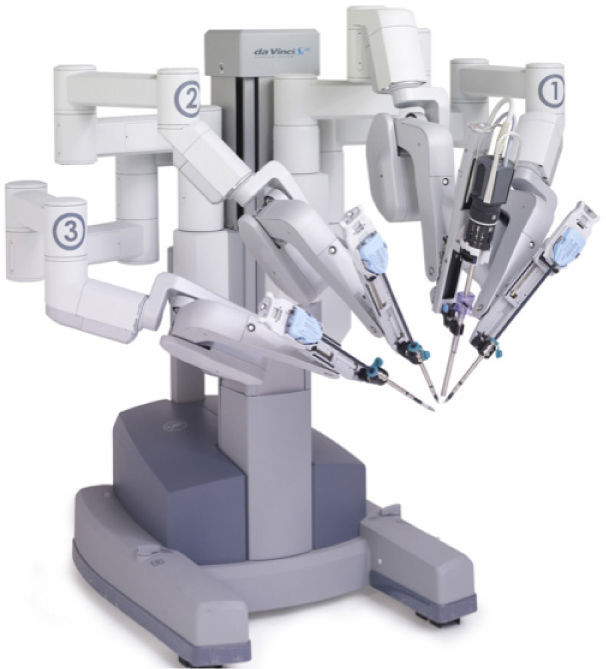
Derivado de estos esfuerzos el año 2000 en EE.UU., la compañía INTUITIVE desarrolla un nuevo sistema de cirugía robótica que toma control de la laparoscopía y provoca una nueva revolución la cirugía mínimamente invasiva. Este sistema es el llamado robot quirúrgico “Da Vinci”, que hoy ya va en su quinta versión (20).
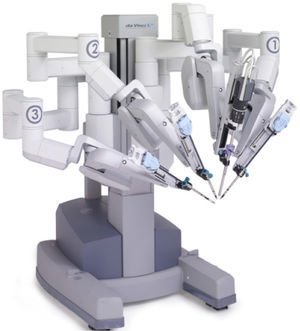
Desde el comienzo sus ventajas técnicas eran evidentes, le entregaba a la cirugía laparoscópica una nueva capacidad de visión tridimensional (3D) en alta definición (HD), una movilidad del instrumental con articulaciones intracorpóreas que permiten rangos de movimiento incluso mayores al humano (Figura 6).
Evitando los controles engorrosos y haciendo que el cirujano use movimientos naturales, escalados a las pinzas robóticas, se logró que esta técnica resulte más intuitiva para los cirujanos, en comparación con las técnicas laparoscópicas. Esta cualidad “intuitiva” le dio el nombre a la empresa. La laparoscopía requiere de habilidades complejas, con una curva de aprendizaje larga y lenta. En cambio el robot permite simplificarlas y ha demostrado ventajas en la facilitación de la cirugía y resultados operatorios que en algunos casos son superiores o por lo menos similares desde el punto de vista médico.
Nefrectomías radicales laparoscópicasInicialmente, en todo el mundo y en Chile, la cirugía laparoscópica se destinó principalmente al tratamiento de patologías benignas misceláneas. Cualquier comunicación respecto de tratar patologías oncológicas era fuertemente resistida mientras no existiera evidencia de su seguridad oncológica. Afortunadamente hubo perseverancia de los pioneros y luego evidencia.
El año 1995, en Chile el Dr. Castillo publicó sus primeras nefrectomías. Sin embargo, la indicación más frecuente de nefrectomía es el tumor renal y habiendo comenzado la experiencia en cirugías oncológicas, con el propósito de no cometer errores y sabiendo que el trabajo era observado con interés y recelo por parte de la comunidad urológica, se definieron limitaciones respecto del tamaño y ubicación del tumor para realizar un abordaje laparoscópico.
Se utilizó esta técnica en tumores pequeños que idealmente no deformaran el contorno renal, lo que dejaba afuera a un gran número de casos de tumores renales (18).
El enemigo era quizás la lumbotomía (Figura 7), la más mutilante de las incisiones abdominales y por eso rápidamente la literatura científica y los congresos urológicos internacionales se inundaron de experiencias clínicas, mostrando la factibilidad de realizar estas cirugías y mostrando que los resultados en la evaluación de los parámetros quirúrgicos eran superiores en recuperación y del punto de vista oncológico en el peor de los casos, comparables con la cirugía abierta convencional (21).
Como se comentó anteriormente, a diferencia de la cirugía general en donde “se cuenta” con la “vesícula biliar”, los urólogos no contaban con órganos que permitieran procedimientos de mediana o baja complejidad para entrenarse en laparoscopía. Anatómicamente, el retroperitoneo, requiere de una disección laboriosa, sólo para acceder al órgano comprometido y luego resolver quirúrgicamente el problema que demanda la intervención. Además de la dificultad técnica, la dificultad que había para acceder a equipos e instrumentos en los servicios públicos hizo que muy pocos, en esa época, pudieran adquirir una casuística y experiencia sólida. Con los años, fruto de la cooperación entre colegas, programas de entrenamiento y menores costos esta técnica se convirtió en el estándar que es hoy en día.
Aunque hoy parezca increíble, en las guías clínicas europeas y americanas, no fue hasta el año 2007, en que la nefrectomía radical laparoscópica fue incorporada como indicación de primera línea para el tratamiento del cáncer renal localizado.
Las ventajas del abordaje laparoscópico son indiscutibles y están dadas por una mejor visualización, menor sangrado, menor dolor, menor traumatismo en la pared abdominal y mejor cosmética (22).
Actualmente como una asistencia a la laparoscopía es posible hacer la cirugía por vía robótica. En estos casos la relación costo beneficio es discutible, dado que la ventaja más importante del robot es la ayuda en la reconstrucción de la vía urinaria y en estos casos radicales se trata principalmente de extirpación. Es posible pensar que el robot permita abordar disecciones más complejas, linfadenectomías más extensas, pero esto está aún por demostrarse.
Otro de los temas a analizar en este punto tiene que ver con el acceso retroperitoneal laparoscópico. La cirugía urológica abierta fue tradicionalmente retroperitoneal. Esto debido que en los inicios de la gran cirugía las complicaciones al entrar en el abdomen eran mayores. Paradojalmente, siendo éste el ambiente natural del urólogo en cirugía abierta, el espacio quirúrgico limitado y la casi total ausencia de puntos de reparo anatómico hizo que en la cirugía laparoscópica urológica, la mayoría de los accesos se realicen en forma transabdominal.
La vía retroperitoneoscópica tendría la ventaja, en casos seleccionados, de limitar el trauma quirúrgico. Sin embargo, la experiencia clínica no mostró diferencia en las complicaciones perioperatorias (23).
Como veremos en los puntos siguientes su indicación actualmente está reservada principalmente a cirugías de tumores renales de la cara posterior del riñón. O cuando, por condiciones especiales del paciente, el retroperitoneo sea el único acceso de abordaje quirúrgico posible (ej. múltiples cirugías abdominales, abdomen sellado). O simplemente la “preferencia” del cirujano entrenado (23,24).
Debido a que se realiza sólo ocasionalmente es recomendable que quienes se dediquen a la cirugía mínimamente invasiva urológica también se entrenen en el manejo del acceso retroperitoneal.
Otra variante a discutir es la nefrectomía radical laparoscópica “mano asistida”. Se define como acceso laparoscópico, pero incorporando una mano al campo operatorio a través de una incisión limitada en la pared abdominal. Fue propuesta como un facilitador de la transición desde la cirugía abierta a la laparoscopía pura. Actualmente no ofrece ventajas y está limitada a ser una alternativa a la conversión a cirugía abierta ante la dificultad de progresión quirúrgica, o a la nefrectomía de donante renal, donde la incisión de extracción se usa como acceso (25).
Nefrectomías parcialesEn la historia de la urología fue la ausencia de diálisis la que llevó al Dr. Novick en la Cleveland Clinic a tratar a pacientes que tenían un riñón único o con insuficiencia renal con nefrectomía parcial. De esta situación de necesidad surgió la evidencia de que oncológicamente la cirugía parcial es equivalente en sobrevida a la cirugía radical para tumores pequeños (26).
A principios de los 2000 se produjo la paradoja de que se podía operar un tumor renal grande por vía mínimamente invasiva, pero para operar tumores pequeños debía hacerse cirugía abierta, por la dificultad técnica de realizar disección adecuada y reconstrucción hemostática, todo esto contra el reloj de la isquemia renal, en que desde el comienzo de la resección del tumor hasta el final de la reparación del riñón no deben pasar idealmente más de 20 minutos (27).
La nefrectomía parcial laparoscópica necesitaba de instrumental especial, clips hemostáticos especiales y de cirujanos con coraje. Si la cirugía corría sin eventos, entonces ganaba todas las ventajas del abordaje mínimamente invasivo, pero si se alarga la isquemia o sangra, entonces solo quedarían las ventajas cosméticas.
Actualmente el abordaje robótico podría facilitar tanto la disección como la reconstrucción y puede hacer más accesible una técnica compleja a cirujanos con capacidades normales. Por esto es que en centros donde se cuenta con robot muchos de los pacientes se operan robot asistidos. La impresión actual es que el uso del robot permitiría tener menos isquemia y avanzar en la cirugía de tumores más complejos en que hace 5 años habríamos optado por una cirugía radical. Pero esto es algo que deberá ser demostrado en el futuro (28,29).
Otro cambio interesante tiene que ver con los bordes quirúrgicos. En los inicios de la técnica se buscaba un margen amplio con el tumor, pero esto justo en los pacientes en los que se desea preservar función renal al máximo. Actualmente se sabe que basta un margen mínimo, frecuentemente dado por la pseudo-cápsula tumoral por lo que hoy se acepta que la enucleación del tumor es tan buena como la resección en tejido sano. Esta técnica fue tempranamente promovida a nivel nacional y luego ratificada en publicaciones de la especialidad (30,31).
Nefrectomías parciales en tumores técnicamente complejosAl poco andar se presentaron casos de cada vez mayor dificultad técnica, lo que nos llevó a identificar un subgrupo de pacientes con lo que se denominó “tumores renales técnicamente complejos”. Casi en simultáneo se proponía en la literatura especializada el mismo concepto (28).
Este subgrupo consistía en tumores mayores a 5cm de diámetro, ubicados en la cara superior del polo superior, menos del 50% exofíticos o totalmente intrarrenales y tumores a menos de 1cm del hilio renal. Hasta hace algunos años, estos casos casi invariablemente se trataban mediante una cirugía radical laparoscópica o se desechaba la alternativa laparoscópica por una cirugía convencional abierta.
Otro grupo de tumores complejos corresponde a tumores renales múltiples, como en casos de tumores familiares o Von Hippel Lindau, o tumores en riñón único.
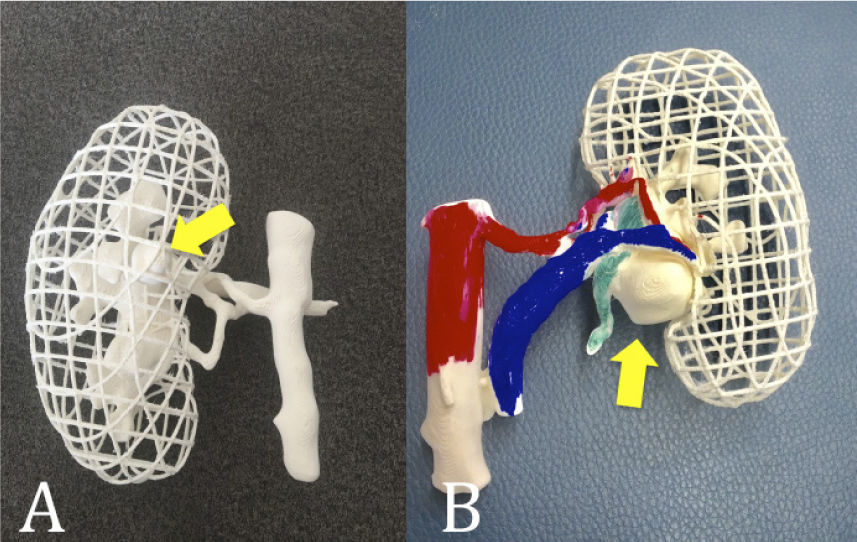
Actualmente este escollo se ha salvado exitosamente en la mayoría de los casos. Como siempre primero concentrando casos en cirujanos expertos y luego entrenando estos a otros; y posteriormente, con la ayuda de la tecnología y mejor instrumental, uso de la cirugía robótica, fluorescencia de los vasos intra-renales, entre otros. (32). Uno de los aportes novedosos es la utilización de modelos impresos en 3D para la planificación de la cirugía (Figura 8) (33).
Adrenalectomía laparoscópicaEl advenimiento de la imagenología permite el diagnóstico incidental frecuente de tumores suprarrenales. En ocasiones además estos tumores son funcionantes y manifiestan síndromes hormonales característicos.
La glándula suprarrenal, por su ubicación en lo profundo del retroperitoneo, es un órgano de muy difícil acceso mediante cirugía abierta. Era necesario efectuar amplias y traumáticas laparotomías para un acceso cómodo y seguro.
Desde el año 1992, con la cirugía laparoscópica se rompió este paradigma y ahora esta cirugía es simple, segura y con un mínimo trauma. Son cirugías que habitualmente no toman más de una hora y en la mayoría de los casos no requiere más de 24 horas de hospitalización.
En este caso es de la máxima importancia un adecuado estudio hormonal. Especialmente dirigido a diagnosticar y preparar adecuadamente a los pacientes portadores de Feocromocitoma. No obstante, incluso en estos casos la cirugía laparoscópica, ya sea convencional o robótica, ha mostrado beneficios claros sobre la cirugía abierta (34).
Es interesante observar la evolución del enfoque de éste problema y darse cuenta que conceptos que se arrastran desde la cirugía convencional influyen hasta el día de hoy en la elección e indicación del tratamiento de los tumores adrenales. Hasta hace no mucho tiempo la recomendación en las guías clínicas era operar un tumor de la glándula suprarrenal no funcionante o incidentaloma con un diámetro mínimo de 6cm. Aunque esto representaba un elevado riesgo de malignidad entre el 25% y 37%, se justificaba esperar hasta este tamaño para compensar el enorme traumatismo ocasionado por la cirugía abierta convencional (35). La recomendación actual en las guías clínicas es operar un incidentaloma con 4cm de diámetro, que representa un riesgo de malignidad entre el 2% y 3% (35).
Los bajos niveles de complicaciones, el mínimo trauma quirúrgico y la facilidad que otorga la protocolización y estandarización de la suprarrenalectomía laparoscópica han llevado a replantear el límite sobre el cual consideramos extirpar un adenoma no funcionante. En nuestro departamento se ha optado por operar estos tumores cuando miden >3cm porque un tumor de este tamaño ya tiene prácticamente reemplazada la glándula en su totalidad y ésta dejó de tener una función normal. Entonces predomina el riesgo del 1% de malignidad por sobre su función. Durante la extirpación quirúrgica de un tumor suprarrenal, es de vital importancia no dañar o comprometer la integridad del tumor ya que esto significa la posibilidad de una recidiva local cercana al 95% y deja al paciente fuera de cualquier posibilidad de un tratamiento curativo. Mientras menor sea el volumen del tumor, se facilita la cirugía y es menor el riesgo de comprometer la integridad de la lesión.
Es interesante considerar que en la vesícula biliar, de forma paradojal, ante un pólipo vesicular de 1cm, teniendo un 1% de riesgo de malignidad, se efectúan colecistectomías en el 100% de los casos (36). En las guías clínicas no se considera esta situación y se proponen diferentes enfoques para un mismo riesgo estadístico. Cabe señalar que el cáncer de vesícula biliar y el carcinoma suprarrenal comparten su extrema agresividad, teniendo como único tratamiento curativo la cirugía en etapas tempranas de la enfermedad.
Linfadenectomía retroperitoneal lumboaórtica laparoscópicaOtra situación en que la cirugía laparoscópica ha producido un beneficio significativo es en los tumores testiculares no seminomatosos en etapa I. Estos tumores pueden tener hasta un 20% de metástasis silentes en el retroperitoneo al momento del diagnóstico. El paciente en conjunto con su tratante pueden decidir si hacer un seguimiento estricto, realizar quimioterapia profiláctica o ir a la linfadenectomía de etapificación (37).
Antes del advenimiento de la laparoscopía, la linfadenectomía podía ser una gran y riesgosa cirugía para efectuar una etapificación linfonodal del retroperitoneo para luego decidir la estrategia de tratamiento. Era necesario efectuar laparotomías que abarcaban desde el apéndice xifoides hasta el pubis.
Mediante la técnica laparoscópica se ha observado la misma efectividad en cuanto a la obtención de linfonodos, con un procedimiento delicado pero sencillo y con una baja morbilidad. Como es común a casi todos los procedimientos laparoscópicos, la recuperación de los pacientes y el reintegro a sus actividades normales es muy rápida.
En estos casos, en nuestro centro se siguen las plantillas de disección de Weissbach, que además de las ventajas de una linfadenectomía reducida, presenta la mantención de la eyaculación cercana al 100% (38,39).
La preservación de la eyaculación es un punto de gran importancia, especialmente tratándose de hombres jóvenes. Además la laparoscopía muestra una mejor relación costo-beneficio, comparado a la cirugía convencional para obtener el mismo resultado (40).
Prostatectomía radical laparoscópica y asistida por RobotEl cáncer de próstata es el cáncer urológico más frecuente. Su tratamiento quirúrgico abierto se estandarizó alrededor de los años 90, gracias a los trabajos del Dr. Patrick Walsh y su comprensión anatómica de la pelvis y la función sexual masculina, publicados una década antes (41).
El año 1998 diversos grupos europeos publicaron los primeros casos de prostatectomía radical Laparoscópica (42,43). Esta compleja técnica lograba llevar los beneficios de la invasión mínima al paciente, pero presentaba desafíos quirúrgicos propios de la reconstrucción funcional en la pelvis, que requería de cirujanos especialmente hábiles y expertos. Por eso el tratamiento quirúrgico del cáncer prostático es probablemente el ámbito en el cual la introducción de la laparoscopía fue históricamente más resistida.
De todas formas, a nivel internacional y nacional hubo centros que perseveraron y lograron demostrar la seguridad y efectividad de este abordaje, con resultados al menos equivalentes a la cirugía abierta, con beneficios siempre controvertidos como una menor estadía hospitalaria, menor sangrado y menor dolor postoperatorio.
Como se mencionó anteriormente, en paralelo se desarrollaban los primeros robots quirúrgicos y ante el desafío técnico de la prostatectomía, la asistencia robótica con su visión tridimensional, instrumental con muñecas flexibles y manejo intuitivo rápidamente encontró un nicho de desarrollo. Las primeras Prostatectomias Radicales Laparoscópicas asistidas con robot se publicaron el año 2003 (44).
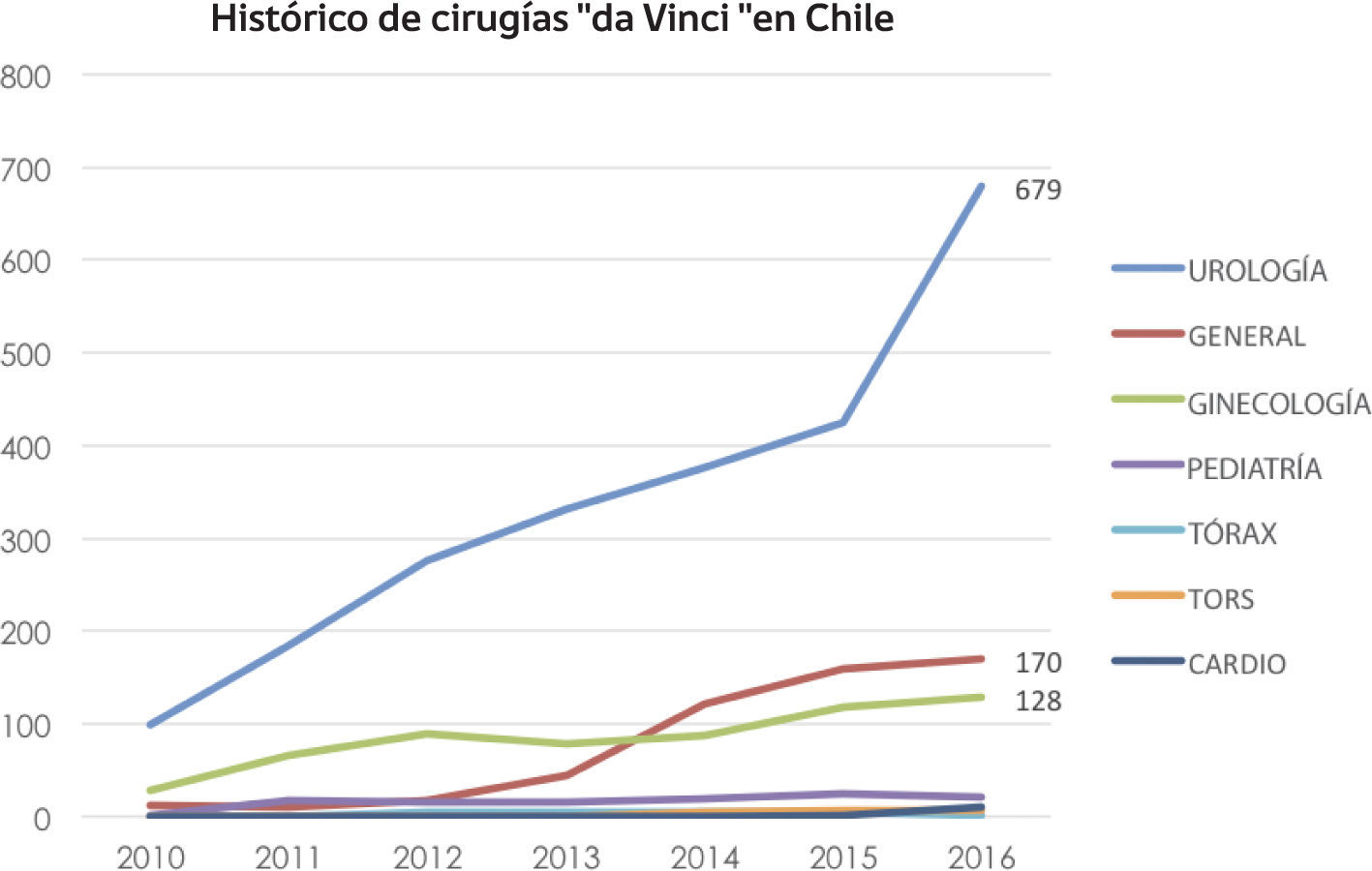
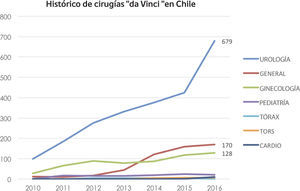
Desde entonces se ha convertido en el abordaje preferido en centros que cuentan con la tecnología y ha propiciado una verdadera epidemia de crecimiento de la robótica en el mundo y en Chile (Figura 9).
Los beneficios del abordaje robótico son evidentes en cuanto a menor sangrado, disminución del dolor, mejor calidad de la anastomosis uretro-vesical y por esto menos necesidad de sonda Foley. Desde el punto de vista oncológico es por lo menos igual que la cirugía abierta (45). Las preguntas sobre recuperación de continencia y función sexual (eréctil) aún están en evaluación, con todas las dificultades que esto significa. Pero los meta-análisis actuales permiten pensar en ventajas hacia el uso de la robótica, con una recuperación más rápida de la continencia y de la potencia sexual en comparación con las técnicas abiertas y laparoscópicas puras (46-48).
Pese a la dificultad de encontrar evidencia científica que la apoye, la prostatectomía laparoscópica asistida por robot ya es una técnica establecida que se acerca a los 20 años de seguimiento. En los EE.UU. alrededor del 90% de los cánceres de próstata se operan por abordaje robótico. Pero esto tiene implicancias de costo que son difíciles de evaluar, especialmente para países como el nuestro. En Chile actualmente contamos con siete robots funcionando activamente.
El Futuro: más Robots, mejores imágenes y entrenamiento simuladoEl concepto de cirugía laparoscópica tiene muchas aristas, pero sin duda ha sido una de las revoluciones históricas de la cirugía, casi tan grandes como el desarrollo de la anestesia y de los antibióticos. Los cambios tecnológicos hoy suceden a una velocidad impensada. Cada día nos enfrentamos a mejoras sutiles que cambian nuestro quehacer.
Los urólogos hoy nos atrevemos a nuevos abordajes para cirugías tan complejas como la cistectomía radical con reconstrucción robóticas o plastías ureterales y vesicales, porque confiamos en el instrumental mínimamente invasivo y nos entrenamos para usarlo. Las posibilidades sólo crecen.
La laparoscopía es un campo en desarrollo, los instrumentos mejoran, agregando flexibilidad a las pinzas, sistemas de hemostasia mejores, mejor definición de imágenes, visión tridimensional.
Con la laparoscopía se ha incorporado la “simulación”, es decir entrenamiento continuo o planificación individual preoperatoria de un caso difícil. En el futuro será habitual imprimir en 3D los hallazgos del paciente y hacer un “ensayo general” ex-vivo para prepararse al procedimiento. Como en la aviación comercial, los centros de excelencia están empezando a exigir “horas en simulador” certificadas para poder acceder a operar pacientes reales. De este modo la cirugía mínimamente invasiva mueve el estándar de seguridad en pabellón haciéndolo más estricto que nunca en la historia.
Ya están comenzando a verse más empresas tecnológicas involucradas en este desarrollo. Se espera que esto reduzca los costos haciendo más asequible la laparoscopía y la robótica a todo nivel.
Los robots del futuro aportarán “háptica” (sensación táctil), integración intraoperatoria con las imágenes radiológicas del paciente, conexión on-line con colegas interconsultores, radiólogos, patólogos o expertos a distancia. Este desarrollo se producirá a una velocidad que sin duda excederá la capacidad científica de demostrar beneficios a cada paso.
Desarrollos que provienen del mundo de la robótica se traspasarán a la laparoscopía más simple, mejorando las imágenes, la tridimensionalidad y la ergonomía del instrumental. De este modo se irán democratizando estos beneficios.
Incluso hoy, innovadores chilenos están activamente desarrollando instrumental magnético para laparoscopía. Sistema que permite dejar una pinza dentro del paciente y manipularla desde el exterior, evitando toda incisión (49).
SíntesisLa cirugía mínimamente invasiva, laparoscópica y/o robótica, ofrece múltiples beneficios a los pacientes por sobre la cirugía abierta y ha tenido gran aplicación en cirugías urológicas.
Aquellas cirugías que más se resistían a la introducción de la laparoscopía convencional, hoy han sucumbido frente a la cirugía asistida por robot. Del mismo modo, esta herramienta ha permitido que más cirujanos puedan llevar a cabo cirugías laparoscópicas y es de esperar que los costos se reduzcan con el tiempo y permitan hacer más accesible esta técnica para todos los pacientes.
Con el refinamiento de los procedimientos quirúrgicos, el rápido desarrollo tecnológico, el entendimiento acelerado del “big data” que posibilitará la inteligencia artificial, ni la mente más imaginativa puede ilustrarnos lo que vendrá.
Ninguno de estos actuales eventos habría sido posible sin las etapas anteriores descritas al inicio. Lo que viene, la “cirugía del futuro”, es difícil de predecir, imaginársela ahora es casi ciencia ficción (50).
Los autores declaran no tener conflictos de interés, en relación a este artículo.